Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.4 Lima Oct./dic. 2007
TRABAJOS ORIGINALES
Evaluación de electrodos de espinela de cobalto y de dióxido de plomo en la oxidación electroquímica de colorantes azo
Evaluation of cobalt spinel and lead dioxide electrodes in electrochemical oxidation of azo compounds
Adolfo La Rosa Toro1* ; Miguel Ponce Vargas1
1 Laboratorio de Electroquímica Aplicada, Facultad de Ciencias. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210, Rímac.
* e-mail: toro@uni.edu.pe
RESUMEN
La electrólisis es una alternativa eficiente para oxidar los compuestos responsables del color de los vertidos acuosos de la industria textil, como son los compuestos del tipo azo. El material del cual está fabricado el electrodo y el pH de la disolución han sido identificados como determinantes en la obtención de la máxima eficiencia en corriente. En este estudio se realizó la oxidación electroquímica del anaranjado de metilo: 4-(4- dimetilaminofenilazo) bencensulfonato de sodio, utilizando electrodos de espinela de cobalto, dióxido de plomo y grafito, en solución de cloruro de sodio a diferentes valores de pH.
Palabras clave: Electrocatálisis, espinela de cobalto, dióxido de plomo.
ABSTRACT
The electrolysis is an efficient alternative to oxidize the compounds responsible for the color of the textile industry waste waters, like the azo compounds. The material of which is manufactured the electrode and the pH of the solution has been identified as decisive to reach the maximum current efficiency. In this study, the electrochemical oxidation of the methyl orange: sodium 4-(4- dimethylaminophenylazo) benzensulfonate, was carried out using cobalt spinel, lead dioxide and graphite electrodes, in a sodium chloride solution at different pH values.
Key words: Electrocatalysis, cobalt spinel, lead dioxide.
INTRODUCCIÓN
Las aguas residuales de la industria textil presentan una fuerte coloración debido a la presencia de compuestos orgánicos del tipo azo. El tratamiento electroquímico es una alternativa basada en tecnologías limpias mediante la cual es posible oxidar los compuestos coloreados, permitiendo plantear un sistema de reciclaje de las aguas utilizadas con el consiguiente ahorro en el costo y mínimo impacto ambiental. El material utilizado en la fabricación de los electrodos y las condiciones del electrolito son determinantes en la eficiencia del proceso. Se espera que los electrodos, además de ser buenos electrocatalizadores, presenten alta estabilidad electroquímica y bajo costo. Con el surgimiento de una nueva generación de electrodos de óxidos metálicos1 preparados con metales no nobles, ha sido posible abordar trabajos de investigación en el campo de la electroquímica ambiental, ofreciendo soluciones a problemas relacionados con el vertido de residuos acuosos industriales sin tratamiento.
Los electrodos basados en espinela de cobalto, CoCo2O4, se caracterizan por presentar un bajo valor de polarización en la formación de oxígeno y alta estabilidad en medio alcalino; el PbO2, por el contrario, presenta una fuerte polarización a la formación de oxígeno en medio ácido, por lo que resulta de interés comparar ambos electrodos en la oxidación de compuestos azo. Además de las características nombradas, los electrodos deben reunir características adicionales resumidas en la tabla 12.

Propiedades electrocatalíticas
La actividad del electrodo dependerá de una suma de factores, los cuales se resumen en la tabla 22.

De todos los factores nombrados, el factor geométrico y la estructura electrónica superficial son los principales en la capacidad electrocatalítica de los electrodos.
Colorantes Azo
Los colorantes azo son muy utilizados en la industria de fabricación de papel, farmacia, textil, cosmética y de alimentos. El vertido de este tipo de residuos causa serios problemas de polución en el medio ambiente, debido particularmente a su alta toxicidad y a lo difícil que es degradarlos biológicamente. Otras técnicas disponibles como: la oxidación fotocatalítica, radiación UV, proceso foto- Fenton y CGDE (electrólisis mediante contacto con chispa de descarga)3, resultan costosas para su aplicación, desmotivando su implementación en las industrias.
En la presente investigación se ha utilizado el anaranjado de metilo: 4-(4- dimetilamino fenilazo) bencensulfonato de sodio como prototipo de colorante azo, el cual será oxidado cuantitativamente. El sistema cromóforo consiste básicamente en un enlace -N=N- asociado con un grupo aromático, como se observa en la figura 1.
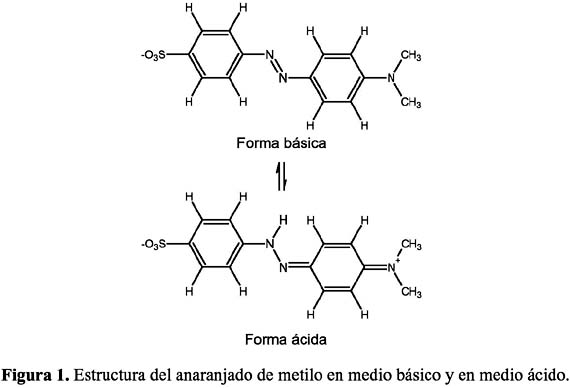
PARTE EXPERIMENTAL
Preparación del electrodo de espinela de cobalto
La preparación del electrodo de espinela se realizó utilizando la técnica de descomposición térmica. Se utilizó como soporte una lámina de titanio 99,99% Goodfellow, cortada en forma de cuadrado de 1,0 cm de lado, al cual fue soldado un alambre de 5 cm de largo del mismo material. El soporte así elaborado, fue desengrasado con acetona y posteriormente atacado químicamente con una solución de ácido oxálico al 10%, a ebullición durante una hora. El tratamiento produjo una superficie rugosa apropiada para la adhesión de los óxidos. La disolución precursora fue preparada utilizando Co(NO3)2.6H2O Mallinckrodt, solubilizado en etanol a una concentración 1,0 M, la cual fue aplicada utilizando una brocha suave, humedeciendo la superficie del soporte. Las etapas fueron las siguientes:
-
Impregnación de la solución.
-
Secado en estufa a 80 ºC por 5 minutos.
-
Tratamiento térmico a 350 ºC por 10 minutos.
-
Enfriado y repetición de todo el proceso.
Culminada la aplicación de 23 capas, según los pasos descritos anteriormente, se realizó un tratamiento térmico final a 350 ºC, con la finalidad de lograr la sinterización homogénea de los óxidos.
El electrodo de espinela de cobalto soportado en titanio fue caracterizado mediante voltametría cíclica, en una solución de hidróxido de sodio 0,5 M.
Preparación del electrodo de dióxido de plomo
La técnica utilizada para la preparación del electrodo de PbO2 fue de electrodepósito anódico utilizando soporte de titanio al cual se le aplicó el mismo tratamiento mencionado anteriormente, El depósito de PbO2 se realizó electrolíticamente a partir de una solución de formulación mostrada en la tabla 34.

Como contraelectrodo se utilizó cobre, empleando una densidad de corriente de 20 mA/cm2 durante 90 minutos a una temperatura de 55 ºC. El electrodo de PbO2 obtenido fue caracterizado mediante voltametría cíclica en una solución de ácido sulfúrico 0,5 M.
RESULTADOS Y DISCUSIÓN
Caracterización electroquímica de los electrodos
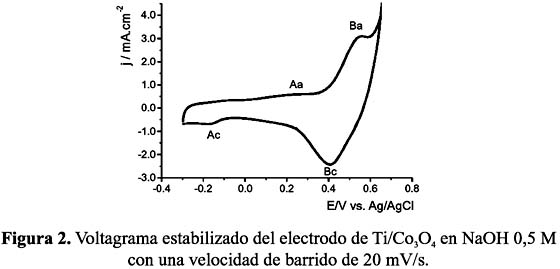
La figura 2 nos muestra el voltagrama estabilizado (Densidad de corriente vs. Potencial del electrodo) de un electrodo de espinela de cobalto soportado en titanio, Ti/Co3 O4, sumergido en una solución de NaOH 0,5 M, utilizando un electrodo de referencia de Ag/AgCl y un contraelectrodo de platino. En él se puede apreciar el perfil característico de este tipo de electrodos. En el barrido en sentido positivo se observan dos picos de oxidación: el primero a 0,25 (Aa) y el segundo a 0,5 V (Ba). Ambos picos presentan sus correspondientes picos de reducción en el barrido negativo, a -0,18 V (Ac) el primero y a 0,4 V (Bc) el segundo. Los dos picos están relacionados con procesos rédox superficiales: el primero a la transformación Co(II)/Co(III), y el segundo a la transformación de Co (III)/Co(IV). A potenciales mayores a 0,55 V aparece un pico de alta intensidad de corriente asociado a la formación de oxígeno5.
La figura 3 nos muestra el voltagrama estabilizado de un electrodo de dióxido de plomo soportado en titanio, Ti/PbO2, en una solución de ácido sulfúrico 0,5 M utilizando un electrodo 2 de referencia de Ag/AgCl y un contraelectrodo de platino. En el barrido en sentido anódico se observan dos picos; éstos corresponden a la formación del α-PbO2 (Aa) a 1,55 V y del β-PbO2 (Ba) a 1,75 V.
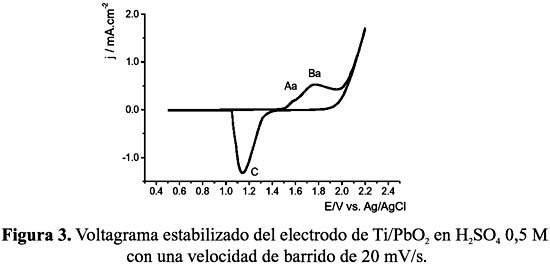
Un pico de reducción es observado a 1,15 V (C); el β- PbO2 de la capa superficial se transforma en PbSO4, el cual desactiva la superficie del electrodo. El pico de reducción es ancho debido a que el proceso involucra a dos compuestos: dióxido de plomo y sulfato de plomo, y necesita la difusión de protones y de ácido sulfúrico dentro de la masa activa.
El pico de alta intensidad producido a potenciales mayores a 2,0 V corresponde a la formación de oxígeno6.
ORP (Potencial de Oxidación Reducción) de la solución electrolizada de NaCl 2%.
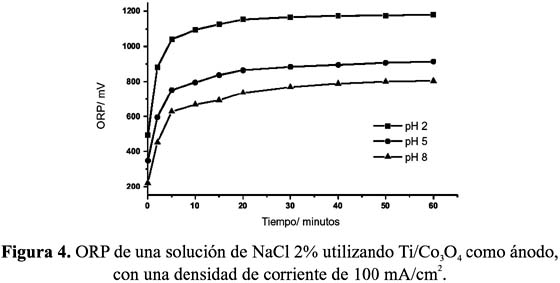
El ORP es una técnica muy útil para determinar la capacidad oxidante de una solución, y puede realizar una medida indirecta de la producción de agentes oxidantes en la celda electrolítica. En la figura 4 se muestra la evolución de los valores de ORP según el avance de la electrólisis en la cual se utilizó un electrodo de Ti/Co3 O4 y solución electrolítica de NaCl 2% a valores pH de 2, 5 y 8, observándose que la máxima productividad de oxidantes se obtiene en disoluciones más ácidas.
En la figura 5 podemos apreciar las diferentes estructuras del anaranjado de metilo (AM) y las especies cloradas predominantes relacionadas a los valores de pH7. En líneas punteadas se presentan los valores de pH (2, 5 y 8) a los cuales se llevaron a cabo las pruebas.
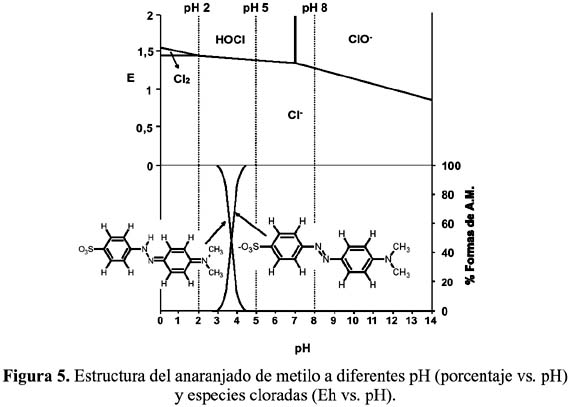
De acuerdo al pH de la solución, los agentes oxidantes serían las especies HOCl y ClO-, las cuales serían responsables del ataque al grupo cromóforo del AM, produciendo la decoloración de la solución que lo contiene. Sin embargo, no se descarta la posibilidad de oxidación directa, la cual ocurriría por adsorción de las moléculas orgánicas sobre el electrodo y su posterior oxidación por transferencia electrónica directa. Para estudiar este efecto se diseñó dos sistemas de electrólisis: in situ y ex situ.
Oxidación electroquímica del anaranjado de metilo (AM)
La oxidación electroquímica se realizó utilizando un electrolito de NaCl al 2%; la eficiencia en corriente fue determinada para cada electrodo en función al pH de la solución.
Las reacciones principales que se desarrollan en el proceso son:
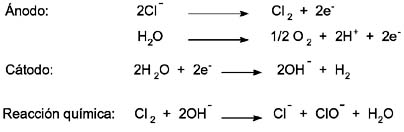
En donde el hipoclorito es el agente oxidante, el cual se encuentra en equilibrio con la especie HClO de acuerdo a la ecuación:

En el ánodo aparecen dos reacciones competitivas; la primera relacionada a la generación de cloro y la segunda asociada a la generación de oxígeno. Esta última reacción es no deseable.
Oxidación in situ (el AM se introduce a la solución electrolítica)
En este experimento se utilizó 60 mL de solución electrolítica conteniendo 2% de NaCl y 50 ppm de AM. En el transcurso de la electrólisis se tomó muestras de 1 mL de solución, cada una de las cuales fue diluida en 9 mL de solución buffer pH 6, siendo agitadas vigorosamente antes de tomar las lecturas de absorbancia. La longitud de onda utilizada fue de 465 nm. Un espectro de absorción, obtenido previamente, nos permitió identificar esta longitud de onda como la correspondiente a la máxima absorbancia por parte del anaranjado de metilo 50 ppm en solución de NaCl 2%.
Oxidación ex situ (el AM es atacado externamente con una porción de la solución electrolizada)
La electrólisis fue realizada utilizando 60 mL de solución al 2% de NaCl. Durante la electrólisis se tomó muestras de 1 mL de solución electrolizada, cada una de las cuales se puso en contacto con 1 mL de solución de AM 50 ppm. Después de agitar vigorosamente, el contenido de cada muestra fue vertido en un vaso con 8 mL de solución buffer pH 6. Una porción de esta muestra fue utilizada para tomar la lectura de absorbancia a una longitud de onda de 465 nm.
Todos los experimentos in situ y ex situ fueron realizados fijando previamente el pH de la solución electrolítica a 2, 5, y 8, y utilizando electrodos de Ti/Co3 O4 , Ti/PbO2 y grafito. Las figuras 6 a 11, muestran los resultados de la oxidación del AM, C/Co (concentración en el tiempo t /concentración inicial) vs. tiempo, a las condiciones fijadas.
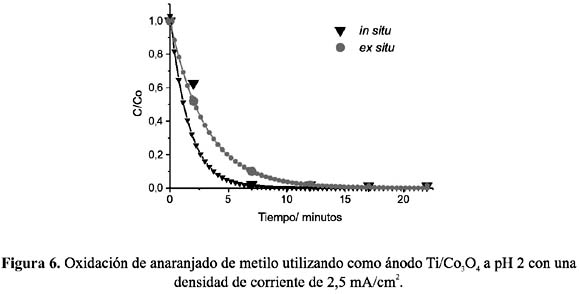
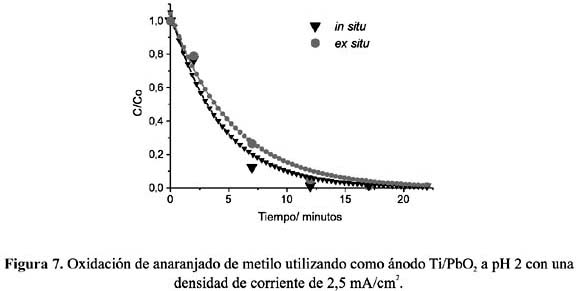
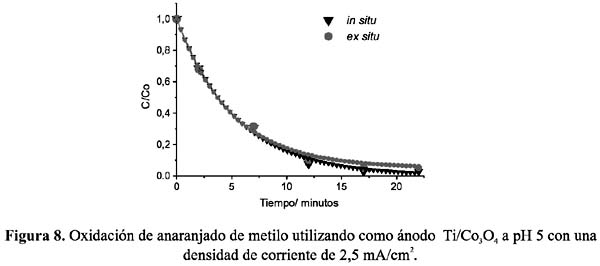
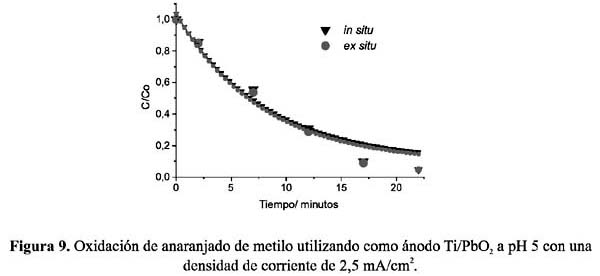
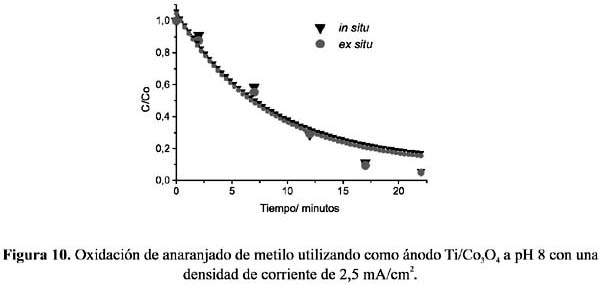
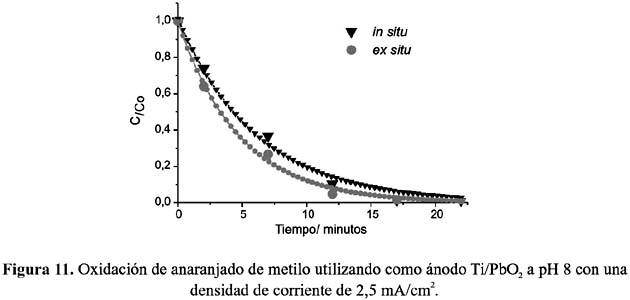
Del análisis comparativo de los gráficos se puede deducir que, en soluciones ácidas, la oxidación en condiciones in situ es mayor que la llevada a cabo ex situ, en donde el electrodo de espinela de cobalto muestra una mayor eficiencia que el de dióxido de plomo. Ésta puede ser atribuida a la característica propia del electrodo de espinela como electrocatalizador directo, mostrando actividad con las moléculas del AM protonadas. Por el contrario, la menor eficiencia de oxidación in situ a pH 8 de ambos electrodos nos indica que las moléculas de AM no protonadas estarían polarizando la reacción de formación de cloro disminuyendo la eficiencia de la oxidación.
Influencia del pH y del material del electrodo
Los gráficos presentados en las figuras 12 y 13 corresponden a pruebas in situ, y en ellos se muestran las curvas de decoloración del anaranjado de metilo utilizando electrodos de espinela de cobalto y de dióxido de plomo a diferentes valores de pH.
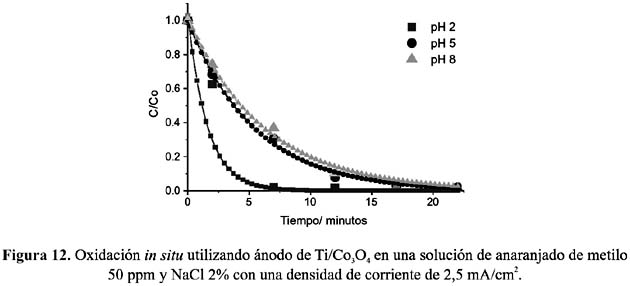
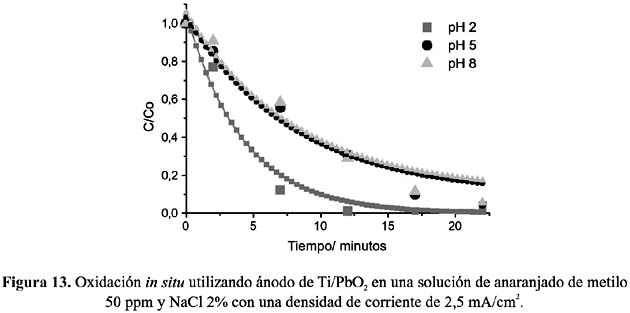
Los experimentos muestran que con ambos electrodos la remoción de color es más eficiente a valores de pH bajos y por el contrario, a pH altos la eficiencia decrece. Este comportamiento puede ser atribuido, esencialmente a dos razones: la primera debido al mayor potencial de oxidación del ácido hipocloroso, HOCl frente al ion hipoclorito ClO- y la segunda, a la mayor facilidad de rompimiento del enlace del cromóforo -N=N- cuando éste se encuentra protonado.
En general, también se debe considerar la posibilidad de ocurrencia de reacciones no deseadas, como la formación de clorato, ClO3-, a partir del ácido hipocloroso y del anión hipoclorito. El pH 8 de la solución es cercano al valor pK del ácido hipocloroso (pK = 7,2). Ácido hipocloroso y anión hipoclorito se encuentran aproximadamente en la misma proporción, desarrollándose la siguiente reacción:

El ion clorato formado es muy estable y no tiene propiedades oxidantes, excepto en soluciones muy ácidas. Esta reacción no deseada, tiende a disminuir la velocidad de decoloración8.
En la figura 14 se muestran las curvas de decaimiento de color utilizando tres diferentes electrodos a pH 2.
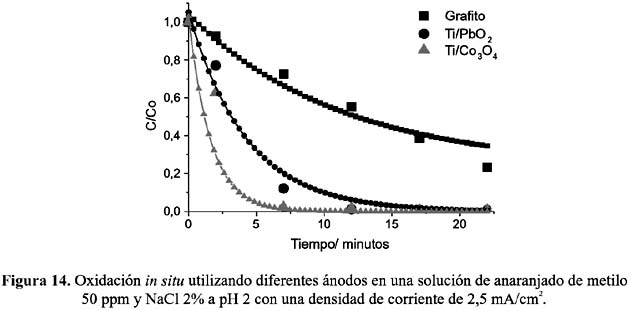
Como se puede observar, el electrodo de espinela de cobalto presenta la mayor eficiencia en la oxidación del AM. La diferencia de actividad de la espinela de cobalto frente a los otros dos electrodos puede ser atribuida a su naturaleza de óxido activo, es decir, en su mecanismo de oxidación participan los estados mixtos Co(II) y Co(III) contribuyendo a una mayor generación de especies oxidantes en el potencial de trabajo utilizado (figura 2).
Contribución de la superficie del electrodo a la oxidación directa del AM
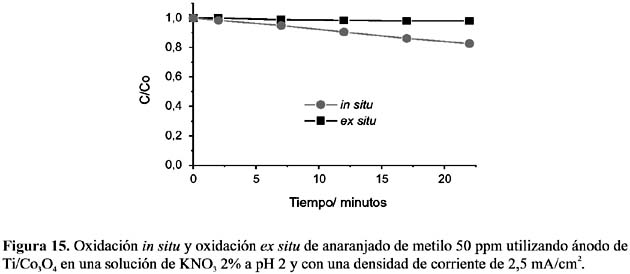
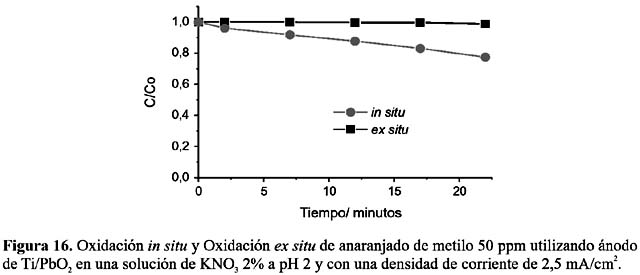
En los experimentos anteriores se ha demostrado que en soluciones ácidas los electrodos de Ti/Co3 O4 y de Ti/PbO2 muestran actividad superficial, promoviendo la transferencia de electrones directamente con las moléculas del AM. Con el propósito de identificar esta actividad se ha realizado la electrólisis del AM in situ y ex situ en solución ácida de nitrato de potasio, el cual, a las condiciones a las que se lleva a cabo la electrólisis, no generaría especies oxidantes.
Las figuras 15 y 16 demuestran que la electrólisis de KNO3 no produce agentes oxidantes capaces de oxidar al AM; sin embargo, en la electrólisis en condiciones in situ se observa un leve perfil de decaimiento del color, mostrando que ambos electrodos pueden oxidar directamente al AM.
CONCLUSIONES
-
Como podemos apreciar en las figuras 6 y 7, en medio ácido, tanto para la espinela de cobalto como para el dióxido de plomo, se consigue una mayor velocidad de remoción de color en la oxidación in situ.
-
A valores bajos de pH se genera el ácido hipocloroso, un poderoso agente oxidante (Eo = 1,62 V). Debemos considerar también que el anaranjado de metilo en su forma ácida ofrece poca resistencia a la oxidación.
-
En medio fuertemente ácido (pH 2), todos los electrodos probados oxidaron con mayor velocidad al colorante azo. La menor velocidad de remoción de color se obtuvo en medio básico (pH 8).
-
Podemos atribuir la menor remoción de color en medio básico al doble enlace -N=N- que posee el anaranjado de metilo en su estructura y a la formación del anión clorato que no presenta propiedades oxidantes.
-
El electrodo de espinela de cobalto es más eficiente en la remoción de color en medio ácido que los electrodos de dióxido de plomo y de grafito.
-
Llevando a cabo la electrólisis en una solución de KNO3, ambos electrodos probaron ejercer una acción oxidante directa sobre el compuesto azo.
REFERENCIAS
1. H. B. Beer, Brit. Patent, 1 147 442 (1965).
2. S. Trassati. Electrochimica Acta Vol. 29 No. 11 (1984) pp. 1503- 1512.
3. J. Gong; C. Weimin. Plasma Science and Technology. Vol. 9, No. 2 (2007) p. 190.
4. Preparación y comportamiento de ánodos de dióxido de plomo soportados sobre titanio. Memoria para optar el grado de licenciado. José González García. Alicante (1992) pp. 45- 48.
5. S. Trassati. Electrodes of conductive metallic oxides. Part A. Elsevier Scientific (1981) pp. 221-259.
6. M. Ghaemi, E. Ghafouri, J. Neshati. Influence of the nonionic surfactant Triton X-100 on electrocrystallization and electrochemical performance of lead dioxide electrode. Journal of Power Sources 157 (2006) pp. 550- 562.
7. E. Deltombe y M. Pourbaix. Atlas of Electrochemical Equilibria in aqueous Solutions. Peragmon Press, Oxford (1966) p. 322.
8. Vijayakumar Sundaram. Tesis para optar el grado de Master of Science. Universidad de Cincinnati. (2005) pp. 23- 45.













