Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.4 Lima Oct./dic. 2007
TRABAJOS ORIGINALES
Actividad citotóxica y antioxidante de los productos de la reacción de Maillard de los sistemas modelo D-glucosa – glicina y D-glucosa – L-lisina
Citotoxic and antioxidant activity of millard reaction products (MRPs) from D-glucose-glycine and D-glucose-L-lysine model systems
Gisella Miranda I., José Ventura H., Silvia Suárez C.2 y César Fuertes R.1*
1* Instituto de Investigación de Ciencias Farmacéuticas y Recursos Naturales Juan de Dios Guevara, Facultad de Farmacia y Bioquímica - UNMSM
2 Centro de Investigación de Bioquímica y Nutrición Facultad de Medicina Humana - UNMSM
RESUMEN
Las melanoidinas son causantes del pardeamiento químico que experimentan los alimentos y los medicamentos. El objetivo de este trabajo fue conocer si los productos de Maillard poseen propiedades citotóxicas y antioxidantes. Se determinó la actividad antioxidante y citotóxica de los productos de la reacción de Maillard (MRP), obtenidos por síntesis a partir de los sistemas modelo D-glucosa - glicina y D-glucosa - L-lisina, y se caracterizó por espectroscopía UV/VIS e infrarroja. La actividad antioxidante fue determinada por autoxidación del pirogalol (inhibición del radical superóxido). Se obtuvo 54% de inhibición para el sistema D-glucosa - L-lisina y 52,24% para el sistema D-glucosa - glicina; la inhibición del radical hidroxilo por el método indirecto de Fenton modificado, mostró la formación de 1,25picomol/mL del complejo malondialdehído (MDA) para el sistema D-glucosa - glicina y 3,05 picomol/mL para el sistema D-glucosa - L-lisina. En cuanto a la citotoxicidad se obtuvo un 100% de embriones no viables en el sistema D-glucosa - Llisina, y 58% con el sistema D-glucosa-glicina a las 24 horas de fecundación y a una concentración de 0,25 mL de MRP en 2,75mL de agua de mar. Los productos de Maillard tienen actividad antioxidante (antirradical libre); los productos obtenidos a las 6 horas de reacción presentan actividad citotóxica según el modelo de huevos fértiles de erizo de mar.
Palabras clave: Reacción Maillard, melanoidina, citotoxicidad, antioxidante, espectroscopía infrarroja.
ABSTRACT
Melanoidins produce the chemical browning that food and pharmaceuticals experience. The objective was to know, if Maillard products have citotoxic and antioxidant properties. It was determined the antioxidant and citotoxic activity of Maillard reaction products (MRP),obtained by synthesis from D-glucose-glycine and D-glucose-L-lysine model systems and characterized by uv/vis and infrared spectroscopy. The antioxidant activity was determined by pyrogalol autooxidation (superoxide radical inhibition). It was obtained 54% * of inhibition for D-glucose-L-lysine system and 52,24% for D-glucose-glycine system; the inhibition of hydroxile radical by modified fenton's indirect method showed a formation of 1,25 picomol/mL of malondialdehyde complex (MDA) for D-glucose-glycine system and 3,05 picomol/mL for D-glucose-L-lysibe system. In terms of citotoxicity, it was obtained a 100% of nonviable embryos in the D-glucose-L-lysine system, and 58% with D-glucoseglycine system at 24 hours of fertilization and at a concentration of 0,25mL of MRP in 2,75mL of sea water. Maillard products have an antioxidant activity (free antiradical); the obtained products at a 6-hour-reaction present citotoxic activity according to the fertile sea urchin's egg model.
Key words: Maillard reaction, melanoidin, citotoxicity, antioxidant, infrared spectroscopy.
INTRODUCCIÓN
Las reacciones del pardeamiento son algunos de los más importantes fenómenos ocurridos en el procesamiento y almacenamiento de los alimentos, y representan una interesante área de investigación en la tecnología y estabilidad de alimentos, así como en nutrición y salud1,2.
La reacción de Maillard es conocida también como una reacción de pardeamiento no enzimático; en la industria de alimentos es responsable de la formación del sabor, color y aroma. Está influenciada por muchos factores como: reactantes, temperatura, pH, tiempo, actividad del agua y concentración de los reactantes1-5.
La reacción entre la formación de color de los productos de la reacción de Maillard (MRP) y la actividad antioxidante fue también confirmada en comestibles como el café, tomate y cerveza, por la habilidad que tienen estas fracciones de quelar metales y reducir compuestos carbonílicos6.
Algunos productos MRP tienen grupos pirrólicos, los que presentan una gran actividad antioxidante, sobre todo cuando aquéllos son solubles en agua7-9.
La reacción de Maillard que tiene como base la interacción entre azúcares reductores y aminoácidos libres o grupos aminos terminales de las proteínas, se lleva a cabo a través de la formación de una base de Schiff, seguido del reordenamiento de Amadori, la formación de dicetosaminas, una enolización y la reacción de Strecker10.
Se acepta, generalmente, que las especies fluorescentes son precursoras de la formación de los pigmentos marrones. El color ocurre debido a la formación de grupos cromóforos, de componentes poliméricos de alto peso molecular conocidos como melanoidinas. Estos son, generalmente, formados por la reacción de los productos de Amadori, es decir, entre compuestos dicarbonílicos y aminoácidos. El pH, y la temperatura influyen en la formación de especies fluorescentes y pardas. Las fracciones heterocíclicas como pirazinas, pirroles, piridinas, oxazoles y oxalinas son generalmente los responsables del aroma de Maillard10.
Con relación al bioensayo de citotoxicidad, una considerable cantidad de investigaciones en el desarrollo biológico, utiliza el modelo del erizo de mar como método para determinar la actividad citotóxica, usando los embriones de erizo recientemente fecundados11,12.
El presente trabajo se ha llevado a cabo teniendo como objetivo determinar la actividad antioxidante (antirradical libre) y el efecto citotóxico, así como determinar algunos componentes de la estructura de los productos obtenidos mediante la reacción de Maillard utilizando dos modelos de síntesis.
MATERIALES Y MÉTODOS
Síntesis de los productos de Maillard (MRP): Se preparó dos sistemas modelo: Dglucosa- glicina 0,5 M y D-glucosa- L-lisina 0,5 M; ajustando el pH a 7,4 con una solución de bicarbonato de sodio 1M. Luego se llevó a reflujo por 6 horas en baño María a 90°C, extrayéndose alícuotas de muestra por cada 2 horas de reflujo.
Determinación de la inhibición de radical superóxido (O2) Se basa en la autoxidación 2 espontánea del pirogalol en medio básico. Al generarse el radical O en el medio de reacción, 2 se aceleró la autoxidación del pirogalol. La presencia de un secuestrador del radical anión superóxido inhibió la reacción de autoxidación del pirogalol. Se preparó la muestra con una mezcla de 890 μL de buffer tris clorhidrato de hidroximetilaminometano 0,05M pH 8,2 (que contiene DTPA 1 mM) y 60 μL de MRP; seguidamente se llevó a baño María a 37°C por 1 minuto y se agregó 50 L de pirogalol 2 mM (en HCl 0,01 N). Se preparó un blanco y se leyeron las absorbancias a 420 nm en intervalos de 1 minuto hasta cumplir 5 minutos en el espectrofotómetro UV/VIS Double beam PC, LABOMED INC del laboratorio de Bioquímica del Centro de Investigación de Bioquímica y Nutrición de la Facultad de Medicina Humana de la UNMSM.
Determinación de la inhibición de radical hidroxilo (OH) Se basó en la generación de radicales hidroxilo por oxidación del Fe+2 a Fe+3 en presencia de un agente reductor. Los radicales hidroxílicos degradaron la glucosa y aminoácidos generando diversos compuestos que al reaccionar con el ácido tiobarbitúrico (TBA) forman el complejo cromóforo malondialdehído (MDA). Se preparó una solución muestra con 1 mL de MRP y 0,2 mL de sulfato de hierro (II) 12 mM; se calentó a 37°C por 15 minutos, luego se diluyó a 1:4 y con el buffer fosfato 0,1 M en cloruro de sodio 0,15 M separando cada solución en dos tubos (0,5 mL en cada uno).
Seguidamente se incorporó a cada tubo 1mL de TBA 1% en hidróxido de sodio 0,05 M y 1mL de ácido acético glacial. Se calentó a 100°C por 30 minutos y se enfrió a chorro de agua fría. También se prepararon tubos blancos y muestra sustituyendo el sulfato de hierro (II) por buffer fosfato. Se leyeron las absorbancias a 532 nm en el espectrofotómetro.
Bioensayo de citotoxicidad: Se recolectó la especie de erizos de mar Tetrapygus niger, en el balneario de Ancón, trasladándolos al laboratorio en condiciones lo más naturales posibles. Se extrajo los gametos masculinos y femeninos de los erizos y se realizan una fertilización in vitro. La aparición de la membrana de fertilización (color amarillo) significa que la fertilización se realizó en condiciones óptimas. Se prepararon dos baterías de muestra, en viales, una con 0,25 mL de MRP y la otra con 0,50 mL de MRP; ambas fueron diluidas con agua de mar filtrada c.s.p. 1mL, luego se agregaron 2 mL de agua de mar conteniendo los óvulos fertilizados y se agitó en sentido horario y antihorario. Seguidamente, se colocó los viales en una canastilla y se llevó a una cámara de frío (17°C) con agitador magnético constante, para favorecer el desarrollo de embriones. Se realizaron observaciones a las 24, 48 y 72 horas de haberse producido la fecundación in vitro, con ayuda de un microscopio estereoscopio electrónico para observar si la muestra expuesta tiene el efecto citotóxico sobre el desarrollo de embriones. Se preparó un blanco haciéndole el mismo tratamiento de las muestras. Se observó cada vial con el microscopio estereoscopio; se empezó con el control de la muestra para establecer un porcentaje de células vivas (condición óptima 100%) y que permitió observar si la fecundación fue dada en condiciones óptimas. Después de observado el control, se continuó con los demás viales.
Análisis espectroscópico: Se realizó un barrido espectral utilizando el espectrofotómetro UV-VIS Hewlett Packard 8452ª y también se sometieron a un barrido espectral infrarrojo en el espectrómetro Spectrum One FT-IR Spectrometer Perkin Elmer.
RESULTADOS
Determinación de la inhibición de radical superóxido (.O ) En los gráficos siguientes 2 se observa el comportamiento de los productos de la reacción de Maillard, según los modelos D-glucosa-glicina (figuras 1 y 2) y D-glucosa-L-lisina (figuras 3 y 4), frente a los radicales libres superóxido e hidroxilo a 90°C, observando la evolución del ensayo a las 2, 4 y 6 horas, expresado en el porcentaje de autoxidación del pirogalol acelerado por presencia del radical libre superóxido, e inhibido por los productos de Maillard, o la inhibición de la producción de malonaldehido.
Bioensayo de citotoxicidad
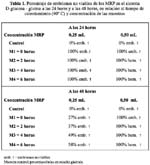
Sistema D-glucosa - glicina: En la tabla 1, se observa el porcentaje de embriones no viables de los productos de Maillard, del modelo D-glucosa- glicina a 90°C y durante 24 y 48 horas a la concentración de 0,25mL y 0,50mL. En la tabla 2 los resultados del modelo D-glucosa – Llisina en las mismas condiciones que el ensayo anterior.
Espectroscopía IR:
Sistema D-glucosa - glicina: Con el propósito de evaluar, de modo general, la estructura de los productos de Maillard, se realizó una determinación espectroscópica infrarroja, tal como se señala en las tablas 3 y 4 y figuras 5 y 6.
DISCUSIÓN
En las figuras 1 y 2 se observa el progreso de la capacidad de atrapar radicales O 2 superóxido, por los MRP obtenidos en los sistemas D-glucosa-glicina y D-glucosa-L-lisina, respectivamente; a las 6 horas de calentamiento la reacción exhibe MRP con mayor inhibitoria. Se reportan los resultados comparativos por el tiempo de calentamiento en ambos casos, lo que nos permiten inferir que los MRP obtenidos poseen actividad antioxidante. Asimismo, la actividad antioxidante podría deberse a la presencia de melanoidinas, que además, son responsables del color, aroma y textura de los alimentos tostados. Diversos estudios2,10-13 corroboran esta propiedad de las melanoidinas; sin embargo, no podemos aseverar que esta dismutación del radical O sea el mecanismo de acción exacto de las 2 melanoidinas puesto que aún no se conoce la estructura exacta de estos compuestos.
Analizando los resultados de las figuras 3 y 4 que muestran la inhibición del radical -OH de los sistemas D-glucosa-glicina y D-glucosa- L-lisina, respectivamente, la mayor capacidad inhibitoria la mostraron los MRP obtenidos del sistema D-glucosa-glicina entre las 2 y 4 horas de calentamiento. Sorprendentemente, esta capacidad se pierde con dos horas adicionales de calentamiento, lo cual podría deberse a la demostración de una actividad prooxidante. En cambio en la figura 4 se puede observar el progreso de actividad prooxidante a antioxidante que podría sugerir, de acuerdo a las etapas de la reacción de Maillard que señalan Oliver y col.14, que los productos iniciales e intermedios de la reacción pueden favorecer la oxidación, lo que no ocurre cuando se forman estructuras poliméricas como las melanoidinas que podrían ser las responsables de los resultados obtenidos a las 6 horas de calentamiento14.
Es necesario considerar que diversos estudios señalan que los MRP son potencialmente mutagénicos; sin embargo, otros estudios señalan que tienen actividad citotóxica15 y antimutagénica16 lo cual estaría ligado a su actividad antioxidante. En el presente estudio la actividad citotóxica aumenta entre las 4 y 6 horas de calentamiento, tiempo en el que coincide con los resultados se actividad antioxidante del sistema D-glucosa-L-lisina. Sin embargo, no tenemos argumentos para explicar estos resultados; pero, cabe señalar que la investigación constituye un estudio inicial para observar la bioactividad de los MRP; en todo caso se hacen necesarios mayores ensayos biológicos para intentar hallar una respuesta a estos resultados.
En nuestro país no existen estudios publicados en este tema, potencialmente aplicable en la industria de los alimentos y en el campo clínico.
CONCLUSIONES
Los productos de la reacción de Maillard, del sistema D-glucosa-L-lisina producen un mayor pardeamiento al compararlos con los productos del sistema D-glucosa-glicina.
La actividad antioxidante, sobre los radicales libres superóxido o hidroxilo, aumenta con la concentración de los productos de Maillard; asimismo, éstos ocasionan importantes cambios en el desarrollo de los embriones del erizo de mar, la citotoxicidad es expresada en altos porcentajes de células no viables, alcanzando a las 24 horas 53% para el sistema Dglucosa- glicina y 100% para el sistema D-glucosa-L-glicina.
REFERENCIAS
1. Manzocco L., Calligaris D., Mastrocola M., Lerici C. Review of non-enzymatic browning and antioxidant capacity in processed foods. Food Sci Technol Res. 2001;11:340-346.
2. Martins S., Jongen W., Boekel M. Unravelling the Maillard reaction network by multiresponse kinetic modelling. Food Sci Technol Res. 2001;11:364-373.
3. Ames J. The Maillard Reaction. In B.J.F. Hudson (Ed), Biochemistry of food proteins (Chapter 4). Elselvier Applied Science. London, 1992.
4. Morales F. Application of capillary zone electrophoresis to the study of food and foodmodel melanoidins. Food Chem. 2002;76:363-369.
5. Fry L, Lewis D. Formation of Maillard Reaction products in parenteral alimentation solutions. J Nutr. 1982; 112:1631-1637.
6. Borrelli R., Fogliano V., Monti S., Ames J. Characterization of melanoidins from a glucose – glycine model system. Eur Food Res Technol. 2002;215(3):210-215.
7. Yanagimoto K., Lee K., Ochi H., Shibamoto T. Antioxidant activity of heterocyclic compounds formed in Maillard reaction products. Int Congr. Ser 2002;1245:335-340.
8. Wagner K., Derkits S., Herr M., Schuh W., Elmadfa I. Antioxidant potential of melanoidins isolated from a roasted glucose-glycine model. Food Chem. 2002;78:375- 382.
9. Yilmaz Y., Toledo R. Antioxidant activity of water-soluble Maillard reaction products. Food Chem. 2005;93:273-276.
10. Borrelli R., Viscondi A., Mennella C., Anese M., Fogliano V. Chemical characterization and antioxidant properties of coffee melanoidins. J Agric Food Chem. 2002;50(22):6527-33.
11. Ibáñez L. Evaluación citotóxica, antimicótica, antimutagénica y antiviral de Calophylum brasilense. Tesis para optar al Grado Académico de Doctor en Farmacia y Bioquímica: UNMSM. Lima, 2004.
12. Hofmann T. Studies on melanoidin-type colorants generated from the Maillard reaction of protein-bound lysine and furan-2carboxaldehyde-chemical characterization of a red coloured domaine. Z Lebensm Unters Forsch. 1998; 206:251-258.
13. Machiels D., Istasse L. La reaction de Maillard: importance et applications en chimie des aliments. Méd. Vét. 2002;146,347-352.
14. Oliver Ch., Melton L.,Stanley R. Critical Reviews in Food Science and Nutrition. 2006; Vol.46;Iss 4;337-351.
15. Jing H., Kitts D. Chemical characterization of different sugar-casein Maillard reaction products and protective effects on chemical-induced cytotoxicity of Caco-2cells. Food Chem Toxicol. 2004; 42:1833-1844.
16. Gow-Chin Y., Ping-Ping H. Possible mechanisms of antimutagenic effect of Maillard reaction products prepared from xylose and lysine. J Agric Food Chem. 1994; 42:133- 137. Ann.