Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.4 Lima Oct./dic. 2007
TRABAJOS ORIGINALES
Aislamiento y algunas propiedades bioquímicas de una hialuronato glucanohidrolasa del veneno de la serpiente Lachesis muta Shushupe
Isolation and some biochemical properties of a hyaluronate glucanohydrolase from the venom of Lachesis muta, peruvian snake
Hurtado, L. ; Lerma, L. ; Rodríguez, E. ; Yarlequé, A*
Laboratorio de Biología Molecular – Facultad de Ciencias Biológicas – Universidad Nacional Mayor de San Marcos. Lima, Perú.
* Correspondencia: ayarlequec@unmsm.edu.pe
RESUMEN
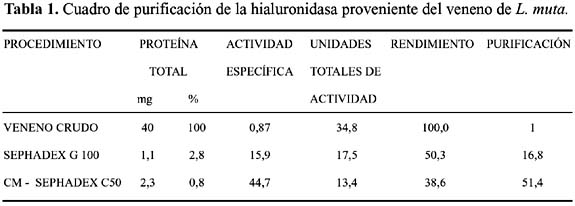
A partir del veneno liofilizado de la serpiente peruana Lachesis muta se ha obtenido un factor proteico capaz de degradar ácido hialurónico, el cual contiene la actividad de hialuronato glicanohidrolasa. Este factor fue purificado a través de dos pasos cromatográficos: el primero en Sephadex G100 y el segundo de CM-Sephadex C-50; ambas columnas fueron equilibradas con buffer acetato de amonio 0,05 M pH 5,0. La enzima pura fue obtenida luego de aplicar una gradiente de NaCl desde 0 hasta 0,7 M en el segundo paso, lográndose una purificación de 51,4 veces, un rendimiento del 38,6% y una recuperación de proteína activa de 0,8%.
La enzima aislada mostró un pH óptimo de 5,0, y mediante PAGE-SDS se determinó que su peso molecular fue de 65 kDa. Se trata de una glicoproteína básica que contiene 15,59% de hexosas, 1,93% de hexosaminas y 0,92% de ácido siálico. Asimismo, el tratamiento con diversos inhibidores enzimáticos mostró que el TLCK a concentraciones de 12 mM inhibió el 40,04% de la actividad inicial, lo que sugiere la presencia de histidina en el sitio activo de la enzima.
Palabras clave: enzima, veneno, serpiente, acido hialurónico, aislamiento.
ABSTRACT
A proteic factor capable to produce hydrolysis into hyaluronic acid was purified from the venom of Lachesis muta, peruvian snake. Using two chromatographic steps: Sephadex G100 followed by CM-Sephadex C-50 columns equilibrated with 0,05M ammonium acetate buffer pH 5,0, purified factor was eluted from the second column with 0 – 0,7 M NaCl linear gradient with 51,4 folds, 38,6 of yield and 0,8% recovering protein.
Isolated enzyme showed 5.0 optimus pH and 65 kDa as molecular weight by PAGE SDS. It is an alkaline glycoprotein containing 15,59% hexoses, 1,93% hexosamines and 0,92% sialic acid. Besides, 12 mM TLCK reduced to 40,04% the initial enzymatic activity, suggesting that histidine is involved into active site.
Key words: enzyme, venom, hyaluronic acid, isolation.
INTRODUCCIÓN
Los venenos de serpientes son complejos proteicos en los que se registran por lo menos dos grupos de proteínas principales: aquéllas que actúan como enzimas causando hemorragia, coagulación y necrosis y las otras que son toxinas capaces de afectar al sistema nervioso y al músculo cardiaco1,2. Los venenos de la familia viperidae, que corresponde a la mayoría de las serpientes peruanas, son fundamentalmente proteolíticos; en estos ha sido posible aislar factores coagulantes como la enzima similar a trombina del veneno de Lachesis muta3, una hemorragina de Bothrops brazili4, proteasas con actividad sobre caseína como la atroxina del veneno de Bothrops atrox5, así como proteinasa I obtenida de la ponzoña de Lachesis muta6. La serpiente Lachesis muta tiene una amplia distribución en Sudamérica con particular abundancia en los departamentos peruanos de Ucayali, Huánuco y Amazonas7, 8. Su veneno causa una potente hipotensión y coagulación sanguínea extendiéndose su acción a diferentes tejidos y al plasma sanguíneo a través de diversos factores proteolíticos, hemorrágicos y miotóxicos9.
Es en el contexto del envenenamiento ofídico que los factores que facilitan la difusión de los principios bioactivos, desde su lugar de inoculación hasta los órganos o sitios diana, cobran particular importancia. En este sentido Durand-Reynals (1936)10, demostró que las hialuronato glucanohidrolasas o hialuronidasas (EC.3.2.1.35), potencian la difusión de las sustancias inyectadas por vía subcutánea y en el año 2003 Yingprasertchai et al.11 demostraron que la inhibición de esta enzima en los venenos de Naja kaouthia y Calloselasma rhodostoma prolongó la vida de ratones albinos inyectados con esta ponzoña.
Este grupo de enzimas han sido encontradas en una amplia variedad de serpientes venenosas, observándose que se halla en mayor cantidad y actividad en los fluidos tóxicos de los vipéridos, mientras que en las de la familia elápidae ésta no es muy abundante y/o potente12,13. La enzima ha podido ser aislada a partir del veneno de las serpientes Agkistrodon acutus acutus14, Agkistrodon contortrix contortrix15 y Naja naja16, demostrándose en todos los casos que se trata de proteínas básicas con un pH óptimo en el rango ácido. Es debido a su importante rol en el mecanismo del envenenamiento ofídico, que decidimos purificar la hialuronidasa a partir del veneno de Lachesis muta la cual había sido previamente detectada en nuestro laboratorio17.
MATERIAL Y MÉTODOS
Veneno.- Fue obtenido de ejemplares adultos de la serpiente Lachesis muta procedentes del alto Marañón, región noreste de la selva peruana. Las serpientes mantenidas en el serpentario Oswaldo Meneses de la UNMSM fueron ordeñadas y el veneno fue liofilizado y conservado a 4°C.
Determinación de proteína.- Se estimó espectrofotométricamente a 280 nm por el método de Warburg y Christian18, y alternativamente por el método de Lowry et al.19, usando albúmina sérica bovina como estándar.
Actividad enzimática.- Fue calculada por el método turbidimétrico de Diferrante20. La mezcla de reacción fue 0,1 mg de ácido hialurónico de cordón umbilical humano en 0,5 ml de buffer acetato de amonio 0,05 M, conteniendo NaCl 0,15M pH 5,0 y 50 µl de la enzima. Luego de 15 minutos de incubación a 37°C se adicionaron 2 ml de reactivo de BCTA (bromuro cetil trimetil amonio) al 2% en NaOH al 2,5%. Finalmente, se midió la actividad a 400 nm en un espectrofotómetro UV – Visible Shimatzu. La actividad fue expresada en unidades Diferrante (UDF) la cual se define como la cantidad de proteína requerida para reducir la turbidez inicial del sustrato en un 50%.
Purificación de la enzima.- 50 mg de veneno crudo fueron aplicados a una columna de Sephadex G100 (45 x 1,2 cm), colectándose fracciones de 1 ml; aquellas que mostraron la mayor actividad se juntaron y cargaron a una columna de CM-Sephadex C-50 (18,5 x 1,2 cm.) a la cual, luego de 2 volúmenes de elusión isocrática, se aplicó una gradiente de NaCl de 0 a 0,7 M. Ambas columnas fueron equilibradas con buffer acetato de amonio 0,05 M pH 5,0.
Peso molecular y contenido de carbohidratos.- El peso molecular se calculó usando el método de PAGE-SDS21 en condiciones reductoras con albúmina bovina (66kDa), ovoalbúmina (45 kDa) y lisozima (14,3 kDa) como proteínas estándar. Asimismo, para estimar el contenido de hexosas y hexosaminas asociadas a la proteína en estudio, se usó el método de Winzler22, en tanto que el ácido siálico fue determinado por el método de Warren et al.23.
pH óptimo e inhibidores enzimáticos.- La medición del pH óptimo se realizó mediante una batería de buffers en un rango de pH de 2,5 a 7,0 usando los siguientes buffers: glicina HCl 0,01 M pH 2,5, 3,0 y 3,5; buffer acetato de sodio 0,1M a pH 4, 4,5 y 5,0 y buffer acetato de amonio 0,1M pH 5,5, 6,0, 6,5 y 7,0. Se preincubó la enzima por 5 minutos con cada uno de los pH´s seleccionados, luego de lo cual se midió su actividad.
En cuanto a la acción de agentes inhibidores, se ensayó el efecto de EDTA (ácido etilendiaminotetracético), iodoacetato, PMSF (fenil metil sulfonil fluoruro), TLCK (tosil lisil clorometil cetona) a concentraciones de 12 mM. Luego de preincubar por 5 minutos a 37°C cada uno de los agentes con la enzima, se procedió a medir la actividad de hialuronidasa.
RESULTADOS Y DISCUSIÓN
Aislamiento de la enzima.- La figura 1 muestra el perfil proteico obtenido tras el primer paso cromatográfico en Sephadex G100 en el cual se puede apreciar hasta cuatro picos proteicos, correspondiendo la actividad de hialuronidasa al primero de ellos. El pasaje de las fracciones con mayor actividad a través del intercambiador catiónico CM-Sephadex C50, rindió un perfil cromatográfico que puede ser observado en la figura 2, en donde la hialuronidasa se obtuvo al estado puro tras aplicarse una gradiente de NaCl desde 0 hasta 0,7 M. Bajo estas condiciones la enzima fue purificada 51,4 veces con un rendimiento de 38,6% y un porcentaje de proteína activa recuperada de 0,8% (Tabla 1).
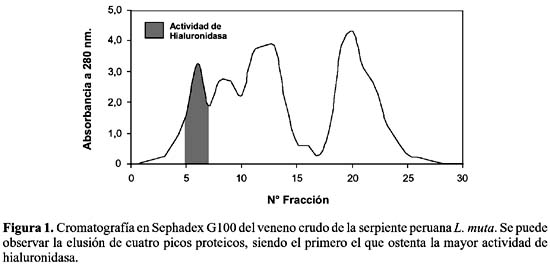
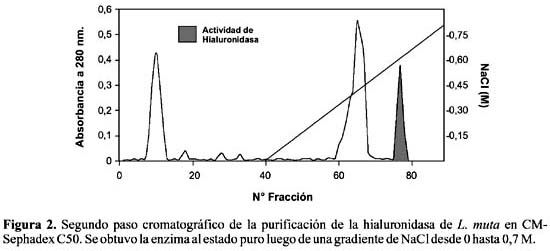
Así mismo, el análisis electroforético en geles de poliacrilamida (PAGE-SDS-12%) usando 2-mercaptoetanol como agente reductor, mostró el estado homogéneo de la proteína aislada, la cual corresponde a una estructura unicatenaria con un peso molecular de 65 kDa. Se trata, entonces, de una proteína básica de alto peso molecular.
Una de las interrogantes de mayor interés en el estudio de los venenos de origen animal, es entender de qué manera estos fluidos tóxicos son capaces de difundirse desde el lugar de su inoculación hasta órganos y tejidos distantes en donde ejercen su actividad nociva. Es evidente a partir de los estudios previos que las hialuronidasas tienen los atributos suficientes para considerarse como las principales responsables del efecto difusor a nivel del tejido conectivo, en donde el ácido hialurónico es uno de los principales componentes. Sin embargo, tenemos que establecer por un lado que cada veneno de serpiente, anfibio, insecto u otra especie tienen una peculiar composición química, lo cual determina que no es posible generalizar la cinética de difusión y por otra parte, si el veneno tiene por objeto inmovilizar o matar a la presa debe disponer de uno o más factores que permitan su rápida dispersión, de tal forma, que asegure la inmovilización de la presa antes de que ésta escape.
Para validar esta hipótesis es necesario, en primer lugar, obtener la enzima pura y en condiciones que permitan la estabilidad de su acción enzimática, para luego evaluar sus propiedades bioquímicas. La marcada inestabilidad de la enzima a pH neutro y ligeramente alcalino, en los que usualmente son estables la mayoría de los componentes del veneno2, así como su termosensibilidad, ya que se inactivan rápidamente en el rango de 37 – 40 °C17; fueron dos factores que se debían superar para poder disponer de esta enzima al estado purificado. El procedimiento cromatográfico descrito por Godoy, N.17, el cual incluía un primer paso en Sephadex G-100 a pH 5,0 con buffer acetato de sodio, dio lugar a una purificación de 2,5 veces con un rendimiento de 45,03%, en tanto que al usarse el segundo paso cromatográfico en CM-Sephadex C50, al mismo pH, la actividad se redujo drásticamente, obteniéndose valores de purificación de 0,95 veces con un rendimiento de 8,8%. Nuestro trabajo fue entonces buscar las condiciones apropiadas para estabilizar al máximo la enzima, habiendo observado que el acetato de amonio y el citrato eran los más idóneos.
El procedimiento cromatográfico desarrollado por nosotros e indicado en las figuras 1 y 2, muestran una exitosa purificación usando dos pasos cromatográficos en los cuales la proteína de 65 kDa se obtuvo con un rendimiento del 38,6%, habiendo elevado su potencia 51,4 veces. En este sentido, Xu et al.14 logró purificar una hialuronidasa de 33 kDa de la serpiente Agkistrodon acutus a través de tres pasos cromatográficos en CM-sephadex C50, Sephadex G75 y CM-sephadex C25, encontrando que esta enzima también se adhería a matrices negativas; esta investigación reportó una eficiencia del 6% otorgando un índice de purificación de 45 veces. Así mismo, del veneno de la serpiente Agkistrodon contortrix contortrix se reportó una hialuronidasa de 61 kDa, purificada mediante dos pasos cromatográficos en una columna de fase reversa de Sephacryl S-200 y CM-sephadex C25 luego de aplicar, NaCl 0,6 M, con una eficiencia del 17% y un valor de purificación de 27,7 veces. Estos resultados muestran que el procedimiento presentado en este estudio es útil y sencillo para obtener la enzima.
Carbohidratos asociados.- Los valores encontrados al determinar el contenido de carbohidratos asociados a la enzima se muestran en la tabla 2. Como puede observarse, la hialuronidasa aislada contiene 15,59% de hexosas, 1,93% de hexosaminas y 0,92% de ácido siálico, por lo que se trata de una glicoproteína. Así mismo, en el veneno crudo se ha encontrado 2,96% de hexosas, 0,37% de hexosaminas y 0,49% de ácido siálico.
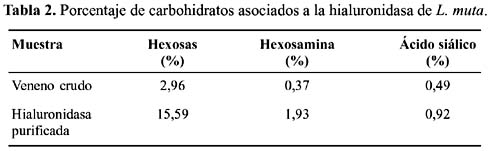
Debemos indicar que el presente trabajo, es el primer reporte acerca del contenido de carbohidratos asociados a la estructura de una enzima de tipo hialuronidasa; los azúcares se distribuyen de acuerdo a la tabla 2. Aunque no hemos podido observar si estos carbohidratos juegan un rol importante en la actividad catalítica, resulta obvio considerar que estos son importantes para conformar la estructura final de la proteína madura y para los fenómenos de reconocimiento antigénico.
pH óptimo.- Luego de ser evaluada a diferentes valores de pH, la enzima en estudio mostró un pH óptimo de 5,0 usando buffer acetato de amonio 0,05 M con NaCl 0,15 M (tabla 3). Observándose que a pH 3,0 la actividad sólo fue de 9% mientras que a pH 7,0 se anuló totalmente.

El pH óptimo, que puede ser observado en la tabla 3, reportado para la enzima en estudio, se encuentra en el rango ácido (pH 5,0), lo cual es concordante con los datos reportados para otras enzimas similares, tales como las hialuronidasas de las serpientes Agkistrodon contortrix contortrix y de Agkistrodon acutus, las cuales tienen valores de pH 6,015 y 4,014, respectivamente. Esto, además de la observación de que estas enzimas son de naturaleza básica, nos indica que ejercen su actividad hidrolítica al encontrarse electrostáticamente cargadas.
Efecto de inhibidores enzimáticos.- Los resultados obtenidos al utilizar inhibidores enzimáticos se indican en la tabla 4. Como puede apreciarse, el PMSF y el EDTA no ejercieron acción alguna sobre la actividad de hialuronidasa, en tanto que el yodoacetato afectó la actividad en 19,5% mientras que el TLCK produjo una inhibición de 40,91% de la actividad inicial.
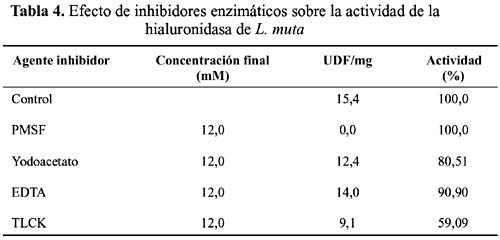
En cuanto al efecto ejercido por diversos agentes químicos (tabla 4) podemos observar una acción inhibitoria por parte del TLCK, lo cual es un claro indicio de que el aminoácido histidina jugaría un rol importante en el sitio catalítico de la enzima en estudio. Los datos obtenidos al analizar el efecto del EDTA nos indican que la enzima no requiere de cationes divalentes para su actividad hidrolítica. Asímismo, la poca sensibilidad de la hialuronidasa al tratamiento con yodoacetato nos indica la probable ausencia de grupos sulfhidrilo libres asociados al centro activo. Finalmente, no se observó ningún efecto causado por el PMSF, lo que indicaría la ausencia de serina en el sitio activo, ya que este reactivo es específico para dicho aminoácido.
Por tanto, el presente trabajo aporta una técnica rápida para el aislamiento de la hialuronidasa proveniente del veneno de la serpiente peruana Lachesis muta con adecuados valores de rendimiento y purificación, procedimiento que puede ser extensivo para purificar hialuronidasa de otros venenos de origen animal.
AGRADECIMIENTOS
Nuestro grupo de investigación agradece a la Academia de Ciencias para el Tercer Mundo (TWAS) y a la UNMSM por haber apoyado financieramente el presente estudio.
BIBLIOGRAFÍA
1. Tu, A. y Hendon, R. R. (1983). Characterization of lizard venoms Hyaluronidase and evidence for its action as a spreading factor. Comp. Biochem. Physiol. (1983) 76: 377 - 379.
2. Lee, Ch. Y. (1979). Enzymes in snake venom. Pp. 99 – 100. In. Spring-Verlag, M. (ed): Snake Venoms. Handbook of experimental pharmacology.
3. Yarlequé, A.; Campos, S.; Escobar, E.; Lazo, F.; Sánchez, N.; Hyslop, S.; Marsh, N.; Butterworth,P. y Price, R. (1989). Isolation and characterization of a fibrinogen-clotting enzyme from venom of the snake Lachesis muta muta (Peruvian bushmaster). Toxicon 27 (11): 1189 – 1197.
4. Isla, M.; Málaga, O. Y Yarlequé, A. (2003). Características bioquímicas y acción biológica de una hemorragína del veneno de Bothrops brazili. Anales de la Facultad de Medicina. 64 (3): 159 – 166.
5. Pantigoso, C.; Escobar, E.; Málaga, O. Y Yarlequé, A. (1996) Aislamiento y algunas propiedades de la Atroxina uno proteinasa del veneno de la serpiente peruana Bothrops atrox Jergón. Acta Científica Venezolana 47: 67 – 73.
6. Rodríguez, E. y Yarlequé, A. (1991) Aislamiento y algunas propiedades de la Proteinaza I del veneno de la serpiente peruana Lachesis muta. Acta Científica Venezolana 42: 219 – 225.
7. Meneses, O. (1974). Los animales venenosos y sus peligros. Instituto de Salud Pública. Lima – Perú. Publicación No 2 p. 3-14.
8. Carrillo, N. e Icochea, J. (1995). Lista taxonómica de los reptiles vivientes del Perú. Publicaciones del Museo de Historia Natural. UNMSM. Seria A. N°49 pp 1 – 27.
9. Magalhaes, A.; Ferreira, R.; Richardson, M.; Gontijo, S.; Yarlequé, A.; Magalhaes, H.; Bloch, C. and Sánchez, E. (2003). Coagulant Thrombin-like enzymes from the venoms of Braziliam and Peruviam busshmaster (Lachesis muta muta) snakes. Comparative Biochemestry and Physiology Part B 136: 255 - 266
10. Duran-Reynals, F., (1936). Invasion of the body by animal poisons. Science (83), 286–287.
11. Yingprasertchai, S.; Bunyasrisawat, S. y Ratanabanaan, K. (2003) Hyaluronidase inhibitors (Sodium cromoglycate and sodium auro-thiomalate) reduce the local tissue damage and prolong the survival time of mice injected with Naja Kaouthia and Calloselasma rhodostoma venoms. Toxicon 42. pp. 635-646.
12. Favilli, G. (1956). Occurrence of spreading factor and some properties of Hialuronidases in animal parasites and venoms, pp. 281 – 289. in: Buckley, E. and Porges, N. (eds.): Venoms. American Association for the Advancement of Science Washington D.C.
13. Zeller, E. A. (1948) Enzymes of snake venoms and their biological significance. Ad. Enzimol. 8: 459 – 495.
14. Xu, X.; Wang, X.; Xi, X.; Liu, J.; Huang, J. ; y Lu, Z. (1982). Purification and partial characterization of Hialuronidase from Five Pace Snake (Agkistrodom acutus acutus) venom. Toxicon 20: 973 – 978.
15. Kudo, K.; Tu, A. (2001). Characterization of a hyaluronidase isolated from Agkistrodon contortrix contortrix (southern copperhead) venom. Archives of biochemistry and biophysics Vol. 386 No. 2. pp. 154 – 162.
16. Girish, K. S.; Shashidharamurthy, R.; Nagaraju, S.; Gowda, T. V.; Kemparaju, K. (2004) Isolation and characterization of Hyaluronidase a Spreading factor from Indian cobra Naja naja venom. Biochimie 86: 193–202.
17. Godoy, N. 1992. Aislamiento y estudio algunas propiedades bioquimicas de una Hialuronidasa presente en el veneno de la serpiente peruana Lachesis muta Shushupe. Tesis para optar el Titulo de Licenciado en Biología, Universidad Ricardo Palma, Lima, Perú
18. Warburg, O. and Christian, W. (1941). Isolierung and cristallisation del Gärungs ferments enolase. Biochemische Zertschrift. 31, 384-421.
19. Lowry, O.H. Rosebrough, N.J. Farr, A.L. and RANDALL, R. (1951). Protein measurement with the folin phenol reagent. J. Biol. Chem. (1951) 193, 265-275.
20. Di-Ferrante, N. (1956). Turbidimetric measurement of acid mucopolysaccharides and hyaluronidase activity, J. Biol. Chem. 220 (1956) 303–306.
21. Laemmli, U. K. (1970). Clevage of structural protein during the assembly of the head of bacteriophage T4. Nature 227: 680 – 685.
22. Winzler, R. (1955). Determination of serum glycoproteins. pp. 279 – 311. In. Lundbard, R.; Fenton, J. W. and Mann, K. G. (eds.): Methods of Biochemical Analysis.
23. Warren, L. (1959). The thiobarbituric acid assay of sialic acids. J. Biol. Chem. (8): 1971 – 1975.













