Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.73 no.4 Lima Oct./dic. 2007
REVISIÓN
Síntesis de ligandos N, O y S dadores y sus complejos metálicos
synthesis of N, O and S donor ligands and its metallic complexes
Jorge Reinaldo Angulo Cornejo1,2
1 Departamento de Química Inorgánica, Instituto de Ciencias Químicas; Facultad de Química e Ingeniería Química, UNMSM, Ciudad Universitaria, Av. Venezuela s/n. Lima 100 - Perú
2 Universidad Nacional de Ingeniería, Facultad de Ciencias, Av. Túpac Amaru , 210, Rímac. joracperu@yahoo.es
RESUMEN
El presente review, está orientado a la síntesis de ligandos N, O y S dadores con capacidad de formar complejos quelatos electroneutrales y posibilidades de aplicación en la industria hidrometalúrgica y en bioinorgánica.
Palabras clave: benzoiltiourea, benzamidina, guanidinas, extracción, complejos metálicos, O-etiléster, S-etiltioéster.
ABSTRACT
The present review, it is faced to the synthesis of ligands N, O and S donors with aptitude to form electroneutral chelates complexes and possibilities of application in the hydrometallurgical industry and in the bioinorganic.
Key words: Benzoylthiourea, benzamidine, guanidine, extraction, metallic complexes, O-ethylester, S-ethylthioester.
INTRODUCCIÓN GENERAL
Las posibilidades de síntesis de ligandos N, O y S es muy amplia, por lo que nuestro interés se centrará en ligandos basados en la estructura de la tiourea sustituida y sus modificaciones por sustitución de uno o más átomos del esqueleto de la tiourea, tal como se puede observar en el esquema 1.
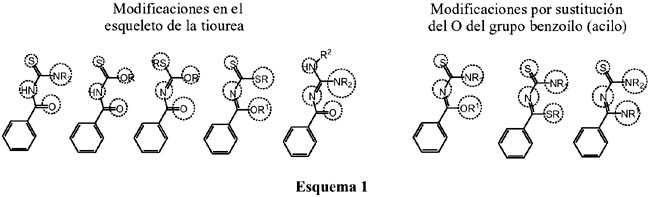
Como se puede observar en el esquema 1, es posible obtener diferentes ligandos por sustitución de cualquiera de los átomos del esqueleto de la tiourea o del oxígeno del grupo acilo.
¿Por qué nos interesan los ligandos N, O y S-dadores?
Nuestro interés por la química de los ligandos polinucleares con átomos N, S y O dadores, con capacidad de desprotonarse y formar complejos metálicos electroneutrales es, sin duda alguna evaluar las posibilidades de aplicación en la industria hidrometalúrgica, para la extracción de metales a partir de sus minerales. Como se sabe los ligandos que son utilizados en los procesos hidrometalúrgicos de extracción con solventes no acuosos, presentan características muy claras respecto a la formación de complejos quelatos electroneutrales, que sean solubles en la fase orgánica, lo que les permitirá separarse de la fase acuosa a un pH determinado. De esta manera podemos lograr una extracción selectiva de metales a diferentes valores de pH. En trabajos recientes se han estudiado algunos ligandos análogos de las aciltioureas como agentes quelantes, tal es el caso de los ligandos 1,1-dietil-3-benzoiltiourea y 1,1-fenil-3-benzoiltiourea1 evaluados en la extracción del cobre y plata. Los resultados obtenidos muestran que la capacidad de extracción de las aciltioureas funciona mejor para la extracción de la plata que para la extracción del cobre. En estos estudios se determinó que la capacidad de extracción de cada metal se incrementa con el pH de la solución acuosa. Estos resultados están en concordancia con la naturaleza ácida dura y blanda de Pearson. La plata (I) es un ácido más blando que el cobre (II), por esta razón tiene más afinidad por el azufre que tiene carácter de base blanda1,2.
Por otra parte, los compuestos en los que se combinan átomos ricos en electrones tales como nitrógeno, oxígeno y azufre con una disposición cercana entre ellos, suelen ser biológicamente activos3,4. Dicha actividad, generalmente, depende de la adecuada disposición de los átomos en la molécula, que no sólo actúan aumentando o disminuyendo la intensidad de sus propiedades sino, además, actúan restringiendo o ensanchando su espectro de acción5.
En este sentido, los compuestos orgánicos con estructura similar a las benzoiltioureas y ellas mismas, han mostrado propiedades tuberculostáticas3, antibacterianas y antiparasitarias notables.4 También se ha observado que la coordinación de metales a dichos compuestos suele tener influencia en sus propiedades biológicas, tanto reforzándolas como reduciéndolas, así como modificando el espectro de acción del ligando libre.
La actividad antimicótica6 del ácido benzoico-metiléster-2-{[(dietiltiocarbamoilimino) fenil-metil]-amino}y del ácido benzoico-metil éster-2-{[(morfolino-4- carbotioilimino)-fenil-metil]-amino}fue reportada frente a patógenos responsables de importantes enfermedades en las siembras (Botrytis cinerea, Colletotrichum fragariae, Fusarium oxysporum y Phoma betae), se encontró que la tiourea que tiene como terminal el grupo dietil presenta una mayor actividad respecto al ligando con terminal morfolino.
Asimismo se han reportado importantes trabajos sobre la actividad biológica de los complejos metálicos de las aciltioureas y sus derivados. Por ejemplo, en el 2002 se reportó el estudio de la interacción del ADN natural y sintético7 con una serie de complejos antitumorales de platino y las aciltioureas; se encontró que existe la coordinación del platino con el nitrógeno contenido en la base del ácido nucleico por el desplazamiento de cloruro.
¿Cómo sintetizamos y caracterizamos los ligandos?
Los métodos de síntesis de estos ligandos son relativamente fáciles; sobre todo es posible reproducir los experimentos a las condiciones del laboratorio, es decir, no requerimos de condiciones especiales como la atmósfera inerte, alto vacío, etc.
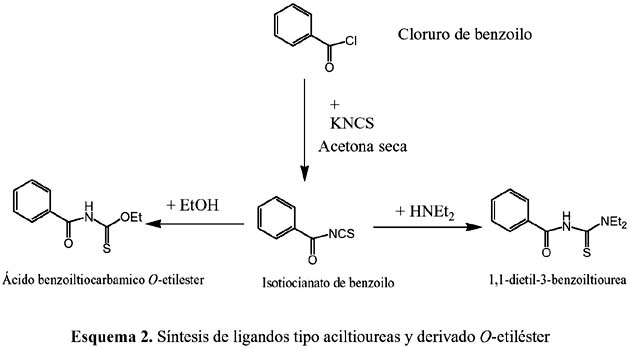
En el Esquema 2 se puede ver claramente cómo se prepara el precursor isocianato y los ligandos acilisoureas y el O-éster correspondiente. De manera similar (esquema 2) se pueden preparar otras aciltioureas; sólo se requiere utilizar la amina primaria o secundaria apropiada (HNR2:HNMe2, morfolina, HNPh2, H2NPh, etc.)
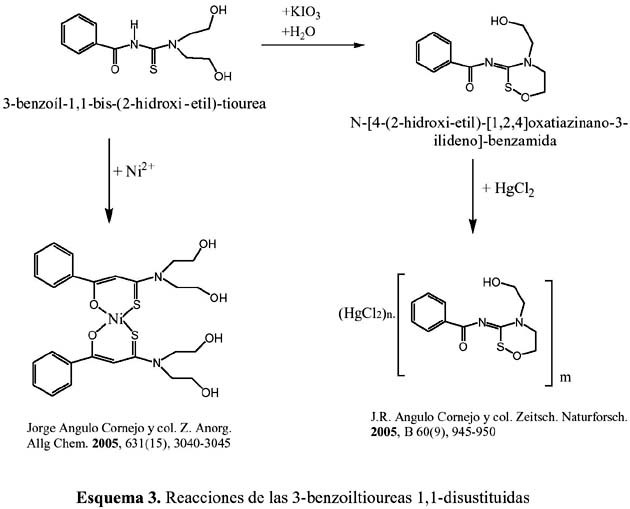
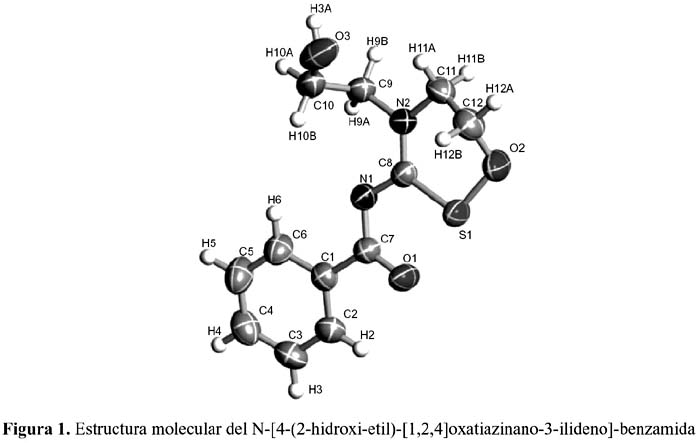
En general, la reacción de las aciltioureas disustituidas con los metales de transición como el CuII, NiII, PdII y otros metales, producen complejos electroneutrales de relación estequiométrica 1:2 (metal: ligando). En el esquema 3, como ejemplo mostramos la formación de un complejo metálico de níquel (II) con el ligando 3-benzoil-1,1-bis-(2-hidroxi-etil)- tiourea. Asimismo, se puede observar la reacción de este ligando con un agente oxidante (KIO ) en medio fuertemente acuoso, del cual se obtuvieron unos cristales transparentes del 3 ligando N-[4-(2-hidroxi-etil)-[1,2,4]oxatiazinano-3-ilideno]-benzamida, que sirvieron para el estudio por difracción de rayos X. En la figura 1 se puede observar la estructura del mencionado ligando.
En principio, creíamos que las posibilidades de reacción de las aciltioureas habían sido agotadas, pero ahora a la luz de los resultados podemos manifestar que las aciltioureas nos proporcionan grandes posibilidades de investigación.
Estamos seguros de que la reactividad de las N-aciltioureas 1-monosustituidas fue el motor que dio impulso a nuestras investigaciones8. En el esquema 4 podemos visualizar la reacción del acetato de cobre (II) con el 1-p-nitrofenil-3-benzoiltiourea en metanol. Sorprendentemente, se obtuvo a partir de la solución madre, el complejo de Bis(N-benzoíl-O- etil-N´-(p-nitrofenil-isoureato)cobre(II), el cual ha sido estudiado por difracción de rayos-X8.
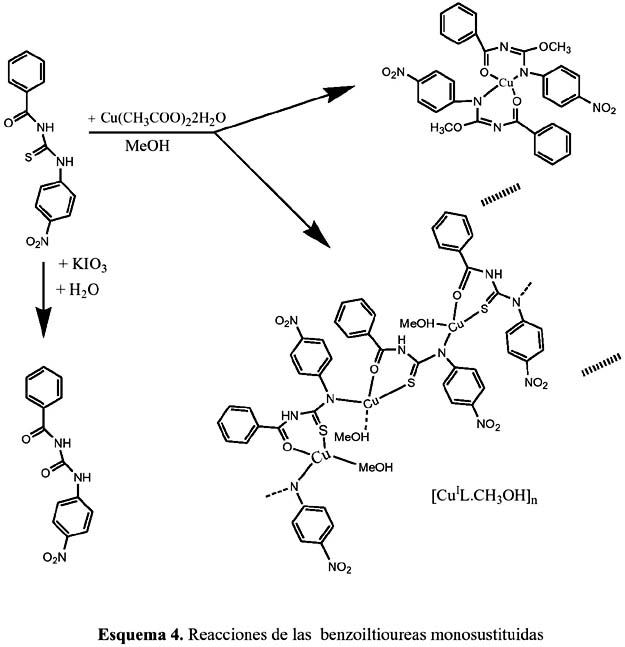
En el esquema 5 le dedicamos especial atención a la síntesis de ligandos que se forman por sustitución del grupo NR de las aciltioureas por el grupo OR y –OS, respectivamente8. Aquí 2 se puede ver la formación de sus respectivos complejos metálicos.
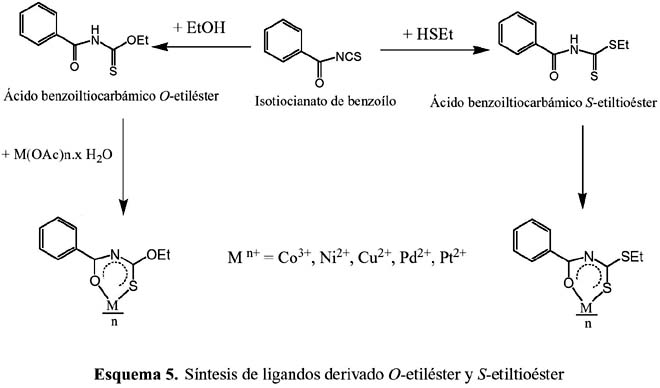
En la figura 2 se presenta el complejo de níquel (II) con el ligando ácido benzoiltiocarbámico -O-etiléster, cuya estructura fue resuelta por análisis estructural de rayos X.
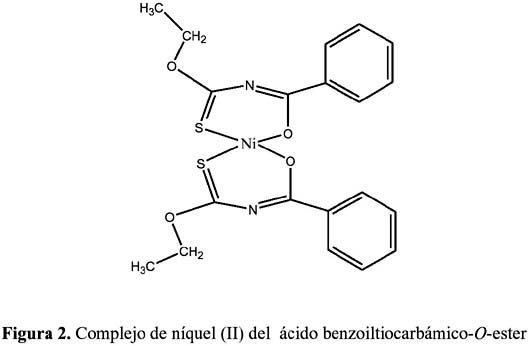
El esquema 6 resume la reactividad del ácido N-benzoiltiocarbámico- O,S-dietiléster para preparar los ligandos 2-benzoilimino-benzamidazolina (X=NH) y N-benzoil-O-etil-N´- m-nitrofenil-isourea y sus complejos metálicos de cobre(II) y níquel (II), respectivamente. 9,10a
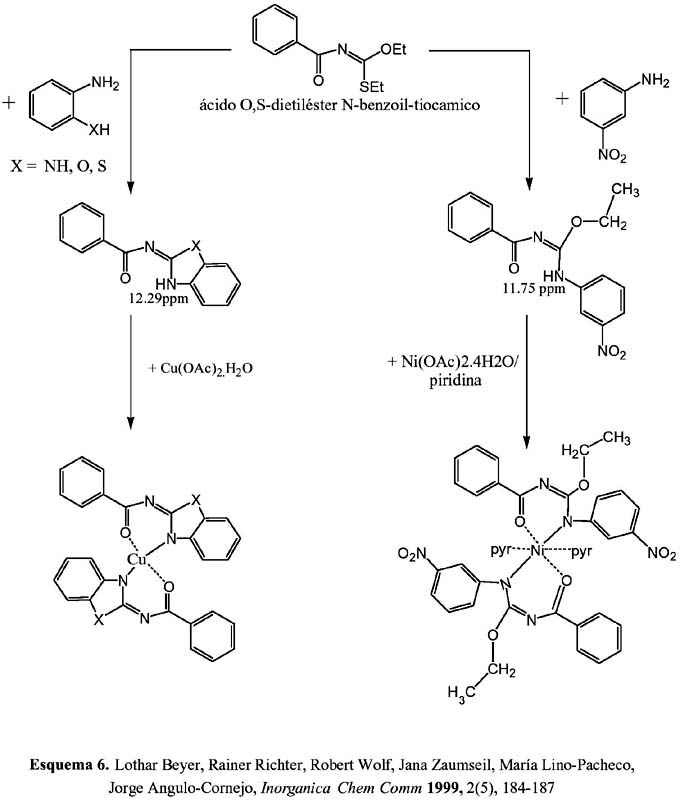
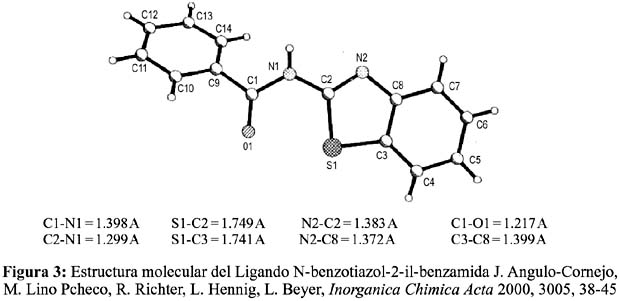
En la figura 3 se muestra el ligando (X= S)10b, que ha sido sintetizado de acuerdo con el esquema 6 por sustitución de los dos grupos O-, y S-éster y cuya estructura ha sido resuelta por análisis estructural de rayos-X.
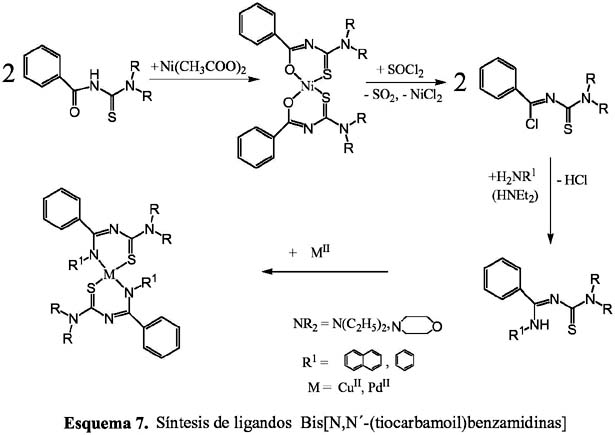
Otro aspecto importante en nuestras investigaciones ha sido la síntesis de ligandos en los que el oxígeno del grupo benzoilo de las aciltioureas es sustituido por aminas primarias o secundarias. En el esquema 7, 8 y 9 se presentan de manera general el procedimiento de síntesis de ligandos orgánicos que pasan por la preparación de los compuestos N- tiocarbamoil-benzimidoil cloruros11.
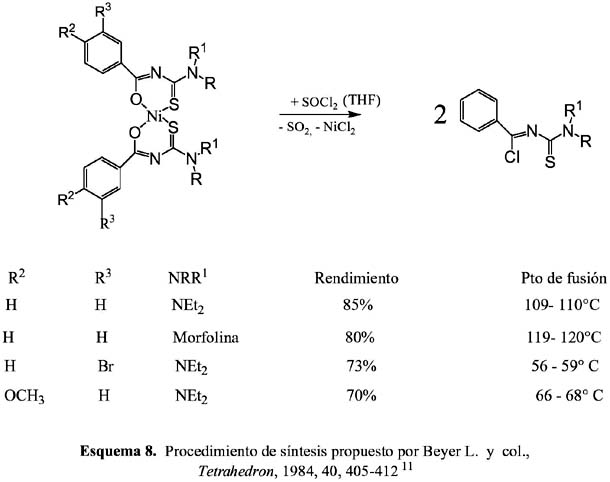
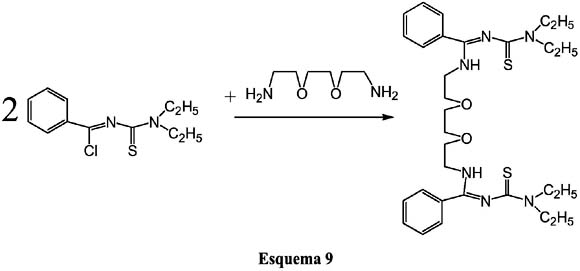
Es evidente que la sustitución del Cl del ligando precursor clorado, nos proporciona muchas vías sintéticas para obtener nuevos ligandos orgánicos con potenciales aplicaciones para la extracción de metales entre otras cosas, tal como se observa en el esquema 9.
REFERENCIAS
1. Anaya Meléndez F.; Angulo-Cornejo J.; Revista Peruana de Química e Ingeniería Química, 2002, 5(1), 23-28.
2. Angulo Cornejo J., Hernández Gorritti W., Bol. Soc. Quim. Perú, 2000, 66(2), 99-112.
3. Angulo-Cornejo Jorge R., Lino Pacheco María N., Sosa Amaya Frida, Bazalar de Valdivia Dolores, Rev. Soc. Quim.Perú, 2004, 70(4), 184-188.
4. Angulo-Cornejo Jorge R, Lino-Pacheco, María N., Quiroz-Huamán Rosa; Bazalar Velásquez Dolores, Rev. Soc. Quím Perú, 2006, 72(3), 117-128.
5. Bae J.W.; Lee S.H.; Cho Y.; Jung Y.J.; Hwang H.J.; Yoon C.M.; Tetrahedron Letters, 2000, 41, 5899.
6. Del Campo Rafael, Criado Julio J., García Eva, Hermosa María R., Jiménez-Sánchez A., Manzano Juan L., Monte Enrique, Rodríguez-Fernández E., Sanz Francisca, J. Inorg. Biochemistry 2002, 89,74-82.
7. Rodger Alison, Patel Kirti K., Sanders Karen J., Datt Michael, Sacht Cheryl, Hannon Michael J., J. Chem. Soc. Dalton Trans. 2002, 3656-3663.
8. Angulo-Cornejo J., Anaya-Meléndez F., Beyer L., Richter R., Sieler J., Z. Anorg. Allg.Chem. 1998, 624, 892.
9. Lino Pacheco María N., Tesis de Maestría, Facultad de Química e Ingeniería Química, UNMSM, Lima 2000.
10. Beyer L.;Richter R.; Wolf R.; Zaumseil J.; Lino-Pacheco M; Angulo-Cornejo J.; Inorganica Chem Comm 1999, 2(5), 184-187. 10b. Angulo-Cornejo Jorge, Lino-Pacheco María, Richter Rainer, Hennig Lothar, Hallmeier Kart-Heinz, Beyer Lothar, Inorganica Chimica Acta 2000, 305, 38-45.
11. Beyer L. Hartung J., Widera R., Tetrahedron, 1984, 40, 405-412.













