Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.74 n.1 Lima ene./mar. 2008
Efecto de aminoácidos sobre la oxidación de vitamina C inducida por Ion Cúprico
Óscar Reátegui Arévalo1, Alejandro Fukusaki Yoshizawa2 y Emilio Guija Poma*
1 Facultad de Medicina - Universidad Científica del Sur. Cantuarias 385, Miraflores, Lima 18 - Perú.
2 Universidad Nacional Agraria La Molina. Lima - Perú.
* eguija@ucsur.edu.pe
RESUMEN
Se ha estudiado la cinética de oxidación del ascorbato por ion cúprico a pH 7,4 en presencia de glicina, histidina y cisteína. Los aminoácidos antes citados inhiben este proceso a través de mecanismos que implicarían su interacción con el metal de transición, impidiendo, de esta manera, la reducción del cobre por el ascorbato e inhibiendo la generación de especies reactivas de oxígeno. La cisteína inhibe la oxidación del ascorbato mediante un proceso que es similar al mostrado por el EDTA. La acción inhibitoria que ejerce la histidina es dependiente del pH, habiendo mostrado un mayor efecto a pH 8,0.
Palabras clave: oxidación de ascorbato, aminoácidos, cobre, radicales libres.
ABSTRACT
The oxidation kinetics of ascorbate by cupric ions has been studied at pH 7,4, in the presence of glycine, histidina and cysteine. The mentioned aminoacids inhibit this process through mechanisms that imply their interaction with transition metal, not allowing the reduction of copper by ascorbate and inhibiting the generation of reactive oxygen species. Cysteine inhibits the oxidation of ascorbate by a process that is similar to the one shown by EDTA. The inhibiting action that is produced by histidine, is dependant of the pH, having shown a greater effect at pH 8,0.
Key words: oxidation of ascorbate, aminoacids, copper, free radicals.
INTRODUCCIÓN
La vitamina C es una sustancia hidrosoluble que el ser humano no la sintetiza por carecer de las enzimas necesarias para dicho propósito; en tal sentido, debe incorporarla necesariamente en su dieta 1,2,3. Esta vitamina cumple múltiples funciones en el organismo: participando en la síntesis de colágeno, absorción del hierro no hemínico, síntesis de carnitina, síntesis de sales biliares, síntesis de esteroides, etc. 1,2.
El ácido ascórbico es un compuesto con una eficiente capacidad de reducción que, a través de la pérdida secuencial de un electrón, se transforma en ácido semideshidroascórbico y ulteriormente en ácido deshidroascórbico, disminuyendo paralelamente su potencial estándar de reducción. En medio acuoso predomina el L-deshidroascórbico presentándose en la forma de especie bicíclica hidratada. Tiene la propiedad de formar complejos con metales como: manganeso, fierro, cobre, níquel, cobalto, plata y oro, cuyas velocidades de reacción son dependientes del pH y de la naturaleza del complejo formado 4.
El efecto tóxico que la vitamina C ejerce a nivel celular, se incrementa considerablemente en presencia de metales de transición, como el Cu-II; esta asociación ocasiona la oxidación del ascorbato que ocurre con la previa reducción del Cu-II2 y la formación de peróxido de hidrógeno; en una siguiente etapa, el peróxido de hidrógeno reacciona con el Cu-I generando el radical hidroxilo, el cual puede reaccionar indiscriminadamente con diversas biomoléculas causando daño a nivel celular5,6. Sustancias como el EDTA, tienen la propiedad de interaccionar con el Cu-II e inhibir la oxidación de la vitamina C; asimismo, otros compuestos, como la tioúrea o manitol, evitan el efecto nocivo que eventualmente podrían ocasionar los radicales libres generados por la oxidación del ascorbato 7.
Los metales de transición son catalizadores muy eficientes, especialmente en reacciones de tipo rédox, por cuyo motivo, es probable que un gran número de reacciones de autoxidación en realidad sean reacciones catalizadas por metales8; el dianión ascorbato es la única especie de ascorbato que sufriría significativamente un proceso de autoxidación9; a pH 7,4 la tasa de autoxidación está determinada por la presencia de Asc 2-.
La oxidación del ascorbato por iones cúpricos se realiza con consumo de oxígeno y formación del radical hidroxilo; en este proceso se produce la formación de un complejo del ion metálico con el ácido ascórbico en la etapa de pre-equilibrio, siendo la velocidad de reacción dependiente del pH. La acción catalítica del Cu-II sobre la oxidación del ácido semideshidroascórbico por oxígeno molecular, es mayor que el ejercido por el Fe-III en medio ácido10.
El radical ascorbato tiene un electrón desapareado en un sistema-∏ altamente deslocalizado, siendo un radical libre poco reactivo; hecho que lo torna en un eficiente antioxidante, teniendo un potencial de reducción menor que los radicales hidroxilo, alcoxilo, peroxilo, urato y tocoferoxilo; a diferencia de otros antioxidantes, el radical ascorbato, como el deshidroascorbato, tienen la ventaja de ser reducidos en una reacción inversa a ascorbato 9.
PARTE EXPERIMENTAL
Reactivos químicos.- El fosfato monopotásico, vitamina C, histidina, glicina, cisteína, sulfato cúprico y etilendiaminotetracético (EDTA) se adquirieron de la Merck Darmstadt.
Métodos.- La reacción de oxidación de la vitamina C de realizó determinando la variación de la absorbancia a 265 nm en un espectrofotómetro Spectronic modelo Genesys 6, al que se le adaptó una impresora11. El medio de ensayo estuvo constituido por tampón fosfato de potasio 50 mM pH 7,4, sulfato cúprico 0,025 mM, ascorbato 0,020 mM y el aminoácido (glicina, histidina o cisteína) en las concentraciones que se indican en los gráficos correspondientes. La reacción se inició mediante la adición de sulfato cúprico y se grabó la disminución de la densidad óptica a 265 nm.
Para observar el efecto del pH sobre la oxidación del ascorbato por iones cúpricos en presencia de histidina, se preparó un medio de ensayo constituido por tampón citrato 50 mM, en un rango de pH comprendido entre 3,9 y 8,0; la concentración de histidina fue de 0,050 mM.
RESULTADOS Y DISCUSIÓN
La oxidación del ascorbato por acción de iones cúpricos genera radicales hidroxilo; este proceso puede inhibirse por acción de la catalasa, enzima que tiene la propiedad de descomponer el peróxido de hidrógeno que se genera en la reacción antes citada, impidiendo de esta manera la formación de radicales hidroxilo; asimismo, el EDTA, compuesto de conocida acción quelante, impide la generación de radicales libres por la propiedad que tiene de ligarse al cobre 4,7.
Los radicales hidroxilo generados por el sistema ascorbato/Cu-II producen daño celular ya que tienen la propiedad de reaccionar con componentes celulares como: proteínas, lípidos, carbohidratos y ADN, por cuyo motivo es necesario que el ser humano disponga de una eficiente defensa antioxidante que le permita protegerse de estos efectos nocivos12. La presencia de aminoácidos en los microambientes en que ocurre la interacción de vitamina C con iones cúpricos, podría afectar de alguna manera la generación de radicales libres. Con la finalidad de observar el comportamiento de aminoácidos como glicina, histidina y cisteína, sobre la oxidación del ascorbato por iones cúpricos, se prepararon medios de reacción a pH 7,4, que permitiesen observar la modificación de la absorbancia a 265 nm, que es característica del ácido ascórbico.
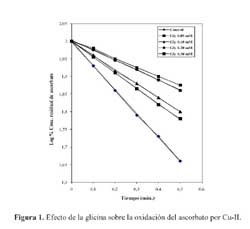
En ensayos preliminares se ajustaron las condiciones experimentales con el propósito de establecer una concentración apropiada de ascorbato y de ion cúprico que permitiera observar adecuadamente la oxidación del ascorbato; de una manera análoga se calcularon las concentraciones de los aminoácidos materia del estudio. La vitamina C, en una concentración 0,02 mM en tampón fosfato a pH 7,4, se oxida en presencia de iones cúpricos proceso que es dependiente de la concentración del metal de transición. La adición de glicina en concentraciones comprendidas entre 50 y 300 M produce una inhibición de la oxidación del ascorbato a través de una reacción que obedece a una cinética de primer orden, conforme se aprecia en la figura 1, en la que se grafica el logaritmo de la concentración residual de vitamina C en función del tiempo. En un gráfico de recíproca simple, es decir, cuando se grafica la inversa de la constante de velocidad de las reacciones antes citadas en función de la concentración de glicina, se obtiene una recta, tal como se observa inserto en la figura 1. La adición de cloruro de sodio en concentraciones comprendidas entre 1,0 y 5,0 mM, no modificaron de manera alguna el efecto ejercido por la glicina.
La glicina ejerce un efecto protector de la oxidación del ascorbato por iones cúpricos y, como consecuencia de ello, disminuye la generación de radicales hidroxilo; es probable que esta acción haya ocurrido como consecuencia de la formación del complejo constituido por glicina y cobre, de tal manera que no se dispondría de Cu-II para oxidar el ascorbato y formar radicales hidroxilo. Se ha mostrado que la glicina ligada al Cu-II puede formar un complejo [Gly-Cu]+ cuyo pico de máxima absorción es a 732 nm, mientras que el complejo [Cu-Gly ] 2 tiene un pico máximo a 624 nm16. Asimismo, se ha sugerido que se formaría un complejo de bis-glicinato-Cu-II, que tendría una estructura tetracoordinada planar, en la cual las moléculas de agua estarían excluidas de las posiciones axiales del cobre 16.
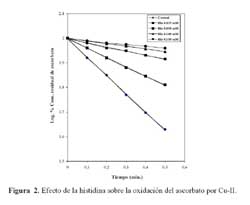
La utilización de concentraciones variables de histidina, comprendidas entre 25 y 150 M, en un medio de ensayo similar al anteriormente descrito, produce una inhibición de la oxidación del ascorbato de un modo que es linealmente dependiente de la concentración de la histidina. La linealidad del gráfico semilogarítmico se muestra en la figura 2; un análisis adicional de estos resultados se observa inserto en el mismo gráfico, en el que se grafica la inversa de la constante de velocidad en función de la concentración de histidina y donde puede apreciarse que existe una relación lineal del proceso antes citado, que es función de la concentración del aminoácido.
El pH modifica el efecto que ejerce la histidina sobre la oxidación de ascorbato por Cu-II; en la figura 3 se observa el comportamiento de la histidina en un rango de pH comprendido entre 3,9 y 8,0, donde se observa que, a medida que se incrementa el pH, el efecto protector de la histidina se torna cada vez mayor. Este efecto es linealmente dependiente de la concentración de histidina cuando el experimento se realiza a pH 8,0, conforme se ilustra en la figura 4.
El cobre reacciona con la histidina formando el complejo histidina/Cu-II, el cual posee una carga (+) simple. Existe cierta controversia sobre la estructura del complejo que se formaría cuando la histidina reacciona con el Cu-II; es probable que esta estructura corresponda a aquélla en la que el metal interaccionaría con los grupos amino de dos aniones histidina en posición trans, formando con el cobre un plano tetragonal constituido por glicinato sustituido de una histidina y dos nitrógenos de otra molécula de histidina 13.
La acetilcolinesterasa es una enzima que es inhibida considerablemente en un medio de ensayo integrado por ascorbato/Cu-II; la adición de EDTA o Detapac, en concentraciones equimoleculares o mayores que las de cobre, disminuye apreciablemente la inactivación de la enzima; asimismo, la incorporación de histidina produce una protección del 95% de la actividad enzimática15. La adición de peróxido de hidrógeno ocasiona una elevada inhibición de la acetilcolinesterasa, mientras que cuando se incorpora catalasa no se observa inhibición alguna.
Es probable que las diferencias que se observan, con respecto al efecto del EDTA y Detapac y aquél mostrado por la histidina, se produzcan a consecuencia de los diferentes potenciales rédox de sus complejos con el cobre, por cuyo motivo, el efecto protector que ofrece la histidina no podría atribuirse a una elevada eficiencia para captar radicales hidroxilo15. Nuestros resultados muestran que la histidina a pH 7,4 ejerce un efecto inhibitorio de la oxidación del ascorbato que es linealmente dependiente de la concentración del aminoácido. La formación de complejos de coordinación entre biomoléculas y metales de transición, a menudo compromete los orbitales-d del metal. Diversos compuestos con propiedades quelantes se han utilizado como herramientas para el estudio de la participación de metales de transición como agentes catalíticos en procesos oxidativos de radicales libres 4.
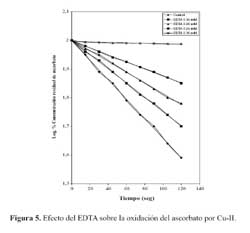
El EDTA es un compuesto que tiene la propiedad de ligarse al Cu-II y formar un complejo de tipo quelato; la presencia de EDTA en un medio de reacción constituido por ascorbato y cobre, disminuye la oxidación del ascorbato a través de un proceso que es dependiente de la concentración de EDTA, conforme se ilustra en la figura 5, en la que puede apreciarse la linealidad del gráfico semilogarítmico. Una regraficación en recíproca simple se muestra incluída en dicha figura donde se observa que al representar 1/k en función de la concentración de EDTA, el valor de 1/k sufre un discreto incremento cuando la concentración de EDTA estuvo en un rango de concentración comprendido entre 150 y 250 µM, pero muestra un inusitado aumento cuando la concentración de EDTA se eleva a 300 µM, es decir, cuando su concentración es mayor a la concentración del Cu-II en el medio de reacción.
El cobre tiene la propiedad de ligarse a las apoproteínas de las LDL. La adición de histidina o EDTA impide la formación de especies reactivas al ácido tiobarbitúrico (TBARS) y de complejos LDL/Cu-II; asimismo, el EDTA inhibe la oxidación del ascorbato catalizada por cobre; en cambio, la histidina no tiene efecto alguno, lo que sugiere que el cobre, dentro del complejo con histidina, estaría disponible para catalizar la reacción, lo que no sucede cuando el cobre está ligado al EDTA. Probablemente, el efecto protector de la histidina, sobre la peroxidación de la LDL catalizada por cobre, no estaría solamente mediada por la acción quelante de los iones cúpricos de la fase acuosa 14.
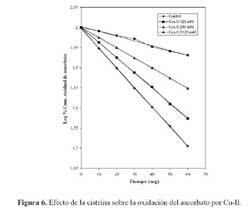
El aminoácido cisteína inhibió la oxidación del ascorbato cuando se utilizaron concentraciones comprendidas entre 125 y 312,5 µM; este comportamiento como en los casos anteriores, se realizó a través de un proceso que es dependiente de la concentración de cisteína, conforme se aprecia en la figura 6. Una regraficación en recíproca simple se ilustra dentro de dicha figura, donde se aprecia un inusitado incremento de 1/k cuando la concentración de cisteína es mayor a 250 µM.
La adición de Cu-II a un medio conteniendo cisteína a pH 7,4 genera la formación de un complejo bis-cisteinato cuproso, lo que es confirmado por un análisis de EPR donde se muestra que el metal permanece reducido en el curso de la oxidación de la cisteína, retornando a la forma oxidada al final de la reacción; es decir, cuando toda la cisteína ha sido oxidada a cistina. También se ha observado que el Cu-II incrementa la tasa de reducción del azul de nitrotetrazolio y del citocromo c por acción de la cisteína bajo condiciones anaerobias, lo que sugiere que se realizaría a través de una directa reducción del aceptor por el complejo antes citado 17.
Se ha observado que la oxidación catalítica del ascorbato por cobre se incrementa considerablemente por la presencia de aniones: cloruro, bromuro y yoduro18, generando peróxido de hidrógeno y radicales libres de oxígeno; en contraposición a este hallazgo se ha descrito que el cloruro de sodio inhibe la oxidación del ascorbato debido a que impide la interacción del cobre con el oxígeno19, así como la reacción que produce anión superóxido, peróxido de hidrógeno y radical hidroxilo, mediante un proceso que no inhibiría la interacción del cobre con peróxido de hidrógeno y la formación del radical hidroxilo a partir del peróxido de hidrógeno formado anteladamente. Los resultados que hemos obtenido sobre la oxidación del ascorbato por iones cúpricos en presencia de cisteína, probablemente haya ocurrido como consecuencia de la competición que se habría establecido entre la cisteína y el ascorbato por el ion cúprico, por cuyo motivo es necesario realizar otros estudios que permitan describir de una manera más apropiada la oxidación del ascorbato por Cu-II.
CONCLUSIONES
- La oxidación del ascorbato por iones cúpricos, es inhibida en grado diverso por los aminoácidos glicina, cisteína o histidina. - La histidina muestra un mejor efecto protector sobre la oxidación del ascorbato por iones cúpricos, que la glicina y cisteína. - El efecto protector que la histidina ejerce sobre la oxidación del ascorbato, es dependiente del pH.
REFERENCIAS
1. Loria, C., Klag M., Caulfield L., Whelton P. Vitamin C status and mortality in US adults. Am. J. Clin. Nutr. 2000; 72:139-145.
2. Levine, M., Rumsey S., Daruwala R., Park JB., Wang Y. Criteria and recommendations for vitamin C intake. JAMA 1999; 281:1415-1423.
3. Barja de Quiroga, G. Radicales libres y antioxidants en: Bioquímica y Fisiopatología del estrés oxidativo. Cascales, M. España 1987.
4. Fornaro, A., Coichev, N. L-ascorbic acid: complexation and redox reactions with some transition metals ions. Quim. Nova 1998:21 (5); 642-650.
5. Balz, F. Natural antioxidants in human health and desease. Acad. Press Inc. New York 1994.
6. Halliwell, B., Gutteridge, JMC. Rol of free radicals and catalytic metal ions in human desease: an overview. Methods Enzymol. 1990; 186:1-85.
7. Inoue, H., Hirobe, M. Disulfide cleavage and insulin denaturation by active oxygen in the copper(II)/ascorbic acid system. Chem. Pharm. Bull. 1986; 34(3)1075-1079.
8. Miller, D.M., Buettner, G.R., Aust, S.D. Transition metals as catalysts of autoxidation reactions. Free Radic. Biol. Med. 1990; 8:95-108.
9. Williams, N.H., Yandell, J.K. Outer-sphere electron-transfer reaction of ascorbato anions. Aust. J. Chem. 1982; 35:1133-1144.
10. Buettner, G.R. In the absence of catalytic metals ascorbato does not autoxidize at pH 7: ascorbate as a test for catalytic metals. J. Biochem. Biophys. Meth. 1988; 16:2740.
11. Lewin, S. Vitamin C: Its molecular biology and medical potential. Academic Press, New York, 1976.
12. Troncoso, L. Guija, E. Radicales libres y envejecimiento. Bol. Soc. Quim. del Perú 2000; LXVI(1):33-51.
13. Fernández, M.C., Paniago, E., Carvalho, S. Copper (II) mixed ligands complexes of hydroxamic acids with glycine, histamine and histidine. J. Braz. Chem. Soc. 1997; 8(5):537-548.
14. Kusuya, M., Yamada, K., Hayashi, T., Funaki, C., Naito, M., Asai, K. y col. Role of lipoprotein-copper complex in copper catalyzed-peroxidation of low-density lipoprotein. Biochim. Biophys. Acta 1992; 1123:334-341.
15. Shinar, E., Navok, T., Chevion, M. The analogous mechanisms of enzymatic inactivation induced by ascorbate and supeoxide in presence of copper. J. Biol. Chem. 1983; 258(24):14778-14783.
16. Hattori, T., Toraishi, T. Tsuneda, T., Nagasaki, S., Tanaka, S. Chemical exchange reaction of glycinate-copper(II) complex in water: A theoretical study. J. Phys. Chem. A. 2005; 109(45):10403-10409.
17. Peccil, L., Montefoschi, G., Musci, G., Cavallini, D. Novel findings on the copper catalysed oxidation of cysteine. Amino Acids 1997; 13(3-4):355-367.
18. Zhang, G., Chen, H. Chemiluminescence studies of the oxidation of ascorbic acid with copper(II) catalyzed by halide anions and its application to the determination of halide anions and ascorbic acid. Anal. Sci. 2000; 16:1317-1321.
19. Harel, S. Oxidation of ascorbic acid and metal ions as affected by NaCl. J. Agric. Food Chem. 1994; 42:2402-2406.