Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.74 n.2 Lima abr./jun. 2008
Determinación de la capacidad antioxidante y compuestos fenólicos de cereales andinos: quinua (Chenopodium quinoa), kañiwa (Chenopodium pallidicaule) y kiwicha (Amaranthus caudatus)
Determination of antioxidant capacity and phenolic compounds in andean cereals: quinoa (Chenopodium quinoa), kañiwa (Chenopodium pallidicaule) y kiwicha (Amaranthus caudatus)
Ritva Repo de Carrasco1, Christian Rene Encina Zelada1
1 Facultad de Industrias Alimentarias. Universidad Nacional Agraria La Molina, Av. La Universidad s/n, Lima12, Perú, Telf. 996214357, ritva@hotmail.com
RESUMEN
Se realizó la extracción de compuestos hidrofílicos y lipofílicos de cereales andinos, siendo el de mayor contenido en ambos casos la muestra de kañiwa (Chenopodium pallidicaule variedad cupi), siguiendo la de quinua (Chenopodium quinoa ecotipo marrón) y finalmente la kiwicha (Amaranthus caudatus ecotipo negra). Se realizó la determinación del contenido de compuestos fenólicos en quince variedades de quinua, siendo la de mayor contenido la variedad PIQ031046 con 139,94 mg ácido gálico/100 g; de las once muestras de kañiwa el mayor contenido de compuestos fenólicos fue el de la variedad Leghepito con 85,71 mg ácido gálico/100 g; y en de las seis muestras de kiwicha la variedad A00254 con 30,41 mg ácido gálico/100 g tuvo el mayor contenido de compuestos fenólicos. Finalmente, se realizó la determinación de la capacidad antioxidante medida por el radical DPPH en la fase hidrofílica en las quince muestras de quinua siendo la de mayor contenido la variedad PIQ031046 (2400,55 μg Trolox/g); en las once muestras de kañiwa la variedad de mayor capacidad antioxidante fue la Puka kañiwa con 1509,80 μg Trolox/g; y de las seis muestras de kiwicha fue la variedad A0011 la de mayor capacidad antioxidante con un contenido de 660,37 μg Trolox/g.
Palabras clave: Cereales andinos, amaranthus caudatus, chenopodium quinoa, chenopodium pallidicaule, capacidad antioxidante, compuestos fenólicos.
ABSTRACT
The extraction of hydrophilic and lipophilic compounds of andean cereals was carried out. The kañiwa (Chenopodium pallidicaule variety cupi) had the highest content of both compounds, followed by the quinua (Chenopodium quinoa brown ecotype) and finally the kiwicha (Amaranthus caudatus black ecotype). The determination of the content of phenolic compounds was made in fifteen varieties of quinua, being that of highest content the variety PIQ031046 with 139,94 mg gallic acid /100 g. Of eleven samples of kañiwa the variety Leghepito had the highest content of phenolic compounds 85,71 mg gallic acid /100 g; and in the case of kiwicha the variety A00254 with 30,41 mg gallic acid /100 g had the highest content of phenolic compounds. Finally, the antioxidant capacity was measured by the radical DPPH-method in the hydrophilic phase in the samples of quinua being that of highest content the variety PIQ031046 (2400,55 μg Trolox/g); in eleven samples of kañiwa the variety with highest antioxidant capacity was the puka kañiwa with 1509,80 μg Trolox/g; and in six samples of kiwicha it was the variety A0011 with major antioxidant capacity with a content of 660,37 μg Trolox/g.
Key words: Andean cereals, Amaranthus caudatus, Chenopodium quinoa, Chenopodium pallidicaule, antioxidant capacity, phenolic compounds.
INTRODUCCIÓN
La quinua (Chenopodium quinoa) tiene una antigüedad, por lo menos, de 5000 años como planta cultivada. Antes de la llegada de los europeos la quinua se cultivaba ampliamente en todo el imperio incaico: en el Perú actual, en Bolivia, Ecuador, Chile, Argentina y Colombia. La quinua era considerada un alimento sagrado, siendo empleada, además, para usos medicinales. La quinua pertenece a la familia Chenopodiaceae. Es una planta anual de tamaño entre 1 y 3,5 metros. La panoja tiene entre 15 y 70cm y puede llegar a un rendimiento de 200 g de granos por panoja. Las semillas pueden ser blancas, cafés, amarillas, grises, rosadas, rojas o negras y se clasifican según su tamaño en grandes (2,2-2,6mm), medianas (1,8-2,1mm) y pequeñas (menos de 1,8mm)1.
La kañiwa (Chenopodium pallidicaule) tiene como origen la región de los Andes del sur de Perú y de Bolivia, distribuyéndose en las regiones semiáridas más altas; soporta bien los climas rigurosos con heladas, sequías y bajas temperaturas. Es probablemente el cultivo de grano que resiste mejor las bajas temperaturas (-3 ºC), sin afectarse su producción. El grano de kañiwa presenta un elevado contenido de proteínas (15-19 por ciento) y, al igual que la quinua y kiwicha, tiene una proporción importante de aminoácidos azufrados; posee un balance de aminoácidos de primera línea, siendo particularmente rica en lisina, isoleucina y triptófano. Esta calidad proteica, en combinación con un contenido de carbohidratos del orden del 60% y aceites vegetales del orden del 8%, la hacen altamente nutritiva2. Tanto la quinua como la kañiwa, son relativamente ricos de lípidos. El aceite de estos cereales tiene alto contenido en ácidos grasos insaturados así como también de tocoferoles3.
La kiwicha (Amaranthus caudatus) es una planta comúnmente cultivada durante el tiempo de los incas y otras culturas anteriores en el Perú. En México los aztecas cultivaron otro amaranto, el Amaranthus cruentus. El color de las semillas varía de negro hasta rojo, siendo más común el blanco o marfil. El valor nutricional tanto de la kiwicha como de la quinua, es excepcional. Especialmente destacan sus proteínas de alto valor biológico, pero también poseen un contenido relativamente alto de aceite de buenas características nutricionales. Son también importantes fuentes de micronutrientes como calcio y hierro3.
Los fenoles son compuestos químicos que se encuentran ampliamente distribuidos en las plantas. Los tres grupos más importantes son los flavonoides, los ácidos fenólicos y los polifenoles, siendo el primero uno de los más estudiados4. Según Vasconcellos5, los fenoles son también antioxidantes y como tales atrapan radicales libres, previniendo que éstos se unan y dañen las moléculas de ácido desoxiribonucleico (DNA), un paso crítico en la iniciación de los procesos carcinogénicos. Hay antioxidantes naturales (fisiológicos), presentes en nuestro organismo y sintéticos. Dentro de cada grupo, los antioxidantes pueden ser enzimas que aumentan la velocidad de ruptura de los radicales libres, o previenen la participación de iones de metales de transición en la generación de radicales libres y los inactivadores o barredores ("scavengers") y de esa manera protegerían de las infecciones, del deterioro celular, del envejecimiento prematuro y, probablemente, del cáncer6. Los compuestos antioxidantes son un grupo de vitaminas, minerales y enzimas que protegen nuestro cuerpo de la formación de estos radicales7.
El método utilizado para analizar la capacidad antioxidante es el que emplea el DPPH8. Este método utiliza un radical estable para medir el efecto antioxidante de un extracto de la muestra. Para el análisis de los polifenoles se utilizó el método de Folin-Ciocalteau9. Este método cuantifica el contenido de compuestos fenólicos totales como ácido gálico.
Los objetivos principales de la presente investigación fue el determinar cualitativamente el contenido de compuestos hidrofílicos y lipofílicos; determinar la mayor capacidad antioxidante y contenido de compuestos fenólicos de las muestras de kañiwa, quinua y kiwicha.
PARTE EXPERIMENTAL
Lugar de ejecución
El presente trabajo de investigación se realizó en los laboratorios de Físico-Química, Instrumentación y Biotecnología, Microbiología y Planta Piloto de Alimentos, de la Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina.
Materiales y reactivos
Muestras: kañiwa, quinua y kiwicha procedentes del departamento de Puno-Perú.
Reactivos: DPPH (1,1-diphenyl-2-picrylhydrazil) de Aldrich Chemical Co.; persulfato de potasio de grado analítico de Harleco 7574; etanol absoluto y hexano de J.T. Baker; metanol de Mallinckrodt; acetona, Folin-Ciocalteu; carbonato de sodio anhidro; ácido acético glacial 100% de Merck.
Equipos: Espectrofotómetro, Molino Cyclotec, Homogenizador.
Métodos de análisis
Determinación de la capacidad antioxidante (Brand-Williams8); determinación de los compuestos fenólicos totales (Swain y Hillis10); determinación cualitativa de compuesto hidrofílicos y lipofílicos (Prior et al.11).
Metodología experimental
Determinación de compuesto hidrofílicos y lipofílicos: Para la determinación cualitativa de compuesto hidrofílicos y lipofílicos en muestras de cereales andinos se utilizó el método de Prior et al.11. Para la extracción de compuestos lipofílicos se pesó 1 g de muestra (molida en el cyclotec malla 0,5 mm), se puso la muestra en un tubo de 15 mL; se adicionó 10 mL de hexano, se homegenizó por 1 minuto colocando el tubo en un baño con agua y hielo; se centrifugó (10 000 rpm por 10 minutos), y se separó el extracto en un tubo (con tapa capacidad de 25 mL); se volvió a re-extraer el residuo con 10 mL de hexano y se centrifugó con los mismo parámetros indicados; la cuantificación espectrofotométrica se realizó a un ëmax = 413 nm. Para la extracción de compuestos hidrofílicos se trabajó con el residuo en el tubo (Torta) de 15 mL, se adicionó 10 mL de acetona: agua: ácido acético (70:29,5:0,5); se homogenizó por 1 min colocando el tubo en un baño con agua y hielo; se dejó en agitación a 4°C por 1 hora; se centrifugó (10 000 rpm por 10 minutos); se decantó el extracto acetona en un fiola 25 mL, y se realizó los mismos procesos con los parámetros ya indicados; finalmente, se llevó este segundo extracto con acetona a la fiola de 25 mL. La cuantificación espectrofotométrica se realizo a un ëmax= 725 nm.
Determinación de los compuestos fenólicos: Para la determinación de los compuestos fenólicos de las diferentes variedades de kiwicha, kañiwa y quinua se utilizó el método de Swain y Hillis10; para lo cual se colocó 5 g de muestra y 20 mL de metanol (o etanol al 95%) dentro de un tubo Falcon; se mezcló con un homogenizador a alta velocidad hasta una consistencia uniforme (1/2 a 1 min.); se dejó el homogenizado en reposo por 12-24 horas en refrigeración (4°C); después del reposo, se centrifugó el homogenizado por 15 min a 29 000 x g (14 500 rpm); con una micropipeta se tomó 0,5 mL de la muestra (sobrenadante claro), y 8 mL de agua ultrapura y se mezcló; al mismo tiempo, se preparó un blanco con 0,5 mL de metanol (etanol 95%); se añadió 0,5 mL del reactivo Folin-Ciocalteu 0,25 N; se mezcló y dejó reaccionar por 3 minutos; al pasar este tiempo, se añadió 1 mL de carbonato de sodio (Na2CO3 ) 1N con una micropipeta; se mezcló y dejó reaccionar por 10 minutos; se centrifugó por 15 minutos a 29 000xg; se llevó el espectrofotómetro a cero con una solución blanco de etanol al 95%; se colocó la alícuota del sobrenadante en una cubeta de vidrio y se llevó al espectrofotómetro a una lectura de 725 nm; se guardaron las lecturas de las absorbancias cada 30 minutos hasta que no hayan cambios significativos en la absorbancia observada; finalmente se estimó la cantidad de fenoles totales a partir de la ecuación desarrollada para ácido clorogénico.
Determinación de la capacidad antioxidante: Para la determinación de la capacidad antioxidante de las diferentes variedades de kiwicha, kañiwa y quinua se utilizó en método del radical DPPH (Método de Brand-Williams et al.8), en la fracción hicrofílica; se pesó aproximadamente 5 gramos de muestra y se agregó 25 mL de metanol hasta conseguir una apariencia homogénea; se mezcló con un homogenizador hasta una consistencia uniforme (½- 1 minuto); se almacenó por 12 – 24 horas a 3 – 4 °C; antes de tomar una alícuota para el análisis, se centrifugó el homogenizado por 20 minutos a 15 000 rpm; con una pipeta se transfirió una alícuota del sobrenadante claro y se colocó dentro de un tubo Eppendorf para medir la actividad antioxidante hidrofílica. El sobrenadante se pudo guardar a –20 °C para análisis posteriores; se llevó el espectrofotómetro a cero con metanol; se aseguró una absorbancia inicial a 515 nm de la solución diluida de DPPH que estuvo alrededor de 1,1 ± 0,02; con una micropipeta se añadió una alícuota de 150 μL de la muestra (en este caso, fase acuosa) con 2850 μL de la solución diluida de DPPH dentro de un vial de plástico limpio; se corrió un blanco con 150 μL del solvente puro (de acuerdo a la solución de extracción) hasta obtener un factor de corrección (debido a la dilución); se dejó que la muestra y el DPPH reaccionaran en un agitador en la oscuridad y cerrar los viales. La temperatura ambiental fue de 20 °C; en diferentes intervalos de tiempo (15 min) se transfirió la solución a una cubeta de vidrio limpia. En algunos casos, se golpeó suavemente la cubeta hasta eliminar las burbujas y se procedió a tomar la lectura del espectrofotómetro a 515 nm; se repitieron las lecturas a través del tiempo hasta que se observó que no había cambios significativos en la absorbancia; el punto final de la absorbancia fue usado para calcular la actividad antioxidante.
Análisis estadístico: Los resultados fueron procesados por un Análisis de Variancia (ANOVA) y la significancia estadística por la prueba de Tukey. Las diferencias en p < 0,05 fueron considerados significativos. El programa empleado fue SAS System V8.
RESULTADOS Y DISCUSIÓN
Análisis cualitativos de compuestos hidrofílicos y lipofílicos
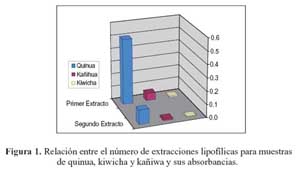
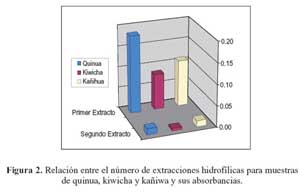
En las tablas 1 y 2 se muestran las absorbancias de los extractos lipofílicos e hidrofílicos, respectivamente. Del conjunto de experimentos que se realizaron11, los que tuvieron como coeficiente de variabilidad de 1,0% a 1,4% obtuvieron que tanto las extracciones con hexano para el análisis de la capacidad antioxidante en la parte hidrofílica por el método ORACFL , así como la mezcla óptima de reactivos para la extracción de compuestos lipofílicos de acetona: agua: ácido acético (70:29,5:0,5), fueron los idóneos para realizar dichas extracciones.
Dichas extracciones, tal como se observa en las figuras 1 y 2, sirvieron para conocer cualitativamente las diferencias de contenido de compuestos lipofílicos e hidrofílicos en las muestras de quinua, kañiwa y kiwicha que posteriormente serían utilizados con la finalidad de realizar extracciones de sus compuestos fenólicos totales y la determinación de la capacidad antioxidante en su extracto hidrófilo.
Determinación de compuestos fenólicos totales
Los compuestos fenólicos están involucrados en la defensa de las plantas contra la invasión de patógenos, incluidos bacterias, hongos y virus12; los antioxidantes son compuestos que impiden o retrasan la oxidación de otras moléculas a través de la inhibición de la propagación de la reacción de oxidación. Actualmente se incrementa el uso de antioxidantes naturales, dentro de los cuales se encuentran los compuestos fenólicos13.
Los compuestos fenólicos poseen una estructura química ideal para actuar como antioxidante, mostrando una mayor eficacia in vitro en comparación a otros compuestos, como las vitaminas E y C14. Por otro lado, la propiedad de quelar metales, particularmente hierro y cobre, demuestra el rol de los compuestos fenólicos como antioxidantes preventivos en función a que inhiben las reacciones químicas que catalizan estos metales, evitando de esta manera la formación de radicales libres15.
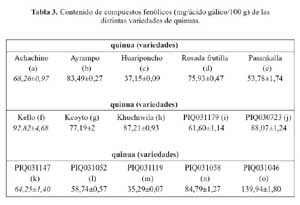
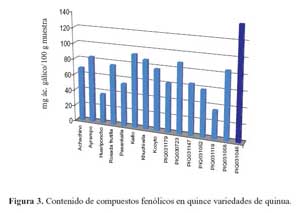
De las distintas variedades de quinua evaluadas, que se muestra en la tabla 3, la variedad o (139,94 mg/ácido gálico/100 g) presentó el mayor contenido de compuestos fenólicos, seguido por las variedades f (92,82 mg/ácido gálico/100 g), j (88,07 mg/ácido gálico/100 g), h (87,21 mg/ácido gálico/100 g)¸ n (84,79 mg/ácido gálico/100 g), b (83,49 mg/ácido gálico/100 g), g (77,19 mg/ácido gálico/100 g), d (75,93 mg/ácido gálico/100 g), a (68,26 mg/ácido gálico/100 g), k (64,25 mg/ácido gálico/100 g), i (61,60 mg/ácido gálico/100 g), l (58,74 mg/ácido gálico/100 g), e (53,78 mg/ácido gálico/100 g), c (37,15 mg/ácido gálico/100 g) y finalmente la variedad m (35,29 mg/ácido gálico/100 g), La mencionada información se observa en la figura 3.
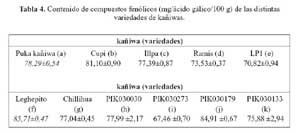
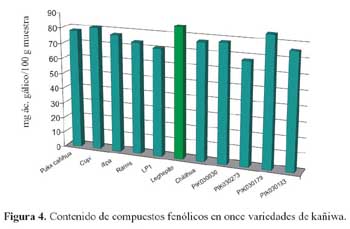
De las distintas variedades de kañiwa evaluadas, mostradas en la tabla 4, la variedad f (85,71 mg/ácido gálico/100 g) presentó el mayor contenido de compuestos fenólicos, seguido por las variedades j (84,91 mg/ácido gálico/100 g), b (81,10 mg/ácido gálico/100 g), a (78,29 mg/ácido gálico/100 g), h (77,99 mg/ácido gálico/100 g), c (77,39 mg/ácido gálico/100 g), g (77,04 mg/ácido gálico/100 g), k (75,88 mg/ácido gálico/100 g), d (73,53 mg/ácido gálico/100 g), e (70,82 mg/ácido gálico/100 g) y finalmente la variedad i (67,46 mg/ácido gálico/100 g), la mencionada información se observa en la figura 4.
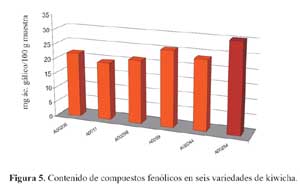
De las distintas variedades de kiwicha evaluadas (tabla 5), la variedad f (30,41 mg/ácido gálico/100 g) presentó el mayor contenido de compuestos fenólicos, seguido por la variedad d (25,50 mg/ácido gálico/100 g), e (23,68 mg/ácido gálico/100 g), a (21,79 mg/ácido gálico/100 g), c (21,33 mg/ácido gálico/100 g) y finalmente la variedad b 19,50 mg/ácido gálico/100 g), tal como se observa en la figura 5.
De los resultados obtenidos se puede observar que las variedades que presentaron un mayor contenido de compuestos fenólicos totales fueron los de coloración morada. De igual forma16, al analizar cuatro variedades de camote (blanca, amarilla, naranja y morada) encontraron un mayor contenido en la variedad morada; sin embargo, otros investigadores17 observaron en diferentes cultivos de camote que una variedad que no contenía antocianinas presentó un nivel mayor de fenoles totales comparada con la variedad morada.
Los valores obtenidos de compuestos fenólicos encontrados en todas las variedades de quinua, kañiwa y kiwicha se pueden comparar con otros cereales como son en el caso del trigo (229-324 mg/ácido gálico/100 g) y del rango encontrado para el amaranto de 39,17 a 56,08 mg/ácido gálico/100 g18,19. En base a los resultados, podemos indicar que tanto las variedades de quinua, kañiwa y kiwicha son granos que poseen un buen nivel de compuestos fenólicos totales, lo que indicaría a su vez buenas características bioactivas, como puede ser una alta capacidad antioxidante.
Otros investigadores20 mencionan que aislaron flavonoides glucosídicos del grano de kañiwa (Chenopodium pallidicaule) y que este grano es rico en la fracción de flavonoides antes mencionada, que incluye hasta 10 compuestos entre los cuales se encuentran los agliconas del quercetín, isorhamnetin, kaemferol y oligosacáridos. Según otro estudio21, la capacidad antioxidante de la fracción de flavonoides con grupos hidroxilo libres actúan como secuestradores de radicales libres, por lo que presentan una elevada capacidad antioxidante.
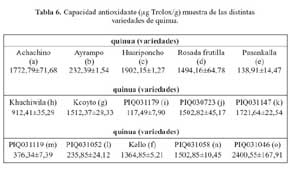
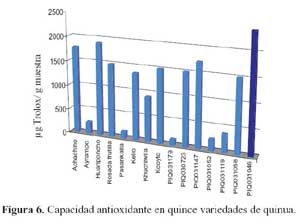
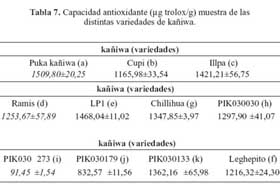
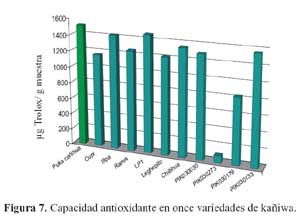
De las quince variedades de quinua (tabla 6) la de mayor capacidad antioxidante determinada en la fase hidrofílica fue la variedad o (2400,55 μg trolox/g), seguida por las variedades c (1902,15 μg trolox/g), a (1772,79 μg trolox/g), k (1721,64 μg trolox/g), g (1512,37 μg trolox/g), n (1502,85 μg trolox/g), j (1502,82 μg trolox/g), d (1494,16 μg trolox/g), f (1364,85 μg trolox/g), h (912,41 μg trolox/g), m (376,34 μg trolox/g), l (235,85 μg trolox/g), b (232,39 μg Trolox/g), e (138,91 μg trolox/g) y finalmente la variedad i (117,49 μg trolox/g) De las once variedades de kañiwa, tal como se observa en la tabla 7, la que tuvo una mayor capacidad antioxidante determinada en la fase hidrofílica fue la variedad a (1509,80 μg trolox/g), seguida por las variedades e (1468,04 μg trolox/g), c (1421,21 μg trolox/g), k (1362,16 μg trolox/g), g (1347,85 μg trolox/g), h (1297,90 μg trolox/g), d (1253,67 μg trolox/g), f (1216,32 μg trolox/g), b(1165,98 μg trolox/g), j (832,57 μg trolox/g) y finalmente la variedad i (91,45 μg trolox/g).
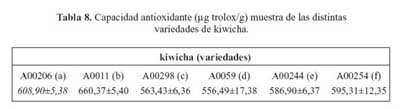
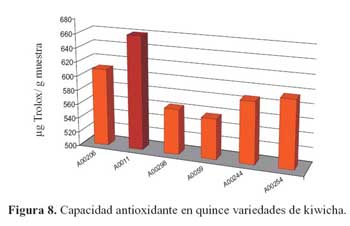
De las cinco variedades de kiwicha (tabla 8), la que tuvo una mayor capacidad antioxidante determinada en la fase hidrofílica fue la variedad b (660,37 μg trolox/g), seguida por las variedades a (608,90 μg trolox/g), f (595,31 μg trolox/g), e (586,90 μg trolox/g), y finalmente, la variedad c (563,43 μg trolox/g), A0059 (556,49 μg trolox/g).
Por los resultados encontrados podemos indicar que todas la variedades de quinua, kañiwa y los de kiwicha tienen una alta capacidad antioxidante al ser comparados con otros alimentos22, como la mora (1784 μg trolox/g), el maíz morado (4720 μg trolox/g) y el camote morado (3167 μg trolox/g), entre otros. De esta forma se aporta con importante información sobre los cereales andinos nativos del Perú, y en especial con el creciente interés sobre los antioxidantes naturales por sus conocidos efectos contra los radicales libres, causantes de problemas de cáncer y enfermedades cardiovasculares, ambas enfermedades causantes de una elevada mortalidad mundial.
Se conocen valores de capacidad antioxidante de 1149, 1380 y 988 μg trolox/g para camote morado, maíz morado y Blueberry, respectivamente22. Resultados que son menores a ocho de las quince variedades de quinua evaluadas; a ocho de las once variedades de kañiwa evaluadas, y mayores que a todas las muestras de kiwicha evaluadas, tal como se observa en las figuras 6, 7 y 8. Estas diferencias se deben específicamente a que ambas son alimentos diferentes taxonómica y morfológicamente; además de sus diferentes contenidos de compuestos fenólicos en cada uno de ellos.
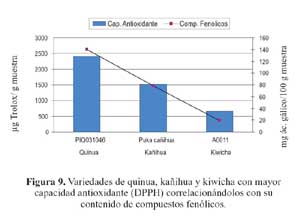
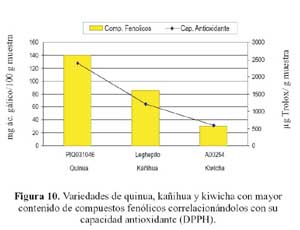
Al realizar el análisis de correlación simple mostrado en las figuras 9 y 10 en las cuales se relaciona el contenido de compuestos fenólicos totales con la capacidad antioxidante de las muestras que obtuvieron la mayor concentración de los compuestos antes mencionados, y según el análisis estadístico de los resultados obtenidos, vemos una alta correlación entre ambas (0,99); lo que nos indicaría la contribución de los compuestos fenólicos en la capacidad antioxidante de los granos en forma directamente proporcional.
CONCLUSIONES
- La quinua (Chenopodium quinoa, ecotipo marrón) es la que presenta mayor contenido de compuestos lipofílicos (Chenopodium pallidicaule, variedad cupi), junto con la kiwicha (Amaranthus caudatus, ecotipos negra).
- La quinua (Chenopodium quinoa, ecotipo marrón) es la que presenta mayor contenido de compuestos hidrofílicos seguido por la kañiwa (Chenopodium pallidicaule, variedad cupi) y kiwicha (Amaranthus caudatus, ecotipo negra).
- El mayor contenido de compuestos fenólicos en las quince muestras de quinua fue el de la variedad PIQ031046 (139,94 mg ácido gálico/100 g); en las once muestras de kañiwa fue el de la variedad Leghepito (85,71 mg ácido gálico/100 g) y en las cinco muestras de kiwicha fue el de la variedad A00254 (30,41 mg ácido gálico/100 g).
- La mayor capacidad antioxidante en la fase hidrofílica medida por el radical DPPH en las quince muestras de quinua fue el de la variedad PIQ031046 (2400,55 μg trolox/g); en las once muestras de kañiwa fue el de la variedad Puka kañiwa (1509,80 μg trolox/g) y en las cinco muestras de kiwicha fue el de la variedad A0011 (660,37 μg trolox/g).
AGRADECIMIENTOS
Al CONCYTEC, al Ing. Policarpio Catacora (NINIA-Puno), al Dr. Ángel Mujica (Puno), a la FIAL-UNALM, Sra. Karina Capa y a la Sociedad Peruana de Química.
REFERENCIAS
1. Glorio, P.; Repo-Carrasco, R. y Velezmoro, C. 2003. Almidón y fibra dietética en alimentos. Experiencia de Perú. Libro CYTED Carbohidratos en alimentos regionales iberoamericanos, Capítulo 25 16.12.05 18:49. Pag. 607-630.
2. Ciedperu. 2007. Página web visitada el 14 de agosto del 2007. Disponible en: http://www.ciedperu.org/productos/kaniwa.htm
3. Repo-Carrasco, R.; Espinoza, C. and Jacobsen, S. 2003. Nutritional value and uses of andean crops quinoa (Chenopodium quinoa) and kañiwa (Chenopodium pallidicaule). Food Research International. 19. 179-189.
4. King, A. and Young, G. 1999. Characteristics and occurrence of phenolic phytochemical. Journal of the American Dietetic Association. 99. 213-218.
5. Vasconcellos, A. 2005. Alimentos Funcionales. Conceptos y Beneficios para la Salud. Departamento de Ciencia de Alimentos y Nutrición, Universidad de Chapman, Orange, California, USA. Visitada el 8 de febrero del 2005. www.worldfoodscience.org.htm
6. Aruoma, O. 2000. Conceptualization of the prooxidant and antioxidant actions of plant food chemicals, phytochemicals and phythopharmaceuticals. AOCS, Press, Champaign, Illinois, 32-46.
7. Murillo, E. 2005. Actividad antioxidante de bebidas de frutas y de té comercializadas en Costa Rica. Instituto de Alimentación y Nutrición de la Universidad de Panamá. Pag. 3- 10.
8. Brand-Willians, W.; Cuvelier, M. and Berset, C. 1995. Use of a free radical method to evaluate antioxidant activity. Lebensm. Wiss. Technol. 28. 25-30.
9. Emmons, C. and Petersen, D. 1999. Antioxidant activity and phenolic contents of oat groats and hulls. Cereal Chemistry. 76. 902-906.
10. Swain, T. and Hillis, W. 1959. The phenolic constituets of Prunus domestica, L - the quantitative analysis of phenolic constituents. Journal of the Science of Food and Agriculture. 10. 63-68.
11. Prior, R.; Hoang, H.; Gu, L.; Wu, X.; Bacciocca, M.; Howard, L.; Hampshch-Woodill, M.; Huang, D.; Ou, B. and Jacob, R. 2003. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORAC ) of plasma and other FL biological and food samples. Journal of Agricultural and Food Chemistry. 51. 3273- 3279.
12. Fellegrini, N.; Ke, R.; Yang, M. and Rice-Evans, C. 1999. Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2'- azinobis(3-ethylenebenzothiazoline-6-sulfonic acid radical cation decolorization assay. Methods in Enzymology. 299. 379-389.
13. Martinez-Valverde, I.; Perriago, M. y Ros, G. 2000. Significado nutricional de los compuestos fenólicos de la dieta. Archivos Latinoamericanos de Nutrición. Vol 50 Nº1. Pag. 5-18.
14. Rice-Evans, C.; Miller, N. and Paganga, G. 1996. Structure antioxidant activity and relationship of flavonoids and phenolic acids. Free Radical Biology and Medicine. 20. 933-956.
15. Cadenas, E. 2001. Sustancias flavonoides. Department of Molecular Pharmacology and Toxicology. School of Pharmacy. Univesity of Southern California. USA. http://www.antioxidant.com.ar/12/Art020.htm
16. Yoshimoto, M.; Okuno, S.; Kumagai, T.; Yoshinaga, M. and Yamakawa, O. 1999. Distribution of antimutagenic components in colored sweetpotatoes (Ipomoea batatas). Japan Agricultural Research Quarterly. 33. 143-148.
17. Oki, T.; Masuda, M.; Furuta, S.; Nishiba, Y.; Terahara, N. and Suda, I. 2002. Involvement of anthocyanins and other phenolic compounds in radical-scavenging activity of purplefleshed sweet potato cultivars. Journal of Food Science. 67.1752-1757.
18. Saura-Calixto, F. and Bravo, L. 2002. Dietary fiber-associated compounds: chemistry, Analysis and nutritional effects of polyphenols. Hand Book of Fiber Dietary. Pag. 415- 430.
19. Klimczak, I.; Malecka, M. y Pacholek, B. 2002. Food extrusion Science and Technology, Marcel Dekker Inc. New New York. USA. Pag. 30-31.
20. Rastrelli, L.; Saturnino, P.; Schettino, O. and Dini, A. 1995. Studies on the constituents of Chenopodium pallidicaule (Canihua) seeds, isolation and characterization of two new flavonol glycosides. Journal of Agricultural and Food Chemistry. 43. 2020-2024.
21. Pekkarinen, S.; Heinonen, M. and Hopia, A. 1999. Flavonoids quercetin, myricetin, kaemferol and (+)-catechin as antioxidant in methyl linoleate. Journal Science of Food and Agricultural. 79. 499-506.
21. Cisneros-Zevallos, L. 2003. Processing and phytochemicals. Food Science Laboratory- Horticulture. Science Department. Texas A&M University. USA. http://www.phytochemicals.tamu.edu/slides/Cisneros1(fullpage):PDF.