Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química del Perú
versão impressa ISSN 1810-634X
Rev. Soc. Quím. Perú v.74 n.2 Lima abr./jun. 2008
Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas
Determination of antioxidant capacity and bioactive compounds in native peruvian fruits
Ritva Repo de Carrasco1, Christian René Encina Zelada1
1 Facultad de Industrias Alimentarias, Universidad Nacional Agraria La Molina. Av. LA Molina s/n, Lima 12, Perú. Telf.: 9962-14357, ritva@hotmail.com
RESUMEN
En el tomate de árbol se destacó el contenido relativamente alto de fibra cruda 4,5 g/100 g de fruta. El tomate de árbol ( y el aguaymanto ( ) tuvieron mayor contenido de proteínas (1,9 g/100 g para ambos frutos) que las otras frutas estudiadas. En cuanto a compuestos fenólicos, la papaya de monte es la fruta que presentó mayor contenido de estos compuestos (167 mg de equivalente ácido gálico/g de fruto). El contenido de betalaínas en tuna roja ( ) fue de 68,95 mg/1000 mL. El aguaymanto tuvo el mayor contenido de ácido ascórbico (43,3 mg/100g), seguido por la papaya de monte (31,41 mg/100g) y el tomate de árbol seguida por la tuna roja 16,09 mg/100g y 22,75 mg/100g, respectivamente. El contenido de carotenoides fue mayor en el tomate de árbol (4 mg -caroteno/100 g) seguido por el aguaymanto con 2,64 mg - caroteno/100 g. La tuna roja presentó una capacidad de inhibición del radical DPPH mucho mayor que las otras tunas estudiadas (77,65 %). Comparando las diferentes frutas en cuanto a capacidad antioxidante medido por el método del DPPH, fue el de la papaya de monte (1936 228 g equivalente trolox/g de fruto); seguido por el tomate de árbol (853 52 g equivalente trolox/g de tejido); y la mayor capacidad antioxidante medida por el método del ABTS fue el de la papaya de monte (2141 71 g equivalente trolox/g de fruto); seguido por el aguaymanto (1066 28 g equivalente trolox/g de fruto). Finalmente, se concluyó que el estado de madurez influye en forma directamente proporcional al contenido de compuestos bioactivos en el aguaymanto, los que a su vez generan una mayor capacidad antioxidante en el fruto mientras más maduro esté.
Palabras clave: Frutas nativas peruanas, Physalis peruviana, Cyphomandra betacea, Carica pubescens, Opuntia ficus indica, capacidad antioxidante, compuestos bioactivos.
ABSTRACT
In the case of the tree tomato ( ) the relatively high crude fibre content stood out (4,5 g/100 g of fruit). The tree tomato and golden berry had higher protein content (1,9 g/100 g for both fruits) than the other fruits. Regarding to the mineral analysis, the prickle pears are very good sources of phosphorus as well as calcium. On the other hand, the tree tomato is an excellent potassium source followed by golden berry and papaya( ). In addition golden berry is a relatively good source of iron and zinc. The mountain papaya is a very important source of phosphorus surpassing to the other fruits. All the samples presented significant difference as
far as the content of total phenolic compounds, but mountain papaya is the fruit that presented the highest content of these compounds (167 mg of gallic acid equivalent/g of fruit). The content of betalains in red prickle pear was of 68,95 mg/1000 mL. Golden berry had the highest vitamin C content (43,3 mg/100g) followed by mountain papaya (31,41 mg/100g). The lowest content of this vitamin was in the tree tomato followed by red prickle pear, 16,09 mg/100g and 22,75 mg/100g, respectively. The content of carotenoids was the highest in the tree tomato, (4 mg -carotene/100 g) followed by golden berry with 2,64 mg -carotene/100 g. Red prickle pear presented much greater capacity of inhibition of radical DPPH than the other varieties (77,65%). Comparing the different fruits regarding to the measurement of the antioxidant capacity, the mountain papaya (2141 71 g equivalent trolox/g of fruit) had the highest value followed by golden berry (1066 28 g equivalent trolox/g of fruit), tree tomato and red prickle pear. Finally, it was found that the grade of maturity had a direct effect to the antioxidant capacity.
Key words: Peruvian native fruits, Physalis peruviana, Cyphomandra betacea, Carica pubescens, Opuntia ficus indica, antioxidant capacity, bioactive compounds.
INTRODUCCIÓN
En el área andina se cultivan muchas frutas poco conocidas en otras regiones, como son el tomate de árbol o sacha tomate, aguaymanto, tuna y papaya de monte. Estas frutas se consumen principalmente en forma natural sin mayor grado de procesamiento; no existe tampoco mucha información sobre su composición química. La revalorización de frutas nativas, poco conocidas o desconocidas fuera de sus regiones de origen, sería de gran beneficio para el poblador rural del interior del Perú que se encuentra entre los grupos poblacionales más pobres de Latinoamérica. Entre estas frutas nativas existen fuentes importantes de vitaminas, azúcares, materias gelificantes (pectinas), materias antioxidantes, ácidos, aromas y sabores que esperan su identificación y posterior explotación por la industria para elaborar productos novedosos y competitivos en el mercado.
El aguaymanto es originaria del Perú y existen diversas referencias históricas que indican que fue domesticado, cultivado y muy apreciado por los antiguos peruanos. La Physalis peruviana posee diferentes nombres comunes, dependiendo de la región: capulí, aguaymanto, awaymanto, bolsa de amor, cereza del Perú, uchuva, etc. El fruto es una baya carnosa, jugosa, en forma de globo con un diámetro entre 1,25 - 2,5 cm y contiene numerosas semillas1.
La tuna, originaria de América, fue llevada por los españoles a Europa y desde allí distribuida hacia otros países del mundo. Esta gran dispersión geográfica dio origen a muchos ecotipos con características locales propias. Su producción, cultivo y/o crianza es altamente rentable, así como la de su huésped, la cochinilla. Se ha realizado la caracterización química de la tuna italiana y un estudio de almacenamiento de jugo de tuna; trabajaron con tres variedades: roja, amarilla y blanca y encontraron que las tunas tienen una acidez baja y un relativamente alto contenido de azúcar y vitamina C2.
El tomate de árbol es originario de la vertiente oriental de los Andes, específicamente Perú, Ecuador y Colombia. Pertenece al grupo de las frutas semiácidas, siendo conocida con diversos nombres en distintas regiones. Es una baya aromática de forma ovoide, punteada en su extremo inferior y con un cáliz cónico, que mide alrededor de 8 cm de largo y 5 cm de diámetro. Los colores de la pulpa varían entre naranja, rojo y amarillo; dicha pulpa es ligeramente firme, suave y jugosa, con un sabor agridulce. La pulpa cercana a la cáscara es firme, mientras que la pulpa interna es suave y jugosa con un sabor agridulce1.
Carica pubescens, llamada también papaya de la sierra, papayita arequipeña o papaya de monte. Requiere de climas templado - cálido. El fruto es una baya, de pericarpio delgado, jugoso, de color amarillo (pulpa y piel), pasando por color verde durante la madurez. El centro es hueco y se encuentra totalmente ocupado por las semillas envueltas en un tejido mucilaginoso; presenta una forma oblongo - ovoide de 5 a 10 centímetros de largo por 3 a 6 centímetros de ancho y tiende a ser ovalada, con los extremos aguzados1.
La presente investigación tiene los siguientes objetivos:
- Determinar el contenido de fibra cruda de las siguientes frutas nativas: tuna, aguaymanto, tomate de árbol y papaya de monte.
- Determinar el contenido de compuestos bioactivos y capacidad antioxidante en las frutas nativas antes mencionadas.
- Determinar cómo el estado de madurez del aguaymanto influye en el contenido de sus compuestos bioactivos y capacidad antioxidante, y determinar el estado de madurez que conlleva un mayor contenido de compuestos bioactivos.
PARTE EXPERIMENTAL
Lugar de ejecución
El presente trabajo de investigación se realizó en los laboratorios de Físico-Química, Instrumentación y Biotecnología, Microbiología y Planta Piloto de Alimentos, de la Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina.
Materiales y reactivos
Muestras: aguaymanto procedente del valle del Mantaro (Huancayo); papaya de monte procedente de Arequipa; tuna de tres colores: roja, verde y anaranjada, procedentes de Ayacucho; tomate de árbol, procedente de Junín.
Reactivos: ABTS (2,2'-azino-bis(3-thylbenzthiozoline-6-sulphonic acid) adquirido de Sigma Chemical Co.®, DPPH (1,1-diphenyl-2-picrylhydrazil) de Aldrich Chemical Co.®, persulfato de potasio de grado analítico de Harleco 7574®, etanol absoluto y hexano de J.T. Baker®, metanol de Mallinckrodt®, acetona, folin-ciocalteu, carbonato de sodio anhidro al 1 N, 2,6 diclorofenol indofenol de Ferak 33095®, ácido l(+)-ascórbico para análisis de Riedel-di Haën 33034®, ácido metafósforico, ácido acético glacial 100% de Merck®, ácido cítrico anhidro extra puro de Schardau® y alcohol de 96°GL
Métodos de análisis
- Análisis proximal: humedad, proteínas, lípidos, fibra cruda, cenizas4.
- Contenido de minerales (Fe, Ca, Zn y P) 3.
- pH3.
- Acidez titulable3.
- Contenido de sólidos solubles3.
- Capacidad antioxidante4,5.
- Compuestos fenólicos totales6.
- Carotenos7, expresado como mg -caroteno/100 g de muestra
- Betalaínas8, los resultados se expresaron como mg de betalaínas/1000 ml
- Ácido ascórbico, determinado por el método de titulación con 2,6 diclorofenol indofenol (James9) expresado como mg ácido ascórbico/100 g muestra.
Metodología experimental
Preparación de las muestras: Se trabajó con frutas sanas y firmes que fueron lavadas con agua destilada; el aguaymanto entero fue licuado durante 30 segundos; la papaya de monte se cortó en mitades para eliminar el mucílago interno y se procedió a licuar durante 1 minuto; las tunas fueron peladas y licuadas durante 30 segundos; el tomate de árbol fue separado en cáscara, pulpa y pepas; cada uno de éstos fue licuado durante 1 minuto; todas las frutas fueron inmediatamente usadas para la preparación de extractos.
Preparación de los extractos:
A. Fenoles totales y capacidad antioxidante con los métodos DPPH y ABTS: Para todas las muestras se pesó 2,5 gramos de muestra y se añadió 12,5 mL de metanol; se homogenizó la muestra con un agitador magnético durante 15 minutos y se almacenó el extracto durante 24 horas a 4°C en oscuridad; luego, se procedió a centrifugar el homogenizado durante 20 minutos a 5000 rpm; el sobrenadante se guardó para análisis posteriores y el precipitado fue eliminado.
Para los ensayos con DPPH, se tomó alícuotas del extracto obtenido: para aguaymanto, tomate de árbol y tuna se tomó 150 mL y para papaya de monte 50 mL.
Para los ensayos de ABTS, se tomó 50 mL del extracto de aguaymanto y papaya de monte y 150 mL del extracto de tuna y tomate de árbol .
B. Vitamina C: Los extractos para la determinación de vitamina C en frutas se preparó según Luximon-Ramma10.
C. Betalaínas: Para obtener el extracto de tuna roja para el análisis de betalaínas, se siguió el método indicado por Osborne11; primero se realizó una inactivación enzimática a 100°C por 5 minutos; luego se peló y se cortó en rodajas y se sometió a una extracción con agua acidulada (ácido cítrico al 0,2%) relación 1:2; se procedió a la precipitación de la goma con alcohol a 96°GL (1:2), y se filtró; la solución filtrada se guardó para posteriores análisis.
D. Determinación del estado de madurez en el contenido de compuestos bioactivos: Para tal fin, se trabajó con el aguaymanto y según la norma técnica Colombiana 458012, en la cual se indica una clasificación objetiva relacionando el contenido de grados brix y la acidez en la materia prima, tal como se indica en el Anexo 1, indicándose los estados de madurez cero, uno, dos-tres, cuatro, cinco y seis y poder conocer cómo el estado de madurez influye en el contenido de los compuestos bioactivos; se trabajó con el estado de madurez dos-tres junto, dado que fue el estado de madurez utilizado para la determinación de un estado de madurez intermedio, necesario para la elaboración de frutas en almíbar (objetivo de otra investigación), dado que para la elaboración de ese producto no se puede trabajar con un fruto inmaduro (estado de madurez cero y uno) ya que no tiene desarrollada las características sensoriales para ser agradable al consumidor, como tampoco se puede trabajar con un fruto sobremaduro (estado de madurez cuatro, cinco y seis) dado que estos frutos no resisten el tratamiento térmico necesario para la pasteurización de la conserva.
Análisis estadístico
Los resultados fueron procesados por un Análisis de Variancia (ANOVA) y la significancia estadística por la Prueba de Tukey. Las diferencias en p < 0,05 fueron consideradas significativas. El programa empleado fue SAS System V8.
RESULTADOS Y DISCUSIÓN
Análisis proximal y químico
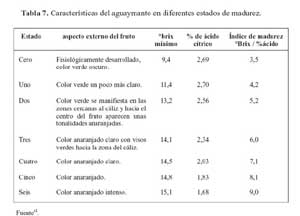
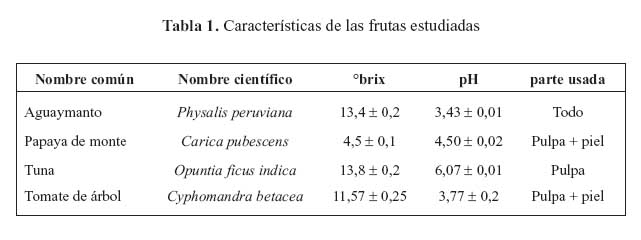
En la tabla 1, se puede apreciar la caracterización de las frutas en cuanto a su pH y grados brix. En el cuadro se aprecia el porcentaje de sólidos solubles promedio para cada uno de los frutos evaluados. Se menciona que la cantidad de sólidos solubles que contiene el jugo de una fruta cítrica es también un índice del grado de madurez de la misma18. La norma técnica de Colombia12 del aguaymanto establece como un grado brix mínimo para el estado de madurez intermedia (dos y tres, Anexo 1) de entre 13,2 y 14,1; mostrando así que nuestro fruto tiene un menor contenido de sólidos solubles, lo que posiblemente se deba a las diferencias entre el aguaymanto producido en Colombia y con el proveniente del valle del Mantaro.
En las tablas 2, 3 y 4 se presentan los resultados de análisis proximal, del contenido de minerales, así como el contenido de compuestos bioactivos y capacidad antioxidante, respectivamente. Todas las frutas tienen alto contenido de agua, entre 78,4 y 93,7% destacando la papaya de monte con el mayor contenido de agua y la tuna roja con el menor contenido. En cuanto al contenido de proteína en frutas, el tomate de árbol y aguaymanto, tenían mayor proporción (1,9 g/100 g).
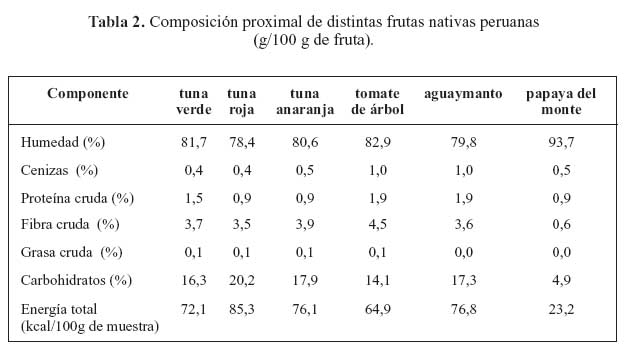
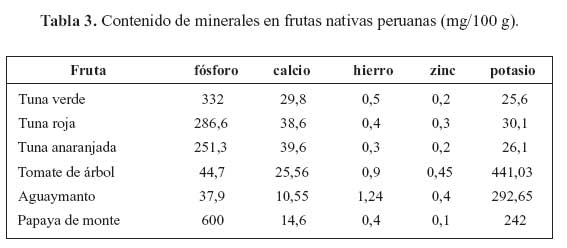
Entre las tres variedades de tuna, la tuna verde tiene el mayor contenido de proteínas (1,5 g/100 g), mientras que la tuna roja y anaranjada presentaron 0,9 g/100 g. Al respecto, se señalan que los frutos, en especial los que poseen características cítricas, tienen un bajo contenido de proteína y de grasa, dentro de los cuales se puede considerar al aguaymanto13. El tomate de árbol tiene un alto contenido de fibra cruda (4,5 g/100 g). Todas estas frutas, como las frutas en general, son fuentes insignificantes de grasas, pero son fuentes importantes de carbohidratos. Los principales carbohidratos de las frutas son los azúcares. Se señala que los carbohidratos en los frutos, especialmente los que poseen características cítricas, están conformados por monosacáridos (glucosa y fructosa), oligosacáridos (sacarosa) y polisacáridos (celulosa, almidón, hemicelulosas y pectinas) 3.
El tomate de árbol y las tunas tienen alto contenido de fibra y podrían ser utilizados en alimentos nutraceúticos ricos en fibra. Este es un aspecto muy interesante, porque la fibra alimentaria tiene propiedades positivas para la salud: reducción del nivel de colesterol en sangre, protección contra diferentes enfermedades, como los cardiovasculares y diferentes tipos de cáncer, etc.
En cuanto al contenido de minerales en las frutas, se puede observar que las tunas son fuentes importantes de fósforo, destacando en este aspecto la tuna verde (332 mg/100 g). Estas frutas son también fuentes, relativamente buenas, de calcio. Asimismo, cabe destacar el alto contenido de potasio que presentan el tomate de árbol y el aguaymanto. Las frutas nativas son fuentes importantes de nutrientes, como vitaminas (vitamina C, betacarotenos) y minerales (fósforo, potasio). El aguaymanto presentó un alto contenido de carotenoides (2,64 mg - caroteno/100 gramos muestra). Las tunas rojas y anaranjadas son ricas en pigmentos, que fueron identificados como betalaínas. Los investigadores franceses encontraron que la cáscara de tuna era rica en calcio y potasio 2,09 % y 3,4 % b.s.14.
Todas las muestras presentaron diferencia significativa en el contenido de compuestos fenólicos, pero la papaya de monte es la fruta que presentó el mayor contenido, como se puede apreciar en la tabla 4, donde también se muestra la relación que tiene el contenido de compuestos fenólicos y la capacidad antioxidante, según la materia prima evaluada. Las frutas, aparte de ser fuentes importantes de ciertas vitaminas, contienen otros componentes, principalmente pigmentados, como son los compuestos fenólicos, los que poseen capacidad antioxidante; son capaces de inhibir los radicales libres.
El contenido de compuestos fenólicos es mayor que el contenido en frutas cítricas y melón, pero menor que en uvas y grosellas encontradas por Vinson15. Según estudios se halló que los tallos de tuna contenían 3,7 mg de compuestos fenólicos totales/g como ácido gálico16. En el caso de la papaya de monte se encontró una mayor cantidad de compuestos fenólicos (167 mg/100g) que en la papaya tropical (57,6 mg/100g)11. El contenido de betalaínas en tuna roja fue de 68,95 mg/1000 ml. Se encontró que la tuna venezolana (Opuntia boldinghii) tenía 0,59 mg/100ml de betalaínas18. El contenido de vitamina C en la tuna peruana fue también mayor que en la tuna venezolana. La papaya de monte tenía menor cantidad de vitamina C que la papaya tropical (31,41 mg/100g y 92,9 mg/100g), respectivamente10.
En la tabla 4 se presenta la comparación de los contenidos de carotenoides en tomate de árbol, aguaymanto y papaya de monte. El tomate de árbol es la fruta que presenta mayor contenido de carotenos. Otros estudios presentan diferentes contenidos de carotenoides en diversas frutas y hortalizas hallados por varios autores en todo el mundo; así tenemos al camote (de 0,02 a 21,8 mg de â-caroteno/100 g), mango (de 0,6 a 2,9 mg de â-caroteno/100 g), melón (de 1,6 a 12,6 mg de â-caroteno/100 g), mangos brasileños (15±7 ìg/g de â -caroteno), papaya (de 0,4 a 10 g/g) y naranja brasileña y papaya roja fueron de 1,2 a 6,1 ìg/g y 2,1 a 10 ìg/g, respectivamente18.
Datos expresados como promedio desviación estándar (n = 3)
a g equivalente trolox / g de tejido
b mg de equivalente ácido gálico / 100 g muestra
c mg ácido ascórbico / 100 g muestra
d mg -caroteno / 100 gramos muestra
e mg de betalaínas / 1000 ml
- valor no determinado
La misma letra en la misma columna indica que no hay diferencia signicativa (p<0,05)
Los resultados promedios de carotenoides totales (2,64 mg de â-caroteno/100g, lo que equivale a 4400 UI de vitamina A) obtenidos para el aguaymanto se presentan en la tabla 4.
En este caso, el aguaymanto con estado de madurez intermedia utilizado como materia prima para la elaboración de conserva, presenta un nivel moderado de â-caroteno13. Sin embargo, en la mayoría de las frutas y vegetales que contienen carotenoides, la maduración se ve acompañada por un aumento de la biosíntesis de carotenoides, como por ejemplo en el damasco, mango, naranja, melón, papaya, etc.; razón por la cual el valor pudo ser algo menor19.
Respecto al tomate de árbol, tuvo un valor de 4 mg -caroteno / 100 gramos muestra, el cual no sólo se considera el mayor en los frutos evaluados, sino también, que se estaría hablando de un frutal con un nivel algo más que moderado de â-caroteno; mientras que la papaya de monte se consideraría como un fruto de nivel bajo en â-caroteno18.
Determinación de la capacidad antioxidante
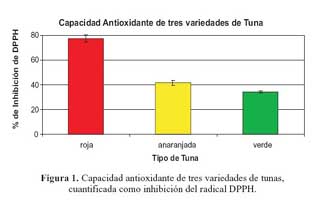
En la figura 1 se puede apreciar la capacidad antioxidante de las tres tunas estudiadas; la tuna roja (77,65%) tiene la mayor capacidad antioxidante en comparación que las otras; le sigue la tuna anaranjada (41,65%) y finalmente la tuna verde con un valor de 34,20% como porcentaje de inhibición del radical DPPH. La capacidad antioxidante está directamente relacionada con el contenido de pigmentos de la fruta. Se determinó la capacidad antioxidante de tallos de tuna, utilizando el método de radical DPPH, obteniendo una inhibición casi total en 40 minutos de reacción. En ambos ensayos (DPPH y ABTS) se encontró que la papaya de monte, presentó mayor capacidad antioxidante que las demás frutas16. La tuna roja fue la fruta que presentó menor contenido de capacidad antioxidante
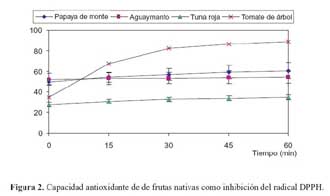
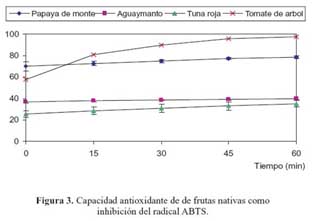
En las figuras 2 y 3 se muestra el porcentaje de inhibición del radical DPPH y ABTS, respectivamente, para cada tipo de fruto evaluado; la capacidad antioxidante de un alimento depende de la naturaleza y concentración de los antioxidantes naturales presentes en él. El tomate tiene el menor valor de capacidad antioxidante, a pesar de tener grandes cantidades de licopeno, probablemente porque el licopeno y los carotenoides, en general, son eficientes en la extinción (quenching) de singletes de oxígeno, y no tanto en el atrapamiento de radicales peroxílicos19.
La capacidad antioxidante de un alimento se debe a la actividad antioxidante de sus diferentes compuestos, entre los cuales están los compuestos fenólicos, carotenos, antocianinas, ácido ascórbico, etc. Por lo tanto, se puede decir, a partir de estas tablas, que existen compuestos fenólicos, carotenos y ácido ascórbico presentes en el aguaymanto, los que tendrían algún potencial antioxidante, el cual tiene un efecto sinérgico entre los compuestos bioactivos que conforman el fruto.
Se señala que los compuestos lipofílicos (carotenoides) son mejores queladores que reductores, es decir, los métodos de cuantificación de capacidad antioxidante lipofílica, tanto por ABTS como por DPPH, no cuantificaría verdaderamente dicho valor, además del efecto sinérgico que existiría entre los compuestos lipofílicos e hidrofílicos presentes en el aguaymanto, tomate de árbol, papaya de monte y tuna19.
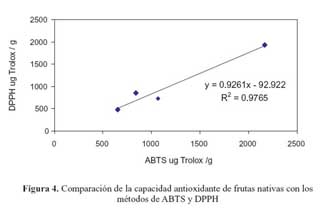
Las frutas evaluadas que presentaron una alta capacidad antioxidante con el método de ABTS también lo presentaron con el método de DPPH, excepto el tomate de árbol. Este mecanismo similar que presentaron (figura 4) muestra una buena correlación entre estos dos ensayos con un coeficiente de correlación = 0,9765, indicando que ambos métodos son practicables para la determinación de la capacidad antioxidante de las materias primas evaluadas. La mencionada correlación en el plotéo de los valores antes indicados y mientras el R2 sea más cercano a 1, mejor será su correspondencia.
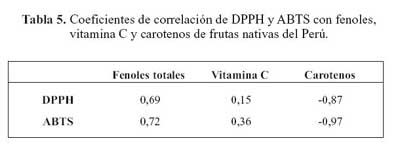
La tabla 5 muestra los coeficientes de correlación del DPPH y ABTS con relación a los compuestos bioactivos de las frutas estudiadas. El contenido de carotenos, correlacionó negativamente con la capacidad antioxidante indicando que a mayor contenido de carotenos la capacidad antioxidante disminuye.
Determinación del efecto del estado de madurez en los compuestos bioactivos del aguaymanto
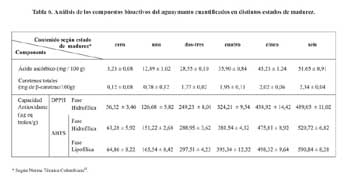
El aguaymanto fue clasificado en función a su madurez en 6 estados según lo recomendado por la norma técnica Colombiana12, la cual se presenta en el Anexo 1. En la tabla 6 se presentan los resultados de compuestos bioactivos en las frutas de aguaymanto en diferentes estados de madurez. Según la tabla 6 se ve claramente que mientras el aguaymanto aumenta en madurez, sus compuestos bioactivos (contenido de ácido ascórbico, compuestos fenólicos y carotenos totales) aumentan, obteniéndose de esta forma una mayor capacidad antioxidante.
Se debe mencionar que la evaluación de la capacidad antioxidante mediante el método del DPPH se realizó utilizando como solvente al metanol; es decir, se cuantificó la capacidad antioxidante de compuestos hidrófilos presentes en el aguaymanto (ácido ascórbico y compuestos fenólicos), mientras que para la evaluación mediante el método del ABTS se evaluó utilizando como solvente al metanol inicialmente y luego una mezcla de isopropanol/hexano, es decir se cuantificó la capacidad antioxidante de compuestos hidrófilos (ácido ascórbico y compuestos fenólicos) y compuestos lipófilos (carotenoides) de la fruta antes mencionada, razón por la cual en el segundo caso se obtuvo una mayor capacidad antioxidante, dado que la capacidad antioxidante total de un fruto es la sumatoria de su capacidad antioxidante en la fase hidrofílica y fase lipofílica.
Se señala que la capacidad antioxidante de un alimento se debe a la actividad antioxidante de sus diferentes compuestos bioactivos, entre los cuales tenemos a los compuestos fenólicos, carotenos, antocianinas, ácido ascórbico, etc21,22. Por lo tanto, se puede decir que son los compuestos fenólicos, carotenos y ácido ascórbico presentes en el aguaymanto, los que aportan su potencial antioxidante, existiendo a su vez un efecto sinérgico entre los compuestos bioactivos que conforman el fruto22.
Adicionalmente, como se muestra en la figura 5 (Anexo 1), al aumentar el contenido de carotenos, que se observa con el aumento del color amarillo, aumenta la capacidad antioxidante del fruto.
Se menciona que la madurez influye directamente en el contenido de compuestos bioactivos, dado que se generan durante la madurez procesos de biosíntesis los que generan mayor contenido de carotenoides, compuestos fenólicos, ácido ascórbico, etc.; compuestos bioactivos que al encontrarse en mayor cantidad en el fruto conllevan a dar una mayor capacidad antioxidante al fruto; así tenemos que en la misma investigación se obtiene como conclusión que la actividad antioxidante se incrementa con la maduración del fruto, encontrando un aumento en el contenido de fenoles totales, acido ascórbico, licopeno y â- caroteno en frutal de pimienta22.

CONCLUSIONES
- El tomate de árbol (4,5 g fibra/100 g fruta) tuvo el mayor contenido de fibra cruda, seguida por la variedad de tuna anaranjada (3,9 g fibra/100 g fruta); tuna verde (3,7 g fibra/100 g fruta); aguaymanto (3,6 g fibra/100 g fruta); tuna roja (3,5 g fibra/100 g fruta) y papaya de monte (0,6 g fibra/100 g fruta).
- La mayor capacidad antioxidante medida por el método del DPPH fue el de la papaya de monte (1936±228 mg equivalente trolox/g de tejido); seguido por el tomate de árbol (853±52 g equivalente trolox/g de tejido); el aguaymanto (729±98 g equivalente trolox/g de tejido) y finalmente la tuna roja (482±35 g equivalente trolox/g de tejido).
- La mayor capacidad antioxidante medida por el método del ABTS fue el de la papaya de monte (2141±71 g equivalente trolox/g de tejido); seguido por el aguaymanto (1066±28 g equivalente trolox/ g de tejido); el tomate de árbol (838±35 g equivalente trolox/g de tejido); y finalmente la tuna roja (651±40 g equivalente trolox/g de tejido).
- El mayor contenido de compuestos fenólicos fue el encontrado en la papaya de monte (167±0,3 mg de equivalente ácido gálico/100 g muestra); el aguaymanto (154±3 mg de equivalente ácido gálico/100 g muestra); el tomate de árbol (130±0,8 mg de equivalente ácido gálico/100 g muestra) y finalmente la tuna roja (52±5 mg de equivalente ácido gálico/100 g muestra).
- El mayor contenido de ácido ascórbico lo tuvo el aguaymanto (43,3±0,5 mg ácido ascórbico/100 g muestra); seguido por la papaya de monte (31,41±1,3 mg ácido ascórbico/100 g muestra); la tuna roja (22,75±0,6 mg ácido ascórbico/100 g muestra) y finalmente el tomate de árbol (16,09±1,6 mg ácido ascórbico/100 g muestra).
- El mayor contenido de carotenos fue en el tomate de árbol (4,00±0,01 mg b-caroteno/100 g muestra), seguido por el aguaymanto (2,64±0,03 mg b-caroteno/100 g muestra) y finalmente la papaya de monte (0,72±0,02 mg b-caroteno/100 g muestra).
- La tuna roja tuvo un contenido de 68,95±0,6 mg de betalaínas/1000 ml de fruta.
- El estado de madurez en el aguaymanto influye en forma directamente proporcional con su contenido de compuestos bioactivos, lo que a su vez repercute en que la capacidad antioxidante sea mayor en el fruto mientras va madurando.
- El mayor contenido de compuestos bioactivos en el aguaymanto fue para un estado de madurez seis con un 51,65 mg ácido ascórbico/100 g muestra; 2,34 mg de â-caroteno/100g muestra; una capacidad antioxidante en el extracto hidrofílico medido por el DPPH de 489,05 mg equivalente trolox/g de tejido y una capacidad antioxidante en el extracto hidrofílico medido por el ABTS de 520,72 mg equivalente trolox/g de tejido y de 590,84 mg equivalente trolox/g de tejido en el extracto lipofílico.
AGRADECIMIENTOS
Al CONCYTEC, a la Facultad de Industrias Alimentarias de la Universidad Nacional Agraria La Molina y a la Sociedad Química del Perú.
REFERENCIAS
1. National Research Council. 1989. Lost Crops of the Incas: Little-Known Plants of the Andes with Promise for Worldwide Cultivation. National Academy Press, Washington, D.C. Pag. 23-56.
2. Gurrieri, S.; Miceli, L.; Lanza, M.; Tomaselli, F.; Bonomo, R. and Rizzarelli, E. 2000. Chemical characterization of sisilian prickly pear (Opuntia ficus indica) and perspectives for the storage of its juice. Journal of Agricultural and Food Chemistry. 48. 5424-5431.
3. A.O.A.C., 1995 Official Methods of Analysis, 15 TH EDN. Association of Official Analytical Chemists. Washington DC .
4. Brand-Williams, W.; Cuvelier, M. and Berset, C. 1995. Use of free radical method to evaluate antioxidant activity. Lebensm Wiss Technology. 28. 25-30.
5. Re, R.; Pellegrini, N.; Proteggente, A.; Yang, M. and Rice-Evans, C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free radical Biology and Medicine. 26. 1231-1237.
6. Swain, F. and Hillis W. 1959. The phenolic constituents of Prunus domesticus. Journal of the Science of Food and Agriculture. 10. 63-68.
7. Talcott, S. and Howard, L. 1999. Phenolic autoxidation is responsible for color degradation in processed carrot puree. Journal of Agricultural and Food Chemistry. 47. 2109 – 2115.
8. Stintzing, F.; Schieber A.; and Carle, R. 2003. Evaluation of colour properties and chemical quality parameters of cactus juices. Europe food research and technology. 216. 303-311.
9. James, C. 1995. Analytical Chemistry of Foods. Blackie Academic & Professional. London. Pag. 23-24.
10. Luximon-Ramma, A.; Bahorun, T. and Crozier, A. 2003. Antioxidant actions and phenolic and vitamin C contents of common Mauritian exotic fruits. Journal of the Science of Food and Agriculture. 83. 496-502.
11. Osborne, D. y Voogt, P. 1986 Análisis de los Nutrientes de los Alimentos. Editorial Acribia. Zaragoza, España. Pag. 123-125.
12. ICONTEC. 1999. Uchuva (Physalis peruviana), para el consumo fresco o destinado al procesamiento industrial. Colombia. Norma Técnica Colombiana NTC 4580.
13. Davies, F. y Albrigo, G. 1994. Cítricos. Editorial Acribia. Zaragoza. España. Pag. 45-48.
14. Lamghari El Kossori, R.; Villaume, C.: El Boustani, E.; Sauvaire, Y. and Mejean, L. 1998. Composition of pulp, skin and seeds of prockly pears fruit (Opuntia ficus indica sp.) Plant Foods for Human Nutrition. 52. 263-270.
15. Vinson, J.; Hao, Y.; Su, X. and Zubic, L. 1998. Phenol antioxidant quantity and quality in foods. Journal of Agricultural and Food Chemistry. 46. 3630-3634.
16. Lee, J.; Kim, H. and Jang, Y. 2002. Antioxidant property of an ethanol extract of the stem of Opuntia ficus indica var. saboten. Journal of Agricultural and Food Chemistry. 43. 1222-1231.
17. Morín, Ch.; Salas, F. y San Martín, A. 1985. El cultivo de los cítricos. Departamento de Horticultura. UNALM. Lima-Perú. Pag. 45-56.
18. Rodríguez-Amaya, D. 1999. Carotenoides y preparación de alimentos: La retención de los Carotenoides Provitamina A en alimentos preparados, procesados y almacenados. Facultad de Ingeniería de alimentos. Universidad Estatal de Campiñas. Campinas SPBrasil. Pag. 35-37.
19. Pineda, D.; Salucci, M.; Lázaro R.; Maiani, G.; y Ferro-Luzzi, A. 1999. Capacidad antioxidante y Potencial de sinergismo entre los principales constituyentes de algunos alimentos. Revista Cubana Alimentación y Nutrición. 13. 104-111.
20. Gordon, M. 1990. Food antioxidants. Chapter 1: The mechanism of antioxidant action in vitro. Elservier Applied Science London and New York. U.S.A. Pag. 205-207.
21. Dragovic-Uzelac, V.; Levaj, B.; Mrkic, V.; Bursac, D. and Boras, M. 2007. The content of polyphenols and carotenoids in three apricot cultivars depending on stage of maturity and geographical region. Food Chemistry. 102. 966–975.
22. Navarro, J.; Flores, P.; Garrido, C. y Martínez, V. 2006. Changes in the contents of antioxidant compounds in pepper fruits at different ripening stages, as affected by salinity. Food Chemistry. 96. 66–73.
Resumen de la norma técnica Colombiana NTC 4580.
PRODUCTO: Uchuva (Physalis peruviana), para el consumo fresco o destinadas al procesamiento industrial.
El grado de desarrollo y el estado de la uchuva debe permitir el transporte y manipulación de manera que llegue satisfactoriamente al lugar de destino.