Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.74 no.2 Lima Apr./jun. 2008
Evaluación electroquímica de la película protectora de una carboxi-amido-imidazolina sobre un acero microaleado bajo condiciones de medio amargo
Electrochemical evaluation of a protective film by the carboxiamidoimidazoline inhibitor on a new microalloyed pipeline steel, under sour environment
Álvaro Torres Islas1 , Sergio Serna Barquera1
1 UAEM, Centro de Investigación en Ingeniería y Ciencias Aplicadas, Av. Universidad 1001, Col. Chamilpa, 62210-Cuernavaca, Mor., México atimarquis93@yahoo.com.mx; aserna@uaem.mx
RESUMEN
En este trabajo se reportan los resultados obtenidos de la evaluación de una carboxiamido- imidazolina utilizada para inhibir la corrosión, por medio de las técnicas de Espectroscopia de Impedancia Electroquímica (EIE) y análisis de ruido electroquímico (ARE). Las pruebas se realizaron utilizando un acero microaleado para tubería de reciente desarrollo, en contacto con medios amargos, en presencia del inhibidor. El medio amargo utilizado simula la composición de una fase acuosa que se forma durante la producción y transporte de gas natural a 50 ºC, sin la presencia de oxígeno. La remoción del oxígeno de la solución de prueba se logró al burbujearle un flujo de gas nitrógeno de alta pureza. El inhibidor se evaluó a cinco diferentes concentraciones en partes por millón (ppm). Los datos obtenidos mediante EIE y ARE fueron analizados y utilizados como indicadores para el monitoreo en el desarrollo de la película protectora generada por el inhibidor. Se encontró que la máxima eficiencia del inhibidor (EI), fue de aproximadamente 80%, lo cual se obtuvo con la adición del inhibidor en 5 y 10 ppm. Asimismo, el inhibidor presentó una buena persistencia en la superficie del acero, obedeciendo a un mecanismo de adsorción, el cual se puede explicar adecuadamente mediante el modelo de la isoterma de Temkin.
Palabras clave: Carboxi-amido-imidazolina; medio amargo, acero microaleado, técnicas electroquímicas.
ABSTRACT
The results of the evaluation of a carboxiamidoimidazoline corrosion inhibitor by means of electrochemical impedance spectroscopy (EIS) and electrochemical noise analysis (ENA) are reported. A new microalloyed pipeline steel was used to perform the electrochemical tests under sour environment in the presence of the corrosion inhibitor. The sour environment in which steel coupons were immersed simulates the composition of an aqueous phase during the production and transportation of natural gas at 50 ºC with oxygen removal by means of high purity nitrogen gas flux. Carboxiamidoimidazoline inhibitor formulation was tested in five different concentrations in parts per million (ppm). EIS and ENA data were analyzed as indicators for monitoring the development of a protective film by the inhibitor. It was found that the maximum inhibiting efficiency, IE, was of approximately 80% having added only 5 and 10 ppm. Moreover, this compound have a good persistency in steel surface that follows and adsorption mechanism, which can be adequately described by the Temkin isotherm.
Key words: Carboxi-amido-imidazoline; sour environment; microalloyed steel; electrochemical test.
INTRODUCCIÓN
Es bien sabido que la corrosión es uno de los problemas más serios en la industria del petróleo y gas natural. Las condiciones ambientales en los sistemas de transporte y distribución de petróleo y gas natural en campo pueden ser muy variadas, pero en general se pueden clasificar de la siguiente manera: Anaeróbicas, con alta concentración de dióxido de carbono (CO2 ), salinidad, y con la presencia de sulfuro de hidrógeno (H2S). El control de la corrosión puede lograrse por varios métodos. Sin embargo, la aplicación de inhibidores es una de las alternativas más efectivas para la protección de las superficies metálicas contra la corrosión. Los inhibidores de la corrosión normalmente se basan en compuestos orgánicos, que al añadirse al medio corrosivo en concentraciones muy pequeñas pueden reducir en gran medida la velocidad de corrosión del metal o aleación expuesta. El mecanismo más común de inhibición de estos compuestos, es mediante la adsorción sobre las superficies metálicas, aislándolas del medio corrosivo.1 Generalmente, la eficiencia se incrementa añadiendo cantidades mayores de inhibidor hasta llegar a un estado, más allá del cual el incremento en la concentración es irrelevante en el aumento de la eficiencia. Singh y Ateya .2,3 mostraron que la eficiencia en la inhibición de la corrosión se incrementa continuamente a medida que se incrementa la concentración de inhibidor. Sin embargo, también encontraron que hasta cierto límite, generalmente una concentración baja (concentración crítica), la eficiencia comienza a disminuir, no importando la cantidad de inhibidor que se añada. No obstante, dependiendo de la naturaleza del medio corrosivo, los inhibidores se comportan de manera diferente.
Recientemente se han hecho investigaciones, acerca del efecto del H2S, en la aceleración de la disolución del hierro, utilizando la técnica de EIE y técnicas potenciostáticas.4,5 Como resultado de estas investigaciones, se ha propuesto un mecanismo para interpretar el comportamiento anódico del hierro en soluciones acuosas que contienen H2S.6; el cual esta relacionado primero con una etapa de adsorción química, seguida sucesivamente por dos etapas de transferencia de carga.
Por otra parte, existen varias técnicas que pueden ser utilizadas para monitorear el comportamiento de un inhibidor. Sin embargo, pocas son capaces de generar un conocimiento fundamental de los procesos de corrosión y los mecanismos mediante los cuales actúan los inhibidores. La técnica de EIE ha demostrado ser particularmente útil para estudiar el proceso de formación y destrucción de la película de inhibidor que se forma sobre la superficie de un metal y para monitorear su persistencia.7, 8 De la misma manera la técnica de ARE ha demostrado ser muy útil para el monitoreo continuo de los procesos de corrosión y el comportamiento de los inhibidores.9
Actualmente se encuentran discrepancias en la literatura 10-15 acerca de los mecanismos de inhibición mediante los cuales las imidazolinas actúan sobre la superficie de un acero o aleación; el propósito de este trabajo es el de continuar con el estudio del comportamiento de este tipo de inhibidores y contribuir al conocimiento relacionado, para que eventualmente los resultados sean considerados en la correcta aplicación de los inhibidores y las técnicas para su evaluación en campo. Con este propósito se evalúan cinco concentraciones de la carboxiamido- imidazolina bajo estudio y se comparan los resultados obtenidos mediante las dos técnicas electroquímicas mencionadas anteriormente (EIE y ARE). Además, se estudia el comportamiento de los mecanismos de absorción de este inhibidor en un acero microaleado de reciente desarrollo utilizando las isotermas de Langmuir, Frumkin, Temkin, y Freundlich.
PROCEDIMIENTO EXPERIMENTAL
Condiciones generales
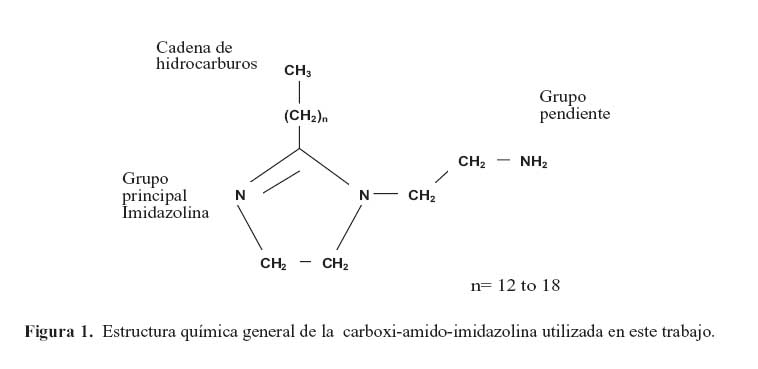
Las pruebas se realizaron utilizando pequeñas secciones extraídas de un planchón de acero grado API X80 experimental. Su composición química y microestructura ha sido reportada por Olivares.16 La estructura química general de la carboxi-amido-imidazolina bajo estudio se muestra en la figura 1. Consiste de tres partes: a) un anillo de cinco átomos unidos a dos átomos de nitrógeno; b) una cadena en un lado con un grupo funcional, y c) una cadena de hidrocarburos. La composición exacta del inhibidor bajo estudio se desconoce. Las concentraciones evaluadas del inhibidor fueron: 5, 10, 25, 50 y 100 ppm. Las pruebas electroquímicas se llevaron acabo en una solución acuosa con agitación, conteniendo NaCl (30 g/l), ácido acético glacial (CH3COOH)-1,7 g/l, y 3,52 g/l de Na2S. Se utilizó un volumen de 100 ml por prueba, utilizando para su preparación agua destilada y reactivos grado analítico. La solución fue desoxigenada antes de cada prueba burbujeándole gas nitrógeno de alta pureza mediante un sistema de purga, durante 1h. Se utilizó una celda de vidrio para la realización de las pruebas electroquímicas a 50 ºC controlando la temperatura mediante un termostato acoplado a una parrilla de calentamiento.
Mediciones de EIE
Para las pruebas de EIE se utilizó un arreglo de tres electrodos. Las señales electroquímicas generadas por el sistema bajo corrosión fueron monitoreadas y registradas utilizando un potenciostato Gill AC conectado a una computadora personal. Este equipo fue previamente calibrado de acuerdo a la norma ASTM G106-89. Se aplicó una señal de voltaje de CA con una amplitud de 5 mV con respecto al potencial de circuito abierto (PCA), en el rango de frecuencia de 2 mHz a 10 kHz, en periodos de 24 hr. Las dimensiones del electrodo de trabajo fueron 3 x 5 x 2 mm, encapsulado en resina poli-acrílica. La conexión eléctrica se hizo soldando al electrodo de trabajo un alambre de 80Cr-20Ni antes de encapsularlo en la resina, y protegiéndolo de la corrosión utilizando un tubo de vidrio. La superficie expuesta del electrodo de trabajo fue de 0,15 cm2. El electrodo de trabajo se lijó utilizando papel de lija hasta la lija 600; posteriormente se limpió con acetona secándolo con aire caliente. Inmediatamente después se introdujo en la solución de prueba. Se utilizó un electrodo de calomel saturado (SCE) como electrodo de referencia en todas las pruebas y un contraelectrodo de grafito.
Mediciones de ARE
Para las pruebas de ARE se utilizaron dos electrodos de trabajo del mismo acero y un electrodo de calomel como electrodo de referencia. Se registraron simultáneamente las fluctuaciones electroquímicas (ruido) en corriente y voltaje con una frecuencia de un punto por segundo durante 2048 segundos, en periodos de 24 hr. Para este propósito se utilizó un amperímetro automatizado de resistencia cero, ACM instruments, conectado a una computadora personal.
Se obtuvo la resistencia de la película del inhibidor con las diferentes concentraciones, y la resistencia de transferencia de carga mediante los espectros de impedancia, utilizando diagramas de Bode a diferentes tiempos. Lo mismo se realizó para el acero sin la presencia de inhibidor. Asimismo se calculó la resistencia en Ruido (Rnoise) mediante el análisis estadístico de las señales de corriente y voltaje aplicando la siguiente fórmula:
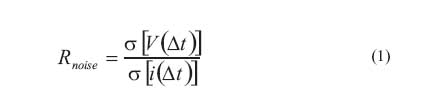
En donde ó[V(Ät)] es la desviación estándar del ruido en voltaje en intervalos de tiempo Ät, y ó[i(Ät)] es la desviación estándar del ruido en corriente en el mismo intervalo de tiempo Ät.
Como primer paso se removió la tendencia de la señal de corriente directa de los datos de ruido electroquímico antes de analizarlos. Para realizar lo anterior se aplicó un ajuste polinomial de primer orden mediante el software comercial Origin en una plataforma de Windows. La tendencia de DC tuvo que eliminarse debido a que puede originar grandes distorsiones en el análisis estadístico de los datos17.
Cálculo de las isotermas de adsorción
La ecuación 2 se utilizó para obtener la fracción de superficie cubierta (è) por la presencia de las moléculas del inhibidor en función de su concentración.

Donde icorr (blank) es la velocidad de corrosión del acero sin añadirle inhibidor y icorr (inhibited) es la velocidad de corrosión en presencia del inhibidor17. Con esta información y los modelos de adsorción representados por las ecuaciones 3 a 6, fue posible determinar qué modelo explica mejor el comportamiento asociado con los resultados experimentales.

En donde Kad es la constante de equilibrio de adsorción; C es la concentración de inhibidor, y f es la constante de interacción molecular.
RESULTADOS Y DISCUSIÓN
Espectroscopia de impedancia electroquímica
La resistencia de la película de inhibidor y la resistencia de transferencia de carga se obtuvieron a partir de los espectros de impedancia. Estos datos se presentan como diagramas de Bode a diferentes tiempos de inmersión. A partir de estos datos se evaluaron los parámetros de resistencia en ruido Rruido y el módulo de impedancia |Z|.
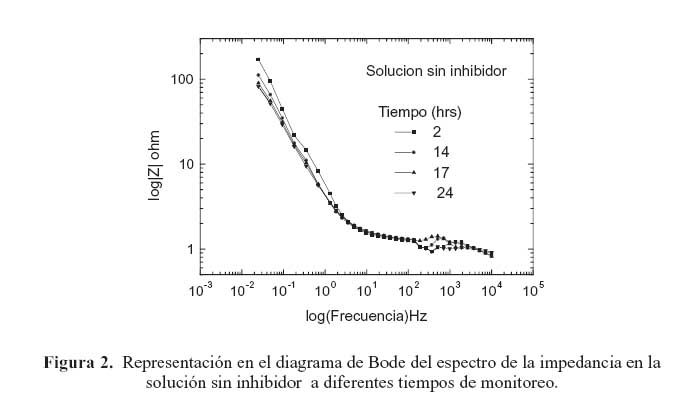
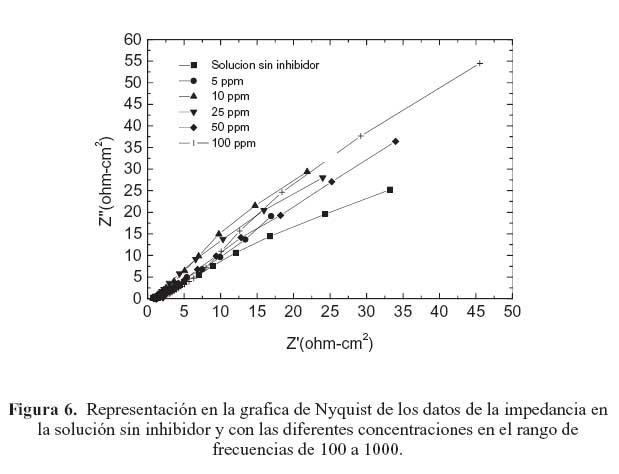
La figura 2 muestra la representación en el diagrama de Bode del espectro de la impedancia del acero en la solución sin inhibidor a diferentes tiempos de monitoreo (2, 14, 17 y 24 horas). En esta gráfica se puede observar que la impedancia de electrodo decrece ligeramente conforme el tiempo de monitoreo se incrementa. Al no contar con la presencia de inhibidor, en este caso el comportamiento anterior tiene que ver con el deterioro que experimenta la película de óxido protector que se forma sobre la superficie del acero en contacto con la solución. Cuando se añaden 5 ppm de inhibidor a la solución de prueba como se ilustra en la figura 3(a) la impedancia de electrodo se incrementa. Sin embargo, conforme aumenta el periodo de monitoreo, la impedancia decrece. Por otra parte, en el rango de alta frecuencia en el diagrama de Bode la forma de la curva presenta una variación abrupta en la impedancia de electrodo, la cual, en general, incrementa en relación con el tiempo de monitoreo. Este comportamiento también se presentó en la prueba con la solución sin inhibidor, pero a una magnitud mucho menor. Este fenómeno ocurre en todas las pruebas con las diferentes concentraciones de inhibidor en el mismo rango de frecuencia; un ejemplo de este comportamiento se muestra en las figuras 4(a) y 5(a), correspondientes a los diagramas de Bode de las pruebas con 10 y 25 ppm, respectivamente. Este comportamiento está relacionado con un proceso de difusión a través de la capa pasiva sobre el acero. Esta idea se apoya tomando en consideración que la impedancia representada en la gráfica de Nyquist de la figura 6 exhibe la forma característica de un proceso controlado principalmente por difusión en este rango de frecuencia.
El comportamiento correspondiente a las pruebas con 50 y 100 ppm de inhibidor presenta características similares a las pruebas sin inhibidor y con 5 y 25 ppm.
En el análisis del ángulo de fase en las gráficas de Bode en las figuras 3 (b), 4(b), y 5(b), correspondientes a las pruebas con 5, 10, y 25, ppm de inhibidor respectivamente, muestran una tendencia general de deterioro del inhibidor en todos los periodos de tiempo de monitoreo. Esta tendencia presenta dos etapas, como se discute a continuación.
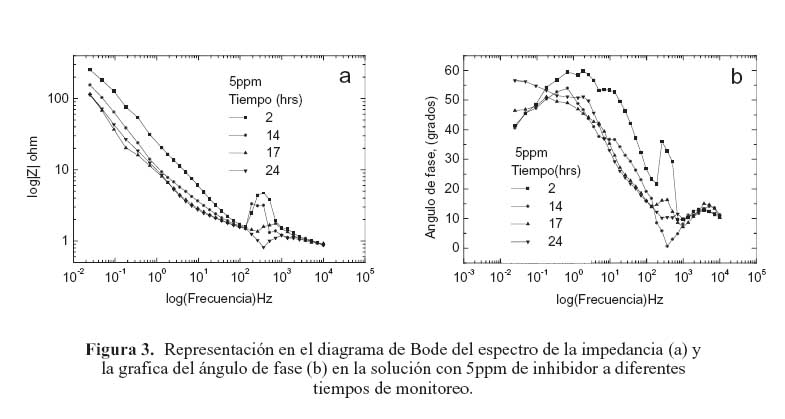
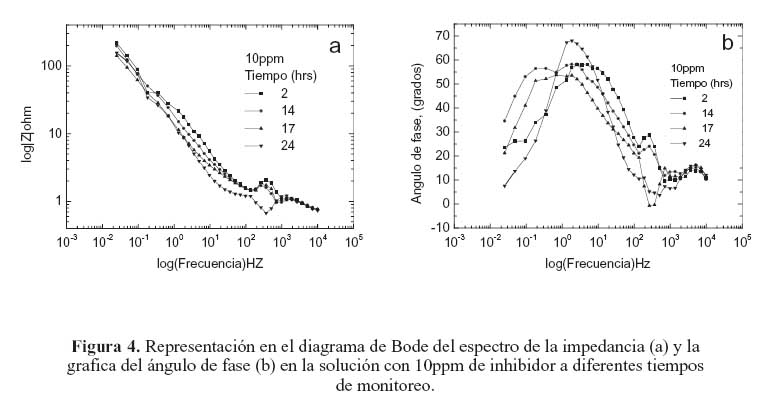
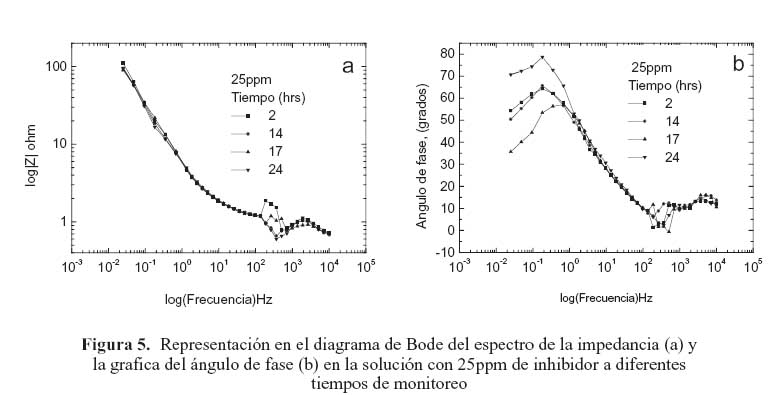
En la primera etapa los diagramas de Bode muestran una reducción de la impedancia en el rango de alta frecuencia. En esta etapa, la película de inhibidor se comporta como una película con propiedades dieléctricas con la presencia de micro-poros.18 Posteriormente, la forma en la grafica del ángulo de fase cambia repentinamente, presentando, en general, un incremento en todos los tiempos de monitoreo. Este comportamiento también se presenta en el acero en la solución sin inhibidor; esto sugiere que en esta etapa existe un proceso de difusión el cual está en función de la resistencia de la solución. La segunda etapa se caracterizó por un pico grande en el ángulo de fase a un rango intermedio de frecuencias en todos los tiempos de monitoreo. Este comportamiento se atribuye a procesos de transferencia de carga relacionados con las características de la doble capa.18,19 En esta etapa, el cambio en el ángulo de fase se vio afectado por la concentración del inhibidor, mostrando un incremento conforme aumenta la concentración de inhibidor. Esto muy probablemente es consecuencia del deterioro que sufre la película de inhibidor conforme pasa el tiempo. La eficiencia del inhibidor en la solución de prueba se incrementa al reducir su concentración, y parece decrecer al aumentar su concentración. Este resultado concuerda con el obtenido por otros investigadores. 20, 21 Sin embargo, los valores de impedancia de electrodo fueron relativamente bajos en todas las concentraciones del inhibidor. Al compararlos con los valores de impedancia del acero sin inhibidor, no exceden un orden de magnitud en sus valores. Lo anterior indica que este tipo de inhibidor no es muy adecuado para proteger al acero de la corrosión, por lo menos en este sistema. Los resultados también indican que la mayor eficiencia posible (cercana al 80 %) se obtiene con 5 y 10 ppm de inhibidor (figura 7).
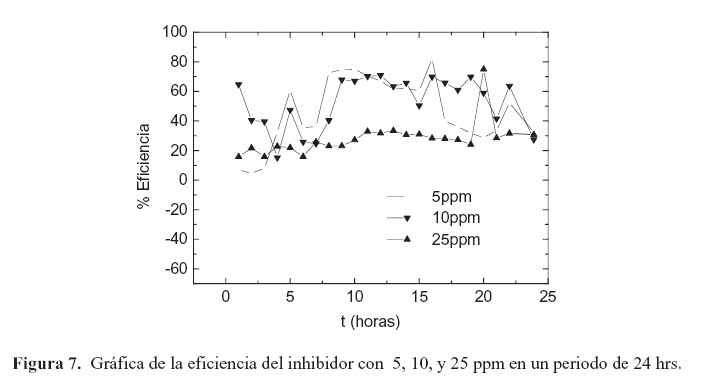
La formación y persistencia de la película de inhibidor ha sido monitoreada con claridad al analizar la tendencia de los datos de EIE, confirmando su desempeño con el cálculo de la eficiencia del inhibidor.
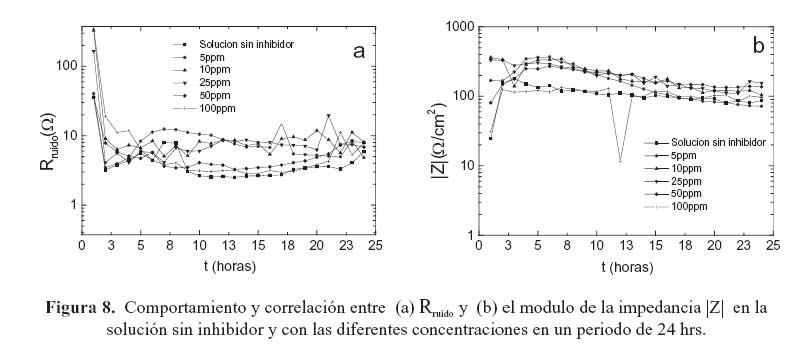
Continuando con el análisis en la formación y desarrollo de la película del inhibidor sobre la superficie del acero, en la figura 1, se muestra la estructura general del inhibidor (carboxiamido- imidazolina). Sus grupos; principal y de cadena, propician un fuerte enlace en la superficie del acero. Esta estructura también le ayuda a mejorar su adsorción molecular 22 de tal forma que la película del inhibidor estuvo presente durante todo el periodo de monitoreo. Esto fue evidenciado por el comportamiento de la resistencia en ruido (R ) y el módulo de ruido impedancia |Z| (figuras 8(a) y 8(b) respectivamente). A pesar de lo anterior, los resultados representados en los diagramas de Bode indican una protección casi nula por parte del inhibidor. Esto sugiere que en la interfase de la doble capa ocurre un proceso de transferencia de carga. Este comportamiento se ha relacionado con la barrera hidrofóbica del inhibidor y a su estructura de cadena de hidrocarburos, los cuales pueden afectar en gran medida su desempeño.22 De esta manera, la película de inhibidor permite la entrada de moléculas de agua y como consecuencia, la alta actividad de reacciones anódicas y catódicas en la superficie de la aleación promueven su bajo índice de protección.
Como se discutió anteriormente, la eficiencia, persistencia y deterioro de la película de inhibidor están normalmente representados por cambios típicos en las gráficas de Bode. Por lo tanto estos diagramas en sí mismo pueden utilizarse como un indicador para el monitoreo y estudio del comportamiento de la película de inhibidor sobre un acero.
Ruido electroquímico y análisis del módulo de la impedancia.
Las señales de ruido electroquímico se registraron de manera continua del sistema bajo estudio, en la solución de prueba durante 24 hrs, con cada una de las diferentes concentraciones de inhibidor respectivamente. A partir de los datos generados por el registro de estas señales se calculó el parámetro de Rruido el cual indica el deterioro así como la persistencia de la película de inhibidor. Además también se realizó la comparación de este parámetro con el módulo de impedancia |Z| a bajas frecuencias.
Al comparar el ARE con las metodologías de EIE, éste demuestra ser más conveniente por su simplicidad experimental, especialmente por su característica de monitorear continuamente el comportamiento de la película de inhibidor. La figura 8(a) muestra el cambio continuo de la Rruido durante el periodo de tiempo de evaluación con cada una de las concentraciones de inhibidor. En esta figura se observa que para 5 ppm de inhibidor la Rruido muestra valores de resistencia mayores en comparación con el acero sin inhibidor. Este comportamiento siguió con una tendencia progresiva hasta 10, ppm de inhibidor. Sin embargo, a 25, 50 y 100 ppm de inhibidor la Rruido muestra una reducción; el mismo comportamiento se aprecia en las gráficas de Bode en las mismas concentraciones. Esto confirma que la mayor eficiencia del inhibidor se presenta a bajas concentraciones y por el contrario, al incrementar la concentración la eficiencia del inhibidor disminuye. De tal manera que la tendencia en las gráficas de Rruido coincide con los resultados de EIE, como se ha establecido anteriormente.
En la figura 8(b) se muestra la gráfica del módulo de la impedancia a bajas frecuencias para la solución sin inhibidor y con cada una de las concentraciones. Al comparar esta gráfica con la de la figura 8 (a) se puede apreciar que la Rruido muestra una fuerte correlación con el comportamiento de la película de inhibidor representada por el módulo de la impedancia. De tal forma que con 5ppm se obtiene la máxima eficiencia del inhibidor mientras que con 10 y 25 ppm el comportamiento de la película de inhibidor es similar, aunque con una menor eficiencia y con 50 y 100 ppm de inhibidor la protección es prácticamente nula.
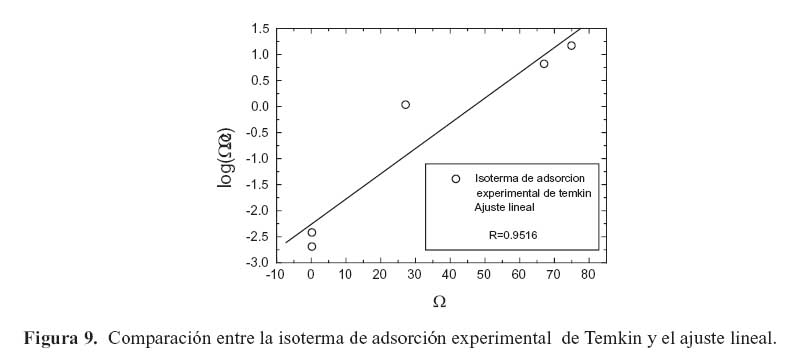
La figura 9 muestra el análisis del modelo de la isoterma de adsorción de Temkin que fue la que más se ajustó al comportamiento del inhibidor. Al emplear los modelos de Langmuir, Frumkin, y Freundlich (eqs. 4-6), el valor de correlación r fue mucho menor a la unidad. Temkin propone que los sitios de mayor energía se ven ocupados primero por los iones de la solución, una vez que la afinidad iónica cae linealmente con el aumento de la adsorción del inhibidor. Y. J. Tan et.al. mencionan que la persistencia de la película de un inhibidor puede evaluarse simplemente al monitorear la amplitud de la corriente en ruido. Sin embargo, para hacer un análisis más detallado se requiere del parámetro Rruido en conjunto con los diagramas de cambio de ángulo de fase, así como la impedancia de electrodo y el análisis de las isotermas de adsorción, como se ha confirmado en este trabajo.
CONCLUSIONES
Las técnicas de EIE y ARE se utilizaron exitosamente como técnicas complementarias para el estudio y evaluación de la formación, comportamiento y persistencia de una película de inhibidor (carboxi-amido-imidazolina), sobre la superficie del acero microaleado, grado API X80, en contacto con un ambiente amargo. Los resultados experimentales mostraron que para el acero microaleado bajo estudio, en las condiciones de prueba se logra la máxima eficiencia de protección del inhibidor con una concentración de 5, 10 y 25 ppm. Mientras que con 50 y 100 ppm de inhibidor la protección del inhibidor es casi nula. La persistencia del inhibidor decrece conforme aumenta el tiempo de exposición, siendo el principal mecanismo de deterioro un proceso de transferencia de carga. El mecanismo de adsorción del inhibidor sobre la superficie del acero puede describirse de manera adecuada utilizando el modelo de la isoterma de Temkin. Sin embargo, a pesar de que con 5, 10 y 25 ppm de concentración de inhibidor se obtiene la mayor eficiencia de inhibición, este no puede considerarse adecuado para la protección del acero, por lo menos en este sistema. Lo anterior es consecuencia de los bajos valores de impedancia registrada en la solución con la presencia de inhibidor, en comparación con los valores del acero en contacto con la solución sin inhibidor.
AGRADECIMIENTOS
Los autores agradecen el apoyo del CONACYT mediante el Programa de apoyo complementario para la consolidación institucional de grupos de investigación (Convocatoria 2006).
REFERENCIAS
1. V.S. Sastri, Corrosion Inhibitors: Principles and Applications, John Willey and Sons, New York, 1998.
2. I. Singh, Corrosion, 49, 6 (1993) p. 473.
3. B.G. Ateya, B.E. EI- Anadouli, F.M. EI- Nizamy, Corrosion Sci., 24, 6 (1984) p. 497.
4. M. Keddam, O.R. Matoos, H. Takenouti, J. Electrochem Soc, 128 (1981) p. 257-274.
5. L.Bai, B.E. Conway. Electrochem Acta, 38 (1993) p. 1803.
6. H.Y. Ma, X.L. Cheng, S.H. Cheng, G.Q. Li, X. Chen, S.B. Lei, H.Q. Yang, Corrosion Sci., 54,8 (1998) p. 634-640.
7. Y.J. Tan, S. Bailey and B. Kinsella, Corrosion Sci., 38,9 (1996) p. 1545-1561.
8. Huey J. Chen, Evaluation of Oilfield Corrosion Inhibitors by EIS, Corrosion 94, paper 92, NACE (1994).
9. Y.J. Tan, S. Bailey and B. Kinsella, Corrosion Sci., 38,10 (1996) p. 1681-1695.
10. Y.J. Tan, B. Kinsella and S. Bailey, NACE Internacional Annual Conference and Exposition Corrosion 96. Paper No. 352.
11. S. Ramachandran, V. Jovancicevic, Corrosion, 55, 3 (1999) p. 259.
12. A. Edwars, C. Osborne, S. Webster, D. Klenerman, M. Joseph, P. Ostovar, M. Doyle, Corrosion Sci., 36 (1993) p. 315.
13. V. Jovancicevic, S, Ramachandran, P. Prince, Corrosion, 55, 5 (1999) p. 449.
14. I. Esih, T. Soric, Z. Pavlinic, Br, Corrosion, 33, 4 (1998) p. 309.
15. D. Wang, S. Li, Y. ying, M. Wang, H. Xiao, Z. Chen, Corrosion. Sci., 41, 10 (1999) p. 1911.
16. I.Olivares, B. Campillo, J.A. Juarez-Islas, Iron and Steel Shaping (In press).
17. W. Durnie, R De Marco, A. Jefferson, B. Kinsella, J. Electrochem Soc., 146 (1999) p. 1751.
18. S. Feliu, J.C. Galvan and M. Morcillo, Corrosion Sci., 30,10, p. 989.
19. C.H. Tsai and F. Mansfeld, Corrosion, 9, 49(1993) p. 727.
20. M.A. Quaraishi, H.K. Sharma, Mater. Chem. Phys., 78 (2002) p. 18.
21. I. Thompson and D. Campbell, Corrosion Sci., 1,36,(1994) p. 187.
22. G. Gusmano, P. Labella, G. Montesperelli, A. Privitera, S. Tassinari, Corrosion 62, 7,(2006), p. 576.













