Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.2 Lima abr./jun. 2010
TRABAJOS ORIGINALES
Relevancia del PH en la adsorción de iones metálicos mediante algas pardas
Relevance of the PH on the adsorption of metallic ions by brown seaweeds
Norma A. Cuizanoa , Ursula F. Reyesa , Susana Domingueza , Bertha P. Llanos*a , Abel E. Navarrob
a Departamento de Quimica, Facultad de Ciencias y Filosofia, Universidad Peruana Cayetano Heredia, Av. Honorio Delgado 430, Lima 31, Peru.
b Graduate School of Arts and Science, New York University, 100Washington Square East, New York, NY, 10003, US. bllanos@upch.edu.pe
RESUMEN
El efecto del pH en el proceso de biosorcion de metales pesados es evaluado considerando la quimica del ion metalico mediante experimentos discontinuos a temperatura ambiente. Se evaluo la adsorcion de los iones metalicos de plomo, zinc, cobre, cadmio y oro con las algas marinas pardas Lessonia nigrescens Bory (L13) y Macrocystis integrifolia Bory (S12). Los resultados muestran un fuerte efecto del pH en la quimica acuosa del ion metalico dominada por aquo e hidroxo-complejos, la cual es condicionada por la propia acidez del cation. Experimentalmente se comprueba la preferencia de ambas algas por el ion Pb (II) yCd (II). La afinidad de las algas con los iones estudiados sigue la tendencia: Pb>Cd>Zn Cu. El ion AuCl4 mostro una lenta cinetica de formación de cloro e hidroxi complejos que depende fuertemente del pH, lo que sugiere un peculiar mecanismo por intercambio de ligandos en comparacion del conocido intercambio ionico que fue observado para los cationes divalentes estudiados.
Palabras clave: biosorcion, pH, metales pesados, algas pardas, especiacion quimica.
ABSTRACT
The effect of the pH on the biosorption process of heavy metals is evaluated by considering the chemistry of the metal ions by means of batch experiments at room temperature. The adsorption of the metal ions of lead, zinc, copper, cadmium and gold were evaluated on the brown seaweeds Bory and Bory. The results show a strong pH effect on the aqueous chemistry of the metal ions dominated by aquo and hydroxo complexes. This aqueous chemistry is conditioned by the own acidity of the cation.
The preference of both algae towards the Pb (II) ion was experimentally confirmed. The affinity of the algae towards the studied metal ions followed the trend: Pb>Cd>Zn Cu. The AuCl ion showed a slow kinetics in the formation of chloro and hydroxyl complexes. These complexes strongly depended on the pH. This suggests a unique mechanism by ligands exchange rather than the well-known ionic exchange that was observed for the studied divalent cations.
Key words: biosorption, pH, heavy metals, brown seaweed, chemical speciation.
INTRODUCCIÓN
La contaminacion es un cambio perjudicial en las caracteristicas fisicas, quimicas o biologicas del aire, tierra o agua que pueden afectar nocivamente al medio ambiente. Es decir, la contaminacion se define como la presencia de concentraciones elevadas por encima de valores concretos, de ciertas sustancias, sedimentos u organismos en el agua o en la atmosfera . Para fines practicos, en este trabajo, se utilizo la palabra contaminacion para referirnos a cualquier cambio en la calidad natural del agua causada por factores quimicos ya sean de origen natural o antropogenico .
Los constituyentes quimicos de las aguas residuales son con frecuencia clasificados en inorganicos y organicos; dentro de los diferentes tipos de contaminantes inorganicos, no solo en el agua, sino en el medio ambiente en general, los metales pesados han sido identificados como los contaminantes mas peligrosos. Los metales pesados son aquellas sustancias que tienen una densidad superior a los cinco gramos por centimetro cubico (cinco veces la densidad del agua) ; en cierto grado estos metales son solubles en agua, pero son mas solubles a pH acidos . El rasgo distintivo de la fisiologia de los metales pesados, es que muchos de ellos, y otros, son esenciales para el crecimiento como el Na, K, Mg, Ca,V, Mn, Fe, Co, Ni, Cu, Zn y Mo; estos se utilizan en pigmentos respiratorios (hierro, cobre, vanadio), enzimas (zinc), vitaminas (cobalto) y otros procesos metabolicos. Los metales pesados resultan toxicos cuando exceden las concentraciones normales; tienen efectos toxicos sobre las celulas, principalmente como resultado de su capacidad para alterar o desnaturalizar las proteinas .
Entre los mecanismos moleculares que determinan la toxicidad de los metales pesados se encuentran: 1) el desplazamiento de iones metalicos esenciales de biomoleculas y bloqueo de sus grupos funcionales; 2) la modificacion de la conformacion activa de las biomoleculas, especialmente enzimas y polinucleotidos; 3) la ruptura de la integridad de las biomoleculas, y 4) la modificacion de otros agentes biologicamente activos . Los metales toxicos estan presentes solo en pequenas cantidades en casi todas las aguas naturales.
Desafortunadamente, los metales pesados forman parte de los residuos de actividades mineras, comerciales e industriales, debiendo ser removidos para evitar que se descarguen directamente al ambiente y provoquen alteraciones al mismo. Las actividades industriales generan una contaminacion a gran escala con metales pesados; organismos tales como la Agencia de Proteccion Ambiental (EPA), han regulado los parametros de descargas de aguas residuales; sin embargo, cuando las descargas industriales exceden los parametros, muchas industrias diluyen sus descargas de materiales peligrosos.
Los metales son especies quimicas no degradables ni biologica ni quimicamente en la naturaleza; por tal motivo, una vez vertidos al medio ambiente, solo pueden distribuirse entre los entornos: aire, agua y suelo, a veces cambiando su estado de oxidacion, o incorporandose en los seres vivos. Los compuestos que contienen otros metales pueden alterarse, pero los metales pesados aun permanecen en las formas mas toxicas del metal. Debido a su movilidad en los ecosistemas acuaticos naturales y a su toxicidad para las formas superiores de vida, a los iones de metales pesados presentes en los abastecimientos de aguas superficiales y subterraneos se les ha dado prioridad como los contaminantes inorganicos mas importantes en el ambiente .
Relevancia del pH en la adsorción de iones metálicos mediante algas pardas
Bajo ciertas circunstancias estos elementos pueden almacenarse en concentraciones toxicas y causar danos ecologicos. En la mineria existe una exposicion superficial con una alta concentracion de los elementos toxicos, dando por resultado la contaminacion del suelo, de la biota y del agua . El termino bioacumulacion hace referencia a la acumulacion neta, con el paso del tiempo de metales (u otras sustancias persistentes) en un organismo a partir de fuentes tanto bioticas como abioticas. El termino biomagnificacion significa la acumulacion progresiva de ciertos metales pesados (y otras sustancias persistentes) de uno a otro nivel trofico sucesivo; esta relacionada con el coeficiente de concentracion en los tejidos de un organismo depredador en comparacion con el de su presa.
En respuesta a este problema, durante la decada pasada, la biorremediacion ha sido vista como una solucion tentativa, debida a su bajo costo y selectividad por metales pesados a bajas concentraciones. La eliminacion de metales por biomasa muerta (biosorcion) es mas atractiva comparada al uso de celulas vivas (bioacumulacion) debido a varias razones: el crecimiento y propagacion de la biomasa pueden ser alteradas por la misma toxicidad del contaminante; a los cuidados que el crecimiento celular requiere y a la multiplicidad de mecanismos posibles ; es por ello que la biosorcion constituye una via tecnologica util para la biorremocion de metales toxicos de aguas de desechos. En el presente trabajo se enfatiza en el uso de algas marinas para la eliminacion de metales pesados de efluentes industriales debido a su abundancia en el litoral peruano, a su gran diversidad que las hace aplicables a distintos fines biotecnologicos y a su irrisorio costo en el mercado.
El rol del pH ha sido ampliamente estudiado para varios sistemas, reconociendo su fuerte influencia en el proceso de biosorcion ; lamentablemente, la informacion aun no es suficiente, quedando remanentes numerosas interrogantes sobre la relacion de un mismo adsorbente frente a varios metales pesados; para tal efecto, se propuso como objetivo de este estudio, el evaluar diversos metales pesados (toxicos y preciosos) ante dos algas marinas del litoral peruano, para analizar la contribucion del pH que condiciona la eficiente interaccion entre el ion metalico y la superficie del adsorbente.
PARTE EXPERIMENTAL
Soluciones: Se uso nitrato de cadmio II tetrahidratado, Cd(NO ) .4H O, cloruro de oro III, AuCl , y sulfato de zinc heptahidratado, Zn(SO ).7H O, de Sigma-Aldrich, nitrato de plomo II, Pb(NO ) , y sulfato de cobre II de Merck, todos de grado analitico. Las soluciones stock fueron preparadas con agua desionizada, purificada por osmosis reversa mediante el equipo Barnstead/Thermolyne (Dubuque, IA) D2714, el cual proporciona agua con una conductividad de 18 m . Se prepararon diferentes soluciones de cada uno de los iones metalicos, mediante dilucion de su respectivo stock hasta alcanzar la concentracion deseada del ion metalico en cuestion.
El pH de las soluciones fue ajustado entre los valores de pH de 2 y 6 para Pb, Cd y Cu; entre 2 y 7 para Zn, y entre 2 y 5 para Au. Esto se llevo a cabo usando soluciones diluidas de acido clorhidrico e hidroxido de sodio. El pH fue controlado por un pH-metro Thermo Electron Corporativo Modelo: Orion 525 At. El rango estudiado de pH depende de la solubilidad del ion metalico en solucion acuosa. Las soluciones de oro presentaron diferentes especies quimicas que cambiaban con el tiempo, por lo que los valores de pH iniciales son aproximados.
Biomasa: Las algas marinas pardas Bory (L13) y Bory (S12) fueron recolectadas de las playas de Tacna y Marcona en Peru, respectivamente, a una distancia aproximada de 200 m de la orilla. Las algas fueron lavadas con abundante agua potable, llevadas al laboratorio para su identificacion taxonomica y mantenidas bajo refrigeracion. Con el fin de descartar la presencia de otros iones metalicos en los adsorbentes, las algas fueron agitadas a 250 rpm durante 3h en una solucion 3M de HCl. Luego se lavo las algas con agua tipo I hasta que el sobrenadante dio neutro al papel de tornasol. Finalmente, los adsorbentes fueron secados a temperatura ambiente, molidos y tamizados hasta alcanzar un diametro de particula entre 106 y 150 almacenaron en un desecador con Silica gel hasta su uso.
Pruebas de biosorción: Se llevaron a cabo experimentos discontinuos con los iones metalicos de plomo, zinc, cobre, cadmio y oro, bajo sus formas quimicas: Pb(II), Zn(II), Cu(II), Cd(II) y AuCl , respectivamente. Estos iones metalicos fueron puestos en contacto con los mismos adsorbentes L13 y S12 a diferentes valores de pH, dependiendo de la precipitacion de los metales. Para todos los metales (excepto oro) se mezclo 20mg de adsorbente con 100mLde solucion del metal de concentracion inicial de 100 ppm; para el oro, se mezclo 10mg del adsorbente con 50mL de solucion de una concentracion de 30 ppm. La diferencia de estos parametros iniciales no afecta el equilibrio ya que la relacion masa/volumen del adsorbente y solucion se mantienen en una relacion 1:5.
Las muestras por duplicado fueron sometidas bajo agitacion orbital de 200 rpm durante 20 horas a temperatura ambiente. Luego de alcanzar el equilibrio (estudios preliminares), se filtro la mezcla en papel Whatman N°42 y se midio el contenido del ion metalico en el filtrado mediante un espectrofotometro de absorcion atomica a la llama (Perkin Elmer 3110).
Análisis de los datos: La cantidad de metal adsorbido fue calculado mediante:
q = (Ci - Cf)V/m
donde Q es la capacidad de adsorcion (mg de metal/ g de biosorbente), es el volumen de la solucion (mL), es la concentracion inicial de metal en solucion (mg.L ), es la concentracion en el equilibrio de la solucion (mg.L ) , y es la cantidad de biosorbente seco (g).
RESULTADOS Y DISCUSIÓN
La adsorcion de metales pesados por biopolimeros es fuertemente influenciada por el pH del medio. Dicho efecto es (i) a nivel de la disponibilidad de los iones metalicos en su forma adsorbible en solucion acuosa y (ii) a nivel de la activacion de grupos funcionales (potenciales centros de adsorcion) en la superficie del adsorbente. Se evaluo (i) sometiendo diferentes iones metalicos (anionico y cationicos) con los mismos adsorbentes L13 y S12.
La formacion de aquo e hidroxocomplejos de metales en solucion acuosa, condiciona la especiacion quimica en la cual el ion se encuentra presente ; dicho comportamiento es regulado por el pH, entendido como el equilibrio de los iones hidronio y oxhidrilo en solucion; de tal forma que proporciona los ligandos a los que estara unido el ion metalico.
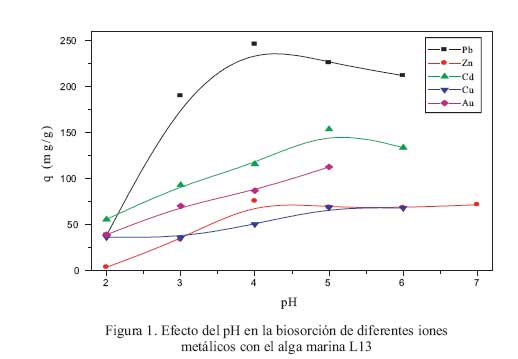
Para el presente estudio se seleccionaron cuatro cationes divalentes (Pb, Zn, Cd y Cu); por ser de importancia biologica (cobre y zinc) y por su impacto en la contaminacion de efluentes mineros e industriales (Pb y Cd) y un anion monovalente AuCl , representando a los metales preciosos. Las figura 1 y figura 2 muestran los resultados del efecto del pH ante los citados iones metalicos, los cuales pueden analizarse desde tres puntos de vista: i) superioridad del ion Pb (II) frente a todos los demas iones como adsorbatos; ii) la adsorcion de todos los iones metalicos entre valores de pH de 4 y 5; y iii) efecto del pH y la quimica acuosa de los iones metalicos.
i) La superioridad del ion Pb (II) frente a otros metales pesados ha sido demostrada anteriormente . Dicha superioridad es explicable en base al concepto de la acidez de Lewis, definida como la relacion masa/carga de determinado cation. Poseer una gran masa involucra tener un volumen adecuado que genera una eficiente separacion de cargas dentro del ion metalico, permitiendo una alta polarizacion dentro del ion que minimiza las repulsiones electron-electron entre el adsorbente y adsorbato. Es decir, si tenemos cationes isovalentes, el ion de mayor peso atomico sera mejor y mas eficientemente adsorbido en comparacion de los demas, debido a su acidez y su interaccion con pares de electrones libres del adsorbente sera favorecida. Esta hipotesis ha sido corroborada anteriormente . Segun los resultados obtenidos; esta hipotesis se cumple ya que se observa la siguiente tendencia en capacidades de adsorcion para los iones divalentes: Pb>Cd>Zn Cu, en total acuerdo con la relacion masa/carga.
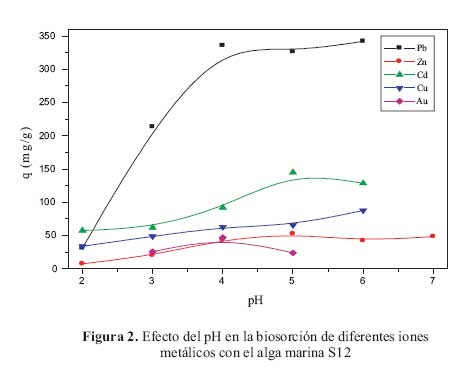
ii) El ion oro (III), bajo la forma AuCl , presente un efecto del pH en su adsorcion en las algas marinas limitada por su solubilidad. Su relacion masa/carga deberia permitir altos valores de capacidad de adsorcion (comparables al plomo), sin embargo, ese comportamiento no es observado. La baja adsorcion de oro podria atribuirse a la constante asociacion y disociacion de complejos de oro con iones hidroxilo y cloruro que estan presentes en la solucion y que constituyen fuerte competidores frente a los centros de adsorcion de las algas marinas.
Si pensamos acerca de un mecanismo tentativo de iones Au (III), podriamos descartar completamente la presencia de interacciones electrostaticas, ya que todos los complejos posibles de Au (III) estan cargados negativamente y, por ende, se repelen en la superficie negativa del adsorbente debido a los alginatos. Por otro lado, si descartamos una interaccion electrostatica, cabria la posibilidad de otros dos tipos de interacciones: dipolo-dipolo y de dispersion. Las interacciones dipolo-dipolo tambien estarian dejadas de lado, ya que AuCl es una especie negativa y la superficie de las algas poseen una alta densidad electronica debido a la presencia de polialginatos, hidroxilos y fucoidanos . La repulsion de polaridades negativas tendria un costo energetico muy alto para que la adsorcion se lleve a cabo. Finalmente, las fuerzas de dispersion, son interacciones muy debiles, presentes en todos los compuestos y elementos. La pequeña contribucion de las fuerzas de dispersion produciria una adsorcion casi despreciable o muy reducida. Sin embargo, los resultados muestran capacidades de adsorcion alrededor de 115 mg/g para el alga L13, que esta muy por encima de la adsorcion de iones Zn y Cu. Incluso para S12, que reporta una menor capacidad de adsorcion de Au, la adsorcion de AuCl es comparable con la adsorcion de Zn (II). Si bien, se necesitan mas estudios al respecto, podriamos sugerir un intercambio de ligandos para Au (III). Es decir, el ion aurico esta unido a 4 ligandos cloruro o hidroxilo, pero en contacto con los pares de electrones libres de los adsorbentes, un ligando cloruro es substituido por un centro de adsorcion, que pasaria a ser un nuevo ligando. Este tentativo mecanismo de adsorcion, estaria de acuerdo con la capacidad de adsorcion, ya que este nuevo complejo seria poco estable debido al impedimento esterico generado por el nuevo ligando provenientes de los adsorbentes y los tres ligandos cloruros o hidroxilo que rodean al ion aurico. Dado que el mecanismo seria un simple intercambio de ligandos, la carga de la superficie del adsorbente pasa a segundo plano y el efecto del pH residiria especialmente en la formacion de iones complejos deAu(III).
iii) La quimica acuosa del ion metalico es el rol mas importante que desempeña el pH en la adsorcion de iones metalicos . Los metales de transicion, entre los cuales se encuentran la mayoria de los metales pesados, se caracterizan por su habilidad en la formacion de complejos de coordinacion con ligandos que poseen pares de electrones libres, en busca de la estabilizacion de sus orbitales vacantes o parcialmente llenos. La molecula de agua es un excelente ligando y la formacion de aquo-complejos es inevitable. A mayor numero de ligandos rodeando un cation metalico, mayor sera su radio ionico y su volumen, convirtiendolo al cation en una especie estericamente impedida para una eficiente interaccion con la superficie del adsorbente. La formacion de complejos con el agua es regulada por el pH, ya que a altos valores de pH, la concentracion de iones oxhidrilo aumenta en la solucion y es capaz de formar hidroxo-complejos, los cuales no solo aumentan el volumen del cation sino que disminuyen su carga neta, disminuyendo tambien su afinidad con el adsorbente.
Mediante estudios de especiacion quimica en soluciones acuosas, ha sido demostrado que el ion Pb (II) se mantiene en su forma Pb (II) como especie predominante hasta pH 4, pH al cual la especie Pb(OH) aparece como nueva especie emergente. Los iones Cd (II) y Zn (II) tienen un comportamiento muy similar teniendo a las especies Cd (II) y Zn (II) como iones predominantes por debajo de pH 5,5 y presentado a los iones Cd(OH) y Zn(OH) como iones emergentes a valores de pH mas altos. El ion Cu (II) tienen una quimica acuosa un poco mas complicada , pero la especie predominante en todo el rango de pH es Cu(II); otras especies que se pueden encontrar son Cu(OH) en muy bajas concentraciones. Todos estos valores de pH concuerdan perfectamente con el pH optimo para los iones metalicos estudiados; por ejemplo para Pb (II) y Zn (II) la maxima capacidad de adsorcion se observo alrededor de 4 -5 para ambas algas, mientras que para Cd (II) fue de alrededor de 5 para ambas algas L13 y S12. En el caso de cobre, ya que la especiacion quimica no es el factor mas importante, la adsorcion dependeria basicamente del adsorbente; por lo tanto mientras mas negativo se encuentre el adsorbente, mayor sera la adsorcion de ion cobre II. Dado que a pH mayores de 3,0, la superficie del adsorbente esta negativamente cargado , es de esperarse que valores de pH altos, produciran una mayor adsorcion para el ion Cu (II).
CONCLUSIONES
El material propuesto es una excelente herramienta, util para el entendimiento del efecto del pH en el proceso de adsorcion de metales toxicos y preciosos y promueve el uso coherente de biopolimeros naturales presentes en biomasa de desecho para la adsorcion selectiva de los mismos. La evaluacion del efecto del pH con respecto al adsorbato, por medio de distintos iones metalicos elucida la gran complejidad de la quimica acuosa de los iones metalicos, cuya especie quimica predominante depende fuertemente de la acidez del medio, sin dejar de lado la importancia de la acidez del cation, necesaria para competir con otros iones por los sitios activos en la superficie del adsorbente.
De los resultados experimentales se concluye la preferencia de los biosorbentes por el ion plomo divalente sobre los demas iones (cationes y aniones) a iguales condiciones experimentales, siendo la acidez de Lewis del ion plomo (II) la responsable de esta diferencia.
La afinidad de las algas estudiadas sigue la tendencia: Pb>Cd>Zn Cu. Asimismo, las algas marinas poseen una alta afinidad hacia metales pesados gracias a la alta concentracion de grupos carboxilo de polialginatos, los cuales se cargan negativamente a pHmayores de 3,0. Finalmente, queda demostrado que la adsorcion de cationes divalentes como Pb, Zn, Cd y Cu se da principalmente por via electrostatica (intercambio ionico), mientras que para la adsorcion deAu se propone un mecanismo peculiar que involucra un intercambio de ligandos.
Esto confirma la lenta cinetica en la formacion de iones complejos condicionada por el pH.
AGRADECIMIENTOS
Los autores expresamos nuestra sincera gratitud al Fondo Concursable de Apoyo a la Investigacion de la UPCH y al Departamento Académico de Quimica por el apoyo brindado para la realizacion de esta investigacion. Tambien hacemos extensivo nuestro agradecimiento a las señoritas Ivonne Chion y Angela Manrique por su colaboracion en el proyecto.
BIBLIOGRAFÍA
1. Horsfall M.,AbiaA., Water Res ., 2003; 37, 4913-4923
2. Guibal E., Roulph C., Le Cloriec P., Environ. Sci. Technol., 1995; 29, 2496-2503
3. Cotton F.,Wilkinson G., QuimicaAnaliticaAvanzada. Mexico: Ed. Limusa; 1976.
4. http://es.wikipedia.org/wiki/Metal_pesado
5. Baran EJ., Quimica Bioinorganica. Madrid: Ed. McGraw-Hill; 1995
6. Jain C., Singhal D., Sharma M., J. Hazard. Mater., . 2004; B114, 231-239
7. Volesky B., Biosorption and Biosorbents. Florida:CRCPress; 1990
8. Bishop P., Pollution prevention: fundamentals and practice. Beijing:Tsinghua University
Press; 2002.
9. VoleskyB Hydrometallurgy, .2001; 59, 203-219
10. Schiewer S.,VoleskyB Environ. Sci. Technol., .1997; 31, 1863-1871
11. Mohapatra H., GuptaR Bioresour. Technol., .2005; 96, 1387-1398
12. Pagnanelli F., EspositoA.,Toro L.,Veglio F ,Water Res.,2003; 37, 627-633.
13. Sheng P.,TingY., Chen J., Hong L., J Colloid Interface Sci., .2004; 275, 131-141
14. SuzukiY., KametaniT., MaruyamaT ., Water Res .2005; 39, 1803-1808
15. Chojnacka K., ChojnackiA., Gorecka H. Chemosphere,, 2005; 59, 75-84.
16. NavarroA., Portales R., Sun-Kou R., Llanos B., J. Hazard. Mater.,2008; 156, 405-411
17. http://www.revistas.unal.edu.co/index.php/rcolquim/article/view/825
18. TheWorld Health Organization Cadmium, Environmental Aspects. Finlandia: WHO, 1992.
19. Campos K. Seleccion del mejor biosorbente para la Biosorcion de ion Zinc (II): Modelamiento y Cinetica, Tesis para optar el titulo de Licenciado en Quimica, UPCH, Peru, 2004.
20. http://www.cec.uchile.cl/~cabierta/revista/15/articulos/pdf/paper4.pdf .
Recibido el 09-10-2009













