Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.76 no.2 Lima Apr./jun. 2010
TRABAJOS ORIGINALES
Adsorción de plomo de efluentes industriales usando carbones activados con H3PO4
Adsorption of lead from industrial wastewater using activated carbons with H3PO4
Carmencita Lavado Mezaa* , Maria del Rosario Sun Koua, Salvador Bendezub
a Dpto. de Ciencias - Sección Química, Pontificia Universidad Católica del Perú. Av. Universitaria 1801-San Miguel – Lima 32, e-mail: carmencita.lavado@pucp.edu.pe
b Facultad de Ingeniería Química, Universidad Nacional del Centro del Perú, Av. Mariscal Castilla km 5, El Tambo, Huancayo.
RESUMEN
Se prepararon carbones activados a partir de astillas de eucalipto ( Labill), mediante activacion quimica usando como agente activante al acido fosforico. Se estudio la influencia de los siguientes parametros de activacion sobre la adsorcion de plomo: razon de impregnacion (agente activante(g)/precursor(g)) y temperatura de activacion. Los materiales obtenidos se caracterizaron mediante adsorcion de N2 a -196 °C, SEM y FTIR. Se estudiaron los parametros que afectan el proceso de adsorcion de plomo: tiempo de contacto, razon masa de carbon/volumen de la solucion, temperatura y pH, lograndose obtener capacidades de adsorcion de hasta 142,1 mg Pb/g. Se logro remover el 99,9% del plomo contenido en un efluente industrial.
Palabras Clave: adsorcion, carbon activado, activacion quimica con H3PO4 , plomo, tratamiento de aguas.
ABSTRACT
Activated carbons were prepared from chips of Labill, as by chemical activation using phosphoric acid activating agent. The influence of activation parameters was studied on the adsorption of lead: impregnation ratio (activating agent (g)/precursor (g)) and activation temperature. The materials obtained were characterized by N2 adsorption at -196 °C, SEM and FTIR. The parameters affecting the adsorption process of lead was studied: contact time, ratio mass carbon/volume of solution, temperature and pH, obtained adsorption capacities of up to 142,1mgPb / g.Achieved 99,9% removal of lead on industrial effluent.
key words: adsorption, activated carbon, chemical activation with H3PO4 , lead, water treatment.
INTRODUCCION
Estudios realizados han mostrado que el incremento en los niveles de contaminacion del agua, debido a la presencia de metales pesados provenientes de efluentes industriales, pone en riesgo la salud humana1 . Los metales pesados como el plomo, cadmio y mercurio estan considerados como uno de los grupos mas peligrosos debido a que no son biodegradables, su alta toxicidad a bajas concentraciones y su capacidad de bioacumularse en los organismos que los ingieren. La contaminacion del agua por plomo se debe a los efluentes industriales no tratados, generados por las fabricas de tetraetilo de plomo, pinturas, baterias, municiones, ceramicas de vidrio, mineria, entre otros. El plomo es un metal pesado toxico y, debido al dano que puede producir su ingesta, la Agencia de Proteccion Ambiental (EPA) lo ha clasificado entre las 20 sustancias quimicas mas peligrosas para la salud humana; asimismo, establecio el limite maximo permisible de plomo en agua potable de 0,001 ppm.
Los metodos de mayor aplicacion en el tratamiento de efluentes que contienen metales pesados son los siguientes: precipitacion, intercambio ionico, osmosis inversa y adsorcion. Comparando dichos tratamientos, la adsorcion presenta la ventaja de poseer las siguientes caracteristicas: facil operacion, retencion del metal en presencia de otros cationes y la posibilidad de recuperar los metales pesados .
El proceso de adsorcion se realiza con diversos materiales, generalmente microporosos, como las arcillas pilareadas, aluminas y carbones activados. Los carbones activados pueden obtenerse utilizando como materia prima a materiales ricos en carbono, basicamente provenientes de fuentes renovables como los materiales lignocelulosicos y desechos agricolas . Generalmente, se busca materiales economicos y disponibles en la region, con la finalidad de reducir los costos de produccion, requisito que las astillas de eucalipto cumplen. Para la activacion del material se usan dos metodos: activacion quimica y activacion fisica. La activacion quimica consiste en poner en contacto la materia prima con un agente impregnante, tal como: KOH, H3PO4 , Cl2Zn, NaOH, etc., el cual actua como agente deshidratante. Los carbones activados quimicamente, en comparacion con los activados fisicamente, presentan la ventaja de tener mayores rendimientos, asi como un buen desarrollo de la porosidad a temperaturas relativamente bajas . Las propiedades adsorbentes del carbon activado son atribuidas a su alta area superficial, porosidad (micro y mesoporos) y grupos superficiales ; sin embargo estas propiedades varian de acuerdo al material de partida, asi como el metodo de activacion usado. En la actualidad, el carbon activado es muy utilizado en el tratamiento del agua potable y aguas residuales, removiendo sustancias organicas como fenoles , pesticidas, aminas o nitratos de los compuestos que causan olores y sabores no deseados y metales pesados . El presente estudio tuvo por objetivos dar a conocer la preparacion de carbones activados con H3PO4 , utilizando como material de partida las astillas de eucalipto, que es un desecho abundante en el valle del Mantaro, departamento de Junin (Peru), por lo que su empleo como materia prima en la preparacion de carbones activados se constituye como un material de bajo costo y le otorga un mayor valor agregado, asi como los ensayos de adsorcion de Pb(II) presente en soluciones acuosas estandar y su aplicacion en el tratamiento de un efluente industrial.
PARTE EXPERIMENTAL
Preparacion del material absorbente
La materia prima (astillas de eucalipto) fue secada e impregnada por via humeda con una solucion de H3PO4 , usando una razon de impregnacion [masa de agente activante (g)/masa de precursor (g)] igual a 0,5; 1,0; 1,5; 3,0 seguido de un proceso de carbonizacion, que se realizo en un reactor de lecho fijo, a temperaturas de: 400, 500, 600 y 700 °C, durante una hora, con flujo continuo de N2 de 100cm3 /min. Finalmente, los carbones obtenidos fueron lavados con abundante agua destilada y secados en una estufa por 24 horas a 80 °C. Para la identificacion de los carbones activos obtenidos se utilizo la siguiente nomenclatura: PX,X/YYY, donde: P se refiere al agente activante usado (H3PO4),X,X la razon agente activante/precursor, YYY la temperatura de activacion.
Caracterizacion de los materiales
El area superficial y la distribucion de poros de los carbones activados se obtuvieron por adsorcion de N2 a -196 °C, en un equipo de adsorcion modelo Micromeritics GIQ-UPV. Para la determinacion del area superficial y volumen de microporos se utilizaron las ecuaciones de Brunauer-Emmett-Teller (BET) y de Dubinin-Radushkevich (D-R). El estudio de los grupos funcionales presentes en la materia prima y carbones activados se realizo por espectroscopia infrarroja con transformadas de Fourier (FTIR). El equipo instrumental utilizado fue un espectrofotometro Perkin Elmer FTIR- 1600. Para ello se prepararon pastillas de carbon activado mezclado con KBr; las muestras fueron analizadas en un rango espectral de 4000 - 400 cm-1 . El analisis morfologico de la materia prima y de los carbones activados se llevo a cabo por Microscopia Electronica de Barrido en un equipo ASPEXLLC.
Adsorción de plomo:
Todos los ensayos de adsorcion de plomo fueron realizados en un sistema batch, en cada caso se utilizo 50 mg del adsorbente y se pusieron en contacto por 3 horas con 50 mL de una solucion de Pb(II) a diferentes concentraciones iniciales, en un agitador multiple a una velocidad de 500 rpm, a temperatura ambiente y pH inicial igual a 5. Finalizada la etapa de adsorcion, las fases fueron separadas por filtracion y se evaluo la concentracion de plomo en las soluciones remanentes por adsorcion atomica en un equipo Perkin Elmer AAS 3100. Para la elaboracion de las isotermas de adsorcion las concentraciones iniciales se variaron en el rango de 50 a 500 mg/L. El estudio de la influencia del pH se realizo variando el pH de la solucion inicial en un rango de 2-9 utilizando soluciones de HNO3 0,1 M y NaOH 0,1 M.
Para determinar la capacidad de adsorcion (qe ) de los carbones activos se utilizo la siguiente ecuacion:

Donde, qe es la capacidad de adsorcion en el equilibrio (mg Pb/g carbon activado), C es la concentracion inicial (mg/L) en una solucion de volumen (L), Ce es la concentracion en el equilibrio (mg/L) luego de la adsorcion yMes la masa del adsorbente (g).
Cinética de adsorción
El estudio de la cinetica de adsorcion se realizo con los parametros de adsorcion optimos obtenidos a diferentes concentraciones iniciales, con una relacion de masa de carbon/volumen de solucion de 50mg/50mL. Durante el proceso de adsorcion a diferentes intervalos de tiempo se separaron pequenas alicuotas a las cuales despues se determino el contenido de plomo.
Muestreo del efluente industrial
Se tomaron muestras de aguas residuales provenientes de una fabrica dedicada a la produccion de sulfato tribasico de plomo (3PbOPbSO4 H2O), compuesto utilizado en la industria plastica como estabilizante.
RESULTADOS Y DISCUSIÓN
Caracterización de los carbones activados:
Análisis textural de los carbones activados. Para la determinacion del area superficial y la distribucion de poros de las muestras se evaluaron las isotermas de adsorcion - desorcion en el sistema solido - gas, donde en este caso el adsorbato es el N2 medido a -196 °C y el adsorbente son las muestras de carbones activados conH3PO4 con una razon de impregnacion igual a 1,0 y activadas a diferentes temperaturas en el rango de 400 hasta 600 C. Para la determinacion de las isotermas se graficaron el volumen deN adsorbido (cm3/g) en condiciones estandar (STP) en funcion de la presion relativa (P/Po ) (figura 1)
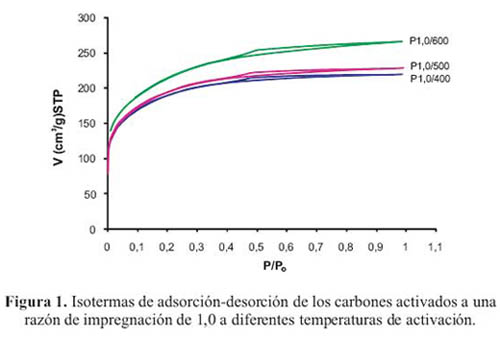
Se puede observar que las formas de las isotermas de los carbones activados son muy similares y presentan caracteristicas asociadas a la isoterma del tipo IV, de acuerdo a la clasificacion de IUPAC, lo que indica una estructura micro y mesoporosa. Como puede apreciarse, la adsorcion de N2 se incrementa inicialmente debido al llenado de los microporos (P/Po = 0); posteriormente la pendiente de la isoterma se incrementa paulatinamente con el aumento de las presiones relativas, lo que se asocia a la adsorcion en multicapas debido al llenado de los mesoporos. Los resultados del analisis de las isotermas de adsorcion de N2 , con las ecuaciones BET y DR se resumen en la tabla 1.
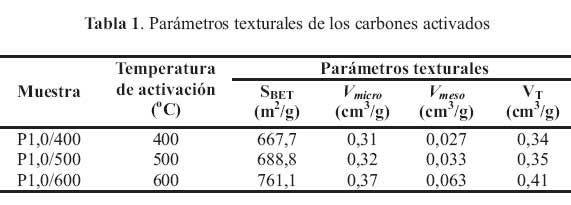
Se puede observar que la temperatura de activacion tiene mas influencia en el desarrollo de los mesoporos que en la de los microporos; se nota tambien que a una temperatura de activacion mayor a 500 °C, la influencia es mayor en el desarrollo de los mesoporos. El area superficial especifica tambien se incrementa con el aumento de la temperatura de carbonizacion, obteniendose una mayor area superficial a 600 °C de 761,1m2 /g.
Análisis morfológico. Las figura 2A y figura 2B muestran las micrografias realizadas a la materia prima y al carbon activado con H3PO4 respectivamente.
Se aprecia una clara diferencia morfologica entre la materia prima y el carbon activado, lo que hace evidente la accion del agente activante y la temperatura de activacion sobre la estructura de la materia prima. Esta ultima presenta una morfologia caracteristica con fibras alargadas, en tanto que la muestra activada presenta una morfologia porosa conformada por agregados ubicados en forma desordenada con generacion de poros heterogeneos entre ellos, lo cual fue confirmada por su alta area superficial que fue determinada por adsorcion de N2.
Identificación de los grupos funcionales por FTIR. Los grupos funcionales presentes en la superficie de los carbones activados desempenan un rol importante en la adsorcion de contaminantes organicos e inorganicos. Ellos le confieren al carbon propiedades hidrofilicas porque incrementan la interaccion especifica ion-dipolo y dipolo-dipolo . En la figura 3 se muestra los espectros FTIR del precursor (astillas de eucalipto) y del carbon activado P1,0/600.
Asi, en el espectro FTIR del precursor se reconocen los principales grupos funcionales presentes: la banda ancha a 3414,16 cm-1 es atribuida a grupos hidroxilicos (O-H), los picos intensos a 2933,39 y 1244,20 cm-1 son debidos a la vibracion de tension y flexion en el plano de los grupos –CH2 - y C-O en esteres (=C-O-C); estos grupos son caracteristicos en la celulosa . La flexion en el plano a 1461,34 cm-1 y la flexion simetrica a 1374 cm-1 indican la presencia de grupos C-H y CH3 respectivamente. Tambien se localizaron bandas atribuidas a las vibraciones de tension a 1595,87; 1504,94 y 1425,21 cm-1 propias de C=C. La senal a 1735,28 cm-1 se atribuye a la presencia deC=Oen aldehidos y lactonas. La senal a 1051,26 cm le corresponde con C-O en fenoles (C-OH, primarios), la senal a 1118,27 cm-1 es debida al CO en fenoles (C-OH secundarios), y a 1159,43 cm-1 le corresponde con C-O-C, estos grupos funcionales identificados en la materia prima son susceptibles a reaccion con acidos y bases.
Luego de la activacion se puede observar que muchas bandas caracteristicas desaparecen manteniendose las senales de los grupos hidroxilicos (3428,97 cm-1 ), C=C (1632,48 y 1456,54 cm-1) y C-O en R-OH primarios (1051 cm-1) y -CH (2917,64 cm-1) aunque en menor intensidad con respecto a la materia prima. Se observa, ademas, una banda en 1130 cm-1, segun Puizy et al. , esta corresponderia a la presencia de especies fosforadas provenientes del agente impregnante. De acuerdo a los resultados del estudio de FTIR se puede establecer que el H3PO4 induce a cambios quimicos importantes en la estructura del precursor (astillas de eucalipto) durante la descomposicion pirolitica, promoviendo la deshidratacion y redistribucion de los constituyentes de la madera: lignina, celulosa y hemicelulosa, favoreciendo la conversion de los compuestos alifaticos a aromaticos, obteniendose carbones activados de caracter principalmente poliaromatico, donde el grupo funcional principal es el OH.
Efecto de la razón de impregnación y de la temperatura de activación en la remoción de Pb(II)
En las figura 4A y figura 4B se muestran las isotermas que representan las capacidades de adsorcion de Pb(II) (q ) expresado en mg de plomo retenido por gramo de carbon activado, variando: la razon de impregnacion (A) y la temperatura de activacion (B); los otros parametros (pH y temperatura) se mantuvieron constantes.
En ambas figuras se puede observar que el valor de q muestra un comportamiento ascendente muy rapido hasta lograr condiciones estacionarias a partir de Ce = 100mg/L. Con respecto a la variacion de la razon de impregnacion, los valores de las isotermas se incrementaron cuando la razon de impregnacion vario de 0,5 a 1,0; aparentemente no existe mucha diferencia en los valores de qe a razones de impregnacion de 1,0 y 1,5, pero cuando la razon de impregnacion se incremento a 3,0 los valores de q disminuyeron, manteniendo la misma tendencia.
Considerando el efecto de la temperatura de calcinacion, se aprecia que a medida que se incremento la temperatura de 400 a 600 °C, la capacidad de adsorcion (qe) aumento. Sin embargo, a la temperatura de 700 °C, el proceso se revirtio, disminuyendo la capacidad de adsorcion en forma proporcional (la tendencia de la curva no cambia), por lo que se puede decir que este efecto se produce debido a los cambios en la porosidad, posiblemente por la reduccion o contraccion de los poros por el efecto termico, lo que afectaria la difusion en el proceso de adsorcion del plomo. Del analisis de las isotermas mostradas en todas las figura 4A y figura 4B, se concluyo que el carbon que proporciona una mayor capacidad de adsorcion fue la muestra P1,0/600 exhibiendo un valor de qe = 142,1mgPb/g de carbon activado.
Correlación de los datos experimentales con los modelos de isotermas de adsorción
Los modelos de Langmuir y Freundlich son los mas usados para describir la relacion entre la cantidad de adsorbato retenido y su concentracion en el equilibrio en los sistemas de adsorcion solido-liquido. En el modelo de Langmuir se asume que la adsorcion ocurre uniformemente en los sitios activados de la superficie del adsorbente, con la formacion de una monocapa en donde el calor de adsorcion es constante para todos los sitios y que no existe interaccion entre las moleculas adsorbidas . La representacion lineal del modelo de Langmuir es expresada del siguiente modo:
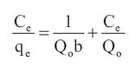
Donde, C es la concentracion en el equilibrio (mg/L), qe la capacidad de adsorcion en el equilibrio (mg Pb/g),Qo maxima cantidad de metal que puede ser adsorbido en la monocapa, b constante relacionada a la energia de adsorcion (L/mg). Los valores de Qo y b se hallaron luego de graficar Ce /qe versus Ce . En el modelo de la isoterma de Freundlich se hace uso de una ecuacion empirica, considerando que las energias de adsorcion son heterogeneas y varian de acuerdo a la superficie cubierta. La forma lineal del modelo de Freundlich es la siguiente:
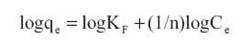
Las constantes Kf y n representan a los factores que afectan la capacidad de adsorcion e intensidad de adsorcion, respectivamente, y son indicativos de la retencion favorable del metal sobre la superficie del adsorbente. Estos valores se hallaron luego de graficar log qe vs log Ce . En la tabla 2, se resume las constantes y coeficientes de correlacion de los modelos de Langmuir y Freundlich hallados de las ecuaciones linealizadas de las isotermas de la figura 4.

Se observa que los datos experimentales de la isoterma se ajustaron mas al modelo de Langmuir (R = 0,9986), lo que indico que la adsorcion se lleva a cabo en monocapa, sin interacciones laterales entre las moleculas del adsorbato y el calor de adsorcion es constante en toda la superficie del carbon activado. Adicionalmente, se aprecia que el carbon P1,0/600 presenta un alto valor de Qo (124,86 mg/g) en comparacion con los reportados por Goel . et al (34,72 mg/g), Issabayeva et al . (95,2mg/g) y Lavado et al. (78,74 mg/g).
Efecto del pH
La figura 5 muestra la influencia del pH inicial de la solucion sobre la remocion de plomo, en el carbon activado P1,0/600, a diferentes concentraciones iniciales. Como se puede observar la cantidad adsorbida de plomo, qe , se incremento con el aumento de los valores del pH, y este valor fue mayor cuanto mas alta fue la concentracion de Pb, obteniendose maximas adsorciones en un rango de pH entre 4 y 5, para pH mayores a 5 la adsorcion decrecio suavemente, manteniendose la misma tendencia para todas las concentraciones de plomo. A partir de un pH de 5,7 el plomo empezo a precipitar como Pb(OH)2 por lo que, sobre este valor de pH se estaria frente a dos fenomenos: precipitacion y adsorcion.

Para entender el mecanismo de adsorcion de los iones metalicos sobre la superficie del carbon se grafico la variacion del pH final (pHf) luego de la adsorcion versus pH inicial (pHi) con diferentes concentraciones iniciales de plomo (300 y 500 mg/L). Para fines de comparacion tambien se realizo una prueba en blanco. Los resultados de esta evaluacion se observan en la figura 6.
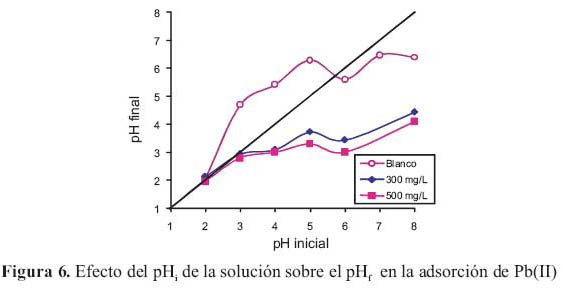
El analisis de la curva de la muestra en blanco en un rango de pH entre 2-5 indica que el pHf > pHi. Esto se deberia a que en este rango de pHi, la reaccion entre el agua y la superficie del carbon produce la liberacion de iones OH incrementandose de esta manera el valor del pHf . La liberacion de OH produciria la protonacion de la superficie del carbon, quedando la superficie cargada positivamente. En las curvas a concentraciones iniciales de Pb de 300 y 500 mg/L se observa que a pHi mayor a 5 el pHf < pHi lo que implica que en la interfase agua - superficie carbon activado, se produciria la liberacion de iones H+ , disminuyendo el valor del pHf con respecto al pHi, y por lo tanto se produce la desprotonacion de la superficie del carbon, quedando esta cargada negativamente.
Los iones Pb(II) en solucion acuosa se encuentran solvatados e hidrolizados a pH>5 donde la especie dominante es Pb(OH)2 y a pH<5,0 las especies existentes son: Pb2+ y PbOH+2 . La influencia del pH en la adsorcion del plomo sobre los carbones activados se podria explicar en base a la interaccion electrostatica, a bajos valores de pH (< 3) la superficie del adsorbente se encuentra protonada de manera que las especies: Pb2+ , PbOH+ producirian una repulsion electrostatica. Adicionalmente, existiria un efecto competitivo por los sitios de adsorcion entre los iones Pb2+ y los protones H+ presentes en la solucion, lo que se reflejaria en el bajo valor de qe .Al incrementarse el pH (> 3), los sitios cargados negativamente en la superficie del carbon van incrementandose, favoreciendo la atraccion electrostatica de las especies de plomo existentes aumentando el valor de qe . Adicionalmente, es posible la existencia de un intercambio ionico entre las especies Pb2+ y PbOH+ y los ionesH de la superficie del carbon lo que se explica mediante las siguientes reacciones:
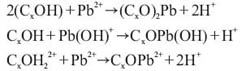
Donde: Cx representa la superficie del carbon.
Este mecanismo de intercambio ionico propuesto se puede confirmar en la figura 6 donde se observa que los valores del pHf con respecto a la muestra en blanco, decrecen, lo que evidencia la mayor liberacion de los protones H+ produciendo el decrecimiento del pHf.
Efecto de la temperatura
La dependencia de la adsorcion de la temperatura esta asociada con varios parametros termodinamicos. Este estudio se llevo a cabo a 20, 25, 35 y 45 °C, manteniendo constantes los demas parametros de adsorcion. La energia estandar de Gibbs fue evaluada por:
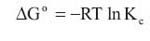
La constante de equilibrio (Ke) fue evaluada para cada temperatura, siguiendo la siguiente relacion:
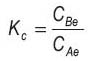
Donde, CBe es la concentracion en el equilibrio en el adsorbente; CAe la concentracion en el equilibrio en la solucion. La entalpia de adsorcion (ΔH°) y entropia (ΔS°) estandar fueron determinadas de la ecuacion de Van`t Hoff2 :
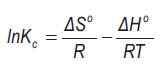
ΔH° y ΔS° fueron obtenidos del intercepto y pendiente de la grafica de Ln Ke versus 1/T. Los valores termodinamicos calculados se resumen en la tabla 3.

Los valores negativos de ΔG° indicaron que el proceso es termodinamicamente factible y espontaneo. El valor positivo de ΔH° refleja que la interaccion entre adsorbato-adsorbente es endotermico y el valor ΔS° , indica que hay un incremento de la aleatoriedad en la interfase solido-liquido.
Cinética de adsorción
En el proceso de adsorcion, los parametros cineticos son utiles para predecir el grado de adsorcion y proporciona importante informacion para el diseno y modelamiento del proceso.
La figura 7 muestra la influencia de la concentracion de la solucion y el tiempo de contacto en la adsorcion de plomo sobre el carbon activado P1,0/600.
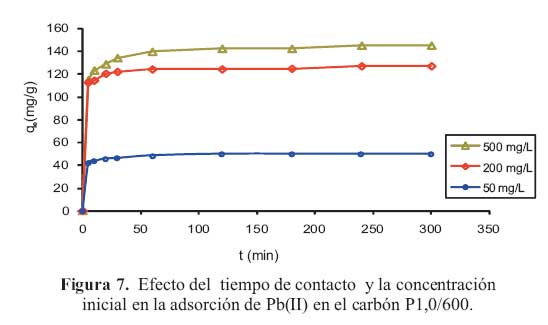
Se observo que el proceso de adsorcion es muy rapido en los primeros 6 min. La capacidad de adsorcion (qt) a un tiempo t, se estabiliza y se mantiene constante despues de 50 min. Estos valores de q se incrementan a medida que la concentracion de la solucion de plomo es mayor.
Los datos experimentales obtenidos de qt y el tiempo de contacto fueron correlacionados en base a dos modelos diferentes: el modelo de Lagergren, o modelo de seudo primer orden y el modelo de seudo segundo orden, detallados a continuacion:
Ecuacion de Lagergren o modelo de seudo primer orden:

Ecuacion de seudo segundo orden:
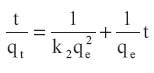
Donde k1 (min-1 ) y k2 (g/mg min) son las constantes de velocidad de seudo primer y segundo orden, respectivamente, qe y qt son las capacidades de adsorcion (mg/g) en el equilibrio y a un tiempo t, respectivamente. Las constantes k1 (min-1 ) y k2 (g mg min-1 ) fueron halladas de los interceptos de las ecuaciones linealizadas de los graficos de log(qe -qt) versus log qe y t/qt versus t, respectivamente. Los valores de k se utilizan para calcular la velocidad inicial (h) determinada por:
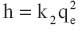
Los valores de las constantes de velocidad de los modelos cineticos a diferentes concentraciones se presentan en la tabla 4.
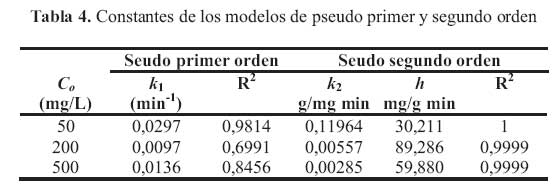
Al analizar los valores de R2 se puede concluir que el modelo que mejor se ajusta a los datos experimentales es el de seudo segundo orden, lo que demuestra que este modelo puede ser aplicado para todo el proceso de adsorcion y establece que el plomo se quimisorbe sobre la superficie del carbon P1,0/600 . Estos resultados concuerdan con otros trabajos realizados por Anoop et al y Sekar . et al . Ellos adsorbieron plomo sobre carbones activados donde los datos experimentales se correlacionaron mejor con el modelo de seudo segundo orden. Asimismo, para una concentracion de plomo de 500 mg/L, al comparar las velocidades iniciales en el proceso de adsorcion de plomo (h) sobre el carbon preparado en el presente estudio con el mismo carbon activado con KOH (h = 40,32mg Pb/g carbon activado.min) , resulto que el carbon activado P1,0/600 presento valores mayores de h (59,88 mg/g min).
Tratamiento del efluente:
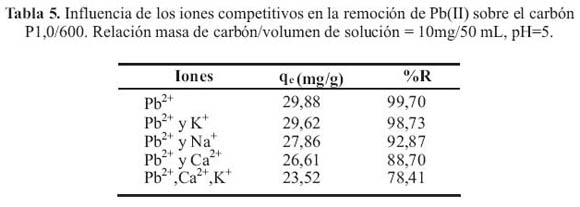
El analisis quimico que se realizo a un efluente industrial mostro que ademas de contener Pb2+ (6 mg/L), tambien contenia los siguientes iones en forma mayoritaria: Ca2+ (131mg/L), K+ (45,51 mg/L), Na+ (44,85 mg/L) los cuales podrian ejercer un efecto selectivo o competitivo que podria influir en la adsorcion de plomo. Por lo que se realizaron pruebas de adsorcion en forma separada con soluciones estandar que contenian plomo y uno de los iones competitivos, en concentraciones similares a las presentes en el efluente industrial, para finalmente realizar ensayos de adsorcion con una solucion que contenia plomo y los tres iones competitivos. En la tabla 5 se muestra los resultados de estas pruebas.
Se puede observar que el ion que ejerce mayor influencia en el proceso de adsorcion de plomo es el Ca2+. Esto podria deberse a que el ion Ca2+ al poseer la misma carga que el Pb2+ , y al estar en mayor concentracion, estaria compitiendo en mayor proporcion con el plomo, sobre todo en el proceso de intercambio ionico en la superficie del carbon activado. El efecto combinado de todos los iones se aprecia en el decrecimiento del porcentaje de remocion de 99,7% hasta 78,41%.
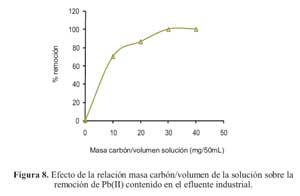
Para evaluar la capacidad de adsorcion de Pb(II) presente en el efluente, se pusieron en contacto diferentes cantidades del carbon con 50 mL del efluente industrial. La figura 8 muestra los resultados de estas pruebas
Se puede apreciar que con una cantidad minima (30 mg) se logro remover hasta 99,9% del plomo presente en el efluente industrial, aun a pesar de la presencia de otros cationes (Ca2+, Na+ ,K+ ,Mg2+ , Zn2+ ).
CONCLUSIONES
- Se logro obtener carbones activados con buenas capacidades adsorbentes de Pb(II), a partir de astillas de eucalipto ( Labill) mediante activacion quimica con H3PO4.
- Las condiciones de preparacion empleadas en la activacion ejercen una marcada influencia sobre la capacidad de adsorcion de Pb(II); dichas condiciones fueron: razon agente activante/precursor = 1,0 y temperatura de activacion = 600 °C (P1,0/600). La maxima cantidad de plomo adsorbido por gramo de carbon fue de 142,1 mg/g. Los resultados obtenidos indicaron que con un control de los parametros de activacion se puede lograr obtener carbones activados con buenas propiedades adsorbentes.
- Los resultados de la caracterizacion indicaron que se obtuvo carbones activados con micro y mesoporosidad y con altas areas superficiales (hasta 761 m2/g). Se identifico la presencia de los grupos funcionales hidroxilos en la superficie del carbon activo (P1,0/600), que fueron los que favorecieron la adsorcion de Pb(II).
- Se obtuvieron maximas remociones a un pH igual a 5, el proceso de adsorcion se dio por interaccion electrostatica e intercambio ionico. El modelo cinetico que describe mejor el proceso de adsorcion fue el de pseudo segundo orden, lo que indica que se produce una quimisorcion del plomo sobre el carbon activado. En tanto que, los datos experimentales de las isotermas se ajustaron mejor al modelo propuesto por Langmuir, el cual representa una adsorcion en monocapa. El estudio termodinamico indico que el proceso de adsorcion de plomo es factible y espontaneo.
- Con la muestra P1,0/600 se logro adsorber un 99,9% de plomo contenido en efluente industrial lo que lo hace muy atractivo para su utilizacion en la remocion de plomo de efluentes industriales contaminados.
AGRADECIMIENTOS
Los autores agradecen la ayuda financiera proporcionada a traves del Concejo Nacional de Ciencia y Tecnologia (CONCYTEC), y el apoyo brindado por el Departamento de Ciencias - Seccion Quimica de la Pontificia Universidad Catolica del Peru, en la realizacion de este trabajo de investigacion. Asimismo, al Dr. Javier Herguido, Dra. Pilar Pina y Gemma Gomez de la Universidad de Zaragoza.
BIBLIOGRAFÍA
1. Sekar M., Sakthi V., Rengaraj S. Journal of Colloid and Interface Science 2004: 279; 307- 313.
2. Kalavathy M.H., Karthikeyan T., Rajgopal S., Miranda L.R. Journal of Colloid and Interfase Science 2005: 292; 354-362.
3. Sudaryanto Y., Hartono S.B., Irawaty W., Hindarso H., Ismadji S. Bioresource Technology 2006: 97; 734-739.
4. Macia Agullo J.A., Moore B.C., Cazorla Amoros D., Linares Solano A. Carbon 2004:42;1367-1370.
5. Carrot P.J.M., Ribeiro Carrott M.M.L., Mourao P.A.M. Journal of Analytical and Applied Pyrolysis 2006:75; 120-127.
6. Mohanty K., Jha M., Meikap B.C., Biswas M.N. Industrial Engineering Chemistry Research 2005:44; 4128-4138.
7. Kadiverlu K., Thamaraiselvi C., Namasivayam C. Bioresourse Technology 2001:76; 2001, 63-65.
8. Lavado C., Recuay N., Bendezu S., Garcia R., Munoz Y., Escalona N. Boletín de la Sociedad Química del Perú 2002: 3; 150-167.
9. Bendezu S., Oyague J, Romero A., Garcia. R, Munoz Y., Escalona N. Journal of the Chilean Chemical Society , 2005:4; 677-684.
10. Peralta J., Sun M., Bendezu S. Revista de la Sociedad Química del Perú 2008:74; 219-232.
11. Khezami L., Chetouani L, B.,Taouk B., Capart R. Powder Technology 2005: 157; 48-56.
12. YoussefA.M., El-Nabarawy Th., Samra S.E. Colloids and surface A: Physicochem. Eng. Aspects 2004:235;153-163.
13. PuziyA., Poddubnaya O., MartinezA., Suarez F,Tascon J. Carbon 2002: 40; 1493-1505.
14. Anoop K., Airuddhan T.S. Industrial Engineering Chemistry Research. 2002: 41; 5085- 5093.
15. Goel J., Kadirvelu K., Rajagopal C., Garg V.K. Industrial Engineering Chemistry Research.. 2005: 44; 1987-1994.
16. Issabayeva G., Kheireddine M., Nik M. Bioresource Technology 2006: 97; 2350 -2355.
17. Lavado C., Sun M., Bendezu S. RevistaVirtualpro 2009: 86, 21.
Recibido el 18-05-2010