Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.2 Lima abr./jun. 2010
ENSEÑANZA DE LA QUÍMICA
Caracterización de bases de Schiff derivadas de 2-aminofenol, usando RMN 1D y 2D
Caracterization of Shiff bases derivated from 2-Aminophenol, using RMN 1D and 2D
Sergio Zamorano*a , Juan Camusa , Andrea Orellanaa , Maribel Osorioa
a Facultad de Ciencias Naturales y Exactas, Universidad de Playa Ancha, Carvallo N°270, Playa Ancha, Valparaíso, Chile. szamoran@upla.cl
RESUMEN
En este trabajo se presenta el resultado de la sintesis de una base de Schiff a partir del 2- aminofenol con benzaldehido y se caracteriza el producto, usando el microanalisis, la espectroscopia infrarroja, la espectroscopia deRMNdeH yC y laRMNen dos dimensiones COSYy HMBC), para determinar su estructura.
Palabras clave: Bases de Schiff, espectroscopia RMN 1D y 2D
ABSTRACT
In this work the result of the synthesis of a base of Schiff is presented, starting from the 2- aminophenol with benzaldehyde and the product is characterized, using the microanalysis, the infrared espectroscopy, the espectroscopy of RMN of H1 and C13 and the RMN in two dimensions(COSYand HMBC), to determine its structure.
Key words: Shiff Bases, RMN 1D and 2D spectroscopy
INTRODUCCION
Las tecnicas mas importantes utilizadas para investigar la estructura de las moleculas actualmente son la RMN y la Difraccion de Rayos X, utilizando principalmente monocristales . La RMN se puede aplicar no solo para determinar la estructura de moleculas simples y complejas como las proteinas , sino tambien para verificar el grado de pureza de drogas y farmacos, control de calidad de productos quimicos, analisis de polimeros, etc. .
La utilizacion de la RMN bidimensional ha alcanzado ultimamente una gran importancia para investigar sistemas homonucleares y heteronucleares; los primeros permiten determinar cuales nucleos se encuentran acoplados entre si, lo que hace posible determinar el numero y tipo de protones que se encuentran a dos o tres enlaces de distancia .
Por ejemplo, el COSY nos indica la correlacion entre dos protones que se encuentran acoplados escalarmente entre ellos; como resultado de esta correlacion se obtiene un diagrama de contorno, donde las senales que se localizan fuera de la diagonal son las mas importantes, porque las coordenadas de ellas son los desplazamientos quimicos de los protones que se encuentran acoplados escalarmente a dos o tres enlaces de distancia. Otro experimentoRMN interesante es el NOESY, que muestra el llamado efecto nuclear Overhause entre dos protones; este efecto se observa cuando los nucleos se encuentran proximos (a menos de 5 Angstroms de distancia); en este caso se generan senales fuera de la diagonal cuya integral en tres dimensiones es proporcional a la distancia entre nucleos .
En cambio, los experimentos heteronucleares permiten correlacionar nucleos distintos; por ejemplo el H1 y el C13 . Entre estos experimentos el HMBC permite detectar al nucleo mas sensible y muestra la correlacion a dos o tres enlaces de distancia entre nucleos distintos, es decir, permite conocer las conectividades entre el H y C en un rango mas amplio (hasta tres enlaces de distancia) .
El objetivo de este trabajo es entregar las herramientas basicas de investigacion en el campo de la RMN bidimensional a estudiantes que se inician en el campo de la sintesis organica y especialmente con el objeto de preparar ligandos para sintesis de compuestos de coordinacion .
PARTE EXPERIMENTAL
Materiales y metodos
Sintesis de la 2-aminofenol con benzaldehido
En un vaso de precipitado de 100 ml se disolvieron 0,5 gramos de 2-aminofenol (Aldrich) en 20 ml de metanol absoluto; se agregaron 0,45 gramos de sulfato de magnesio (Fluka), para eliminar el agua producida en la reaccion y 0,465 gramos de benzaldehido (Merck). Se agito durante 1 hora; se dejo reposar 1 dia, bajo refrigeracion y luego se mantuvo en el congelador durante 2 semanas a -5.°C . Se obtuvo 430 mg de cristales de color cafe oscuro que pudieron ser separados de la solucion. El rendimiento de la reaccion fue de 47,6%.
RESULTADOS Y DISCUSION
Los resultados del analisis quimico elemental se obtuvieron usando un equipo Fison EA-1108 (CHNS-O): El%de carbono, teorico/experimental 79,2/79,0; el % de hidrogeno 5,6/6,5; y el % de nitrogeno 7,1/7,2%.
Las bandas mas importantes del espectro IR para la amina (2-aminofenol), son las senales del grupo amino: dos picos anchos correspondientes a la vibracion vN-H que se presenta entre 3304,6-3375,5 cm-1 ; tambien se observa la senal del anillo aromatico a los 742,5 cm-1 y una banda ancha a los 3051,8 cm-1 que corresponde a la vibracion del OH. El espectro IR para el benzaldehido presenta dos picos bastante agudos, pero debiles en el intervalo 2737,8-2819,8 cm-1 correspondientes a las senales C-H del aldehido; ademas, se observan una banda a los 1701,2 cm-1 correspondiente a la vibracion C=O; la absorcion aromatica para el vC-H, a los a 3063 cm-1 y la senal del anillo aromatico a los 745,9cm-1 . El espectro IR de la base de Schiff (BS-BZ) muestra una nueva banda a los 1625,1 cm que corresponde a la vibracion de , lo cual comprueba la formacion del enlace iminico .
El espectro de RMN H1 , de la amina presenta una senal a los 3,6 ppm correspondiente a la vibracion N-H; tambien se observa una senal a los 4,8 ppm correspondiente a la vibracion OH. Los protones del anillo aromatico C-H absorben a campo bajo en el intervalo 6,8-6,9 ppm. En el espectro de RMN H1 del benzaldehido se observa un singulete a campo muy bajo, a los 9,6 ppm, correspondiente a la vibracion C-H del aldehido. Las senales del anillo aromatico se encuentran en el intervalo de 7,5-7,8 ppm.
En el espectro RMN H1 de la base de Schiff (BS-BZ) a campo bajo ( 8,7 ppm) aparece un singulete caracteristico del proton iminico del -N=CH- correspondiente a la formacion de la base de Schiff. Se identificaron los 11 atomos de hidrogeno, (asignados como a-k, en la figura 2) que presenta la molecula y que aparecen en el intervalo de 6,8-7,3 ppm.
El espectro de RMN C13 , de la amina presenta a campo bajo la senal del carbono unido al grupo hidroxilo a los 145,8 ppm. En cambio, la senal del carbono unido al grupo amino aparece a los 137,8 ppm. Los carbonos aromaticos presentan los siguientes desplazamientos quimicos: del benzaldehido se observa a campo bajo el carbono del grupo aldehido que aparece a los 192 ppm. La senal del enlace C-C se observa ligeramente a campo bajo apareciendo a los 136,9 ppm. Los carbonos aromaticos presentan los siguientes desplazamientos quimicos : 129,8; 129,2; 134,2; 129,2; 129,8
En el espectro de RMN C13 , de la base de Schiff (Bs-Bz) se observa a campo bajo una senal a los 157,2 ppm, asignada al carbon iminico. La senal C-OH tiene un leve desplazamiento hasta 152,4 ppm. Los carbonos aromaticos presentan los siguientes desplazamientos : 115,1; 128,9; 120,4; 115,9; 128,9*(carbono 9 y 9'); 129,0** (carbono 10 y 10'); 131,7. Los carbonos cuaternarios C-C aparecen a los 135,9; C-N a los 135,6 yC-OHa los 152,4 ppm. En resumen, los espectrosRMNcorrespondientes a la base de Schiff (BS-BZ) de formula C13H11NO, permitieron asignar los nucleos de hidrogeno y carbono-13 y encontrar sus correlaciones en la estructura. El analisis del espectro de RMN H1 se inicio observando cada senal; se extrajo informacion basica como el corrimiento quimico de los p on de intensidades de los picos. En el espectro se identificaron los 11 hidrogenos que presenta el compuesto, en el intervalo 6,8-7,3 ppm, se observan las senales correspondientes a los hidrogenos de los anillos aromaticos y a campo bajo a los 8,7 ppm se observa una senal correspondiente al proton imino.
Los espectros RMN C13 y DEPT 135 permiten identificar los carbonos cuaternarios: 3 senales ubicadas en los desplazamientos quimicos = 152,4; 135,9 y 135,6 ppm. La senal de 157,2 ppm es caracteristica del carbono iminico -N=CH- reafirmando la formacion de la base de Schiff. Las otras 5 senales corresponden a carbonos aromaticos, que presentan los siguientes desplazamientos quimicos: 115,9; 120,1; 128,9;115,0; 131,7 ppm (figura 1).
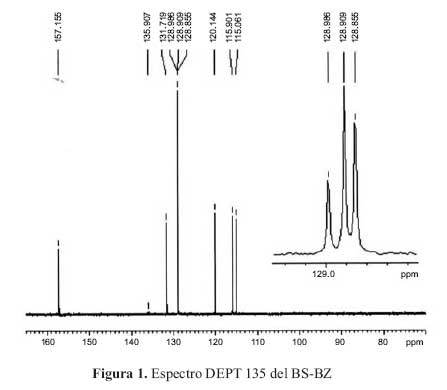
En el modelo bidimimensional propuesto (figura 2) los carbonos se marcaron en forma correlativa del 1 al 11
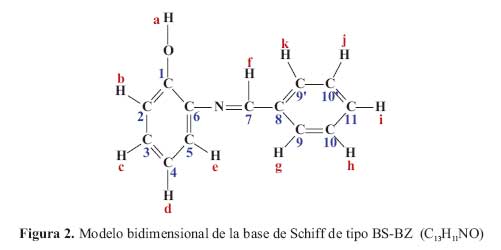
Para verificar el modelo estructural propuesto se utilizaron los espectros bidimensionales COSYHH (figura 3) yHMBC(figura 4).
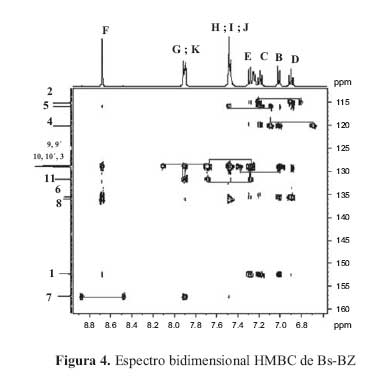
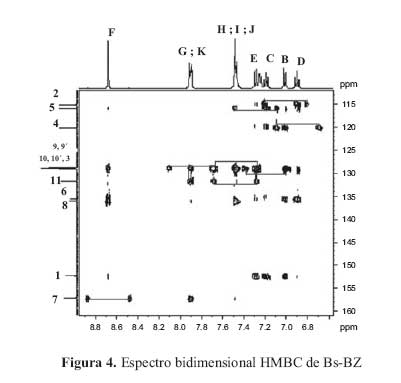
El espectro bidimensional COSY HH del BS-BZ muestra las 11 senales correspondientes a los 11 protones de la molecula, a lo largo de la diagonal. Los picos de interseccion permiten observar cuales protones estan acoplados; estos picos aparecen en posiciones simetricas respecto de la diagonal y son 10 en total, correspondientes a los dos anillos aromaticos
El espectro bidimensional HMBC muestra las conectividades entre el H1 y el C13 . Los carbonos cuaternarios presentan una o varias senales, pero no se observa acoplamiento, debido a que la interaccion C-H no es directa, sino que el carbono interacciona con un proton que se encuentra a dos o tres enlaces de distancia. Este espectro proporciona informacion sobre los carbonos acoplados y no acoplados y ademas, sobre la conectividad de ellos, con los hidrogenos unidos a traves de uno, dos o tres enlaces.
La interpretacion de los espectrosRMNbidimensional yHMBCde interaccion C -H, a traves de 2 o 3 enlaces, para la base de Schiff BS-BZ, considerando la asignacion de los nucleos de hidrogeno de la figura 2, es la siguiente:
El carbono N°.1(152,4 ppm) no tiene hidrogeno directamente; interacciona con el hidrogeno b (7,2 ppm) a traves de dos enlaces y con el hidrogeno c (7,1 ppm) a traves de tres enlaces.
El carbono N°.2(115,1 ppm) tiene el hidrogeno b directamente (7,2 ppm); interacciona con el hidrogeno c (7,1 ppm) a traves de dos enlaces y con el hidrogeno d (7,2 ppm) a traves de tres enlaces.
El carbono N°.3(128,9 ppm) tiene el hidrogeno c directamente (7,1 ppm); interacciona con el hidrogeno b (7,2 ppm) a traves de dos enlaces y con el d (7,2 ppm) a traves de dos enlaces y con el e (7,2 ppm) a traves de tres enlaces.
El carbono N°.4(120,1 ppm) tiene el hidrogeno d directamente (7,2 ppm); interacciona con el hidrogeno c (7,1 ppm) a traves de dos enlaces y con el hidrogeno e (7,2 ppm) a traves de dos enlaces y con el b (7,2 ppm) a traves de tres enlaces.
El carbono N°.5(115,9 ppm) tiene el hidrogeno e directamente (7,2 ppm); interacciona con el hidrogeno c (7,1 ppm) a traves de tres enlaces y con el hidrogeno d (7,2 ppm) a traves de dos enlaces.
El carbono N°.6(135,6 ppm) no tiene el hidrogeno directamente; interacciona con el hidrogeno e (7,2 ppm) a traves de dos enlaces y con el hidrogeno d (7,2 ppm) a traves de tres enlaces y con el f (8,7 ppm) a traves de tres enlaces.
El carbono N°.7(157,2 ppm) tiene el hidrogeno f directamente (8,7 ppm); interacciona con el hidrogeno g (7,4 ppm) a traves de tres enlaces y con el hidrogeno k (7,4 ppm) a traves de tres enlaces.
El carbono N°.8(135,9 ppm) no tiene el hidrogeno directamente; interacciona con el hidrogeno f (8,7 ppm) a traves de dos enlaces y con el hidrogeno g (7,4 ppm) a traves de dos enlaces, con el k (7,4 ppm) a traves de dos enlaces, con el h (7,3 ppm) a traves de tres enlaces y con el j (7,3 ppm) a traves de tres enlaces.
El carbono N°.9 y su equivalente 9* (128,9 ppm) tiene el hidrogeno g directamente (7,4 ppm) y k (7,4 ppm) interacciona con el hidrogeno h (7,3 ppm) a traves de dos enlaces y con el hidrogeno j (7,3 ppm) a traves de dos enlaces, con el f (8,7 ppm) a traves de tres enlaces y con el i (7,2 ppm) a traves de tres enlaces.
El carbono N°.10(129,0 ppm) y su equivalente 10*, tiene el hidrogeno h directamente (7,3 ppm); interacciona con el hidrogeno i (7,2 ppm) a traves de dos enlaces, con el hidrogeno k (7,4 ppm) a traves de dos enlaces y con el g (7,4 ppm) a traves de dos enlaces.
El carbono N°.11(131,7 ppm) tiene el hidrogeno i directamente (7,2 ppm); interacciona con el hidrogeno h (7,1 ppm) a traves de dos enlaces, con el hidrogeno j (7,3 ppm) a traves de dos enlaces, con el k (7,4 ppm) a traves de dos enlaces y con el g (7,4 ppm) a traves de dos enlaces.
CONCLUSONES
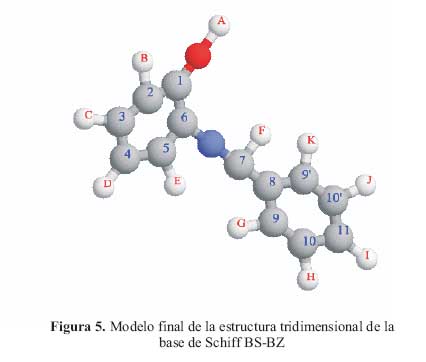
Se sintetizo una nueva base de Schiff y se caracterizo el compuesto integrando varias tecnicas de investigacion, como el microanalisis, espectroscopia IR, la RMN de H1 y de C13 y para determinar la estructura propuesta se utilizaron los espectros DEPT, HMBC y COSY que permite, en ambiente magnetico de los sistemas de spin, proponer la posible estructura tridimensional de la molecula (figura 5).
BIBLIOGRAFÍA
1. J. R. Dyer. Aplicaciones de espectroscopía de absorción en compuestos orgánicos. Editorial Prentice/Hall-Internacional. España.
2. J. Del Rio. Determinacion de la estructura de proteinas por RMN. Mensaje Bioquimico. Vol 2003 en http://bq.unam.mx/mensajebioquimico.
3. A.E. Derome. The use of NMR Spectroscopy en the Structure determination of Natural Products:Two dimensional methods. Nat Prod Rep 1989; 6:111.
4. G.A. Morris. Modern NMR techniques for structure elucidation. Magn Reson Chem 1986; 24:371.
5. H. Friebolin. Basic one-and two-dimensionalNMRspectroscopyWiley-VCH, 1998.
6. H. Dudderck, W. Dietrich y G. Toth. Elucidacion Estructural por RMN Ed. Springer. 3ra.ed 2000.
7. A. Orellana yM. Osorio. Seminario de tesis para optar al titulo de Profesor de Quimica y al grado de Licenciado en Educacion. Universidad de Playa Ancha; 2007. Valparaiso, Chile.
8. S. Prestsch. Tablas para determinacion estructural por metodos Espectroscopicos. 3. edicion, Ed. Springer-Verlog Iberica, Espana.
Recibido el 16-12-2009













