Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.3 Lima jul./dic. 2010
TRABAJOS ORIGINALES
Sensores basados en óxido de Fe dopados con Ag para la detección de sulfuro de hidrógeno
Sensors based on Ag-doped
α-Fe2 O3 for the detection of hydrogen sulfide
Gino Picassoa ; María del Rosario Sun Koub* ; Yennyfert Aguilara ; Alcídez Lópeza ; Manuel Arrueboc
a Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac
Amaru 210, Rímac, Lima - Perú, gpicasso@uni.peb Pontifica Universidad Católica del Perú, Av. Universitaria 1801, San-Miguel, Lima-Perú, msun@pucp.edu.pe
c Universidad de Zaragoza, Departamento de Ingeniería Química y Tecnologías del Medio Ambiente, c/ Pedro Cerbuna 12, 50009, Zaragoza-España
RESUMEN
En este trabajo se han estudiado sensores basados en nanopartículas de
α-Fe2O3, puros y dopados con Ag (con cargas del 0,5 al 5% Wt), preparados por el método de co-precipitación para la detección de sulfuro de hidrógeno. Se usó alúmina como material soporte de los sensores y formvar (poliviniloformal) como material ligante. Los difractogramas XRD revelaron la presencia mayoritaria de la fase α-hematita en todos los sensores. El tamaño promedio de las nanopartículas, determinado mediante micrografías TEM, estuvo entre 30 y 50 nm con presencia de aglomeraciones de diversos tamaños. Las isotermas BET mostraron que los sensores presentaban una superficie mesoporosa con un área promedio entre 66 y 88 m2/g. En los ensayos, se observó que los sensores dopados con plata presentaban mayor sensibilidad que las muestras no dopadas, revelando el efecto catalítico de la plata en la reacción superficial. Para encontrar las condiciones óptimas de trabajo (temperatura y concentración), para cada sensor se realizaron dos grupos de ensayos: un grupo, realizado en un intervalo de temperatura de 159°C a 388°C a un nivel medio de concentración de 90 ppm, y otro grupo, en un intervalo de concentraciones de 30 a 90 ppm a temperaturas medias de 159, 205 y 251ºC. La muestra dopada con 0,5% de Ag presentó la mayor sensibilidad a las temperaturas de operación de este trabajo y a una concentración de 90 ppm de sulfuro de hidrógeno, atribuyéndose estos resultados a la presencia de la estructura α-hematita y a la estabilidad térmica del sensor.Palabras clave: sensores,
α-Fe2O3, sulfuro de hidrógeno.
ABSTRACT
In this work, sensors based on undoped
α-Fe2O3 and doped with Ag (metal loading ranging from 0,5 to 5% Wt) prepared by coprecipitation method for the detection of H2S have been studied. Alumina has been used as material support of sensors and formvar (polyvinyl formal) as binder material. XRD patterns of all samples showed typical peaks of α-hematite. Mean particle size of nanoparticles evaluated by TEM was between 30 and 50 nm. BET isotherms showed that sensors presented mesoporous surface with mean surface area between 66 and 88 m2 /g. Sample tests of doped sensors with Ag showed higher sensibility than their undoped counterparts revealing catalytic effect of Ag on the surface reaction. In order to find optimal operating conditions (temperature and concentration), two groups of tests have been performed: first one were at constant propane concentration of 90 ppm in a temperature range from 159 °C to 388 °C and the second one were at constant temperatures of 159, 205 and 251 ºC in a concentration range of 30 to 90 ppm. Doped sensor with 0,5 % Ag presented higher sensibility at all operating temperatures and 90 ppm as hydrogen sulfide concentration and this behavior was attribuible to the presence of α-hematite morphology and higher thermal stability of sensor.Key words: sensors,
α -Fe2O3, hydrogen sulfide.
INTRODUCCIÓN
La nanotecnología es una ciencia que permite la manipulación de la estructura de la materia a escala nanométrica (30-50 nm), generando así materiales y estructuras con características diferentes de aquéllos empleados corrientemente. Existen varias técnicas utilizadas para la síntesis de nanopartículas como sol-gel, precipitación, abrasión con láser, entre otras. Todas ellas persiguen la obtención de nanopartículas con un tamaño predefinido y con una estructura estable, partiendo de una solución de sal metálica o un compuesto organometálico.
El óxido de hierro en su forma más estable, la
α-hematita, posee propiedades conductoras y magnéticas específicas, por las cuales ha recibido gran aplicación científica y tecnológica en calidad de: catalizador1 , intercambiador iónico2 y como material aditivo en baterías iónicas de litio3.La aplicación del óxido de hierro como sensor de gas en estado sólido es reciente
4-6. Las altas temperaturas de operación y su baja sensibilidad, han limitado su uso comercial como sensor 6. Algunas investigaciones han mostrado que el dopaje con algunos metales nobles como Au, Pt, Pd mejora las propiedades como sensor del óxido de Fe por la influencia cooperativa del metal dopante con la α-hematita por efectos químicos y electrónicos, que se refleja en una mejora de la sensibilidad obtenida y reducción de las temperaturas de operación7-12. El óxido de Fe ha sido frecuentemente usado para la detección de algunas sustancias de naturaleza orgánica como alcoholes y aminas13-15. En este trabajo se ha seleccionado trabajar con óxido de Fe, empleando Ag como material dopante, por ser un material noble y más económico que sus análogos (Au, Pt).Adicionalmente, el sulfuro de hidrógeno (H
2S) es un gas incoloro, inflamable, extremadamente tóxico y corrosivo que se produce en minas de carbón, refinerías de gas natural e industrias de lubricantes1 6 . Este gas produce severos efectos en el sistema nervioso humano incluso por debajo del valor límite de exposición ocupacional (10 ppm por 8 h); sin embargo, ha sido poco estudiado como gas de detección en sensores. El objetivo de este trabajo fue potenciar las propiedades químicas y electrónicas del óxido de hierro mediante su dopaje con Ag formando nanopartículas de Ag/α-Fe2O3 por coprecipitación, para su uso como sensor de H 2S en fase gas.PARTE EXPERIMENTAL
I.- Preparación de los sensores
Material de partida
Los materiales de partida para la preparación de los sensores fueron los siguientes: nitrato de hierro III, Fe(NO
3) 3.9H 2O (MERCK, PF=404,00 g/mol);cloruro de hierroIII, FeCl3.6H 2O (MERCK, PF=270,33 g/mol); nitrato de plata, Ag(NO3).4H2O (MERCK, PF=169,87 g/mol); carbonato de sodio, Na2CO3 anhydrous, (RIEDEL-DE-HAEN, PF=105,99 g/mol); polietilenglicol, (HOCH2CH2OH)n PEG 20000 (MERCK); etilenglicol, HOCH2CH2OH, (MERCK, PF=62,07 g/mol); formal de polivinilo (formvar- ALDRICH); 1,2-dicloroetano (MERCK, 99,5%, PF=98,96 g/mol); soporte de alúmina con electrodos de Au y resistencia de Pt.Preparación de las nanopartículas de óxido de hierro
El método usado para la preparación de los sensores fue el de co-precipitación a partir de soluciones 0,1 M Fe(NO
3)3 y 0,5 M Ag(NO3).4H2O . La solución mixta de las sales metálicas (en proporción establecida) fue agregado gota a gota (0,5 ml/min) a la solución 0,3 M de Na 2CO3 en agitación constante a una temperatura de 80 ºC, la cual contenía polientileglicol al 0,2 % usado como surfactante17. Para estudiar el efecto del tamaño molecular del surfactante algunas muestras fueron preparadas en las mismas condiciones con etilenglicol. Posteriormente, se agregó una cantidad adicional de solución de carbonato de sodio a fin de mantener un pH = 9,72. La mezcla obtenida continuó en agitación por una hora adicional y seguidamente se la sometió a un envejecimiento por una noche a temperatura ambiental. Luego, el precipitado se filtró, se lavó con agua destilada y se secó a 80 °C por una hora. Una vez obtenido el polvo, se calcinó a temperatura de 400ºC por una hora con una velocidad de calentamiento de 2ºC por minuto. En estas condiciones se obtuvieron las nanopartículas con las características estructurales de cristalinidad adecuada en la fase α-hematita9. Adicionalmente, este tratamiento permitió estabilizar el material, evitando cambios en la respuesta de los sensores a las condiciones de operación, y se logró obtener una buena reproducibilidad a temperaturas elevadas. Se han preparado diferentes muestras con el propósito de estudiar el efecto de diferentes variables experimentales en la sensibilidad de los sensores frente a: la presencia del surfactante, el efecto de la sal precursora (preparación de α- Fe2O3 a partir de cloruro de Fe III) y la presencia de Ag como material dopante. En la tabla 1 se recoge el total de sensores preparados en este trabajo y las condiciones de preparación.
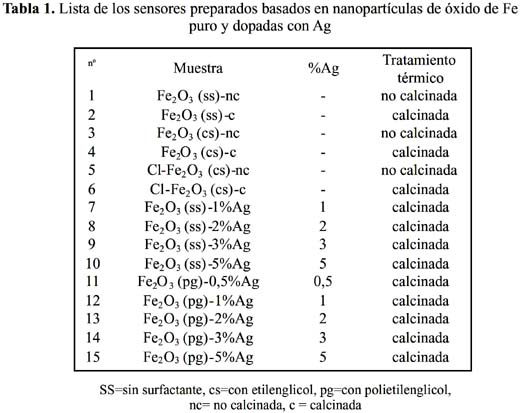
Preparación y acondicionamiento de los soportes de alúmina
Los sensores fueron preparados sobre un soporte de alúmina, el cual es inerte químicamente al óxido de hierro, y posee propiedades refractarias, por lo que resulta ideal para los ensayos a las temperaturas de operación (T < 400 ºC). Los soportes, antes de su uso se limpiaron en un baño de acetona y fueron secados al ambiente. Las dimensiones de los soportes fueron ajustadas para ser usados con el equipo experimental especialmente diseñado para el estudio de detección de gases con sensores. Las dimensiones del soporte de alúmina fueron de 9 mm x 6 mm (figura 1) y para su uso se le acoplaron electrodos de Au, empleado como medio electroconductor y de contacto con el material del sensor (cara anterior) y una resistencia de Pt usado como calentador térmico (cara posterior), donados por el laboratorio de Microscopía Electrónica de la Facultad de Ciencias de la Universidad Nacional de Ingeniería.
Para la adhesión del material sensor sobre los sustratos de alúmina se utilizó como material ligante una solución de formvar (formal de polivinilo), que fue preparado en una concentración de 25% Wt en 1,2-dicloroetano. Luego, fue introducida las nanopartículas de óxido de Fe en agitación constante en ultrasonido hasta obtener una pasta viscosa homogenizada. La pasta resultante de color marrón fue depositada sobre los electrodos de oro hasta obtener una capa uniforme. Una vez aplicado la pasta sobre los electrodos se realizaron varias pruebas a diferentes temperaturas para encontrar las condiciones óptimas de calcinación que permitieran eliminar los restos de disolvente y resina empleados y fijar de manera estable la capa de las nanopartículas al sustrato de alúmina. Luego de varios ensayos, las condiciones óptimas de calcinación de los sensores se fijaron en 400 °C durante 8 h. De esta manera se obtuvo una capa con el mayor límite de grano posible, aumentando la capacidad conductora del sensor. Adicionalmente, la evaporación de la resina permitió obtener una superficie muy porosa y rugosa, adecuada para la adsorción preferencial del gas de detección, lo que mejoró la capacidad receptora del sensor.

II.- Caracterización de los sensores
Los métodos de caracterización empleados con las muestras másicas y soportadas fueron:
Difracción de rayos X (XRD). Para la identificación cristalográfica de las muestras se utilizó la técnica de difracción de rayos. El equipo utilizado fue un RIGAKU Modelo Miniflex, con tubo de cobre y filtro de níquel, con 30 kV y 15 mA. El equipo está provisto de un ánodo rotatorio. Se usó un monocromador de grafito con el objeto de seleccionar la radiación CuKa del ánodo de cobre
(λ=1,5418 Å) y se ha trabajado con ángulos de barrido entre 5° y 100º, con una medida de paso de 0,10º y un tiempo de paso de 2,5 s. Los picos de difracción obtenidos fueron identificados a partir de los manuales del International Centre for Diffraction Data (JCDS). El tamaño medio de los granos cristalinos fue calculado a partir del análisis de los picos de difracción más intensos mediante la ecuación de Debye-Scherrer: 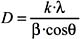
Donde D - es el tamaño medio de grano cristalino (Å),
λ - es la longitud de onda de la radiación incidente (1,5418 Å), k es una constante de calibración medida a partir de muestras patrón de tamaño conocido de partícula y que toma el valor de 0,9;β es la anchura del pico a la mitad de su intensidad máxima (en radianes) y θ es el ángulo de difracción para dicha intensidad.Microscopio electrónico de transmisión (TEM). Esta técnica fue empleada para determinar el tamaño medio de las nanopartículas preparadas. El microscopio electrónico de transmisión emite un haz de electrones dirigido hacia el objeto que se desea analizar. Una parte de los electrones se retrodispersan o son absorbidos por la muestra y otros lo atraviesan formando una imagen aumentada de la muestra; dicha imagen se registra mediante una placa fotográfica. El microscopio electrónico de transmisión (TEM) empleado es del modelo Philips EM 300G de 80 keV, ubicado en el laboratorio de Microscopía Electrónica de la Facultad de Ciencias de la Universidad Nacional de Ingeniería; tiene un límite de resolución de aproximadamente 2 nm y es ideal para detectar nanopartículas en el rango de 5 a 40 nm, que son las que se obtuvieron en este proyecto. La muestra en suspensión fue dispersada mediante ultrasonido; posteriormente se colocó una pequeña porción de esta suspensión sobre una rejilla con membrana de soporte de parlodión y se mantuvo allí hasta que el solvente se evaporó completamente.
Adsorción-desorción de N
2 (técnica BET): Mediante esta técnica se obtuvo información de la textura superficial de las muestras. El equipo utilizado para la realización de las isotermas fue un Micromeritics modelo ASAP 2000. Las isotermas de adsorción (representación del volumen de N2 adsorbido por cm STP/g de catalizador frente a la presión relativa de N 2, P/P 0) fueron obtenidas a la temperatura del nitrógeno líquido (77 K), en el rango de bajas presiones 10-4-10-8 torr. Antes de cada análisis, las muestras fueron sometidas a un pretratamiento de desgasificación a 200 °C por 8 h y con un vacío residual de 10-3 torr. Este pre-tratamiento tuvo por objetivo eliminar el agua fisisorbida y las sustancias retenidas en la superficie del sólido.Microscopía de luz blanca. Mediante esta técnica se cuantificó el espesor medio de la capa de óxido depositado sobre la alúmina. Esta técnica está basada en microscopía de luz blanca que consiste en hacer pasar un haz de luz a través de la muestra obteniendo una imagen, que luego es amplificada mediante una serie de lentes para poder ser registrada luego en una cámara digital.
III.- Ensayos en el equipo de detección de H
2SPara los ensayos de detección de H
2S con los sensores preparados se utilizó gas patrón (sulfuro de hidrógeno, AIRGAS, 99,02 ppm) y aire comprimido como diluyente para obtener las mezclas gaseosas seleccionadas de: 30, 50, 70 y 90 ppm. Las temperaturas de operación de los sensores en este trabajo fueron: 159, 205, 251, 296 Cº. Estas variaciones se realizaron con el objetivo de determinar la temperatura óptima de trabajo de cada sensor a diferentes concentraciones y para evaluar la influencia del porcentaje de plata en la sensibilidad del sensor. Dicha sensibilidad se determinó mediante la siguiente expresión: Ggas/G0 , donde Ggas, es la conductancia en presencia del gas modelo mezclado con aire y G0, es la conductancia en presencia sólo de aire. A través del equipo de ensayo de sensores se recogen valores de voltaje, los cuales son transformados a valores de conductancia mediante la siguiente fórmula: 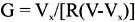
Donde, V
x es el voltaje que se mide en el equipo, V es el voltaje de referencia (5 voltios), R es igual a 20 Mohm = 20 x106 ohm.Previo a los ensayos se calibró el controlador de temperaturas y se establecieron los caudales en los flujómetros para la obtención de la concentración de H
2S en aire.RESULTADOS Y DISCUSIÓN
En la figura 2, se presentan los difractogramas característicos de las muestras estudiadas. Los patrones de difracción de los óxidos sintetizados muestran mayoritariamente la presencia de los picos característicos del Fe
2O3 en la forma de α-hematita (JCPDS - Internacional Centre for Diffraction Data Nº 33-0664). Se distinguen especialmente los picos mayoritarios de la fase α-hematita para un 2θ igual a 33,18º y 35,64º con una intensidad relativa de 100 y 70, respectivamente.En general, las muestras calcinadas han presentado mayor cristalinidad que las no calcinadas, como se observa en la figura 2 al comparar el difractograma de Fe
2 O 3(ss)-c con el correspondiente a Fe2 O 3(ss)-nc y el de la muestra Fe2O3(pg)-c con el de Fe2O3(pg)-nc. De igual forma las nanopartículas sintetizadas sin surfactante mostraron una mayor cristalinidad que sus homólogas con surfactante, como se aprecia en la misma figura, al comparar los perfiles de Fe2O3(ss)-c y Fe2O3 (pg)-c. Los óxidos preparados han presentado un tamaño medio de grano de 20 nm, que coincide con el obtenido en algunos trabajos18-19.El tamaño medio del grano ha sido afectado por la presencia del surfactante, como se observa en la figura 2, al comparar el difractograma de Fe
2 O 3(ss)-c con la correspondiente a Fe2 O 3(pg)-c; la primera presenta un mayor grado de cristalinidad y, por tanto, con mayor tamaño de grano que la segunda. La temperatura de calcinación en las muestras fue fundamental para la definición de la fase α-hematita, como se observa en la misma figura. Si bien el efecto del surfactante ha contribuido en parte a la formación de la red cristalina, el tratamiento térmico a 400 ºC durante la calcinación ha sido determinante en la estabilidad y sensibilidad de las nanopartículas.
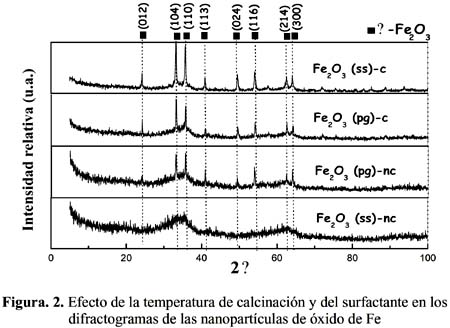
El dopaje con Ag no afectó ni la cristalinidad inicial obtenida en el óxido de Fe ni el tamaño de grano como se aprecia en la figura 3, por lo que se puede deducir que la introducción de la plata no ha modificado la estructura matriz del óxido de Fe. Por otro lado, la muestra (Cl-Fe
2 O3 (cs)- c) preparada a partir de precursor cloruro siguiendo un tratamiento experimental similar a las muestras preparadas a partir del precursor nitrato, no ha presentado suficiente cristalinidad para identificar la fase α-hematita, como se observa en la figura 3, debido probablemente a la influencia negativa del cloruro en los procesos de nucleación y crecimiento de los granos cristalinos.
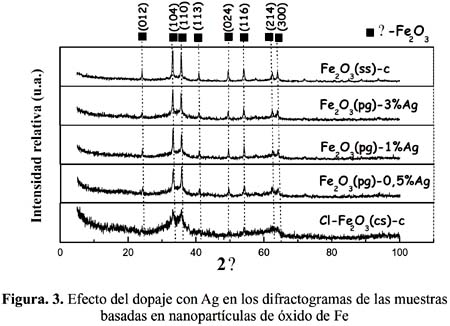
En referencia a la muestra Fe
2O3 (ss)-c, se puede observar en la micrografía TEM de la figura 4, partículas esféricas de tamaño uniforme entre 30 y 40 nm con presencia de aglomeraciones de diversos tamaños. En la misma muestra analizada con mayores aumentos (micrografía de la figura 5), se observan las partículas pequeñas así como el patrón de difracción electrónica con buena definición de los anillos del patrón cuando crecen los granos cristalinos. Esta característica está en acuerdo con los difractogramas XRD de la figura 3, que también describen a las muestras como altamente cristalinas. Algunas partículas han presentado una morfología de aspecto cúbico aunque prevalecen más las partículas con formas esferoidales (figura 6). El mayor tamaño de partícula observado por la técnica TEM fue de 40 nm.


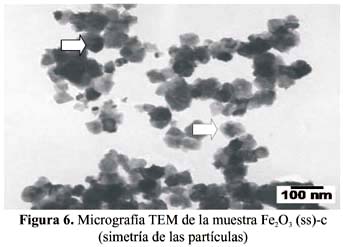
Para estudiar el efecto del surfactante en los sensores soportados se presentan en las figuras 7 y 8, las micrografías TEM de las muestras Fe
2O3 (ss)-1%Ag y Fe 2O3 (pg)-1%Ag, respectivamente. Se puede apreciar en la figura 7 que las partículas están aglomeradas en forma de racimo con tamaños medios de 40 a 50 nm, similares al observado en la muestra Fe 2O3 (ss)-c. En este caso también se producen partículas de simetría cúbica que se observan mejor en la ampliación en la misma figura 7. Las nanopartículas se encuentran mejor dispersadas en presencia de surfactante, tal como se observa en la figura 8, con un tamaño medio de partícula entre 10 a 15 nm. La presencia del surfactante permitió estabilizar térmicamente las nanopartículas, pues no se observó cambios estructurales apreciables por efecto de la temperatura. Un resultado similar se observó en las micrografías TEM de las figuras 9 y 10, correspondientes a las muestras Fe 2O3 (ss)-5%Ag y Fe 2O3 (pg)-5%Ag, respectivamente. La diferencia observada en este caso está en la prevalencia de partículas esferoidales. Además, en la figura 10 se observa el patrón de difracción de electrones de la muestra Fe 2O3 (pg)-5%Ag en donde la presencia de una alta definición en los anillos de difracción ha significado también (como en el caso de la figura 5), un crecimiento de los granos cristalinos.
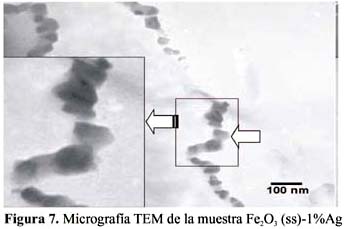



La fijación del material sensor sobre la superficie del soporte de alúmina se analizó por la técnica de microscopía de luz convencional; esto permitió estudiar el grado de homogeneidad superficial y el espesor obtenido del material sensor mediante la deposición por impregnación, con ayuda del polímero ligante (formbar). En la figura 11, en una vista de perfil, se observa que el espesor de recubrimiento obtenido de la capa de óxido fue de aproximadamente 120 µm, muy por debajo del correspondiente al soporte de alúmina (600 m). En general, un espesor medio de recubrimiento de 100 µm es el valor obtenido en algunos trabajos con óxido de Fe
7, 19.
En la tabla 2 se recogen los valores de la superficie BET de las muestras de óxido de Fe puro y dopadas, preparadas sin surfactante y con etilenglicol. En la figura 12 se muestran las isotermas de los sensores basados en óxido de Fe puro y con dopante usando etilenglicol como surfactante y en la figura 13, se tienen los resultados de las mismas muestras pero en ausencia de surfactante. En general, todas las muestras presentaron una isoterma tipo IV, según la clasificación IUPAC, característica de materiales mesoporosos. Las muestras con surfactante presentaron mayor superficie (por ejemplo, la muestra Fe
2 O3 (cs)-2%Ag tuvo una superficie de 53 m /g que fue mayor comparada con su homóloga Fe2O3 (ss)-2%Ag, con 36 m /g); esta diferencia fue atribuida al mayor tamaño de la molécula del surfactante, la cual después de ser eliminada por calcinación forma espacios vacíos (poros) de mayor diámetro.

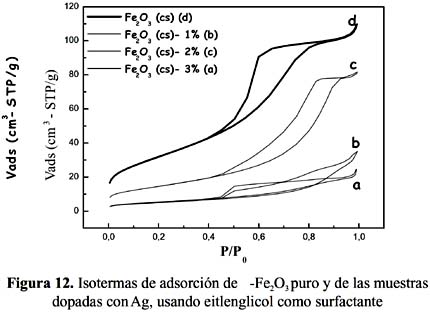
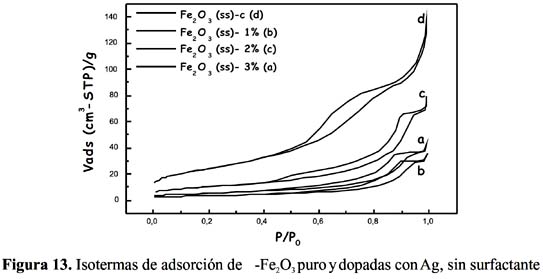
La introducción de la plata redujo drásticamente la superficie en casi 10 veces, como se observa en la tabla 2 para las muestras Fe
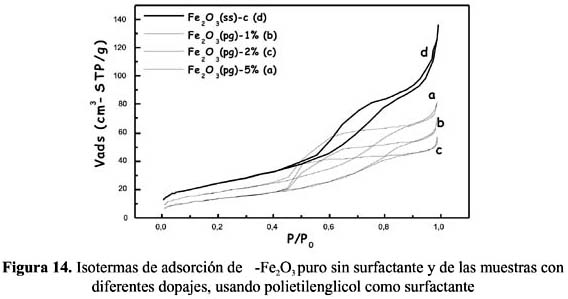
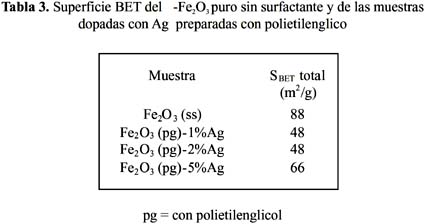
2O3 (ss) y Fe 2O3 (ss)-1%Ag con una reducción de 88 a 12 m /g, y Fe2O3 (cs) - Fe2O3 (cs)-1%Ag, con una disminución de 116 a 18 m /g, respectivamente. Este hecho y el cambio que se observó en las isotermas (figura 12) en la forma de la histéresis del tipo H1 al tipo H2, característico este último de materiales con poro cuello de botella, permiten establecer que posiblemente estos cambios sean la consecuencia de la obstrucción de la entrada de los poros por las partículas de plata o podría ser debido a la formación de aglomerados independientes sobre la superficie externa, tal como sugieren algunos autores7-18.La forma y tipo de isoterma de adsorción de los sensores preparados con polietilenglicol (figura 14), también son del tipo IV pero la histéresis no está bien definida y podría aproximarse al tipo H1, el cual se atribuye a materiales con poros aproximadamente cilíndricos. Como se observa en la tabla 3 y figura 14, el cambio en la magnitud de la superficie conforme aumenta el contenido de plata sigue la misma tendencia que la observada para el etilenglicol, con cambios en la forma de la histéresis al tipo H2. Sin embargo, los valores de superficie de las muestras dopadas con polietilenglicol son de mayor valor que las correspondientes a etilenglicol con la misma carga dopante, por ejemplo para 1%Ag/Fe
2 O 3(pg) con 48 m /g (tabla 3) frente 18 m /g correspondiente a su homóloga 1%Ag/Fe2 O 3(cs) (tabla 2). Esta diferencia confirma la mayor capacidad antiaglomerante del polietilenglicol.
Ensayos con los sensores en el equipo de detección de H
2SSe han realizado experimentos en el equipo de sensores en fase gas con el objeto de estudiar la sensibilidad del sensor frente a cambios de temperatura (intervalo de 159 a 388 ºC), de concentración del sulfuro de hidrógeno (rango de 30 a 90 ppm) y las muestras preparadas con polietilenglicol dopadas con Ag, en el rango entre 0,5 al 5%. El equipo experimental para los ensayos con los sensores consiste en 3 partes fundamentales:
-
Sistema de alimentación, consistente en la fuente de gas de alimentación, controlado por 2 flujómetros, que permitieron establecer las concentraciones de sulfuro de hidrógeno en aire (en ppm).
-
Sistema de análisis, consistente en un cilindro de acero con cerradura hermética para la introducción y estudio del sensor soportado en alúmina. Además conectado a éste un voltímetro (para el seguimiento de la conductividad y temperatura) y una interfase de control digital.
-
Sistema de procesamiento de datos, consistente en una PC con el software empleado para el estudio del sensor de gases.
Las muestras de óxido de Fe sin dopar preparadas a partir de precursor nitrato presentaron en general muy baja sensibilidad a bajas temperaturas (< 350 ºC), mientras que la preparada a partir de precursor cloruro produjo una mejor sensibilidad. Esto se podría explicar considerando que a la temperatura de calcinación de los sensores (400ºC), el precursor nitrato se ha descompuesto en su totalidad formando óxido mientras que en el caso de la muestra con cloruro, se ha demostrado en trabajo anterior que el cloruro es más difícil de eliminar por calcinación
2 0 , por lo que el cloro residual podría haber contribuido parcialmente con la oxidación del sulfuro de hidrógeno.Los sensores preparados tuvieron en general buena señal de respuesta en relación con las concentraciones de H
2S, como se observa en la figura 15 para el sensor Fe2O3 (pg)-0,5%Ag, en la figura 16 para el sensor Fe2O3 (pg)-1%Ag, en la figura 17 para el sensor Fe2O3 (pg)-3%Ag y en la figura 18 para el sensor Fe2O3 (pg)-5%Ag. En la tabla 4 se recogen las sensibilidades máximas de los sensores dopados a 159 ºC y 90 ppm de H 2S.
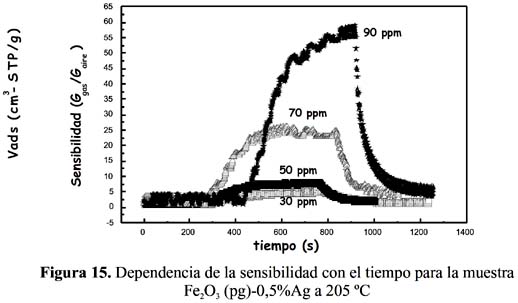
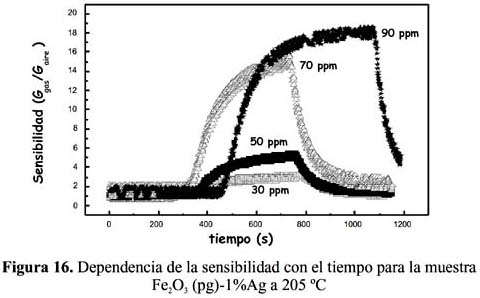
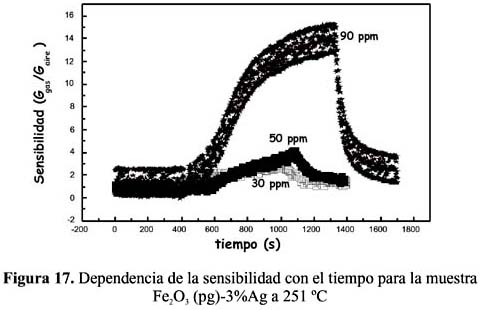
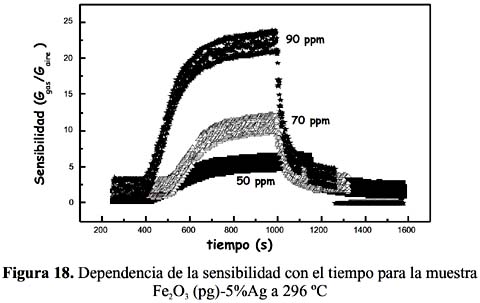

En todos los casos, la sensibilidad y el tiempo de detección fueron más altos a una mayor concentración del H
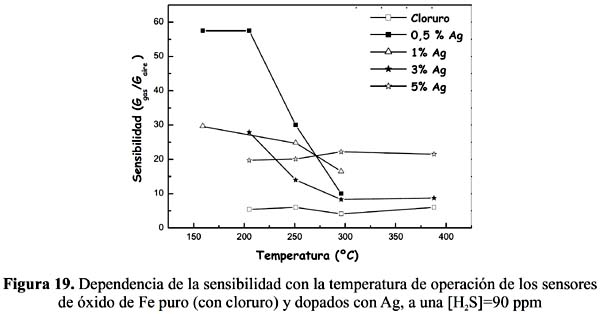
2S. En ningún caso se ha observado una dependencia lineal de la señal de respuesta respecto a la concentración que es explicable considerando el mecanismo complejo de detección y la naturaleza de los sitios activos. Por otro lado, el sensor Fe 2O3 (pg)-0,5%Ag ha resultado tener mejor comportamiento, que ha conducido a mayores sensibilidades a la menor temperatura de operación, como se observa en la tabla 4 con una señal máxima de 57,5 muy por encima respecto a los otros sensores dopados a la misma temperatura y concentración. Este buen resultado en la muestra dopada al 0,5% de Ag tiene relación con la formación de la estructura α-hematita estudiada por la técnica de rayos X (figura 3) y la presencia en la superficie de una adecuada posición de los sitios activos de Ag.Respecto a la temperatura, los sensores dopados con plata han presentado una mayor sensibilidad en todo el rango de temperaturas estudiado con relación a sus análogos sin dopar, como se puede observar en la figura 19. El sensor sin dopar (preparado con nitrato) no registró señal mientras que el preparado con cloruro presentó sensibilidades pequeñas y menores a las de todas las muestras dopadas (figura 19).
Como se observa en la figura 19, la sensibilidad experimental respondió bien a los cambios de temperatura y tiende a disminuir al aumentar su magnitud como se observa en los sensores dopados 0,5%, 1% y 3% o permanecer aproximadamente constante como en la muestra al 5%. La capacidad receptora del sensor es sensible al tamaño de las nanopartículas de óxido de Fe y a la presencia de límites de grano
7. El aumento de temperatura promociona la sinterización de partículas y por tanto disminuye las fronteras de grano por lo que la capacidad receptora del sensor tiende a disminuir. La mejor sensibilidad de los sensores se obtuvo a las temperaturas de 159 y 205ºC (figura 19). El sensor Fe2O3 (pg)-0,5%Ag presentó la máxima sensibilidad respecto a todas las muestras a las temperaturas de 159, 205 y 251ºC con una concentración de H 2S de 90 ppm. De los resultados obtenidos se puede establecer que la plata ha contribuido favorablemente en la interacción del oxígeno quimisorbido en la superficie de las nanopartículas de óxido de Fe. Las temperaturas de máxima sensibilidad obtenidas en este trabajo están dentro del promedio de temperaturas reportadas para sensores de H 2S, como por ejemplo en el trabajo de Wang y col. 9 la máxima sensibilidad se obtuvo con un sensor de óxido de Fe dopado con 2%Wt Pt a 160 ºC para 100 ppm de H S, y en el trabajo de Xu y col 21 se obtuvo con un sensor de In 2O3 a una temperatura de 268,5 ºC para 50 ppm de H2S.
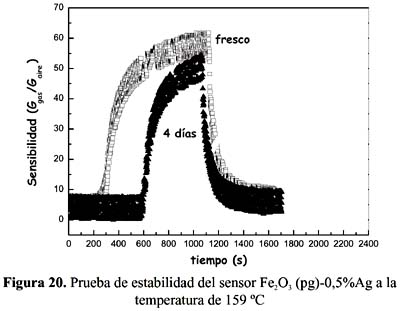
El sensor Fe
2O3 (pg)-0,5%Ag presentó además una buena estabilidad térmica a la temperatura de 159ºC después de 4 días del ensayo original (figura 20). Como se observa, la señal de respuesta de máxima sensibilidad se mantiene prácticamente constante después del cuarto día de ensayos, e incluso el tiempo de respuesta fue similar. La estabilidad térmica alcanzada del sensor se le puede atribuir a la capacidad estabilizadora del surfactante y al posicionamiento de la plata en sitios superficiales de fácil acceso para el contacto gas-sólido. El buen rendimiento del sensor de 0,5% Ag a la temperatura de 151 ºC y su estabilidad térmica hace atractiva su aplicación como sensor de H2S aunque se requiere estudios posteriores para describir la naturaleza de los sitios metálicos ocupados por la plata en la superficie del sensor y mejorar la sensibilidad de detección de H 2S a bajas concentraciones.
CONCLUSIONES
-
En este trabajo se han preparado sensores basados en nanopartículas de óxido de Fe puros y dopados con Ag por coprecipitación. Los sensores preparados por este método presentaron buena sensibilidad y estabilidad.
-
El análisis XRD de los sensores mostraron la presencia mayoritaria de la fase hematita en todos los materiales, presentando mayor cristalinidad las muestras sin surfactante y calcinada. El análisis TEM ha mostrado la presencia de partículas de 40 nm. El área superficial disminuye conforme aumenta el contenido de plata posiblemente por efecto de la obstrucción producida por la presencia de la plata en la entrada de los poros o por aglomeración de este metal en la superficie externa del sensor.
-
Los sensores mostraron mejor estabilidad en la deposición de las nanopartículas sobre el soporte de alúmina cuando fueron calcinadas a 400 ºC por 8 h con un espesor medio de 120 m.
-
Los sensores de óxido de Fe dopados con plata mostraron una mayor sensibilidad, que las no dopadas, comprobando el efecto favorable de la presencia de la plata en la reacción de oxidación del H
Los ensayos realizados variando la sensibilidad del sensor con la temperatura, concentración y tiempo de detección revelaron que las muestras preparadas con nitrato y dopadas con plata fueron mucho más efectivas que sus homólogas sin material dopante. El sensor de óxido de Fe dopado con 0,5 % de Ag presentó el mejor comportamiento a la temperatura de 159 ºC, con una concentración de 90 ppm y con un tiempo de detección de 1000 s (aproximadamente 17 minutos), atribuyéndose probablemente este comportamiento a la presencia de la estructura
AGRADECIMIENTOS
Los autores agradecen al CONCYTEC (PROYECTO PROCYT 240-2008-CONCYTEC- OAJ), al Instituto de Investigación de la Facultad de Ciencias de la Universidad Nacional de Ingeniería, al Lab. 4 de la Sección Química de la PUCP y al Departamento de Ingeniería Química y Tecnologías del Medio Ambiente de la Universidad de Zaragoza por el apoyo logístico y la ayuda financiera otorgada a este trabajo.
BIBLIOGRAFÍA
1. Picasso G., Quintilla A., Pina M.P., Herguido J, Applied Catalysis B: Environmental, v.46, p. 133-143, (2003).
2. Mitra S., Das S., Mandal K., Chaudhuri S., Nanotechnology 18, 275608 (2007).
3. Chen, L.N. Xu, W.Y. Li, Adv. Mater. 17, 582–586 (2005).
4. Huo L.H., Li Q., Zhao H., Yu L.J., Gao S., Zhao J.G., Sensors and Actuators B: Chemical, V. 107, I. 2, p. 915-920 (2005).
5. Esteban-Cubillo A., Tullían J.M., Pecharromán C., Moya J., J. European Ceramic Society 25, p. 1983-1989 (2007).
6. Mukta V. Vaishampayan, Rupali G. Deshmukh, Pravin Walke, I.S. Mulla, Materials Chemistry and Physics 109, 230–234 (2008).
7. Wang Y., Wang Y., Cao J., Kong F., Xia H., Zhang J., Zhu B., Wang S., Wu S., Sens. Actuators B 131, p. 183-189 (2008).
8. Wang Y., Kong F., Zhu B., Wang S., Wu S., Huang W., Materials Sci. and Eng. B 140, 98-102 (2007).
9. Wang Y., Wang S., Zhao Y., Zhu B., Kong F., Wang D., Wu S., Huang W., Zhang S., Sensors and Actuators B 125, 79-84 (2007).
10. Malyshev V.V., Eryshkin A.V., Koltypin E.A., Varfolomeev A.E., Vasiliev A.A., Sensors and Actuators B 18-19, 434-436 (1994).
11. Huo L.H., Li Q., Zhao H., Yu L.J., Gao S., Zhao J.G., Sens. Actuators B 107, 915–920 (2005).
12. Funazaki N., Hemmi A., Ito S., Asano Y., Yamashita S., Kobayashi T., Haruta M., Sens. Actuators B 14, 536-538 (1993).
13. Tan O.K., Cao W., Zhu W., Chai J.W., Pan J.S., Sens. Actuators B 93, 396–401 (2003).
14. Dai G.R., Sens. Actuators B 53, 8–12 (1998).
15. Neri G., Bonavita A., Ipsale S., Rizzo G., Baratto C., Faglia G., Sberveglieri G., Materials Science and Engineering: B 139, p. 41-47, (2007).
16. http://en.wikipedia.org/wiki/Hydrogen_sulfide, 12.05.09.
17. Luo C., Zhang Y., Zeng X., Zeng Y., Wang Y., J. Colloid Interface Sci. 288, 444-448 (2005).
18. Wang X., Gao L., Zheng H., Ji M., Shen T., Zhang Z., J. Crystal Growth 269, 489-492 (2004).
19. Jing Z., Wu S., Material letters 58, 3637-3640 (2004).
20. Picasso G., Sun Kou M.R., Gómez G., Hermoza E., López A., Pina M.P., Heguido J., Revista de la Sociedad Química del Perú, v. 75, Nº 2, p 163-176 (2009).
21. Xu J., Wang X., Shen J., Sensors and Actuators B 115, 642-646 (2006).













