Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.3 Lima jul./dic. 2010
TRABAJOS ORIGINALES
Evaluación del contenido de fitoesteroles, compuestos fenólicos y métodos químicos para determinar la actividad antioxidante en semilla de sacha inchi (Plukenetia volubilis L.)
Evaluation of the content of phytosterols, phenolic compounds and chemical methods to determine antioxidant activity in sacha inchi`s seed (Plukenetia volubilis L.)
Ana Muñoz Jáureguia* ; Fernando Ramos Escuderob ; Carlos Alvarado Ortiz-Uretaa ; Benjamín Castañeda Castañedaa ; Edy Barnett Mendozaa ; Jaime Yáñez Farfánc ; Delia Cajaleón Asenciosd
a Facultad de Medicina Humana, Universidad de San Martín de Porres, Av.
Alameda del Corregidor 1531, Lima 12, Perú, amariamj@yahoo.esb Facultad de Farmacia, Universidad de Sevilla.
c Departament of Drug Metabolism and pharmacokinetics, Merck & Co., Inc. Merck Reserch Laboratories, Kenilworth, NJ 07033,USA.
d Facultad de Bromatologia y Nutrición, Universidad Faustino Sánchez Carrión.
RESUMEN
En el presente estudio se realizó la cuantificación de compuestos fenólicos por HPLC según condiciones cromatográficas descritas por Muñoz et al. La torta de sacha presentaron ácidos fenólicos tales como ácido cafeico 3,51 mg/kg, y ferúlico 1,68 mg/kg. Asimismo, se encontraron flavonoides: 42,93 mg/kg de rutina, 28,46 mg/kg de hesperidina y 53,24 mg/kg de morina. Se identificaron en torta y aceite por el método descrito por Fierro et al., usando TLC la presencia de fitoesteroles en sacha inchi. Inmediatamente se cuantificaron fitoesteroles por HPLC en aceite donde se realizó el tratamiento de la muestra mediante extracción por saponificación según CEE 2568-91. Los resultados mostraron un contenido promedio de 75,49 mg/100g para estigmasterol y 74,56 mg/100g de
β-sitosterol. La actividad antioxidante se realizó mediante los métodos ABTS según Van Overveld et al., y DPPH según Brand-Williams et al. Los resultados mostraron que el extracto lipofílico del aceite presentaba mayor actividad antioxidante y mayor capacidad inhibitoria con el método DPPH; sin embargo, el extracto hidrofílico del aceite mostró mayor actividad con el método ABTS.Palabras clave: ácidos fenólicos, flavonoides, fitoesteroles, sacha inchi.
ABSTRACT
The present research was the quantification of phenolic compounds by HPLC chromatographic conditions as described by Muñoz etal., in the sacha inchi`s cake that quantified phenolic acids found an average of 3,51 mg/kg of caffeic and 1,68 mg/kg of ferulic. Also flavonoids are found an average of 42,93 mg/kg routinely 28,46 mg/kg of hesperidin and 53,24 mg/kg of morin. Was identified by the method described by Fierro et al., using TLC where they detected the presence of phytosterols in sacha inchi. Content were quantified by HPLC phytosterols in oil which was extracted by saponification according to EEC 2568-91. Results were average content of 75,49 mg/100g for stigmasterol, while the content of
β-sitosterol was 74,56 mg/100g. Antioxidant activity was determined by ABTS methods according to Van Overveld et al., And DPPH as Brand-Williams et al. The results showed that the lipophilic extract oil had higher antioxidant activity showed a greater inhibitory capacity with DPPH method, however, the hydrophilic extract of the oil showed greater activity with the ABTS method.Key words: phenolic acids, flavonoids, phytosterols, sacha inchi.
INTRODUCCIÓN
El sacha inchi Plukenetia volúbilis L. en nuestro país se encuentra en estado silvestre en diversos lugares de San Martín, Ucayali, Huánuco, Amazonas, Madre de Dios y Loreto. El presente estudio evalúa la presencia de fitoesteroles, compuestos fenólicos, y actividad antioxidante de la semilla de sacha inchi
1 . Actualmente son de gran importancia los compuestos fenólicos por sus propiedades como antioxidantes y por sus atributos sensoriales que brindan a los alimentos como: sabor, color, y por brindar estabilidad por su resistencia a la oxidación lipídica2 . Asimismo, son excelentes conservadores naturales brindando estabilidad al alimento desplazando a otros conservadores sintéticos. La proyección en cuanto a su aplicación en la industria alimentaria y farmacéutica está en aumento; evaluar sus propiedades antioxidantes y la presencia de polifenoles permitirá abrir nuevos posibles mercados3 . El objetivo del presente trabajo es determinar el contenido de compuestos fenólicos por HPLC, capacidad antioxidante e identificación y cuantificación de fitoesteroles en semilla de sacha inchi.PARTE EXPERIMENTAL
Materiales e insumos
Membrana nylon 42mm de 45 um, Acrodisk GHP 45um de 25 mm, Cromatofolios de silicagel G f254.
Metanol HPLC, éter etílico, hidróxido de potasio, agua ultra pura para HPLC, etanol p.a., estándares de ácidos fenólicos: cafeico y ferúlico, estándares de flavonoides: hesperidina, rutina y morina.
Metodología
Preparación de la muestra
La extracción del aceite de las almendras de sacha inchi se llevó a cabo por el prensado en frío. Las presiones de extracción fueron de 300 700 PSIA por espacio de 5 minutos, a la presión y temperatura ambiente. Las extracciones se realizaron con muestras de 90 gramos. Las muestras fueron colocadas en cilindro extractor de acero inoxidable, sometiéndose lentamente hasta llegar a las presiones establecidas, manteniendo la palanca de activación a presión constante por espacio de 5 minutos, controlándose esto con un cronómetro. Terminado el proceso de extracción la torta residual obtenida luego del prensado fue secada a 45 ºC durante 2 horas, luego se envasó y selló en bolsas plásticas grado alimenticio (ziploc
®) y mantenidas en refrigeración.Luego se procedió a realizar los estudios cromatográficos de identificación y cuantificación de compuestos fenólicos, y fitoesteroles por HPLC en el laboratorio de Bioquímica y Nutrición del Instituto de Investigación de Medicina Humana de la Universidad de San Martín de Porres.
Determinación de compuestos fenólicos
Ensayos preliminares
Para la cuantificación de los compuestos fenólicos se realizaron pruebas preliminares con estándares de ácidos fenólicos como clorogénico, cafeico y ferúlico, lográndose identificar y cuantificar dos de ellos: cafeico y ferúlico. Asimismo, se identificaron y cuantificaron hesperidina, rutina y morina.
Las pruebas preliminares de cromatografía fueron desarrolladas en la Facultad de Farmacia de la Universidad de Sevilla en un HPLC Agilent Technologies (Waldbronn, Germany), modelo 1100; el sistema consistió de un desgasificador de vacío, bomba cuaternaria, automuestreador, termostato para columna y detector de arreglo de diodo (DAD). El análisis fue corrido en una columna SB C18 (250 x 4,6 mm, 3,5 µm, Agilent Technologies). La fase móvil fue: solvente A (agua ultrapura ajustada con ácido acético a pH 2,65) y solvente B (20 % A y 80 % MeCN). La velocidad de la inyección fue a 1,5 mLmin
-1 y la temperatura de la columna a 40 ºC. El tiempo total del análisis fue 45 min y el tiempo post-corrida fue 15 min. El volumen de inyección de la muestra fue 50 µL. Se logró identificar ácido siríngico y cinámico.Cuantificación de compuestos fenólicos por HPLC
Las condiciones del análisis por HPLC fueron previamente descritas por Muñoz et al. (2007)
4 . Se elaboraron estándares de ácidos fenólicos donde se pesaron individualmente los ácidos fenólicos: cafeico y ferúlico y se preparó otro estándar con flavonoides: rutina, hesperidina y morina de los que se pesó 10 mg de cada uno y se diluyó con agua en fiola de 100 ml; luego se tomaron 2 ml y se llevó a una fiola de 100 ml con con una mezcla hidroetanólica en el caso de los ácidos fenólicos. De los flavonoides se pesaron 10 mg en fiolas de 50 ml y de ahí se tomó 2 ml para diluirlo en 25 ml con una mezcla hidroetanólica (60:40); seguidamente fueron identificados por su tiempo de retención y calculados en función a sus respectivas áreas de los picos registrados a 370 nm.La separación cromatográfica fue desarrollada a temperatura ambiente con una columna LiChroCART
® 250-4 LiChrospher® 60 RP-18 (5 µm) (Merck KGaA, Alemania). La separación fue corrida a un flujo de 1000 µL min-1 y la fase móvil consistió en una mezcla de gradiente del eluyente A (agua – ácido o-fosfórico, pH 2,5) y eluyente B (acetonitrilo). El programa de gradiente utilizado fue el siguiente: 0 min, 100 % de A; 2 min, 80 % de A y 20 % de B; 15 min, 70 % de A y 30 % de B; 16 min, 40 % de A y 60 % de B; 22 min, 60 % de A y 40 % de B; 26 min, 100 % de A; 28 min, 100 % de A. las concentraciones de los ácidos fenólicos y flavonoles se expresaron en mg/kg de peso. Para el tratamiento de la torta de sacha inchi se trabajó con el extracto acuoso a una concentración de 8%,la misma que fue sonificada 20 minutos y agitada por media hora antes de llevar a volumen.Identificación de fitoesteroles por TLC
Se realizó mediante el método descrito por Fierro et al., (2004)
5 . Las muestras de torta y aceite de sacha inchi fueron pesadas en tubos diferentes y se les agregaron metanol a una concentración de 10mg/ml. Los tubos fueron agitados en vortex por 30 minutos y 20 minutos sonificados; luego se guardó 24 horas. Despues se procedió a sembrar en las placas cromatográficas con micropipeta 10 ul. Se utilizaron dos sistemas cromatográficos como fase móvil. La primera fase móvil fue (CHCl3 :CH3 OH:H 2O 10:1:0,05) y fue corrida hasta la mitad de la placa cromatográfica. Luego la placa fue secada y corrida completamente en el segundo sistema de solvente (CHCl3 ).Cuantificación de fitoesteroles
Se realizó el procesamiento de las muestras según el método descrito por el reglamento CCE 2568-91
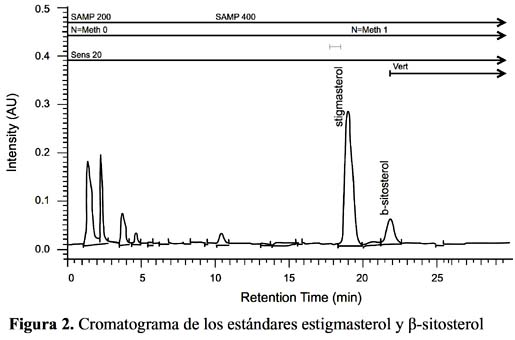
6 donde se pesó en un balón 5 gramos de aceite de sacha inchi y se trataron de forma similar al estándar constituido por aproximadamente 10 mg de β-sitosterol y 50 mg de estigmasterol, los que fueron saponificados en baño maría y se les extrajo con éter etílico usando peras de decantación tres veces, llevando a volumen en una fiola de 100 ml; luego se concentró sólo 25 ml con nitrógeno y se reconstituyó con metanol HPLC para ser analizados bajo las condiciones cromatográficas similares a las descritas por Fierro et al5 ., donde se trabajó en un HPLC Lachrom Merck -Hitachi 7100 con detector uv.vis a una longitud de 215 nm con una columna RP 18 250x4 de 5 um con fase móvil ACN:METOH (65:35) con flujo de 1,2 ml por 30 minutos. El tiempo de retención fue de 19,4 minutos para el estigmasterol y de 22,23 minutos el β-sitosterol.
Actividad antioxidante
Ensayo DPPH
Se utilizó el radical estable DPPH (Brand-Williams et al., 1995; Gómez-Alonso et al., 2003)
7. Se tomó 300 µL de cada fase y se añadió 2700 µL de DPPH de 100 µM, se vorteó durante 1 minuto, luego se centrifugó durante 5 minutos a 3500 rpm; a los 10 minutos se tomaron las lecturas a 515 nm. Los resultados se expresaron en función a Trolox equivalente; el rango de las concentraciones fue de (1, 5, 10 y 15 µmol/L).Ensayo ABTS
Las mediciones del potencial antioxidante total radical-trapping (TRAP), fue desarrollado mediante el ensayo ABAP/ABTS (van Overveld et al., 2000)
8 . Se tomaron 150 µL de cada fase y se añadió 2850 µL de ABTS/ABAP; se vorteó durante 1 minuto, luego se centrifugó durante 5 minutos a 3500 rpm; a los 10 minutos se tomaron las lecturas a 734 nm. Los resultados se expresaron en función a Trolox equivalente; el rango de las concentraciones fue de (1, 4, 7 y 10 µmol/L).RESULTADOS Y DISCUSIÓN
Determinación de compuestos fenólicos por HPLC
Los resultados obtenidos sobre el contenido de compuestos fenólicos en torta de sacha inchi están expresados en la tabla 1. El contenido de compuestos fenólicos muestra cantidades inferiores a la que presenta el aceite de oliva
2 . Los frutos secos como el maní y las semillas oleaginosas son buena fuente de de ácidos fenólicos como el cafeico9 . Estudios realizados por Oliveras2 manifiesta que hasta el momento se han detectado los siguientes compuestos polifenólicos en aceite oliva extra virgen: hidroxitirosol, tirosol, cafeico, vanillina, p-cumárico, luteolina, quercetina y apigenina. Asimismo, Oliveras expresa que estos componentes son los que se encuentran con más frecuencia en el aceite de oliva virgen, tal y como lo reflejan numerosos estudios (Pirisi, 1997; Mateos, 2001; Montedoro, 1993; Brenes, 1999)10-13.
Determinación de fitoesteroles
Identificación de fitoesteroles por TLC
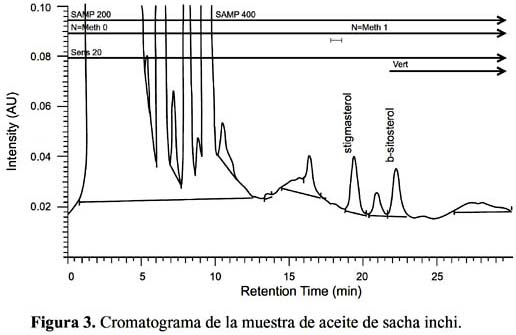
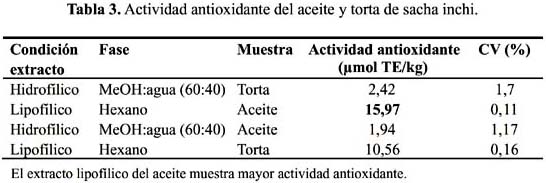
Podemos apreciar la presencia de fitoesteroles ß-sitosterol y stigmasterol siendo los RF muy cercanos de ambos estándares. En la muestra de aceite se observó mayor concentración de ß-sitosterol que en la muestra de torta de sacha inchi.
Cuantificación de fitoesteroles
La tabla 2 nos muestra el contenido de estigmasterol y
β-sitosterol en el aceite de sacha inchi expresados en mg/100 g. Se observa en el cromatograma de la figura 2 la corrida de los estándares estigmasterol y β-sitosterol, y en la figura 3 la corrida correspondiente al aceite de sacha inchi.

En cuanto a fitoesteroles el sacha inchi presenta mayor contenido de
β-sitosterol que otros alimentos como los frejoles 17,1 mg/100g y arvejas 49,5 mg/100 g estudiados por Fierro5 y que otros aceites en el mercado según lo que reporta Aparicio14 .Los límites que establece el reglamento (CEE) Nº 2568/91, modificados en el reglamento (CE) Nº 282/98
6 para aceite de oliva virgen, los niveles de esteroles totales se establece 1000mg/kg, los que pueden presentar los distintos tipos de esteroles: colesterol 0,5 %, brasicasterol 0,1 %, campesterol: 4,0 %, estigmasterol =campesterol, β-sitosterol 93 %, δ-7- estigmastenol: 0,5 %.La presencia de fitoesteroles dentro de la fracción insaponificable y su cantidad, está considerado como uno de los en la calidad del aceite de oliva. Por otro lado, altos niveles de estigmasterol se correlacionan con alta acidez y baja calidad sensorial del aceite (Gutiérrez et al., 1999; Soledad et al., 2001)
15-16.Actividad antioxidante
Ensayo DPPH
El ensayo de la actividad antioxidante por decoloración de radical estable DPPH, los resultados se muestran en la tabla 3, tanto del aceite como de la torta en ambas fases.
Ensayo ABTS
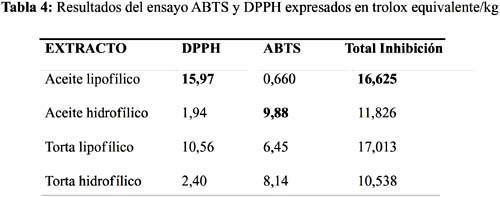
La mayor parte de los métodos de medida de la actividad antioxidante miden solamente compuestos solubles en agua debido a las naturalezas hidrofílicas de las especies reactivas y de los sustratos oxidables que emplean. Algunos ensayos pueden adaptarse para medir antioxidantes lipofílicos como el ABTS; por ese motivo es aconsejable emplear varios métodos, ya que cada uno ofrece información diferente. Hay compuestos antioxidantes que no reaccionan con determinadas especies oxidantes y sí con otras. En la matriz de la semilla sacha inchi encontramos componentes antioxidantes como los compuestos fenólicos, tocoferoles y vitaminas antioxidantes que van a influir en los resultados. La actividad antioxidante en sacha inchi según el método de DPPH muestra mayor actividad en el extracto lipofílico del aceite, mientras ABTS muestra mayor actividad antioxidante en el extracto hidrofílico del aceite (tabla 4); sin embargo, cuando adicionamos ambos métodos el extracto lipofílico del aceite muestra mayor actividad antioxidante; esto se explica porque ambos métodos abarcan también otros componentes antioxidantes que son capaces de reaccionar con cada reactivo diferente en cada método; por lo tanto no necesariamente van a coincidir los métodos aplicados. El método ABTS se adapta más para medir extractos lipofílicos que el DPPH, siendo en ambos especies radicales no biológicas.
CONCLUSIONES
-
La torta de sacha inchi contiene compuestos fenólicos en promedio: 3,51 mg/kg de cafeico, 1,68 mg/kg de ferúlico, 42,93 mg/kg de rutina, 53,24 mg/kg de morina y 28,46 mg/kg de hesperidina.
-
Se detectó en la torta de sacha inchi la presencia de ácido cinámico y siríngico.
-
El aceite de sacha inchi contiene en promedio 75,49 mg/100g de estigmasterol y 74,62 mg/100g de
El extracto lipofílico del aceite mostró mayor actividad antioxidante con el método DPPH, mientras el extracto hidrofílico del aceite mostró mayor actividad con el método ABTS.
AGRADECIMIENTOS
Agradecemos el apoyo recibido por CONCYTEC, a su Presidente Dr. Augusto Mellado Méndez; a la USMP y al Decano de la Facultad de Medicina Humana Dr. Frank Lizaraso Caparó por haber hecho posible la realización de esta investigación.
REFERENCIAS
1. D. Cachique."Estudio de la Biología Floral y Reproductiva en el Cultivo de Sacha inchi (Plukenetia volubilis L.)INIEA-UNSM", tesis para optar el título de Ing. Agrónomo, Universidad Nacional de San Martín-Perú, 70, 2006.
2. M. Oliveras, "Calidad del aceite de Oliva virgen extra antioxidantes y función biológica", tesis para optar el grado de Doctor en Farmacia, Universidad de Granada- España, 104, 2005.
3. Brack, "Diccionario enciclopédico de plantas útiles del Perú. Programa de las Naciones Unidas para el Desarrollo, Centro de Estudios Regionales Andinos Bartolomé de las Casas. Cusco-Perú, 1999, 550.
4. Muñoz, A. Fernández, F. Ramos, C. Alvarado-Ortíz. Rev. Soc. Quím. Perú, 2007; 73(1):30-40.
5. Fierro, Y. Vásquez, M. Reyes-Parada, S. Sepúlveda-Boza. Clínica y Ciencia, 2004; 2(2):43-48.
6. Reglamento Comunidad Económica Europea (CEE) No 2568/91 de la comisión de 11 de julio de 1991.
7. W. Brand-Williams, M. Cuvelier, C. Berset. Food Science and Technology, 1995; 28(1):25 – 30.
8. V. Overveld, G. Haenen, J. Rhemrev, J. Vermeiden, A. Bast.
Chemico-Biological Interactions, 2000; 127(2): 151 – 161.9. J. Sabaté, "Nutrición vegetarina". Editorial Safeliz científica, Madrid-España, 2005, 356-57.
10. F. Pirisi y col. J. Chromatogr A., 1997; 768:207-213.
11. R. Mateos y col. J. Agric.Food.Chem. 2001;49(5)2185-2192.
12. G. Montedoro y col. J. Agric.Food.Chem. 1993; 41:2228-2234
13. M. Brenes, A. García, P. García, J. Ríos, A. Garrido. J.Agric.Food.Chem. 1999; 47:3535-3540.
14. R. Aparicio, L. Roda, M.A. Albi, F.J. Gutierrez.
Journal of Agricultural and Food Chemistry, 1999; 47(10); 4150 – 4155.15. F. Gutiérrez, B. Jiménez, A. Ruíz, and M. Albi. "Effect of Olive Ripeness on the Oxidative Stability of Virgin Olive Oil Extracted from the Varieties Picual and Hojiblanca and on the Different Components Involved".
J. Agric. Food Chem., 1999; 47, 121-127.16. Mª .Soledad. Grasas y Aceites, 2001; 52(1): 52 – 58.




![Efecto de la asistencia del líquido iónico [BMIM][BF4] en la cristalinidad y la morfología de nanoestructuras de Sb2S3 sintetizadas por ultrasonido](/img/es/prev.gif)








