Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.76 no.3 Lima July/Dec. 2010
TRABAJOS ORIGINALES
Cinética de la bioadsorción de iones cadmio (II) y plomo (II) de soluciones acuosas por biomasa residual de café (Coffea arabica L.)
Biosorption kinetic of cadmium (II) and lead (II) ions from aqueous solutions by biomass residual of coffee
Myriam Eugenia Pacheco Tanakaa ; Jorge Paúl Pimentel Frisanchoa ; Wilfredo Fernando Roque Villanuevaa,b
a Facultad de Ingeniería Química Universidad Nacional del Altiplano
b Escuela de Postgrado de la Universidad Nacional de San Agustín de Arequipa. Av. El Ejército 329 Casilla Postal 291 Puno-PERÚ
RESUMEN
La biomasa residual del café, químicamente modificada, fue utilizada para evaluar la adsorción y la cinética de los iones plomo (II) y cadmio (II) de soluciones acuosas a escala de laboratorio en proceso Batch. Experimentalmente se comprueba que el biosorbente preparado tiene preferencia por el ion plomo (II) frente al ion cadmio (II). El proceso de adsorción está representado por el modelo cinético de pseudo primer orden, Elovich y reversible de primer orden.
Palabras clave: Adsorción, equilibrio, cinética, taninos, biosorbente.
ABSTRACT
Residual biomass of the chemically modified coffee was used to evaluate the adsorption and the kinetics of lead (II) and cadmium (II) ions from aqueous solutions scale of laboratory in process batch. Experimentally it is verified that the adsorbent has preference by the lead (II) ion, in front of cadmium (II) ion. The process of adsorption is represented by the kinetic model of pseudo first order and model of Elovich and reversible of first order.
Key words: adsorption, equilibrium, kinetic, tannin, biosorption.
INTRODUCCIÓN
La continua descarga de relaves mineros a fuentes acuíferas es aún un problema de nivel mundial en espera de solución
1 . Diversos metales pesados bajo su forma iónica son descargados a ríos y mares especialmente el cadmio y plomo provenientes de la industria metal-mecánica, curtiembre, fotográfica, de baterías y metalúrgica, sin el debido control ambiental, sobrepasando en muchos casos los valores máximos permisibles por legislaciones internacionales2 . El establecimiento de normas rígidas, así como la conciencia ambiental están apuntando para la necesidad de seguir investigando a fin de encontrar nuevas tecnologías para la remoción de metales tóxicos del ambiente.Las técnicas usadas para eliminar metales tóxicos de aguas residuales de desecho son filtración, electro-deposición, resinas de intercambio iónico, ósmosis, micro-precipitación, etc. Desafortunadamente, dichos métodos no encuentran efectividad ante bajas concentraciones de metales pesados en solución, tornándose altamente costosos y de bajo rendimiento en esas condiciones.
Dentro de este contexto, la biotecnología ha separado dos grandes áreas dentro del mismo objetivo: bioacumulación y biosorción. La primera es considerada como un proceso activo de eliminación de metales mediante mecanismos metabólicos involucrando masa viva, mientras que la biosorción es entendida como un proceso pasivo con mecanismos netamente físico- químicos, por medio de biomasa muerta. Por lo tanto, la biosorción es un área de investigación con muchos aportes a la comunidad industrial, por ser una alternativa técnica y económicamente viable, por su capacidad de depuración y de bajo coste de operación que tiene, y por ser considerada una tecnología "limpia" en la eliminación de metales tóxicos y de alta ley, de soluciones acuosas
3, 4.La capacidad de biosorción de estas biomasas se debe a la potencial cantidad de compuestos orgánicos capaces de secuestrar y/o intercambiar iones metálicos, entre los cuales destacan: taninos, polialginatos, péptidoglucanos, polisacáridos, glicoproteínas, fucanoides, compuestos heterocíclicos, flavonoides
5,6. etc., en los cuales los centros atrayentes de cationes son los grupos funcionales amino, hidroxilo, carboxilato, fosfato, sulfhidrilos, conocidos por su potencial nucleófilo.En los últimos años se ha estudiado diversos tipos de biosorbentes, especialmente algas y residuos agrícolas, analizando su capacidad para retener diversos metales. En el presente trabajo se utilizó como biosorbente, la biomasa residual del café (fruto cereza de café despojado de la pulpa o epicarpio), que es el principal subproducto de la agroindustria cafetera.
La industria cafetalera produce este producto en grandes cantidades y sus costos son muy bajos o nulos; además, genera en ocasiones problemas para su gestión, por lo que su uso como biosorbente de metales pesados se convierte en una alternativa muy deseable y que se convertiría en dar un valor agregado al beneficio del café antes de su eliminación final.
Se sabe que por cada dos toneladas de café verde se produce también una tonelada de biomasa residual de café (en peso seco). A nivel mundial se producen más de 7 000 000 de TM de café por año.7
El presente trabajo pretende obtener en la primera etapa un biosorbente mediante la inmovilización de taninos presentes en la cáscara de café, seguido de la caracterización mediante el estudio IR a fin de determinar los grupos funcionales presentes que puedan participar en la biosorción.
En la segunda etapa se propone evaluar el proceso de la biosorción de iones metálicos Pb (II), y Cd (II) en un sistema mono-metálico, a escala de laboratorio, de soluciones diluidas utilizando este biosorbente, y evaluar también los parámetros: temperatura, granulometría, pH y tiempo de adsorción. Posteriormente y en base a los resultados obtenidos, estudiar la cinética y el equilibrio de biosorción en proceso discontinuo; ensayar modelo predictivos: pseudo-primer orden, pseudo-segundo orden, Elovich, de difusión intrapartícula y de primer orden reversible que ayuden a describir el proceso.
PARTE EXPERIMENTAL
Los trabajos experimentales se han realizado en la ciudad de Puno, a condiciones ambientales de 487 mm de Hg de presión, altitud a 3 832 msnm y una temperatura variable entre 10 y 20 ºC registrados durante la ejecución de las pruebas experimentales.
Sólido sorbente
En todos los experimentos se ha utilizado la biomasa residual del grano de café, el cual ha sido obtenido luego del proceso denominado "beneficio del café" vía húmeda de los productores de café del distrito de San Juan del Oro provincia de Sandia del departamento de Puno.
Para realizar el estudio granulométrico del residuo, se tomaron muestras de 100 gr que previamente han sido secadas, triturada y seleccionadas mediante una tamizadora de alta vibración, malla 30 y tamaño de partículas de 0,50 mm.
Obtención y evaluación del extracto acuoso concentrado (EAC) de la biomasa residual de café
Considerando que la obtención del extracto de tanino es con fines de cuantificación se propone obtenerlo de acuerdo con lo que presentan Waterman-Mole (1994) y González et al. (1989), con respecto a los solventes y condiciones de extracción para compuestos fenólicos; los extractos se obtuvieron a partir de la biomasa residual de café seca y triturada, tamizada a un tamaño de partícula de malla 30 y 60.
Se obtuvieron extractos en etanol acuoso al 50 %. En los extractos etanólicos se utilizaron 10 g de cáscara y 100 ml de etanol al 50 %, se maceraron a temperatura ambiente durante 24 horas y se filtraron sobre papel filtro. A la cáscara remanente se le adicionaron 100 ml de solvente fresco y se repitió el proceso. Los extractos obtenidos de la primera y segunda maceración se combinaron y concentraron a temperatura de 35°C aplicando vacío, obteniendo un extracto acuoso concentrado (EAC), a partir del cual se realizaron los análisis.
Se obtuvo el EAC del material vegetal antes y después de la inmovilización de taninos, y se utilizó como solvente una solución de 1:1 de etanol-agua.
Sustancia de referencia
Como sustancia de referencia se utilizó ácido tánico puro para análisis, de la firma Merck.
Para la medición de la absorbancia se empleó un espectrofotómetro UV-VIS SPECTRONIC GENESYS serie 10.
Método espectrofotométrico para la cuantificación de taninos en el extracto acuoso de la biomasa residual de café
Fundamento
Los taninos vegetales presentes en la corteza de los árboles constituyen una mezcla de grupos fenólicos los mismos que se oxidan por el reactivo Folín-Ciocalteu el cual está formado por mezcla de ácido fosfotúngstico (H
3PW 1 2O 4 0) y ácido fosfomolíbdico (H 3PMo 1 2O 4 0) que se reduce, por acción de fenoles, en una mezcla de óxidos azules de tungsteno (W8 O 2 3) y de molibdeno (Mo 8O 2 3). La coloración azul producida posee una absorción máxima aproximadamente a los 700 nm y es proporcional a las tasa de compuestos fenólicos, obteniéndose con esta determinación el porcentaje de taninos reportado como ácido tánico.Reactivos
Reactivo de Folín-Ciocalteu adquirido de Laboratorios Merck., solución de Carbonato de sodio al 20 %. (p/v), solución standard de 25 ppm de ácido tánico.
Determinación de fenoles en EAC (expresados como ácido tánico)
El análisis de fenoles totales se realizó por el método de Folín-Ciocalteu, de acuerdo con lo establecido por Waterman-Mole (1994) y Scalbert (1992), utilizando ácido tánico como estándar, por lo que los resultados se expresan como porcentaje de ácido tánico en cada extracto.
Este es un método espectrofotométrico que consiste en tomar 2 ml de EAC en un matraz de 25 ml que contenga de 6 a 7 ml de agua desionizada, luego 2 ml del reactivo comercial de Folín- Ciocalteu. Después de 1 min. y antes de 8 min. se agregan 1 ml de Na
2 CO3 al 20%, se afora a 25 ml con agua desionizada, se agita, homogeniza, enrasa y se dejó reposar por 5 min. Leer la absorbancia de dichas soluciones a 700 nm después de transcurridos dos minutos.Curva patrón
Se pesó con precisión 25 mg de ácido tánico, se transfirieron a un matraz aforado de 1000 ml y se completó el volumen con agua destilada, a partir de la cual se realizó una curva de calibración con las siguientes concentraciones: 0, 4, 7, 10, 13, y 16 mg/L.
-
Especificidad
Repetibilidad: Se repitió el método espectrofotométrico descrito anteriormente, tres veces para cada muestra, el mismo día y con el mismo equipo. Reproducibilidad Linealidad
Obtención del adsorbente
Inmovilización de taninos (medio ácido)
Pesar 10 gramos de la biomasa residual de café, con tamaño de partícula seleccionado con malla 30 y 60, previamente secada en la estufa durante un tiempo de 4-6 horas y a una temperatura de 98-110 °C. Verter la muestra en un balón de 500 mL que contenga 1,5 mL de formaldehído 200 mL de agua destilada y 0,2 mL de HCl concentrado a una temperatura constante de 60-80°C. Calentar la mezcla reaccionante durante un tiempo de 30-45 minutos y después agitar (a una velocidad de agitación entre 45 y 70 rpm) durante un tiempo entre 20 y 35 min. Pasado este tiempo filtrar el material obtenido y el residuo sólido lavar con suficiente cantidad de agua destilada. Secar el producto durante un período entre 3 y 5 horas a una temperatura entre 100 y 105°C. Se obtendrá de esta forma el adsorbente.
Análisis químico.
La caracterización química consiste en la determinación de los grupos funcionales activos del adsorbente (cáscara de café), se realizaron en la Universidad de Surrey de Inglaterra en un espectrofotómetro de Infra Rojo, Modelo Spectrum 4500, utilizando como diluyente de la muestra yoduro de potasio.
Preparación de la solución patrón de metales (plomo y cadmio)
Se preparó soluciones estándar con una concentración de 1000 ppm de Pb (II) y Cd (II) respectivamente a partir de la sal nitrato (Aldrich grado analítico).
Estudio de la adsorción en batch
Los factores que afectan la capacidad del adsorbente fueron examinados en un sistema batch. Las soluciones del ion metálico fueron preparadas diluyendo la solución stock de 1000 ppm. Para la ejecución de los experimentos en proceso discontinuo se ha evaluado metal por metal Pb (II) y Cd (II), y se ha contado con una instalación consistente en un baño termostatizado, un agitador magnético, (todos los experimentos fueron realizados pesando exactamente 1 gramo de adsorbente y disolviéndolos en 50 ml de una disolución de Pb y Cd a una concentración de 150 ppm, y luego se ajustó el pH al valor deseado).
Una vez transcurrido el tiempo de operación (240 minutos), se extrae del reactor la fase líquida se centrifuga y se filtra la disolución sobrenadante, desechándose el biosorbente.
Finalmente, se analiza la fase líquida, junto con una muestra de disolución original, para determinar la concentración inicial y final del catión metálico, y por lo tanto, obtener el porcentaje del mismo que ha sido retirado por el biosorbente estudiado.
La evaluación de la capacidad de adsorción por el adsorbente hacia los cationes de Pb, se evaluaron por lotes analizando la concentración del Pb antes y después del equilibrio mediante titulación complexométrica con EDTA y mediante absorción atómica en un equipo modelo 3100 de Perkin Elmer de la Universidad de ORURO (Bolivia), dotado de un cátodo hueco mono cátodo con una llama aire-acetileno, recomendada para ambos cationes.
Se han utilizado soluciones estándar para que la concentración quede dentro del rango lineal del espectrofotómetro. Todas las mediciones se realizan por triplicado obteniéndose un valor promedio.
RESULTADOS Y DISCUSIÓN
Caracterización del bioadsorbente
Pagnanelli, Bressani, determinaron el porcentaje de taninos (polifenoles) 2,90 % (base seca)
6,8:Cuantificación de taninos
El primer parámetro evaluado fue la linealidad de la curva de calibración del ácido tánico; esta curva de calibración, en el rango de las concentraciones estudiadas, corresponde a la línea recta de ecuación: Y= 0,1372X – 0,1556, (con un coeficiente de correlación de 0,9963.)
La muestra estudiada tuvo una absorbancia de 0,242 lo cual representa un % de taninos de 2,23 de acuerdo a la curva de calibración que se realizó; luego de inmovilizar el tanino se midió la absorbancia obteniendo 0,085 lo cual representa un porcentaje de taninos de 0,82; obteniendo un rendimiento en la inmovilización de 63,23 %
Los taninos disminuyen en el extracto luego de una reacción de polimerización por condensación del biosorbente, esto determina que la diferencia corresponde a la cantidad de taninos que ha sido inmovilizado retenido por el adsorbente.
Estudio infrarrojo del bioadsorbente
Para evaluar el efecto de la retención de los cationes Pb y Cd sobre la posición e intensidad de vibración, se han determinado los espectros IR mostrados en las figuras 1 y 2; con objeto de compararlos se han incluido el espectro IR del biosorbente antes de su uso, a fin de observar cómo varia la transmitancia; para ello se han elegido las condiciones de operación, concentración inicial de Pb (II) y Cd (II), tiempo, temperatura, pH y granulometría.
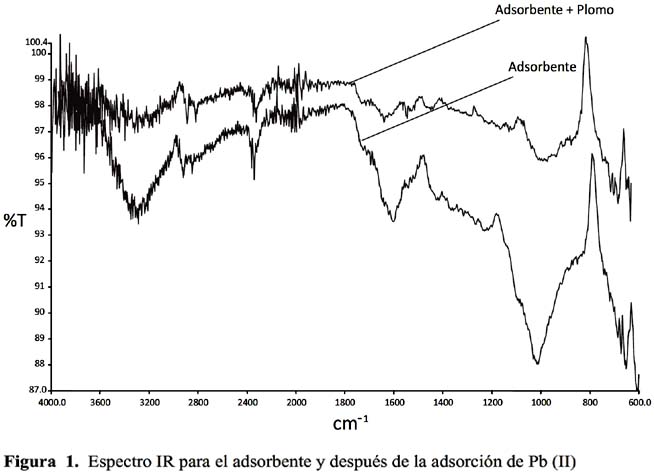
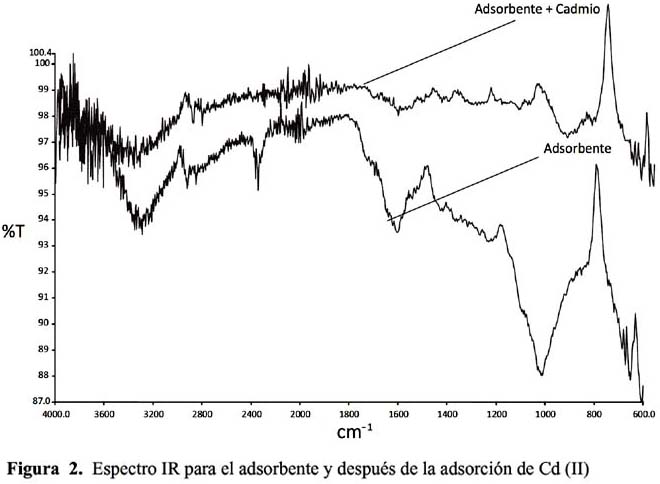
De los espectros se recogen los picos más significativos junto con la intensidad y posición; se muestran las principales diferencias encontradas en las bandas de vibración antes y después del proceso de biosorción.
En bibliografía se encuentran numerosas referencias que indican la importante participación de estos picos hacia 3200 cm
-1en la retirada del plomo y cadmio que es atribuido al O-H de los grupos carboxilo.Asimismo, se observa una banda variada e intensa centrada alrededor de 1605,95 cm
-1 que correspondería a los grupos carbonilo presentes y al doble enlace C=C aromático; la presencia de polímeros orgánicos presentes en la cáscara del café se atribuye una alta capacidad de adsorción, la que se debe a que es un sorbente rico en grupos funcionales superficiales con sitios negativos, destacándose vibraciones de alargamiento O-H alcohólicos o fenólicos, vibraciones del C=O de cetonas, ésteres, quinonas o ácidos carboxílicos, se confirma la presencia del grupo carboxilo, por la banda de absorción intensa y bastante amplia centrada en 3288,05 cm-1 y que correspondería al alargamiento O-H. Las bandas de alargamiento C-H más débiles se encuentran superpuestas sobre la banda de O-H al igual que las otras bandas de O-H fenólico y vibraciones de aromáticos CH que en parte son muy similares para los dos cationes, confirmándose la presencia de grupos carboxilos fundamentalmente y por la variación del pH durante la biosorción, siendo mayor para el Pb que el Cd lo que parece indicar que la biosorción del Pb (II) y Cd (II) puede llevarse a través de un proceso de intercambio iónico. También puede observase una menor intensidad en las bandas de vibración para el Cd que el Pb lo que parece estar de acuerdo con la menor retención del Cd que el Pb con este biosorbente.Cinética de adsorción
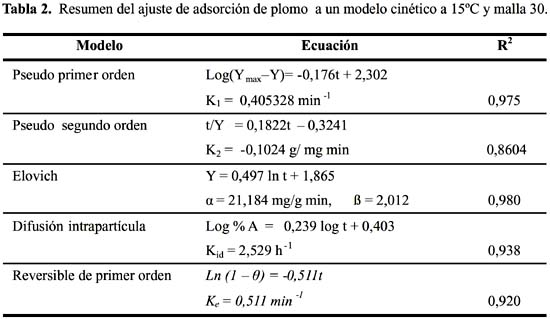
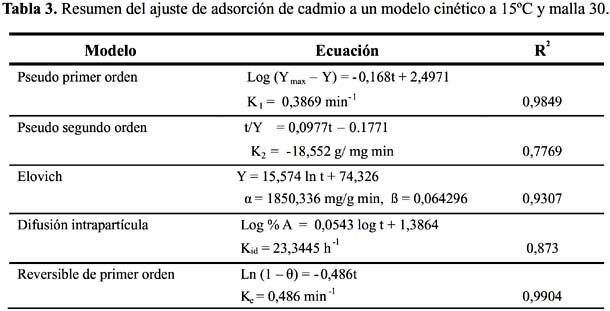
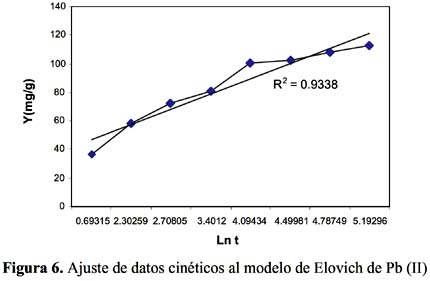
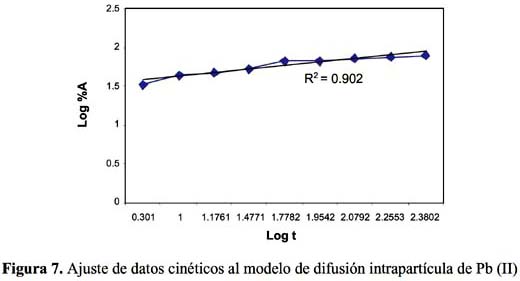
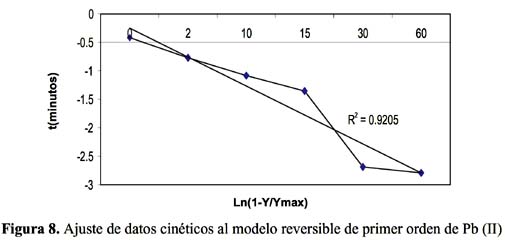
Para estudiar la cinética de adsorción del Pb (II) y Cd (II) se han seleccionado 5 modelos propuestos en la bibliografía
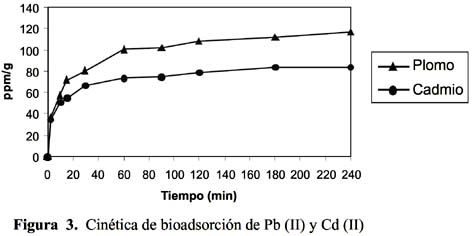
9, 10: modelo cinético de pseudo primer y segundo orden, Elovich, difusión intrapartícula y primer orden reversible; para el ajuste de los resultados experimentales se ha analizado la variación de pH durante el tiempo de contacto del metal y el solido adsorbente; se ha controlado la temperatura a 15 ºC velocidad del proceso y tamaño de partícula malla 30. En la figura 3 se muestra la cinética para el Pb (II) y Cd (II).
Influencia del pH
El pH de la solución es una de las variables más importantes en el control del proceso de biosorción de metales pesados y puede influir en sus formas iónicas que se encuentran en disolución como el estado de los grupos funcionales responsables de la unión del metal a la superficie del solido; a bajos valores de pH, los iones H
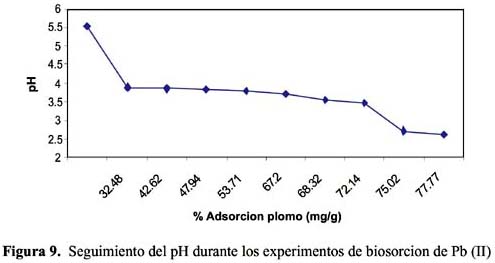
+ se unen a grupos funcionales que quedan cargados positivamente e impiden, por tanto, la unión de los cationes metálicos por la competencia que existe entre ambos iones (Yetis 11 et al. 2000).Se observa una importante influencia del pH en relación a la concentración de los iones en solución ya que en rango de 5 y 3,5 existe la mayor retención Pb y Cd (116-85 ppm) mientras que a partir de 3,5 la concentración de los iones Pb y Cd es mínima, esto significa que existe un efecto de intercambio iónico; habría que trabajar con una mayor cantidad de biosorbente por la saturación de los sitios en este rango de pH.
Tiempo máximo de adsorción
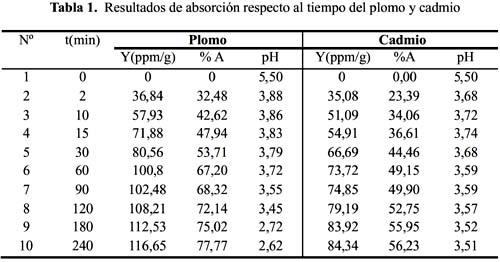
Los resultados de la máxima adsorción con respecto al tiempo se muestran en la tabla 1 y los resultados se interpretan y se discuten por separado catión por catión en la siguiente sección. Para la determinación del tiempo máximo de adsorción de Pb (II) y Cd (II), y nitrato como anión, se realizó en un prueba por lotes; en esta prueba se utilizó una concentración inicial uniforme de Pb igual a 150 ppm. Se presentan los siguientes resultados para el Pb y Cd a 15 ºC y tamaño de partícula malla 30.
Representación de cinéticas de adsorción mediante los Modelos Cinéticos
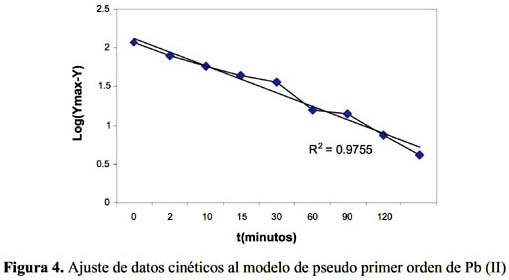
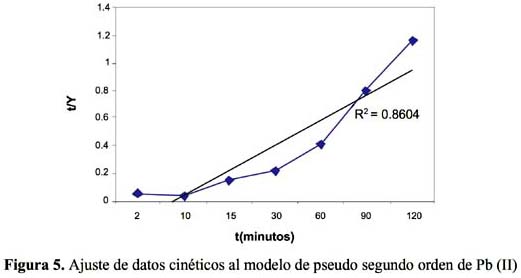
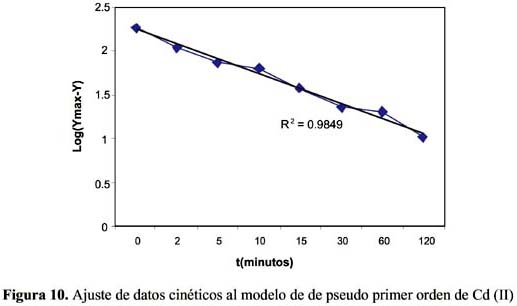
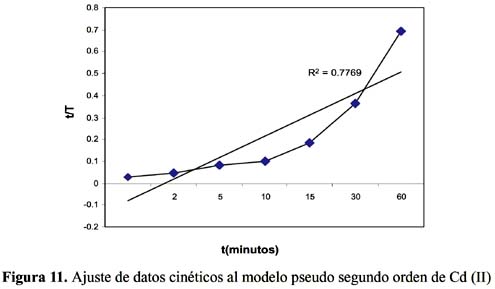
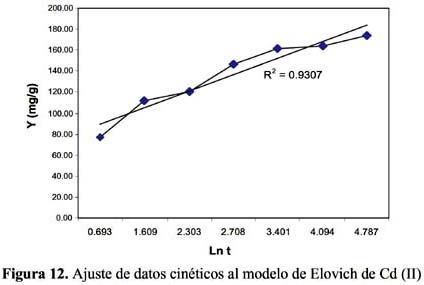
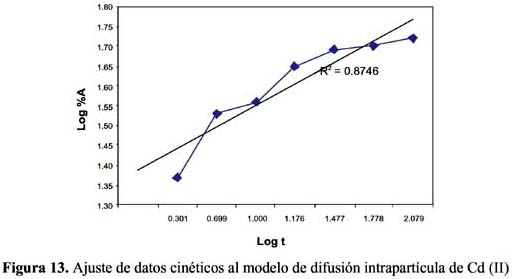
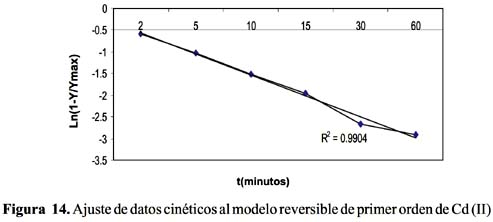
La cinética de adsorción del Pb (II) y Cd (II) fue analizada usando los modelos cinéticos de pseudo primer y segundo orden, Elovich, difusión intraparticula y primer orden reversible; el ajuste de los datos experimentales para el Pb se puede observar en las figuras 4 a 8 y para el Cd en las figuras 10 a 14.
Los resultados experimentales ajustados demuestran que los modelos de pseudo primer orden y Elovich son los que mejor reproducen los valores obtenidos y explican al 97,5 y 98 % de incertidumbre, (se muestra un resumen en la tabla 2). La retención de Pb (II) aumenta a medida que pasa el tiempo; sin embargo disminuye al alcanzar el equilibrio. Para analizar el mecanismo probable de interacción entre el sólido y adsorbente se ha medido la variación de pH en el tiempo. Los valores de pH en los primeros minutos descienden rápidamente hasta alcanzar un valor de 2,62 y es el punto donde se consigue la máxima adsorción 77,77% (figura 9).
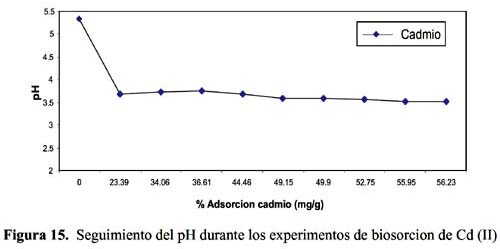
Los resultados experimentales ajustados demuestran que para el catión Cd (II) los modelos pseudo primer orden, Elovich y reversible de primer orden son los que mejor reproducen los valores obtenidos y explican al 98, 93 y 99 % de incertidumbre, (se muestra un resumen en la tabla 3). La retención de Cd (II) es menor que la obtenida con el Pb (II) en este caso también ocurre un proceso reversible lo que puede estar relacionado a que el Cd (II) tendría menor afinidad hacia el sólido adsorbente y que la interacción sólido-metal es más débil. El pH de la solución de Cd (II) disminuyó de 5,5 a 3,51 que explicaría una menor retención de este metal por el adsorbente. Los valores de pH en los primeros minutos descienden rápidamente hasta alcanzar un valor de 3,51 y es el punto donde se consigue la máxima adsorción 56,23% (figura15).
El hecho que en medios ácidos disminuya el porcentaje del metal atrapado, podría ser el resultado de la competencia que existe entre los protones H
+ y iones Pb (II) y Cd (II) por los lugares de sorcion con una aparente predomino de los protones de hidrógeno, lo que limita la aproximación de los cationes del metal como consecuencia de las fuerzas de repulsión. A medida que se aumenta el pH del medio; por una parte este efecto de competencia disminuye, y por otra parte la solubilidad del Pb (II) y Cd (II) también disminuye favoreciendo la formación de hidróxidos del metal correspondiente.
CONCLUSIONES
-
La biomasa residual del café previamente modificada resulto ser efectiva en la remoción de iones Cd (II) y Pb (II).
-
Los espectros infrarrojos del adsorbente analizados muestran una naturaleza altamente compleja debido a la gran cantidad de grupos funcionales superficiales presentes. Los espectros IR de los sólidos después de la biosorción de Pb y Cd demuestran que las bandas de vibración son inferiores para el Cd que para el Pb lo que parece estar de acuerdo a la menor retención de este metal por el adsorbente.
-
El tiempo necesario para alcanzar el equilibrio indica que la retención del Pb y Cd se produce en forma rápida en los primeros 30 minutos y alcanzando el equilibrio cerca a los 90 minutos siendo menor en el Cd que en el Pb; esto sugiere que probablemente existe unión entre el ion y los sitios activos y que tiene lugar preferentemente en la superficie del sólido; además, tiene poca importancia la difusión al interior de la partícula. De otro lado, la mayoría de estudios de bioadsorción muestran que los grupos funcionales presentan mayor afinidad por los iones con mayor radio iónico e índice covalente, que es justamente mayor para el Pb que para el Cd.
-
Para el Pb se observo una absorción eficiente entre una concentración de 0 a 100 ppm/g, en un tiempo aprox. de 1 hora.
-
Para el Cd se observó una absorción eficiente entre las 0 a 68 ppm/g, en un tiempo aprox. de 30 minutos.
-
Los modelos cinéticos de pseudo primer orden y Elovich son los que mejor reproducen la cinética de la adsorción para el ion Pb (II). Para el ion Cd (II) los modelos de pseudo primer orden, Elovich y reversible de primer orden a las condiciones experimentales de estudio.
AGRADECIMIENTOS
A la Universidad de Surrey, Inglaterra y Universidad de Oruro, Bolivia, por el apoyo en la parte experimental de este trabajo.
BIBLIOGRAFÍA
1. Viera, R; Volesky, B.; Biosoption: a solution to pollution. International Microbiology, 3 (2003), page. 17-24.
2. J. Ubio, I. Schneider, W. Aliaga, Proc III Int. Conf. on Cleaning Tech. for the Mining Ind., (85-98, 1996).
3. S.R. Shukla, R.S. Pai, Sep. Pure. Technology. 43, (1-8), 2005.
4. M.N. Pradad, H. Freitas, Environment Pollution., 110, (277-83), 2000.
5. Z. Lin, J. Wu, R. Xue, Y. Yang., Spectrochemical Act, A61, (761-5), 2005.
6. F. Pagnanelli, A. Esposito, F. Veglio., Water Researchh s., 36, (4095-4105), 2002.
7. Cámara de negocios, Colombia www.portafolio.com.co/negocios/agronegocios/2008-08-11
8. Bressani R., Estrada V., Jarquin E. Pulpa y pergamino de café: I. Composición química y contenido de aminoácidos de la proteína de la pulpa. Asociación Latinoamericana de Producción Animal, Alpa. Bogotá. Colombia. Turrialba. 22. 3. Jul.-sept. 1972.
26-30 abr. 1971. 299-304.9. King P.; Rakesh, N.; Beenalahari, S.; Removal of lead from aqueous solution using Syzygium cumini L.; Equilibrium and kinetic studies, Journal of Hazardous Materials, 142 (1-2), 340-347 (1007).
10. Dabrowski A., Hubicki Z., Podkoscienly P. Robens E. 2004 "Selective Removal of the Heavy Metal Ions From Waters and Industrial Wastewaters by Ion-Exchange Method", Chemosphere, 56, 91.













