Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.76 no.4 Lima Oct./Dec. 2010
TRABAJOS ORIGINALES
Síntesis y caracterización de quitosano cuaternario nativo y reticulado en polvo para su aplicación en la adsorción de aniones metálicos
Synthesis and characterization of powdered native and cross-linked cuaternary chitosan for their application on adsorption of anionic metals
Abel E. Navarro
1* ; Ángela Manrique2 ; Ernesto Iparraguirre2 ; Carlos Díaz3 ; Christian Jacinto3 ; Norma Cuizano2 ; Bertha P. Llanos21 Graduate School of Arts and Science, Department of Chemistry, New York, University, New York, 10003, NY, US.
2 Departamento de Química, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia, Lima, L31, Perú.
3 Laboratorio de Química Analítica e Instrumental, Facultad de Ciencias, Universidad Nacional de Ingeniería, Lima, L31, Perú.
*aen234@nyu.edu
RESUMEN
La adsorción de aniones metálicos siempre ha constituido un problema en biosorción, debido a la escasez de adsorbentes cargados positivamente que permitan una adecuada interacción. La presente investigación tiene como objetivo presentar una nueva versión de adsorbentes mediante la modificación química de quitosano. Se han combinado dos reacciones para este fin: la cuaternarización mediante reacción con glicidiltrimetilamonio (QC1) y la cuaternarización acoplada a la reticulación con glutaraldehído (QC2). Se caracterizaron ambos adsorbentes mediante técnicas espectroscópicas, análisis termogravimétrico, superficie específica, microscopía de barrido electrónico y conductometría. La presente investigación fue completada con la evaluación de estos adsorbentes para la adsorción de iones oro y cromo. Los resultados son muy prometedores, sobre todo con oro, alcanzando una capacidad de adsorción de 45 mg de Au/g de adsorbente. El uso de estos adsorbentes constituyen una promesa en el área de la biosorción para la remoción de aniones de interés industrial y ambiental.
Palabras clave: quitosano cuaternario, glicidiltrimetilamonio, biosorción, reticulación, pH
.
ABSTRACT
The adsorption of anionic metals has always been a problem in biosorption, due to the lack of positively charged adsorbents that allow an efficient interaction. This research proposes a new batch of adsorbents by chemical modification of chitosan. Two reactions were combined to achieve this goal: quaternarization by the reaction with glycidyltrimethylammonium (QC1) and the quaternarization coupled with the cross-linkage with glutaraldehyde (QC2). Both adsorbents were characterized by spectroscopic techniques, thermogravimetric analysis, specific surface determination, scanning electron microscopy and conductometry. This investigation was completed with the evaluation of these adsorbents for the adsorption of gold and chromium ions. The results are very promising, more with gold, achieving an adsorption capacity of 45mg Au/g of adsorbent. The use of these adsorbents constitutes a promise in the biosorption area for the removal of anions of industrial and environmental interest.
Key words: quaternary chitosan, glycidyltrimethylammonium, biosorption, cross- linkage, pH.
INTRODUCCIÓN
Quitosano es, después de la celulosa, el más abundante de los biopolímeros en la naturaleza. Además, es considerado uno de los más versátiles y ampliamente usado polisacáridos en la industria de cosméticos, farmacéutica, química de polímeros, vinícola, cervecera y medicina. Su versatilidad ha trascendido estas áreas y ha incursionado en la biotecnología de remediación de metales pesados y otros contaminantes mediante la adsorción. La afinidad de quitosano hacia metales pesados, es una de las estables y ventajosas en el área de biosorción, siendo igualada sólo por los alginatos presentes en las algas pardas1. Por definición, el quitosano es un polímero de cadena lineal formado por monómeros de D-glucosamina, enlazado mediante enlaces glicosídicos de tipo β (1→4). El quitosano es un compuesto insoluble en agua, pero soluble en medio ácido. Se obtiene del biopolímero quitina, mediante procesos secuenciales de desmineralización, desproteinización y desacetilación. La quitina nativa es obtenida, principalmente, por separación directa del caparazón de crustáceos marinos. Quitosano es caracterizado por su alto contenido de nitrógeno, presente en la forma de grupos amino que son responsables de la interacción con iones metálicos mediante mecanismos de quelación2, 3. Sin embargo, debido a su constante de acidez, que oscila entre 6,2 y 7,0 (dependiendo en el grado desacetilación), está protonado en soluciones ácidas. Esto lo convierte en un poderoso adsorbente de iones negativamente cargados en solución a valores de pH menor que 6, mediante mecanismo de intercambio aniónico. Por otro lado, glutaraldehído es frecuentemente usado para entrelazar cadenas de quitosano y estabilizarlo en soluciones ácidas. Esta reacción ocurre por medio de una reacción de base de Schiff entre los grupos aldehído del entrecruzante (glutaraldehído) y algunos grupos amino del quitosano. La modificación química puede ser usada para incrementar la eficiencia de adsorción y también para mejorar la selectividad de adsorción4.
Desafortunadamente, el uso de quitosano en la adsorción de metales pesados tiene dos desventajas que han sido ampliamente discutidas. Primero es su inestabilidad en medios ácidos; dado que la mayoría de relaves mineros y aguas residuales también presentan una alta acidez, el uso de quitosano se vería disminuido. La acidez disuelve el polímero y hace imposible su separación de la solución. Segundo, el grupo amino del quitosano tiene una constante de acidez muy cercana a 7 (neutra), esto conlleva a que ligeros cambios en pH en aguas residuales tratadas o superficiales, produzca ionización en el quitosano. Por ejemplo, a pH menores que 6, la adsorción de cationes es grandemente disminuida, mientras que a valores de pH mayores que 7, la adsorción de aniones es casi nula. En otras palabras, la selectividad del quitosano varía con el pH de la solución2,5.
El desarrollo y diseño de nuevos adsorbente es una constante preocupación de la biosorción, la cual, como área de la biotecnología ambiental, tiene como objetivo la eliminación de contaminantes orgánicos e inorgánicos. Los avances de la biosorción incluyen la eliminación de plomo, cadmio, y demás metales pesados así como de derivados fenólicos y colorantes artificiales mediante adsorbentes provenientes de materia biológica, como hongos, algas, quitosano, cáscaras de huevo, entre otras. La ventaja de estos adsorbentes biológicos reside en su bajo costo y fácil manejo, por considerarse materia de desecho, en comparación de las técnicas convencionales de carbón activado y resinas de intercambio iónico. Existen otras técnicas de separación de contaminantes, como la filtración, floculación, electrodeposición y precipitación; sin embargo, estas metodologías generan lodos residuales y tortas de filtración, cuyo tratamiento y disposición constituyen un gasto extra en el proceso de purificación5,6.
En el presente trabajo, mediante una reacción SN2 entre el grupo amino y cloruro de glicidiltrimetilamonio, se consigue cuaternarizar el grupo amino del quitosano y evitar el problema de la ionización del grupo amino con el pH7,8. Las propiedades mecánicas del quitosano cuaternario también son reforzadas mediante reticulación con glutaraldehído para comprobar la afinidad de ambas modificaciones químicas, así como encontrar la proporción adecuada de cuaternizante y reticulante que brinde la permanente carga negativa en el grupo amonio (NR +) y estabilidad mecánica y térmica, respectivamente. Se caracterizó los adsorbentes obtenidos mediante técnicas espectroscópicas, térmicas y conductométricas. Finalmente, se evaluó la eficiencia de los adsorbentes producidos frente a los iones oro (III) y cromo (VI) como aniones metálicos (precioso y tóxico, respectivamente) de importancia en la industria y la salud.
PARTE EXPERIMENTAL
Materiales y reactivos
Los reactivos usados en la investigación fueron adquiridos en grado reactivo o analítico, dependiendo de su aplicación. Quitosano (grado de desacetilación 90%) fue adquirido de Spectrum Chemicals. Cloruro de glicidiltrimetilamonio al 90% fue proveído por Fluka Analytical. Las soluciones estándar de oro y cromo fueron adquiridas de Aldrich Chemistry. Los demás reactivos y solventes provinieron de Merck. Las soluciones acuosas de los metales pesados fueron preparadas por dilución a partir de una solución stock de 1000 ppm de oro y cadmio. Las soluciones stock fueron preparadas con agua desionizada, purificada por ósmosis reversa mediante un purificador Barnstead/Thermolyne (Dubuque IA) D2714, el cual provee agua con una máxima conductividad de 18 mΩ.
Preparación de los adsorbentes
Se sintetizó quitosano cuaternario mediante una reacción de substitución nucleofílica bimolecular (SN2) entre el grupo amino del quitosano (-NH2) y el epóxido del cloruro de glicidiltrimetilamonio (figura 1).
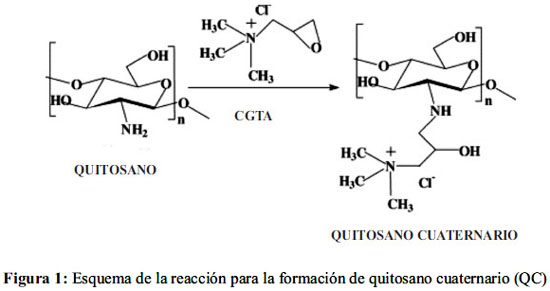
Quitosano cuaternario en polvo (QC1) fue preparado de la forma siguiente. Se pesó una cantidad de quitosano y se dispersó en un volumen de agua bajo agitación magnética. Luego, se agregó una cantidad estequiométrica en exceso de cloruro de glicidiltrimetilamonio (CGTA) y se dejó reaccionar durante 24 horas a 50°C bajo agitación. Al término de la reacción se precipitó el producto con acetona; luego se filtró, enjuagó con acetona y se secó en la estufa a no más de 60°C para evitar descomposición orgánica9,10.
Luego se procedió a reducir el tamaño de partícula mediante un molino y separar las partículas por tamaño mediante tamices. Este procedimiento fue repetido con diferentes cantidades estequiométricas de CGTA, hasta obtener el quitosano cuaternario óptimo con la máxima cuaternarización y que a la vez permitiera una reticulación eficiente para la síntesis del próximo adsorbente.
El quitosano cuaternario entrecruzado (QC2) fue preparado con el siguiente método. Se pesó 10g de QC1 y se suspendió en 200mL de etanol. Luego se añadió 10mL de una solución al 25% w/v de glutaraldehído. La mezcla resultante se agitó durante 24 horas a temperatura ambiente.
Al finalizar la reacción, se filtró, se enjuagó con etanol y se secó a 50°C. Finalmente, se molió y se separó las partículas por tamizado, del mismo modo que con QC1.
Ambos adsorbentes fueron colocados en viales de vidrio y almacenados hasta su uso en los estudios de caracterización y adsorción.
Caracterización de los adsorbentes
La cantidad de grupos amonio fue determinada por conductometría. Se suspendió 0,1g del adsorbente modificado en 200mL de agua desionizada y se tituló con una solución estandarizada de 0,01N de AgNO 3. Dado que cada grupo amonio está unido a un ion cloruro, la cantidad de grupos –NR + fue determinada indirectamente mediante precipitación de los iones 4 cloruro con iones plata. La modificación química del quitosano fue también monitoreada mediante espectroscopía infrarroja con transformada de Fouier (FTIR). Los análisis fueron realizados en un espectrofotómetro Nicolet, modelo IMPACT 410 para los adsorbentes Q, QC1 y QC2.
La estabilidad física y mecánica, así como la presencia de impurezas volátiles en los adsorbentes, fueron estudiadas mediante análisis termogravimétrico. El método consiste en el registro de pérdida de peso de la muestra. Se utilizó un equipo Linseis STA 1600 con un incremento paulatino de temperatura a razón de 5°C/min alcanzando un máximo de 550°C.
Un microscopio de barrido electrónico PHILIPS ESEM, XL-30 TMP fue utilizado para elucidar la textura superficial y la morfología de los adsorbentes obtenidos. Asimismo, la superficie específica de los adsorbentes fue determinada mediante el método del azul de metileno.
Experimentos de adsorción de cromo y oro
Se llevó a cabo experimentos de adsorción discontinuos a temperatura ambiente y a diferentes valores de pH iniciales de las soluciones. Se mezcló 50mL de soluciones de oro (10ppm) y cromo (50ppm) con 50 mg de cada adsorbente bajo agitación orbital durante 18h. El tiempo de equilibrio para la adsorción fue determinado mediante pruebas preliminares. Al término de ese periodo, las muestras fueron filtradas y la solución sobrenadante fue analizada mediante absorcion atómica a la llama (Perkin Elmer 100) para determinar la concentración de metal remanente en la solución al equilibrio. Los resultados fueron expresados en función de la capacidad de adsorción (q) en miligramos del metal por gramo de adsorbente.
RESULTADOS Y DISCUSIÓN
Preparación de los adsorbentes
La reacción de síntesis fue directa y con muy pocas reacciones secundarias. Dado que estudios futuros incluyen la generación de perlas de quitosano cuaternario, se evaluó la relación estequiométrica de CGTA y quitosano que permita la solubilización del QC en ácido acético. Como es de esperarse, la reducción de grupos amino libres reduce la solubilidad del quitosano en soluciones ácidas e imposibilita la formación de perlas de gel. Por lo tanto, nuestra metodología permitió determinar la máxima cantidad de grupos amino cuaternarios que se pueden insertar, sin reducir sustancialmente la solubilidad a bajos valores de pH para la formación de perlas porosas que maximicen la difusión intraparticular y el acceso a centros de adsorción en el interior del adsorbente.
Caracterización de los adsorbentes
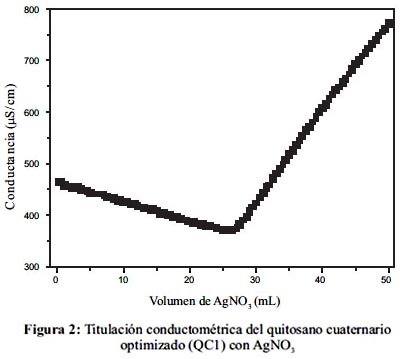
El grado de cuaternarización fue medido por titulación conductométrica con una solución 0,01N de AgNO3 con el adsorbente obtenido con la óptima relación estequiométrica de CGTA: quitosano, como se explicó en la sección anterior. La figura 2 muestra la titulación conductométrica del adsorbente optimizado con AgNO3. De los resultados se concluye que el adsorbente posee una concentración de 2,6 mmol de grupos amonio por gramo de adsorbente. Estos resultados están en completo acuerdo con Spinelli et al.10, que obtuvieron un grado de cuaternarización de 2,9 mmol/g. La diferencia es atribuida al hecho que nuestro adsorbente ha sido diseñado con miras a la producción de perlas de gel. Esto obliga a una menor cuaternarización para hacer efectiva la disolución del adsorbente para la formación de perlas. Debido a que el adsorbente QC2 fue obtenido por entrecruzamiento de QC1 con glutaraldehído, se asumió que la concentración de grupos NR4+ no fue afectado, dado a que no participa en dicha reacción.
Ambos adsorbentes también fueron analizados mediante espectroscopía FTIR. La tabla 1 resume los grupos funcionales observados tanto en el quitosano nativo como en los adsorbentes preparados. Los picos característicos de quitosano fueron identificados7,8 en todas las muestras a 3455, 1093, y 661 cm-1. Desafortunadamente, FTIR no confirma la presencia de grupos amino cuaternarios, debido a que sus enlaces tipo C-N no son visibles mediante FTIR. Sin embargo, se puede apreciar otros cambios en las muestras. Por ejemplo, picos característicos de alcanos (2937 y 1460cm-1), se hicieron más claros e intensos, debido a la existencia de grupos metilos de la amina cuaternaria. Además, en comparación con Q, QC1 y QC2 mostraron una reducción en la banda a 1599cm-1, que se ha atribuido como pico característico de aminas primarias debido a la vibración de deformación de enlaces N-H11. Por otro lado, para QC2 se muestran los mismos cambios en la concentración de metilos y metilenos, pero también se percibe la presencia de un nuevo grupo a 1650cm-1, atribuido a grupos imino (base de Schiff), los cuales son producto de la reacción de grupos amino libres con glutaraldehído. Finalmente, ninguno de los tres quitosanos mostraron cambios en el pico correspondiente al grupo O-H (1152 y 1030 cm-1), demostrando que la reacción química no alteró los hidroxilos, sino únicamente a los grupos amino.

Las propiedades de superficie de los adsorbentes producidos fueron evaluadas mediante microscopía de barrido electrónico (SEM), mientras que la superficie específica fue determinada mediante la técnica de azul de metileno (MB). La superficie de QC1 fue de 694,4m2 /kg, mientras que la de QC2, fue de 1036 m2 /kg. De acuerdo a estos resultados, se espera una mayor adsorción de QC2 frente a QC1. Una explicación a esta diferencia en superficies específicas, podría deberse a que el entrecruzamiento de cadenas mediante glutaraldehído, organiza las cadenas de quitosano, de tal manera que se forma una red tridimensional organizada y eficiente. Por otro lado, en el quitosano cuaternario sin modificar, las cadenas de quitosano se asocian al azar, ocultando centros de adsorción, y por ende reduciendo su superficie específica.
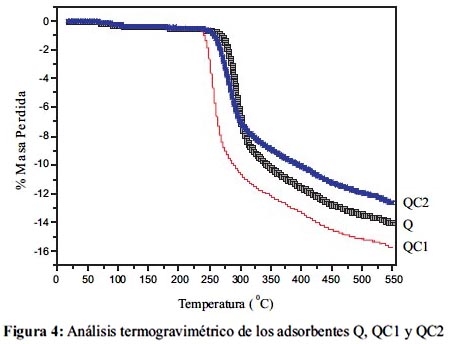
La figura 3 muestra las microscopías de los 3 adsorbentes. Las imágenes muestran una distribución de partículas poco homogéneas para el quitosano y el quitosano cuaternario QC1; esto se debe a las diversas ramificaciones propias de un polisacárido como el quitosano. Por otro lado, el quitosano cuaternario reticulado muestra una imagen muy diferente a las predecesoras; QC2 muestra una superficie más homogénea; las partículas están asociadas de manera más organizada en tamaño y en distribución. Esto se debe a que las cadenas de quitosano han formado una red polimérica donde el glutaraldehído actúa como espaciador entre las cadenas, permitiendo una eficiente organización de las cadenas de N-glucosamina cuaternaria. Finalmente, los adsorbentes Q, QC1 y QC2, también fueron caracterizados mediante análisis termogravimétrico para determinar su estabilidad térmica, en relación al quitosano nativo12-14.

Como se muestra en la figura 4, el quitosano nativo, Q, resultó ser el adsorbente más estable, térmicamente hablando, con un Tm de alrededor de 300°C, seguido por QC2, con un Tm aproximadamente de 295°C y finalmente, seguidos por QC1 con un Tm de 250°C. Los resultados concuerdan con las predicciones de estabilidad de acuerdo a la estructura. Se predijo que quitosano presente el mayor Tm debido a la presencia de grupos aminos libres que forman puentes de hidrógeno entre las cadenas de quitosano; esto le da una mayor rigidez a los polímeros, mediante un entrecruzamiento natural de las cadenas. En el caso de QC1, el Tm disminuye, porque los grupos amino han sido convertidos en grupos amino cuaternario, y si bien poseen una carga electrostática positiva permanente; esa carga no es utilizada en la formación de interacciones con las otras cadenas; por el contrario, el quitosano pierde la habilidad de formar puentes de hidrógeno y su Tm se ve afectado hasta en 50°C, comparado con el quitosano nativo. Por el contrario, QC2, muestra una estabilidad térmica comparable al quitosano nativo; esto se debe al entrecruzamiento de las cadenas de quitosano mediante glutaraldehído12,13. Si bien, muchos grupos amino se han sacrificado para la formación de amina cuaternaria, los pocos grupos amino restantes que establecen el entrecruzamiento de cadenas, mediante bases de Schiff, elevan el Tm.
Experimentos de adsorción con aniones metálicos
Se procedió a hacer pruebas preliminares de adsorción con los adsorbentes producidos, para evaluar la afinidad frente a aniones metálicos. Se escogieron oro y cromo, como modelos de metales preciosos y tóxicos, respectivamente. Los resultados se muestran en la figura 5 donde se evalúa pH vs capacidad de adsorción (q).
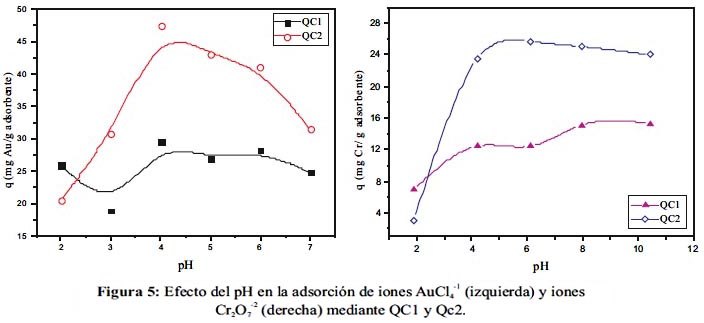
Los resultados muestran claramente que el adsorbente QC2 es el más efectivo en la eliminación de ambos metales en casi la totalidad del rango de pH estudiado. Esto concuerda perfectamente con los resultados de determinación de superficie específica con el método de MB, donde QC2 tuvo una mayor superficie expuesta al solvente que QC1. La organización adecuada de las cadenas de quitosano cuaternario permite la maximización del uso de la superficie del adsorbente. Esto se corroboró con las microscopías donde se indicó una perfecta red polimérica. De los resultados también se observa que a pH mayores de 4, el efecto del pH es casi nulo, esto se debe a la carga permanente de la amina cuaternaria. Por otro lado, sorprende la diferencia en capacidades de adsorción entre Cr y Au. Se esperaba una mayor adsorción de Cr, debido a su carga [-2]. Una posible explicación de este fenómeno podría deberse al poder oxidante del ion dicromato que puede dañar la estructura del adsorbente mediante ruptura del entrecruzamiento u oxidación de las unidades de glucosamina9,10. Además, cabe resaltar la baja capacidad de adsorción de ambos adsorbentes con ambos metales a bajos valores de pH; esto podría deberse a la protonación de los iones oro y cromo, que disminuyen la interacción electrostática15,16.
CONCLUSIONES
El desarrollo de nuevos adsorbentes para la eliminación de metales preciosos y tóxicos es abordado mediante la modificación química de uno de biosorbentes más populares, como es quitosano. La introducción de grupos amino cuaternario, previenen al adsorbente de experimentar cambios en su química acuosa, a causa del pH. Por otro lado, la reticulación con glutaraldehído brinda estabilidad térmica y mecánica al quitosano. Ambas modificaciones fueron puestas en práctica para producir los adsorbentes QC1 y QC2. La síntesis y purificación fue exitosa como se demuestra con la caracterización de ambos adsorbentes. Se cuantificó el número de moles de amina cuaternaria incorporada por gramo de adsorbente; alcanzó un valor de 2,6. Asimismo, se verificó la eficiencia de la reacción de cuaternarización mediante FTIR, mostrando cambios en las bandas de absorción típicas de la reacción. La superficie de los adsorbentes también fue evaluada y se determinó la superficie específica de 694,4m2 /kg para QC1; mientras que la de QC2, fue de 1036 m2 /kg. Este estudio fue completado con microscopías electrónicas que confirmaron la formación de cadenas entrecruzadas en QC2. Finalmente, la estabilidad térmica de QC2 fue casi equivalente a la del quitosano nativo. La pérdida de grupos amino libres, reduce la estabilidad térmica de QC1. Los experimentos de adsorción discontinuos completaron el estudio elucidando la factibilidad de ambos adsorbentes en la eliminación de iones oro y cromo. Cabe resaltar la superioridad de adsorción de oro sobre cromo, debido quizá, a la reactividad y propiedades oxidantes del mismo metal. Por lo expuesto, el desarrollo de estos adsorbente abre nuevos horizontes en la biosorción de aniones, la cual ha sido dejada de lado por la baja afinidad de los adsorbentes comunes; se espera completar este estudio con una evaluación completa del equilibrio y cinética de adsorción de ambos metales, para poder aplicarlos en la remoción de otros aniones de interés industrial y ambiental.
AGRADECIMIENTOS
Este trabajo fue financiado por PROCYT-CONCYTEC. Los autores también deseamos extender nuestro agradecimiento a Rosa Medina, por facilitar e interpretar las espectroscopías de barrido electrónico.
BIBLIOGRAFÍA
1. Guibal E., Milot C., Tobin J.. Ind. Eng. Chem.Res. 1998, 37, 1454-1463.
2. Kawamura Y., Mitsuhashi M., Tanibe H. Ind. Eng. Chem. Res. 1993, 32, 386-391.
3. Guibal E., Milot C., Eterradossi O., Gauffier C., Domard A. Int. J. Biol. Macromol. 1999, 24, 49-59.
4. Ly M., Maldonado G., Horna O., Guibal E. Hydrometallurgy. 2003, 71, 191-200.
5. Chojnacka K. Biosorption and Bioaccumulation in Practice. 2009. Nova Science Publishers, Inc. New York, US.
6. Wang J., Chen C. Biotechnol. Adv. 2009, 27, 195-226.
7. Xu W., Wu J., Fu C. Chinese Chem. Lett. 2001, 12, 1081-1084.
8. Kim C., Choi J., Chun H., Choi K. Polym. Bullet. 1997, 38, 387-393.
9. Rosa S., Laranjeira M., Riela H., Favere V. J. Hazar. Mater. 2008, 155, 253-260.
10. Spinelli V., Laranjeira M., Favere V. Reactive & Func Polym. 2004, 61, 347-352.
11. Li H., Du Y., Wu X., Zhan H. Colloids and Surf. A: Physicochem. Eng. Aspects. 2004, 242, 1-8.
12. Navarro A., Cuizano N., Portales R., Llanos B. Sep. Sci. Technol. 2008, 43, 3183-3199.
13. Navarro A., Cuizano N., Lazo J., Sun-Kou R., Llanos B. J. Hazar. Mater. 2009, 164,1439-1446.
14. Cuizano N., Llanos B., Navarro A. Rev. Soc. Quím. Perú, 2009, 75, 33-43.
15. Volesky B. Sorption and Biosorption. 2003. BV Sorbex, Inc. Quebec, Canada.
16. Liu Y., Wang J. Fundamentals and Applications of Biosorption Isotherms, Kinetics and Thermodynamics. 2009. Nova Science Publishers, Inc. New York, US.
Recibido el 28-10-2010













