Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.4 Lima oct./dic. 2010
TRABAJOS ORIGINALES
Contribución al estudio fitoquímico del liquen Thamnolia vermicularis subsp.
Vermicularis S. STR.Contribution to the phytochemistry study of the lichen Thamnolia vermicularis subsp.Vermicularis s. STR.
Olivio Nino Castro Mandujano
Pontificia Universidad Católica del Perú, Departamento de Ciencias – Sección Química; Av. Universitaria 1801, San Miguel, Lima 32, Perú, ocastro@pucp.pe
RESUMEN
En el presente trabajo se investigó al Thamnolia vermicularis (Sw.) Ach. Ex. Schaer. Subsp. Vermicularis. Se hicieron dos extracciones sucesivas por maceración con acetona; se procedió a separar diversos componentes del extracto; para ello se usaron solventes y mezclas de solventes de polaridad variable. Se aislaron y purificaron mediante técnicas cromatográficas y recristalizaciones. Finalmente, se elucidaron y se determinaron las estructuras de los sólidos obtenidos, analizando sus espectros de IR, H1-NMR, C13–NMR y EM; estos son: compuesto H (ácido descarboxithamnólico), y el compuesto D (ácido thamnólico).
Palabras clave: Liquen, Thamnolia vermicularis, ácido thamnólico, ácido descarboxithamnólico.
ABSTRACT
In the present work there was investigated the Thamnolia vermicularis (Sw.) Ach. Ex-. Schaer. Subsp. Vermicularis. Two successive extractions were done by maceration in acetone; one proceeded to separate diverse components of the extract, for it there were used solvents and mixtures of solvents of increasing polarity; then isolated and purified by means of chromatographic techniques and recrystallizations. Finally, they were elucidated and there decided the structures of the obtained solids; analyzing his spectra of IR, H1-NMR, C13-NMR and SM; these are: compound H (decarboxithamnolic acid), and the compound D (thamnolic acid).
Key words: Liichen, Thamnolia vermicularis, thamnolic acid, decarboxithamnolic acid.
INTRODUCCIÓN
El liquen es un organismo simbiótico conformado por un hongo (micobionte) y un alga (ficobionte). Crecen sobre rocas, corteza, hojas de árboles, suelos, etc. Aquellos compuestos que son sintetizados sólo por los líquenes se les llama compuestos liquénicos; generalmente se agrupan de acuerdo al tipo de estructura: Dépsidos, depsidonas, depsona, ácidos úsnicos y dibenzofuranos. Los líquenes son usados en base a sus propiedades farmacológicas, capacidad quelante, por tener acción sobre reacciones fotoquímicas con cationes y también son usados como pigmentos.1-3
Este género thamnolia, tiene un amplio rango de distribución: se encuentra principalmente en el ártico y montañas en el hemisferio norte, como en las montañas alpinas y en regiones de fría temperatura en el hemisferio sur; se caracteriza por tener un talo hueco, de reproducción asexual, químicamente variable, de color blanco.4 Entre las especies del género thamnolia tenemos a la Thamnolia vermicularis subsp. vermicularis y a la Thamnolia vermicularis subsp. solida (figura 1).

PARTE EXPERIMENTAL
La muestra constituye el liquen completo, el cual ha sido recolectado por Nino Castro, en el departamento de Junín, provincia de Huancayo, a orillas del lago Huaytapallana que está a una altitud de 4200 msnm., en mayo de 2000; su nombre científico es: Thamnolia vermicularis subsp. vermicularis s. str, el cual ha sido identificado por la Dr. Teuvo Ahti (University of Helsinki - Finlandia ), y el PD Dr. H. Thorsten Lumbsch (Universität GH Essen - Germany ).
Para reconocer los ácidos fenólicos se emplea el cloruro férrico en disolución acuosa al 1%, o en disolución etanólica. Las sustancias liquénicas que posean en uno de sus anillos dos grupos hidroxilos en posición meta (2-4 ó 4-6), se pueden reconocer empleando una disolución acuosa saturada de hipoclorito de calcio.2,3
La presencia de depsidonas es detectable empleando una disolución acuosa de KOH al 5%. Su acción se basa en la ruptura del éster mediante hidrólisis alcalina, conduciendo a la formación de un compuesto difenólico con un enlace éster, observándose color rojo con depsidonas.2
Se extrae 210 gramos de liquen con acetona por maceración por 7 días a temperatura ambiente, se filtra; se repite la extracción por otros 7 días; finalmente se tiene un extracto total de 1,5 L de acetona, el cual se concentra al vacío con el rotavapor, hasta 100mL. Este extracto concentrado se guarda en reposo a OºC, durante un día; se observa que precipita, el que se filtra y se lava con cloroformo frío, obteniéndose un sólido I. El líquido filtrado se concentra hasta 25 mL, luego se realiza con él una cromatografía en columna (CC), con el sistema CHCl3 – MeOH, aumentando la cantidad de metanol; se colectaron en total 60 fracciones de 5 mL cada una. Se agrupan las fracciones según su análisis de cromatografía de capa delgada, y se obtienen 6 fracciones.
La fracción II, se disuelve en el sistema CHCl3 – MeOH (1:1), se deja en reposo a 0ºC, luego se filtra, se seca y se obtiene un sólido H (80 mg, color blanco. La fracción III se purifica disolviéndola con CHCl3 – MeOH (1:1), se guarda a 0ºC por dos horas y luego se filtra; así se obtiene un sólido C (120 mg, color crema); este sólido C se disuelve en acetona calentando, luego se deja en reposo a 0º C por todo un día, se filtra y se lava con acetona helada; finalmente se obtiene unos cristales en forma de agujas ligeramente amarillas (compuesto D); se verifica su pureza realizando una CCD sobre cromatofolios de sílica gel bajo el sistema tolueno – AcOEt – ácido acético glacial (6:4:1), revelando con una solución de H2SO4 (10%) en MeOH , el resultado confirma que H y D tienen una mancha.
Los sólidos del extracto acetónico (H, C y D), se envían al extranjero (Universidad Nacional de Australia), para su análisis por HPLC. La muestra se trata de la siguiente manera: 20 mg de muestra sólida se extraen con acetona fría, por 5 minutos en un Ultrasonic, se decanta y se toma una alícuota para inyectar al cromatógrafo.5 Se compararon los tiempos de retención obtenidos de la muestra con la base de datos que tiene el laboratorio a partir de muestras puras extraídas de otras plantas, bajo la mismas condiciones.
RESULTADOS Y DISCUSIONES
Elucidación estructural del sólido H.- La reacción de coloración con KOH nos dio amarillo; H tiene punto de fusión 215ºC con descomposición; el espectro UV-vis tiene longitud de onda máxima en 267, 313 y 365 nm; todo esto indica la presencia de un grupo cromóforo fuertemente conjugado.
Del espectro IR , se determina la presencia del grupo OH fenólico a 3411,6 cm-1, C=O cetónico a 1745 , C=O ácido a 1651 cm-1; C=C a 1526,6 cm-1 ; los otros valores son: 3599,9; 3181,1; 1430,1; 1293,4; 1277,9; 1238,0; 1200,4; 1187,5; 1113; 1099,1; 833,1; 812,1; 775,2; 724,1; 656; 643,6; 589; 516,4; 460,7; 415,3; 404,1 cm-1.
Analizando el espectro H
1 - NMR, en acetona – d6 se observan los desplazamientos δ, del solvente es a 2,86 y 206 ppm (figura 2) y se identifican los desplazamientos de cada protón: Los metilos, por lo general, aparecen alrededor de 1,0 ppm, pero cuando están acoplados a grupos como a anillos aromáticos o grupos OH, son desplazados sus señales a campos bajos 2,28 y 2,55 ppm. Además, en el espectro se observa también señales de 2 protones aromáticos a 6,41 y 6,79 ppm, los cuales estarán en dos anillos diferentes y éstos a su vez estarán bien sustituidos ya que las señales son singuletes y de diferentes alturas de los picos. Por otro lado, se observa que a 10,3 ppm hay una señal lo que indica presencia de un aldehído aromático; finalmente, del pico de 11,2 ppm se puede afirmar que se trataría un grupo COOH, ya que estos grupos frecuentemente presentan señales entre 11–12 ppm; la información espectroscópica se muestra en la tabla 1.
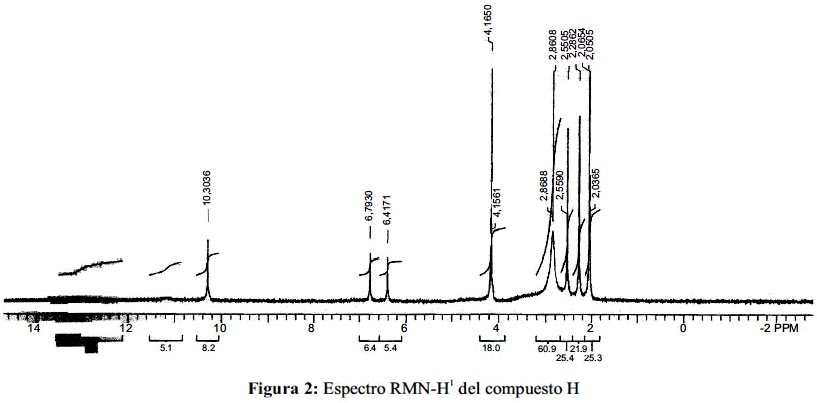
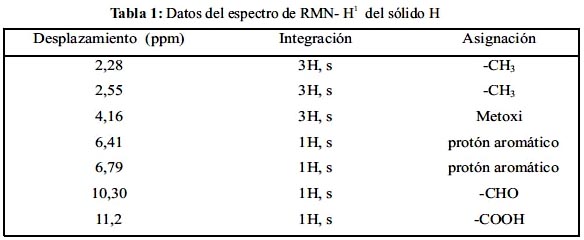
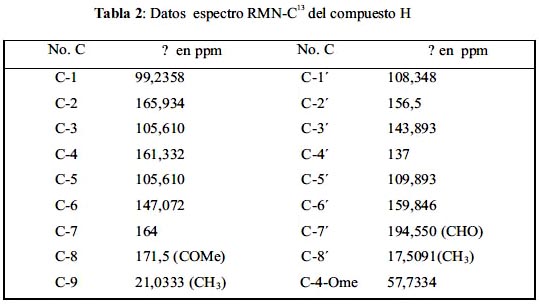
Reuniendo los datos de UV-Vis, IR, H1–NMR y según el cromatograma de HPLC, nos indica que el compuesto H se trataría del compuesto ácido decarboxithamnólico; entonces se analiza el espectro de C13–NMR del compuesto H, para sustentar esta hipótesis. Los desplazamientos de cada carbono del compuesto se resumen en la tabla 2.
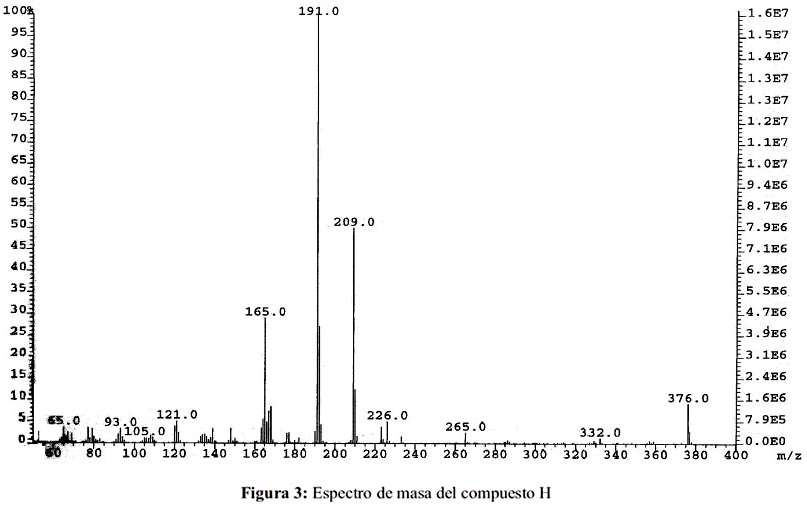
Los datos del espectro de masa (figura 3), nos indica que su fórmula global es: C18H16O9, su peso molecular es de 376,0; con fragmentos a 332 (al perder un CO2 de 376), 265, 226 (cuando pierde un grupo CHO del fragmento 265), 191 (pico padre); otros fragmentos son 165, 150, 121, 105, 93 y 65 6-9. En la figura 4, se propone la fragmentación del compuesto H.
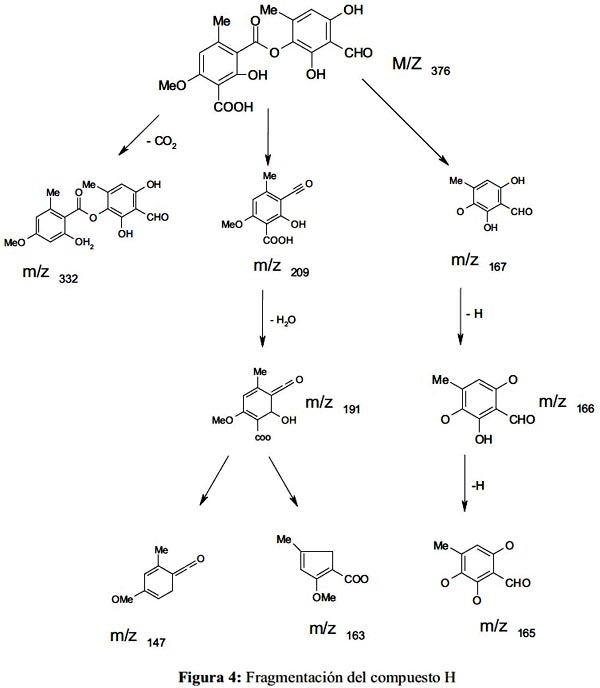
Entonces, el compuesto H aislado, se propone que se trataría del ácido decarboxi-thamnólico:
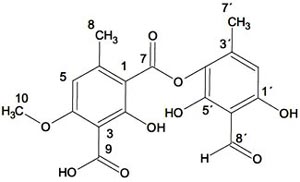
Elucidación estructural del compuesto D.- El compuesto D son cristales en forma de agujas ligeramente amarillo, su punto de fusión es 222-224ºC; reacciona con KOH resultando amarillo. Analizando el cromatograma HPLC del compuesto D, nos indica que se trataría del acido thamnólico cuyo tiempo de retención es 22,565 min.
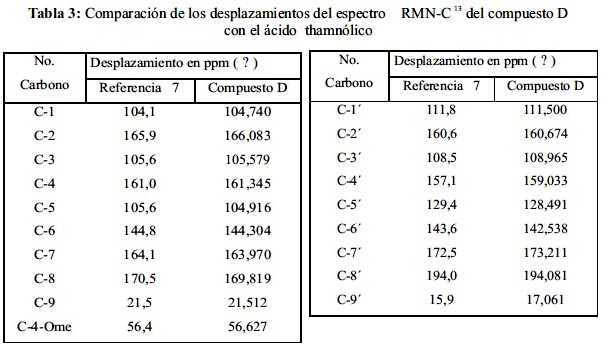
Analizando y comparando los datos espectroscópicos de RMN-C13 del compuesto D (figura 5) con el espectro del ácido thamnólico, se observa que hay bastante similitud entre estos dos compuestos; 6-9 el resumen de esta observación está en la tabla 3.
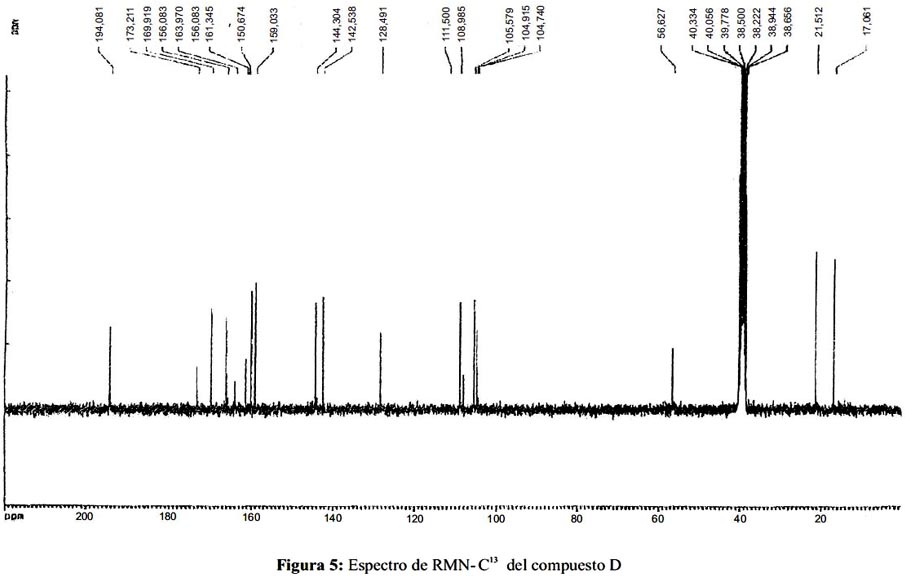
Finalmente, se propone que el compuesto D es el ácido thamnólico, según los datos de cromatograma de HPLC y el espectro de RMN-C13; la estructura química propuesta sería:
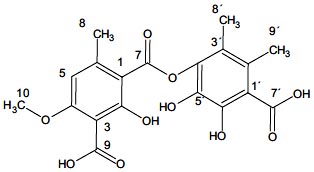
CONCLUSIÓN
Se aisló y se determinó la estructura de 2 compuestos liquénicos; estos son: Compuesto H (ácido descarboxithamnólico) y compuesto D (ácido thamnólico).
El tiempo de retención, en el análisis cualitativo por HPLC de los compuestos aislados son: 20,092 min y 22,565 min para el ácido descarboxithamnólico y el ácido thamnólico, respectivamente.
AGRADECIMIENTOS
Esta investigación fue realizada gracias a la colaboración de la Dra. Magdalena Pavlich de la Universidad Peruana Cayetano Heredia. Agradezco, igualmente, a las siguientes personas: al Dr. H. Thorsten Lumbsch de la Universität GH Essen - Germany, por la identificación botánica del liquen estudiado; al Dr Arturo San Feliciano (Universidad de Salamanca - España) por la realización del análisis de RMN-H1 , RMN-C13 y EM; al Dr. John Elix de la Universidad Nacional de Australia por los análisis de HPLC, y a la Dra. Neli Kika Honda de la Universidad Matto Grosso Do Sul - Brasil por el espectro de RMN-C13
BIBLIOGRAFÍA
1. Kika Honda , N, Vilegas, W., A química dos líquenes, Química Nova – Brasil, 21, 110 – 124 (1998).
2. Reinhold L. D., Progress in Phytochemistry, 1968, pag 225.
3. Robles C., Pastor, A., Morales P., Líquenes, Revista química – PUCP, (1992).
6, 65-76.4. Karnefelt, E.I., Thell, A., Lichenol., (1995), 58, 213-234.
5. Feige, G. B., et al., J. Chromatography, (1993), 646, 417-427.
6. Robles, C., Pastor, A., Morales P., Líquenes–Segunda parte, Revista Química – PUCP, (1992), 6, 192-200.
7. Huneck, S., And Yoshimura, I., Identification of the lichen substances, ed. Springer, Berlin, 1996.
8. Silverstein, R.M., Spectrometric identification of organic compounds, 5TH. Edition, Ed. John Wiley, 1998.
9. Pretsch, C., Tablas para la elucidación estructural de compuestos orgánicos por métodos espectroscópicos, Ed. Springer–Verlag Ibérica, Barcelona, 1998.
Recibido el 27-10-2010













