Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.76 n.4 Lima oct./dic. 2010
TRABAJOS ORIGINALES
Aislamiento del ácido úsnico de Flavoparmelia caperata y su determinación cuantitativa por espectroscopía UV, en diez líquenes
Isolation of the usnic acid of Flavoparmelia caperata and cuantitative determination by Uv spectroscopic, of ten lichens
Olivio Nino Castro Mandujano1*
1 Pontificia Universidad Católica del Perú, Departamento de Ciencias - Sección Química.
*ocastro@pucp.pe
RESUMEN
El aislamiento del ácido úsnico se realizó a partir del liquen Flavoparmelia caperata, mediante extracción por maceración usando cloroformo a temperatura ambiente. El compuesto aislado denominado S2 fue purificado mediante técnicas cromatográficas y subsecuentes recristalizaciones, obteniendo el ácido úsnico puro. La elucidación del ácido fue realizada por técnicas espectroscópicas IR, H1-NMR, C13–NMR y EM.
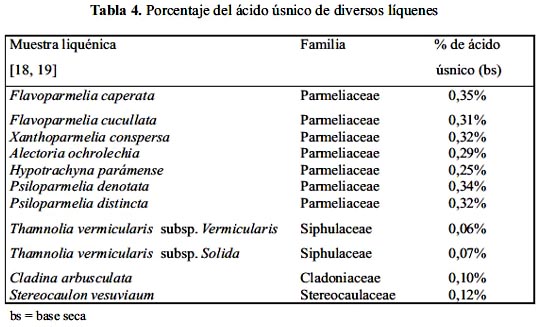
La cuantificación de este ácido fue evaluado por espectroscopía ultravioleta-visible, y fue aplicada a los siguientes líquenes: Flavoparmelia caperata, Flavoparmelia cucullata, Xanthoparmelia conspersa, Alectoria ochrolechia, Hypotrachyna paramense, Psiloparmelia denotata, Psiloparmelia distincta (familia parmeliaceae); Thamnolia vermicularis subsp. Vermicularis, Thamnolia vermicularis subsp. Solida (familia siphulaceae); Cladina arbusculata (familia cladoniaceae) y Stereocaulon vesuvianum (familia stereocaulaceae).
Palabras clave: Liquen, Flavoparmelia caperata, ácido úsnico, espectroscopía UV.
ABSTRACTS
The isolation of the usnic acid was realized from the lichen Flavoparmelia caperata by extraction – maceration with chloroform at room temperature. The isolated compound called S2 was purificated by chromatography techniques and several recristalizations. The elucidation was determined by spectroscopy techniques: IR,1H-NMR, 13C-NMR and MS.
The quantitative analysis of this acid was tested by UV spectroscopy and it was applied a the following lichens: Flavoparmelia caperata, Flavoparmelia cucullata, Alectoria ochrolechia, Xanthoparmelia conspersa, Hypotrachyna paramense, Psiloparmelia denotata, Psiloparmelia distincta (familia parmeliaceae); Thamnolia vermicularis subsp. Vermicularis, Thamnolia vermicularis subsp. Solida (familia siphulaceae); Cladina arbusculata (familia cladoniaceae) and Stereocaulon vesuvianum (familia stereocaulaceae).
Key words: Lichen, Flavoparmelia caperata, usnic acid, spectroscopic UV.
INTRODUCCIÓN
El liquen es un organismo simbiótico conformado por hongos (micobionte) y algas (ficobionte). Mientras los hongos se encargan del abastecimiento del agua y de las sales minerales, las algas proveen de los productos fotosintéticos, tales como los glúcidos. Se calcula que existen aproximadamente 13 500 especies dentro de 600 géneros1,2.
El compuesto liquénico más estudiado es el ácido úsnico porque sus isómeros ópticos muestran un amplio espectro de actividad fisiológica frente a neumococos, estreptococos y estafilococos; además, tienen actividad antibiótica frente a diferentes tipos de Mycobacterium. Asimismo, se ha conseguido ampliar considerablemente el espectro de antibiosis de estos ácidos por la obtención de derivados 3. El ácido úsnico es un metabolito frecuente en líquenes, variando su concentración según la especie. Por tanto, el objetivo de esta investigación es aislar, purificar y cuantificar el ácido úsnico del liquen Flavoparmelia caperata (figura 1) para emplearlo como patrón en la cuantificación del ácido en las otras especies estudiadas.

MATERIALES Y MÉTODOS
Las muestras de líquenes empleadas fueron recolectadas durante los meses de marzo a mayo de 1998 a 4100 m.s.n.m. en Pumacancha (Junín - Perú). La detección preliminar de los diferentes constituyentes liquénicos se realizó por pruebas de coloración y marchas fitoquímicas.2,4,5
Aislamiento. Se usaron 210 gramos del liquen Flavoparmelia caperata (seco y molido) para la extracción por maceración con 1 L de acetona a temperatura ambiente. El proceso se repitió y el extracto total (1,6 L) fue concentrado al vacío en rotavapor hasta obtener 100 mL. Este extracto se mantuvo en reposo a 0 ºC por 24 horas, del cual se obtuvo un precipitado denominado sólido I que fue separado por filtración y posteriormente lavado con cloroformo frío. El líquido filtrado fue guardado para posteriores investigaciones.
Al sólido I se le agregaron 15 mL de acetona que fue calentado hasta ebullición; el sólido fue separado por filtración en caliente (2 veces). El extracto acetónico fue concentrado a 5 mL y dejado en reposo a 0 ºC durante un día, obteniendo unos cristales amarillos, S2. Estos cristales fueron separados por filtración en frío y lavados con acetona helada. Se determinó el punto de fusión de este compuesto. Se realizaron cromatografías de capa delgada (CCD) bajo el sistema: Tolueno–AcOEt - Ac.Ac. Glacial (6:4:1), que se revelaron con solución de H2SO4 en MeOH (10%). La caracterización del sólido denominado S2 fue realizada usando técnicas espectroscópicas de 1H-NMR, 13C-NMR y espectrometría de masas en los Laboratorios de la Universidad de Salamanca (España). Los análisis de UV-Vis e IR se realizaron en el Laboratorio de Instrumentación de la PUCP.
Asimismo, se realizaron análisis por HPLC a los sólidos aislados. Cada muestra fue disuelta en acetona fría, se decantó y se tomó un alícuota que fue inyectado al cromatógrafo6 . Las condiciones instrumentales fueron: Cromatógrafo Kontron HPLC, detector UV - 430, Columna Spherisorb 5 ODS-2 Kontron 250 x 4,6 mm, estándares internos 20 mg de ácido benzoico y 20 mg de ácido solorínico por 1000 mL de acetona, fase móvil A: Agua bidestilada con 1% de ácido ortofosfórico. B: 100 mL metanol Baker, A y B desgasificado por el Ultrasonic; Flujo 0,7 mL/min, volumen de inyección 5 µL, longitud de onda 245 nm. Se compararon los tiempos de retención para cada muestra con la base de datos disponibles, identificando la composición de cada muestra. Estos análisis fueron realizados por el Dr. J. Elix, químico orgánico de la Universidad Nacional de Australia especialista en plantas liquénicas.
Análisis cuantitativo del ácido úsnico. Esta determinación se realizó usando el método espectrofotométrico UV-V. Se obtuvo la absorbancia máxima haciendo un scan entre 200 y 400 nm usando 0,1 ppm de ácido úsnico en cloroformo.
La absorbancia máxima obtenida fue 284 nm confirmándose que a esa longitud de onda no interfiere el solvente.
Rango de linealidad. Se prepararon soluciones de 1000, 100, 10 y 1 ppm de ácido úsnico en cloroformo y se midieron sus absorbancias a 284 nm. A partir de estos valores se determinó la zona de linealidad y se preparó la curva de calibración con 1,6 mg de ácido úsnico en 50 mL de cloroformo y a partir de esta solución se prepararon otras soluciones de 6,4 ppm, 3,2 ppm, 1,28 ppm y 0,64 ppm. Se plotearon los datos de concentración (ppm) vs absorbancia y se obtuvo la curva de calibración para encontrar la línea de correlación.
Cuantificación del ácido úsnico en los diferentes líquenes. Se extrajo un gramo de muestra problema con 150 mL de cloroformo en un soxhlet (2 veces). Los extractos se juntaron y concentraron hasta un volumen de 100 mL, y a partir de esta solución se obtuvieron diluciones de 1/10, 1/50, 1/100, 1/500 y 1/1000 de tal forma que al registrar la absorbancia de las soluciones a 284 nm se encuentren en la zona de linealidad. Por último se realizó el cálculo del contenido de ácido úsnico por gramo de muestra usando la curva de calibración.
DISCUSIÓN DE RESULTADOS
La marcha fitoquímica realizada al liquen Flavoparmelia caperata indicó que éste contiene fenoles, taninos, aminoácidos, esteroides, triterpenos, ácidos fenólicos, depsidonas, dépsidos y ácido úsnico.
De la fracción I se obtuvo 110 mg del compuesto S2, en forma de agujas amarillas. Su punto de fusión varió entre 203-204ºC. La reacción con KOH dio una coloración amarillo intenso y los cromatogramas CCD bajo el sistema: Tolueno–AcOEt - Ac.Ac. Glacial (6:4:1) revelados con solución de H2SO4 en MeOH (10%) evidencian una sola mancha con Rf de 0,45.
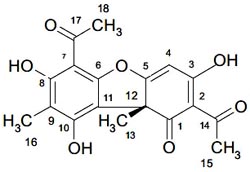
Elucidación estructural del compuesto S2. El compuesto S2 es un sólido cristalino cuya rotación óptica dió [α]25 = +492. Estas características indicaron que podría tratarse del (+) R ácido úsnico (R por su configuración y + giro dextrógiro); por otro lado, el cromatograma de HPLC, confirma que efectivamente se trata del ácido úsnico cuyo tiempo de retención fue 26,103 min. 7-9
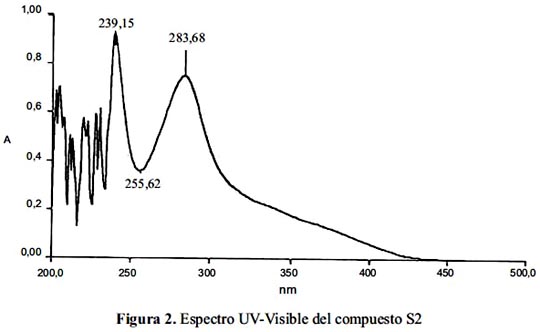
En el espectro UV-vis, (figura 2), se aprecia los valores de absorbancia máxima los cuales son bastante cercanos comparados con los reportados por Morales8 y Culberson9 , ambos medidos en cloroformo; los valores de longitud de onda máxima se muestra en la tabla 1.

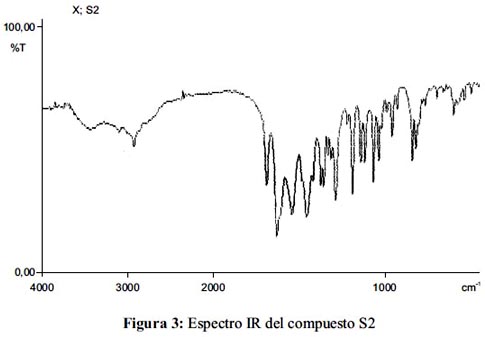
Del espectro IR, (figura 3), se observan valores a 1691 cm-1 que indica un alargamiento del C=O; a 1290 cm-1 alargamiento del C-O-C en el anillo; 1632 cm-1 para el grupo C=C conjugado, a 3008 cm-1 alargamiento del C-H aromático, a 3438 cm-1 presencia del los OH; en general, las zonas de huella dactilar son bastante parecidas en KBr (cm-1) IR 700,8; 803,2; 819,5; 840,5; 930,7; 959,1; 992; 1024,4; 1040,1; 1070,4; 1118,5; 1144; 1190,7; 1221,5; 1290,8; 1317,5; 1334,5; 1358,1; 1375,6; 1421,2; 1456,1; 1542; 1632,2; 1691,4; 3008,3; 3438,1 [15-17].
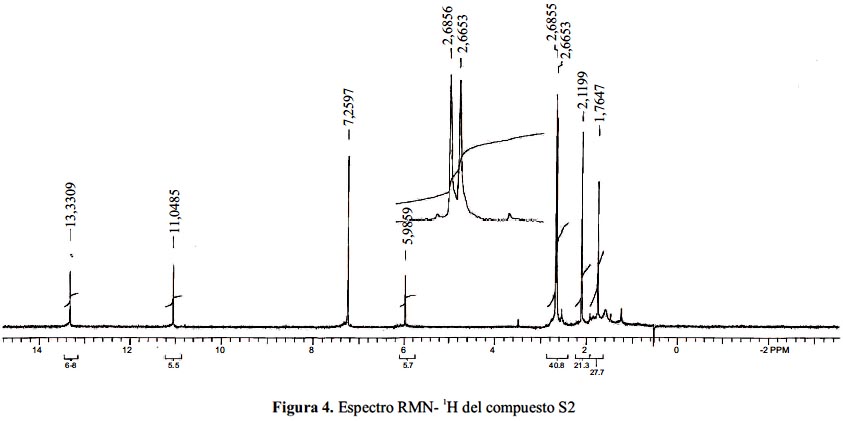
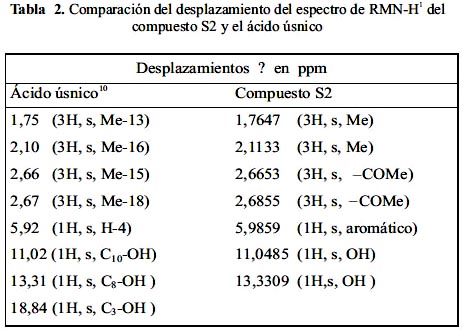
Analizando el espectro RMN-H1 (CDCl)3 del compuesto S2 (figura 4), se determina que hay 2 metilos singuletes a 1,76 ppm y a 2,1 ppm, aproximadamente. Este último está desplazado por estar unido a un anillo aromático; además, hay otros 2 grupos metoxilo singuletes que sus señales están muy cerca (2,66 ppm y 2,68 ppm); por otro lado, hay también un protón aromático. Se observa, además, 2 oxhidrilos; el tercero no se distingue porque su señal está alrededor de 18 ppm y el espectro no indica este rango. En la tabla 2 se muestra una comparación de los valores de desplazamiento con los que indican las referencias.
En el espectro de 13C - RMN (figura 5), medido en CDCl3, se observa que los carbonos de los carbonilos de los grupos del –COMe se encuentran desplazados a 200,29 (C-14) y 201,73 (C-17) ppm; para los metilos aromáticos los valores son 27,88 (C-13) y 7,50 (C-16) ppm; para el desplazamiento 98,27 ppm se concluye que hay una sola señal para dos tipos de carbonos con desplazamientos muy cercanos (C-4 y C-6).
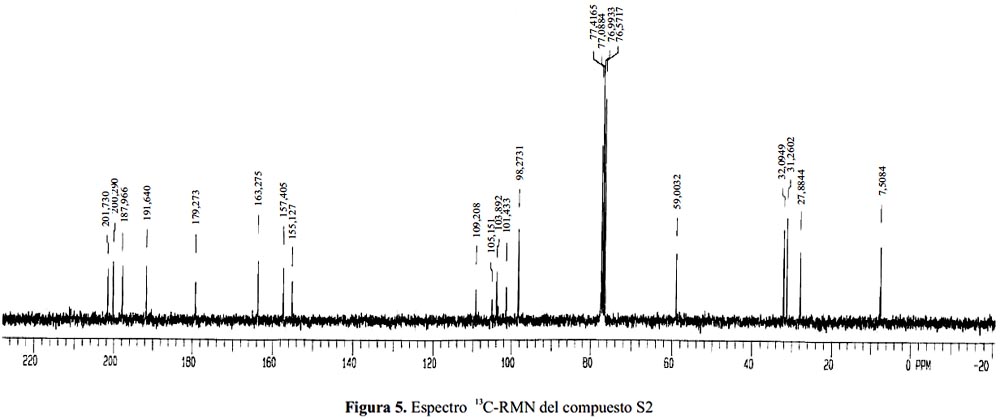
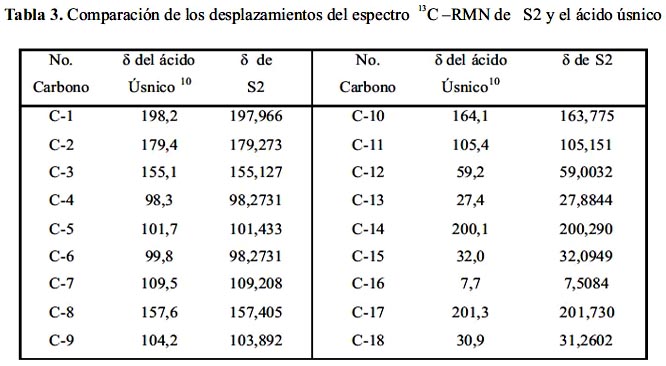
En general, se observa que hay valores de desplazamiento muy parecidos entre el compuesto S2 y el ácido úsnico, tabla 3.
Analizando el espectro de masas (figura 6) nos indica que se trata del compuesto C18H16O7 cuyo peso molecular es 344,0; sus fragmentos son: 260, 233(100), 217, 161, que coinciden exactamente con los datos de referencia10. En la figura 7 se propone la fragmentación del compuesto S2.
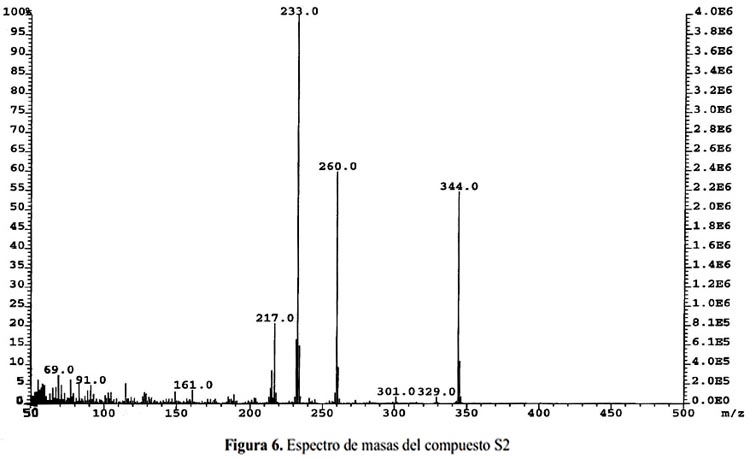
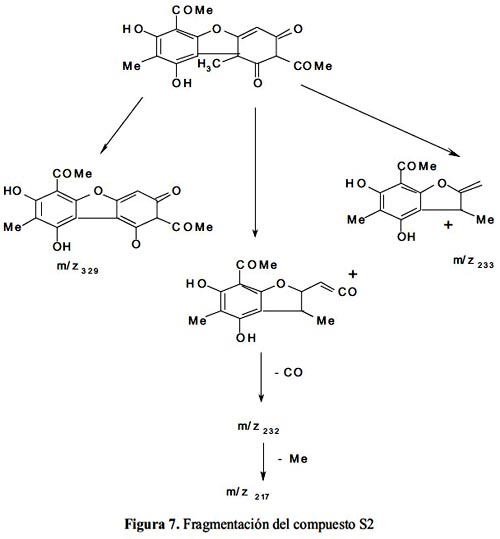
Analizando el espectro de masas (figura 6) nos indica que se trata del compuesto C18H16O7 cuyo peso molecular es 344,0; sus fragmentos son: 260, 233(100), 217, 161, que coinciden exactamente con los datos de referencia10. En la figura 7 se propone la fragmentación del compuesto S2.
Con todos los datos espectroscópicos y cromatográficos se propone que el compuesto S2 sería el ácido úsnico cuya estructura es la siguiente:
Resultados del análisis cuantitativo del ácido úsnico. La gráfica que relaciona los valores de absorbancia para soluciones de 0-1000 ppm indicaron falta de linealidad en ese rango; mientras que en el rango de 0 a 10 ppm se cumple la correlación de la Ley de Lambert-Beer, tal como se observa en la figura 8.
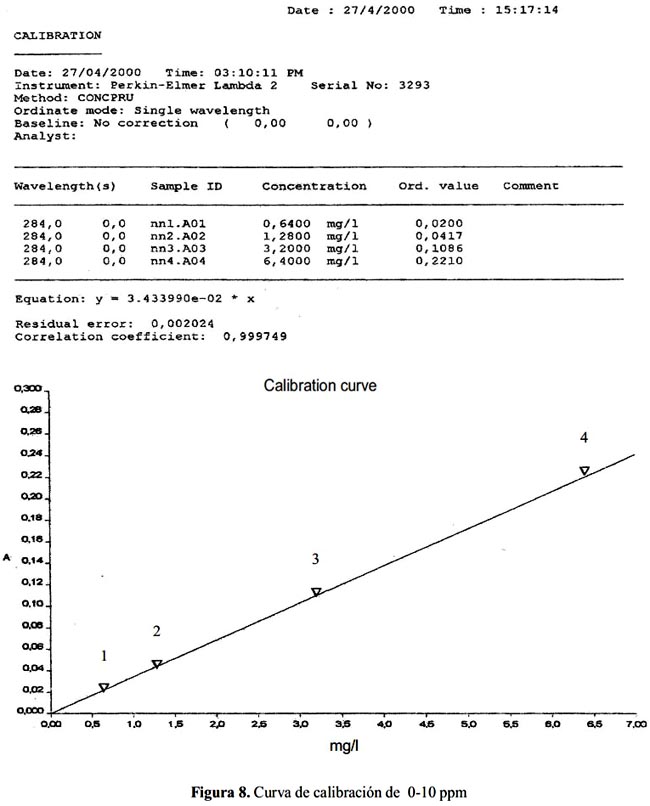
De la curva de calibración se obtuvo la línea de correlación Y = 0,0343 X, donde Y = absorbancia y X = concentración. La cuantificación de ácido úsnico en las diferentes especies liquénicas se muestran en la tabla 4.
CONCLUSIÓN
Todos los líquenes estudiados contienen el ácido úsnico en diferentes proporciones, de ellos, las especies de la familia Parmeliaceae son las que tienen mayor cantidad de ácido úsnico 0,30-0,35% y los líquenes de otras familias (siphulaceae, stereocaulaceae, cladoniaceae) contienen solamente de 0,07 hasta 0,12%.
AGRADECIMIENTOS
Esta investigación se realizó gracias a la colaboración de los siguientes profesionales:
Por la identificación botánica de los líquenes estudiados, a la Dra. Magdalena Pavlich de la Universidad Peruana Cayetano Heredia; a la Dra. Mónica T. Adler de la Universidad de Buenos Aires, Argentina; al Dr. H. Thorsten Lumbsch de la Universität GH Essen, Germany y al Dr. Teuvo Ahti de la University of Helsinki, Finlandia. Por la realización del análisis de RMN-H1, RMN-C13 y EM al Dr. Arturo San Feliciano de la Universidad de Salamanca, España, y por los análisis de HPLC al Dr. John Elix de la Universidad Nacional de Australia.
BIBLIOGRAFÍA
1. Vicente Córdova, C., Fisiología de las sustancias liquénicas, Ed. Alhambra, Madrid, 1975.
2. Kika Honda, N, y Vilegas, W., Química Nova – Brasil, 21, 110 – 124 (1998), "A química dos líquenes".
3. Reinhold Leonora, D., Progress in Phytochemistry, Ed. Interscience, London, 1968, p 225.
4. Robles Caycho, J., Pastor de Abram, A. "Líquenes y sustancias liquénicas", Revista química – PUCP, 6, 65-76 (1992).
5. Lock De Ugaz, O., Investigación fitoquímica, Fondo editorial de la Pontificia Universidad Católica del Perú, Lima, 1994.
6. Feige, G. B., "Identification of lichen substances by a standardized High-performance liquid chromatographyc method". J. Chromatography 646, 417-427 (1993).
7. Robles Caycho, J., Pastor De Abram, A. "Líquenes y sustancias liquénicas - Segunda parte". Revista Química - PUCP, 6, 192-200 (1992).
8. Morales Bueno, P. Tesis de licenciatura, Fondo Editorial de la Pontificia Universidad Católica del Perú, Lima, Perú, PUCP, 1992.
9. Culberson, C.F., Phytochemistry, 2, 335-340 (1963).
10. Huneck, S., and Yoshimura, Isao, Identification of the lichen substances, ed. Springer, Berlin, 1996.
11. Silverstein Robert., M., Spectrometric identification of organic compounds, 5TH. Edition, Ed. John Wiley, 1991.
12. Pretsch, E., et al., Tablas para la elucidación estructural de compuestos orgánicos por métodos espectroscópicos, Ed. Springer –Verlag Ibérica, Barcelona, 1998.
Recibido el 27-10-2010













