Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.1 Lima ene./mar. 2011
TRABAJOS ORIGINALES
Determinación de la estructura de bases de Schiff derivadas de 2-aminofenol, nitro y flúor sustituidas, utilizando la RMN 1D y 2D
Structure determination of the Schiff bases derivated from 2- aminophenol, nitro and fluorid substituted, using RMN 1D and 2D
Sergio Zamoranoa* ; Juan Camus
a Facultad de Ciencias Naturales y Exactas, Universidad de Playa Ancha, Carvallo Nº270, Playa Ancha, Valparaíso, Chile. *szamoran@upla.cl
RESUMEN
En este trabajo se presenta el resultado de la síntesis de bases de Schiff a partir del 2-amino fenol con 4-nitro y 2-fluorbenzaldehído y se caracterizan los productos, usando el microanálisis, la espectroscopía infrarroja, la espectroscopía de RMN de H1 y C13 y la RMN en dos dimensiones (COSY y HMBC ), para determinar sus estructuras. Además, se estudia el corrimiento que sufren los carbonos con respecto al tipo de sustituyente del aldehído en la base de Schiff
.Palabras clave: Bases de Schiff, espectroscopía RMN 1D y 2D.
ABSTRACT
In this work the result of the synthesis of a base of Schiff is presented, starting from the 2-amino phenol with 4-nitro and 2- fluorbenzaldehyde and the products are characterized, using the microanalysis, the infrared spectroscopy, the spectroscopy of RMN of H1 and C13 and the RMN in two dimensions (COSY and HMBC), to determine their structures. In addition, the shifts that suffering the carbon atoms respecting to the type of sustituents in the Schiff base are studied.
Key words: Schiff bases, NMR 1D and 2D spectroscopy.
INTRODUCCIÓN
En la publicación anterior describimos detalladamente el uso y la importancia que está teniendo la RMN 1D y 2D en la determinación de la estructura de moléculas orgánicas y su penetración al campo de los compuestos de coordinación,1,2. En los sistemas homo y heteronucleares, la RMN bidimensional está siendo ampliamente utilizada para dilucidar estructuras, debido a su gran versatilidad, permitiendo por ejemplo, determinar la conectividad del número y el tipo de protones que se encuentran a dos o tres enlaces de distancia3-7
Los experimentos homonucleares RMN COSY como el NOESY entregan valiosa información en los llamados diagramas de contorno, que permiten determinar los desplazamientos químicos de los protones y las distancias entre núcleos4,7
Los experimentos heteronucleares RMN HMBC permiten detectar al núcleo más sensible y muestra la correlación a dos o tres enlaces de distancia entre núcleos distintos como el H1 y C13 en un rango más amplio (hasta cuatro enlaces de distancia)4,7.
El objetivo de este trabajo es estudiar la actividad de los grupos que ceden densidad electrónica por hiperconjugación y que dirigen la sustitución en orto y para8; para ello hemos utilizado la fluoración y nitración electrófila de las bases de Schiff que se han sintetizado anteriormente1,9,10. En definitiva, la idea es conocer cuál es la influencia que tendrán estos grupos dirigentes en la capacidad de la molécula de estabilizar compuestos de coordinación. Suponemos que estos productos fluor y nitro derivados favorecerán la formación de enlaces metal-ligando11-13.
PARTE EXPERIMENTAL
Materiales y métodos
Síntesis de las bases de Schiff a partir del 2-aminofenol con 4-nitrobenzaldehído y con 2-fluorbenzaldehído
En un vaso de precipitado de 100 ml se disolvió 0,248 gramos de 4-nitrobenzaldehído (Aldrich) en 20 ml de etanol; se agregó 0,225 gramos de sulfato de magnesio (Fluka), para eliminar el agua producida en la reacción. Sobre esta mezcla se añadió directamente 0,250 gramos de 2-aminofenol (Merck). Se agitó durante 1 hora, se dejó reposar 1 día, bajo refrigeración y luego se mantuvo en el congelador durante 2 semanas a -5ºC . Se obtuvo cristales aciculares de color amarillo que pudieron ser separados de la solución, lavados con etanol y secados en estufa a 50ºC. El rendimiento de la reacción fue de 64,04%.
De manera similar se sintetizó la segunda base de Schiff:
En un vaso de precipitado de 100 ml se disolvió 0,238 gramos de 2-fluorbenzaldehído (Aldrich) en 20 ml de etanol; se agregó 0,225 gramos de sulfato de magnesio (Fluka), para eliminar el agua producida en la reacción. Sobre esta mezcla se añadió directamente 0,225 gramos de 2-aminofenol (Merck). Se agitó durante 1 hora, se dejó reposar 1 día, bajo refrigeración y luego se mantuvo en el congelador durante 2 semanas a -5ºC . Se obtuvo cristales aciculares de color amarillo que pudieron ser separados de la solución, lavados con etanol y secados en estufa a 50ºC. El rendimiento de la reacción fue de 71,67%.
RESULTADOS Y DISCUSIÓN
Los resultados del análisis químico elemental se obtuvieron usando un equipo Fison EA-1108 (CHNS-O): Para el caso de derivado de fluor: El % de carbono, teórico/experimental 64,46/64,46 el % de hidrógeno 4,16/4,52 y el % de nitrógeno 11,56/11,58%, respectivamente. Para el nitroderivado: El % de carbono, teórico/experimental 72,54/71,94 el % de hidrógeno 4,68/4,79 y el % de nitrógeno 6,50/6,58%, respectivamente.
El espectro de RMN H1 de la amina presenta una señal a los 3,6 ppm, correspondiente al N-H; también se observa una señal a los 4,8 ppm correspondiente al OH. Los protones del anillo aromático C-H absorben a campo bajo, en el intervalo 6,8-6,9 ppm.
En el espectro de RMN H1 del 2-fluorbenzaldehído se observa un singulete a campo muy bajo, a los 10,31 ppm correspondiente al C-H del aldehído. Las señales del anillo aromático se encuentran en el intervalo de 7,17-7,81 ppm. En la base de Schiff fluorderivada a campo bajo (9,00 ppm) aparece un singulete característico del protón imínico del -N=CH- correspondiente a la formación de la base. También se observan los C-H aromáticos (figura 1) presenta la molécula y que aparecen en el intervalo de 6,91-8,15 ppm.
Similarmente, en el espectro de RMN H1 del 4-nitrobenzaldehído se observa un singulete a campo muy bajo a los 10,15 ppm, correspondiente al C-H del aldehído. Las señales del anillo aromático se encuentran en el intervalo de 8,09-8,35 ppm. En la base de Schiff nitroderivada 8,79 ppm aparece un singulete característico del protón imínico -N=CH- correspondiente a la formación de la base de Schiff. Se identificaron 7 átomos de hidrógeno, (figura 1) que presenta la molécula y que aparecen en el intervalo de 6,94-8,35 ppm.
El espectro de RMN C13, de la amina presenta a campo bajo la señal del carbono unido al grupo hidroxilo a los 143,8 ppm. En cambio, la señal del carbono unido al grupo amino aparece a los 136,4 ppm. Los carbonos aromáticos presentan los siguientes desplazamientos químicos
δ (ppm) 114,3; 116,4; 119,4; 114,4.
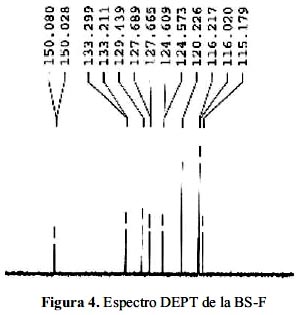
En el caso de las bases de Schiff fluorderivada, los espectros RMN C13 y DEPT 135 permiten identificar las 13 señales atribuibles a la totalidad de los carbones de los cuales 9 están protonados y 4 son cuaternarios (que no aparecen en el DEPT). Los carbonos cuaternarios presentan 4 señales ubicadas en los desplazamientos químicos
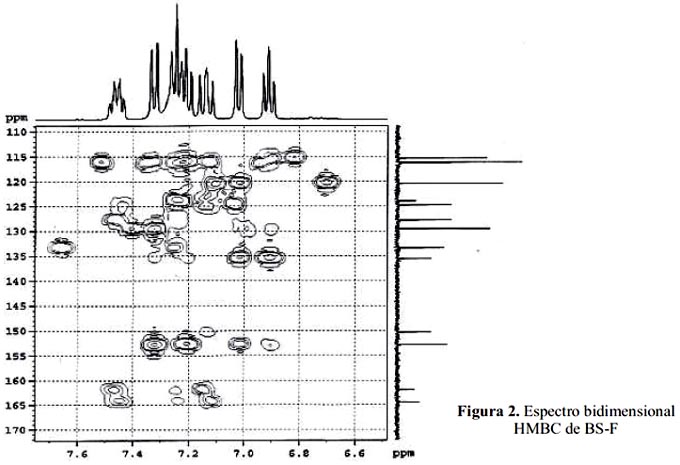
δ = 152,7; 135,6; 161,4 y 164,3 ppm. La señal de 150,2 ppm es característica del carbono imínico N=CH- reafirmando la formación de la base de Schiff. Las otras señales corresponden a carbonos aromáticos, que presentan los siguientes desplazamientos químicos: 115,2; 116,1; 123,9;124,7; 128,4; 129,4; 133,4 y 161,4 ppm (figura 2).
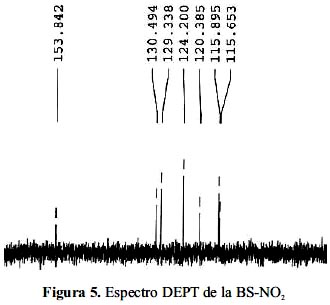
En la base de Schiff nitroderivada, los espectros RMN C13 y DEPT 135 permiten identificar las 11 señales atribuibles a la totalidad de los carbones de los cuales 2 están sobrepuestos, son equivalentes. Se presentan 7 señales que corresponden a carbonos que están protonados y 4 son cuaternarios (que no aparecen en el DEPT). Estos carbonos cuaternarios presentan 4 señales ubicadas en los desplazamientos químicos
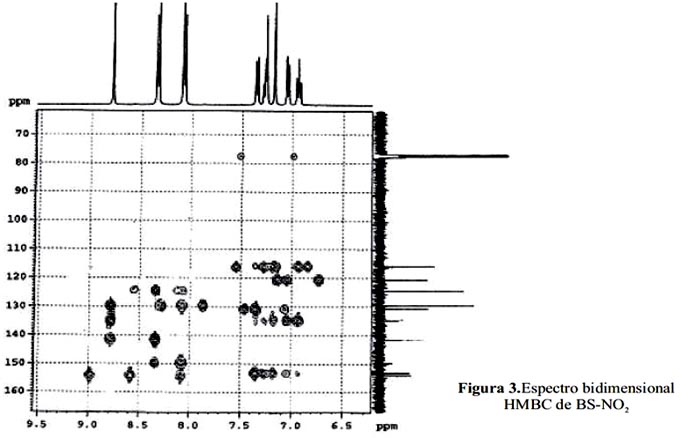
δ = 153,0; 134,7; 141,4 y 149,6 ppm. La señal de 154,0 ppm es característica del carbono imínico -N=CH- reafirmando la formación de la base de Schiff. Las otras señales corresponden a carbonos aromáticos, que presentan los siguientes desplazamientos químicos: 115,8; 116,1; 120,6;124,8; 124,8; 129,5; 129,5 y 130,7 ppm (figura 3).
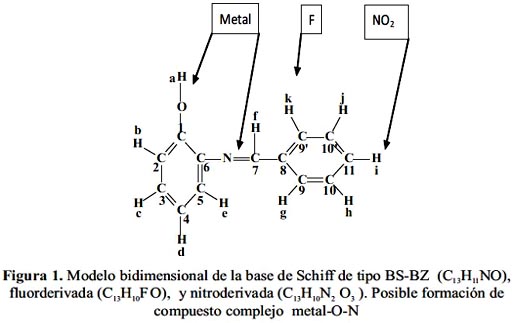
En resumen, los espectros RMN correspondientes a las bases de Schiff de fórmula C13H10 N2 O3 y C13H10 FO, respectivamente, permitieron asignar los núcleos de hidrógeno-1 y carbono-13 y encontrar sus correlaciones en la estructura. El análisis del espectro de RMN H1 se inició observando cada señal, se extrajo información básica como el corrimiento químico de los picos (
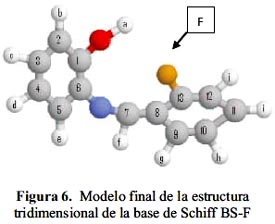
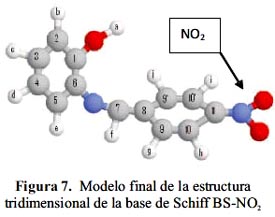
δ), el tipo de pico (doblete, triplete, o multiplete) y la relación de intensidades de los picos. En el espectro se identificaron los hidrógenos que presentan los compuestos.En el modelo bidimimensional propuesto (figura 1) los carbonos se marcaron en forma correlativa del 1 al 11 y los protones con letras minúsculas a-k.
Para verificar el modelo estructural propuesto se utilizaron los espectros bidimensionales COSYHH y HMBC (figuras 4 y 5).
El espectro bidimensional HMBC muestra las conectividades entre el H1 y el C13. Los carbonos cuaternarios presentan una o varias señales, pero no se observa acoplamiento, debido a que la interacción C-H no es directa, sino que el carbono interacciona con un protón que se encuentra a dos, tres y hasta cuatro enlaces de distancia. Este espectro proporciona información sobre los carbonos acoplados y no acoplados y además, sobre la conectividad de ellos, con los hidrógenos unidos a través de uno a cuatro enlaces.
La interpretación del espectro RMN bidimensional y HMBC de interacción C – H, a través de 2 ó 3 enlaces, para la base de Schiff BS-BZ, considerando la asignación de los núcleos de hidrógeno de la figura 1, es la siguiente:
El carbono Nº1 (152,4 ppm) no tiene hidrógeno directamente; interacciona con el hidrógeno b (7,2 ppm) a través de dos enlaces y con el hidrógeno c (7,1 ppm)a través de tres enlaces.
El carbono Nº2 (115,1 ppm) tiene el hidrógeno b directamente (7,2 ppm); interacciona con el hidrógeno c (7,1 ppm) a través de dos enlaces y con el hidrógeno d (7,2 ppm) a través de tres enlaces.
El carbono Nº3 (128,9 ppm) tiene el hidrógeno c directamente (7,1 ppm); interacciona con el hidrógeno b (7,2 ppm) a través de dos enlaces y con el d (7,2 ppm) a través de dos enlaces y con el e (7,2 ppm) a través de tres enlaces.
El carbono Nº4 (120,1 ppm) tiene el hidrógeno d directamente (7,2 ppm); interacciona con el hidrógeno c (7,1 ppm) a través de dos enlaces y con el hidrógeno e (7,2 ppm) a través de dos enlaces y con el b (7,2 ppm) a través de tres enlaces.
El carbono Nº5 (115,9 ppm) tiene el hidrógeno e directamente (7,2 ppm); interacciona con el hidrógeno c (7,1 ppm) a través de tres enlaces y con el hidrógeno d (7,2 ppm) a través de dos enlaces.
El carbono Nº6 (135,6 ppm) no tiene el hidrógeno directamente; interacciona con el hidrógeno e (7,2 ppm) a través de dos enlaces y con el hidrógeno d (7,2 ppm) a través de tres enlaces y con el f (8,7 ppm) a través de tres enlaces.
A partir del carbono 7 se producen importantes desplazamiento en los espectros debido a la presencia del fluor en la posición orto (9´ en la figura 1) y por la presencia del grupo nitro en la posición para (11 en la figura 1), por lo que resulta interesante cuantificar estos corrimientos (
Δ) en ppm, que se presentan en la tabla 1.
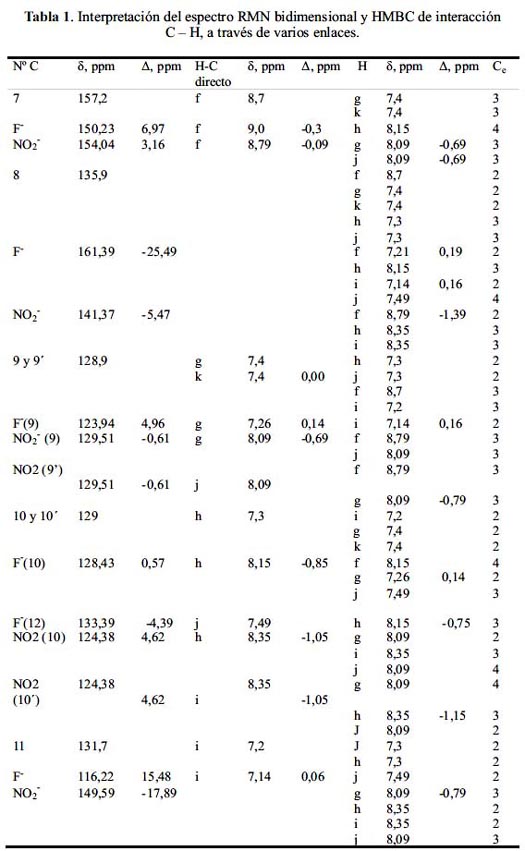
El carbono Nº7 (157,2 ppm) tiene el hidrógeno f directamente (8,7 ppm); interacciona con el hidrógeno g (7,4 ppm) a través de tres enlaces y con el hidrógeno k (7,4 ppm) a través de tres enlaces. Esta conectividad se presenta en la tabla 1 en la última columna como Ce.
El carbono Nº8 (135,9 ppm) no tiene el hidrógeno directamente; interacciona con el hidrógeno f (8,7 ppm) a través de dos enlaces y con el hidrógeno g (7,4 ppm) a través de dos enlaces, con el k (7,4 ppm) a través de dos enlaces, con el h (7,3 ppm) a través de tres enlaces y con el j (7,3 ppm) a través de tres enlaces.
El carbono Nº9 y su equivalente 9´ (128,9 ppm) tiene el hidrógeno g directamente (7,4 ppm) y k (7,4 ppm); interacciona con el hidrógeno h (7,3 ppm) a través de dos enlaces y con el hidrógeno j (7,3 ppm) a través de dos enlaces, con el f (8,7 ppm) a través de tres enlaces y con el i (7,2 ppm) a través de tres enlaces.
El carbono Nº10 (129,0 ppm) y su equivalente 10´, tiene el hidrógeno h directamente (7,3 ppm) y j (7,3 ppm); interacciona con el hidrógeno i (7,2 ppm) a través de dos enlaces, con el hidrógeno k (7,4 ppm) a través de dos enlaces y con el g (7,4 ppm) a través de dos enlaces.
El carbono Nº11 (131,7 ppm) tiene el hidrógeno i directamente (7,2 ppm); interacciona con el hidrógeno h (7,1 ppm) a través de dos enlaces, con el hidrógeno j (7,3 ppm) a través de dos enlaces, con el k (7,4 ppm) a través de dos enlaces y con el g (7,4 ppm) a través de dos enlaces. Llama la atención los considerables desplazamientos hacia campos bajos como altos, en los
espectros RMN C13 (segunda columna tabla 1) en el caso del carbono 8 de los flúor y nitroderivados estarían indicando una alta facilidad para formar compuestos de coordinación con metales de transición paramagnéticos.CONCLUSIONES
Se sintetizaron bases de Schiff flúor y nitro derivadas de la 2-aminofenol y se caracterizaron los compuestos integrando varias técnicas de investigación, como el microanálisis,
espectroscopia IR, RMN de H1 y de C13, para determinar las estructuras propuestas se utilizaron los espectros DEPT, HMBC y COSY que permiten en ambiente magnético de los sistemas de spin, proponer la posible estructura tridimensional de las moléculas (figuras 6 y 7) y facilitar el ambiente electrónico para formar enlaces de coordinación con diversos metales de transición. Se determinaron, además los corrimientos de los carbonos con respecto al tipo de sustituyente del aldehído en la base de Schiff.
BIBLIOGRAFÍA
1. Zamorano S., Camus J., Orellana A., M. Osorio M. Rev. Soc. Quim. Perú 2010; 76(2):187-192
2. Gaggelli E., Gaggelli N. y Valensin G. 2D NMR Methods for Structural Delineation of Copper(II) Complexes of Penicillin and Pilocarpine. Metal-Based Drugs. Volume 1 Issue 2-3, Pages 279-287. 1994.
3. Friebolin H. "Basic one-and two-dimensional NMR spectroscopy" Wiley-VCH, 1998.
4. Dudderck H., Dietrich W. y Toth G. "Elucidación Estructural por RMN" Ed. Springer. 3ra.ed 2000.
5. Dyer J.R. "Aplicaciones de espectroscopía de absorción en compuestos orgánicos" Editorial Prentice/Hall-Internacional. España. Pag 606.
6. Del Río. Determinación de la estructura de proteínas por RMN. Mensaje Bioquímico. Vol 2003 en http://bq.unam.mx/mensajebioquimico
7. Morris G.A. Modern NMR techniques for structure elucidation. Magn. Reson. Chem. 24:371 1986.
8. Peter K., Vollhard C., y Schore N.E. Química Orgánica. II edición Ed. Omega S.A. 1994.
9. Orellana J.A. y Osorio M. Seminario de Tesis para optar al titulo de Profesor de Química y al grado de Licenciado en Educación. Universidad de Playa Ancha ; 2007. Valparaíso, Chile.
10. Aedo D. y León N. Seminario de Tesis para optar al titulo de Profesor de Química y al grado de Licenciado en Educación. Universidad de Playa Ancha ; 2009. Valparaíso, Chile.
11. Niccolai N., Tiezzi E. and Valensin G., Chem. Rev. 1982, 82, 359.
12. Bertini I. and Luchinat C., NMR of Paramagnetic Species in Biological Systems, Benjamin Cummings, Menlo Park, CA 1986.
13. G. Navon and G. Valensin, Metal Ions in Biological Systems, H. Sigel ed., Marcel Dekker, New York, Vol.21. 1987.
Recibido el 24-01-2011
Aprobado el 14-02-2011













