Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.2 Lima abr./jun. 2011
TRABAJOS ORIGINALES
Caracterización microestructural de cenizas de Morinda citrifolia Linneo (noni)
Microstructural characterization of ashes from Morinda citrifolia Linneo (noni)
Zoila Garay1; Alcides López1,2,*; Otilia Acha De la Cruz1; Amanda Souza3; Ingrit Collantes1; Paula Olivera2; Julio Santiago2,4
1 Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Lima 25, Perú
2 Dirección de Investigación y Desarrollo, Instituto Peruano de Energía Nuclear. Av. Canadá 1470, Lima 41, Perú
3 Laboratorio de Extração, Universidade Paulista. Av. Paulista 900, Bela Vista, São Paulo, Brazil
4 Facultad de Química e Ing. Química, Universidad Nacional Mayor de San Marcos, Av. Venezuela S/N, Lima 1, Perú
* Correspondencia autor: alopez@ipen.gob.pe
RESUMEN
El noni, Morinda citrifolia Linneo, es muy utilizado en la medicina tradicional debido a su actividad antibacteriana, antiviral, antiparasitaria, anti-hongos, previniendo la proliferación de tumores y la diabetes. En este trabajo se presenta el estudio de la composición elemental y morfológica de las cenizas de las cáscaras, semillas, pulpa y hojas del noni. Se ha encontrado que estas cenizas son básicamente de naturaleza amorfa, excepto las que provienen de la calcinación de las hojas. Los compuestos principales que han sido identificados son: CaCO3 (semillas y hojas), CaC2O4 (cáscaras y semillas), KHCO3 (en todas las muestras excepto en las hojas), KCl (hojas) y SiO2 (hojas y pulpa). Se han podido observar nanopartículas (20 nm) en todas las muestras, excepto en las cenizas de hojas.
Palabras clave: Noni, caracterización microestructural, cenizas.
ABSTRACT
Noni, Morinda citrifolia Linnaeus, is widely used in traditional medicine due to its antibacterial, antiviral, antiparasitic and antifungal properties, preventing the proliferation of tumors and diabetes. This paper presents a study of the elemental and morphological composition of the ashes from the peels, seeds, pulp and leaves of the noni. These ashes are basically amorphous, except those from the annealing of the leaves. The main compounds that have been identified are the CaCO3 (seeds and leaves), CaC2O4 (peels and seeds), KHCO3 (all samples except in leaves), KCl (leaves) and SiO2 (leaves and pulp). Nanoparticles (20 nm) have been observed in all samples except in the ashes of leaves.
Key words: Noni, microstructural characterization, ashes.
INTRODUCCIÓN
El noni (Morinda citrifolia Linneo) conocida como queso de frutas, noni, morera india, etc; pertenece a la familia de las Rubiáceas y es nativa del sureste de Asia, Oceanía y de Asia tropical que se extiende desde la Polinesia a la India.
El noni es una planta mundialmente utilizada en la medicina tradicional para reforzar el sistema inmunológico debido a su actividad antibacteriana, antiviral, antiparasitaria, anti-hongos, lo que permite prevenir la proliferación maligna de tumores y la diabetes1-4. Por esta razón ha despertado un gran interés económico y actualmente se cultiva a escala comercial en los trópicos y en el hemisferio sur4.
El género Morinda comprende alrededor de 80 especies y están presentes exclusivamente en zonas de clima tropical5. Esta especie es un árbol pequeño con flores blancas, hojas anchas y brillosas; la fruta madura tiene un olor fétido, cuyo responsable sería el octanoato de metilo, componente mayoritario del aceite esencial de la cáscara, pulpa y semillas6.
Se han hecho muchos estudios para identificar los componentes presentes en el noni; hasta el momento se han aislado aproximadamente 200 compuestos en los que se observa antraquinonas glicosiladas, ácidos grasos y sus derivados, iridoides e iridoides glicosilados, lignanos, neolignanos, flavonoides glicosilados, fenilpropanoides, triterpenos y azúcares7-10. Sin embargo, no se ha reportado hasta el momento ningún estudio de la composición de las cenizas obtenidas por calcinación de las diferentes partes del noni.
Como referencia de otros estudios de cenizas de especies vegetales podemos mencionar el estudio por Microscopía Electrónica de Transmisión (MET) de las cenizas de la cáscara de arroz, donde se observó un 94% de SiO nanoestructurado11, 12. De otro lado, en un estudio realizado por MET y difracción de rayos X (DRX) sobre las cenizas del bagazo de la caña de azúcar calcinado a 800 y 1000 ºC se encontraron partículas menores a 90 micras que cambian su morfología y textura en presencia de calcio y silicio, observándose magnetita en sitios ricos en calcio, se encontraron además, que estas cenizas tienen alta influencia en la actividad puzolánica13, 14. En otro estudio con Microscopía Electrónica de Barrido (MEB) y MET se ha identificado la morfología de la parte orgánica que no ha sido completamente calcinada encontrándose que estas fibras retienen sus características originales15.
De acuerdo con lo mostrado, los vegetales tienen componentes inorgánicos que pueden mantener o cambiar su fase con los procesos y en especial con los tratamientos térmicos que se les practique y que han podido ser estudiadas a nivel microscópico. Tales trabajos han motivado una propuesta de estudio para las cenizas de diferentes partes de la M. citrifolia mediante MET y otras técnicas analíticas.
PARTE EXPERIMENTAL
Las muestras de la Morinda citrifolia fueron obtenidas en la ciudad de Pucallpa, departamento de Ucayali el 15 de mayo de 2007 y fueron depositadas en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos e identificadas por la Bióloga Joaquina Albán Castillo.
Las cenizas para el presente estudio fueron preparadas por calcinación a 400 oC en una mufla eléctrica y caracterizadas haciendo uso de un equipo de FTIR SHIMADZU ATR por reflectancia difusa; un microscopio electrónico de transmisión marca Philips EMG 300, en los modos de imagen y difracción de electrones; Microscopía de Luz (Meiji ENT), Difracción de Rayos X (Rigaku, modelo Miniflex, utilizando el intervalo 5º < 2θ < 80º con pasos 2è de 0,02º y avance de 2 s/paso), Fluorescencia de Rayos X en Energía Dispersiva. Se irradió la muestra con una fuente anular de Cd-109 durante 1000 segundos. La adquisición de datos se llevó a cabo con un sistema de espectrometría de rayos X, constituido principalmente por un detector de alta resolución, de Si (Li) marca CANBERRA Modelo SL 30165 (Resolución 165 eV para 5,89 keV) y un Analizador Multicanal PCAII The Nucleus. La evaluación de los espectros e identificación de los elementos presentes en las muestras se hizo utilizando el Software Quantitative X Ray Analysis System (QXAS) proporcionado por el Organismo Internacional de Energía Atómica.
Preparación de la muestra para análisis por MET
Luego de la calcinación, el tamaño de las partículas fueron homogenizadas mediante la molienda de las cenizas en un mortero de ágata. Dichas partículas fueron suspendidas en agua destilada para hacer que las partículas más grandes precipitaran más rápido, la parte alta de la suspensión, la cual contenía las partículas más pequeñas fueron tomadas con una pipeta Pasteur y colocadas sobre una membrana de parlodion de las rejillas portamuestras. Luego de evaporarse el agua a temperatura ambiente se procedió al análisis morfológico y su microestructura cristalina mediante la Difracción de Electrones de Área Selecta (DEAS).
RESULTADOS Y DISCUSIÓN
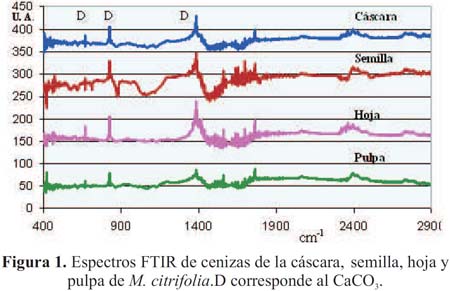
En el análisis por IR, figura 1, no se detecta estructuras orgánicas, pero sí se llega a identificar la presencia de CaCO3 en todas las muestras.
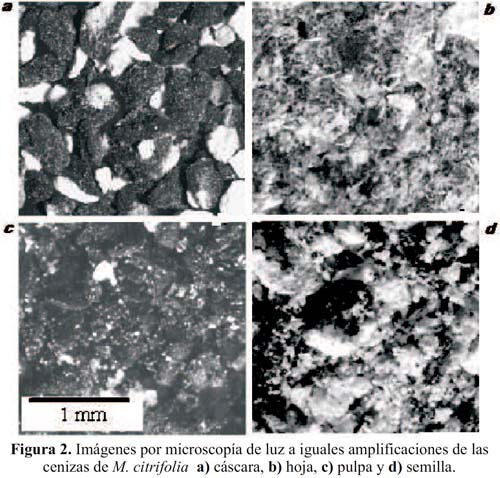
En el análisis por microscopía de luz se observa que las cenizas de cáscara de noni, figura 2a, presentan un aspecto granular con un diámetro medio de 0,5 mm distinguiéndose una fase oscura y otra clara, ambos duros para la molienda. Las cenizas de las hojas, figura 2b, son de color gris claro con aspecto de polvo muy suave para la molienda. Las cenizas de la pulpa, figura 2c, están constituidas de granos oscuros de aproximadamente 0,3 mm mezclados con un polvo blanco, ambos muy suaves para la molienda. En contraste con los casos anteriores, las cenizas de la semilla, figura 2d, tienen un color gris claro y granos blancos de 0,4 mm, suaves a la molienda.
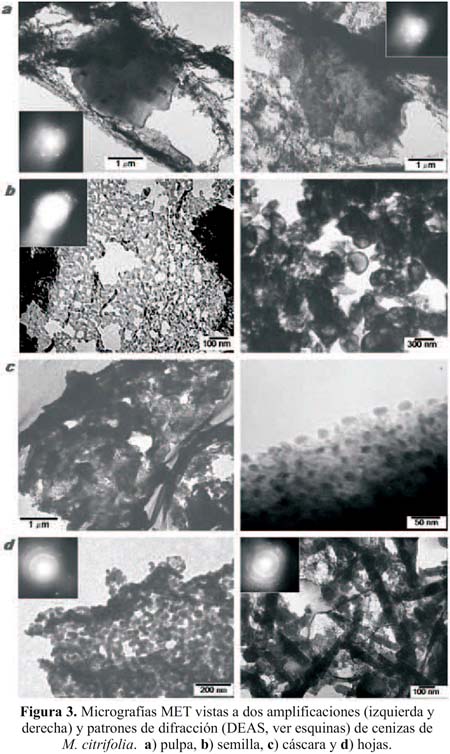
En el estudio de las cenizas por MET de los diferentes órganos de M. citrifolia se ha encontrado abundante material micro y nano estructurado. En la figura 3, en cada caso, se muestran las imágenes obtenidas por esta técnica, mostrando su respectiva barra de calibración con el propósito de estimar las formas y dimensiones de los diferentes componentes presentados en cada micrografía. Adicionalmente, en algunas de las micrografías se han incorporado en una esquina, su correspondiente patrón de difracción electrónico. Al hacer el estudio de dichos patrones se han encontrado coincidencias con estructuras variadas y se muestran en la tabla 1; éstas se obtuvieron al ser comparadas con las distancias interplanares de la base de datos JCPDF (Joint Comitte of Powder Diffraction File) usados para los análisis por difracción de rayos X. Según los espectros de DRX, figura 4, en las cenizas de cáscara se observa la predominancia de oxalato de calcio, CaC2O4, bicarbonato de potasio y KHCO3, siendo la mayor parte de este material de naturaleza amorfa.
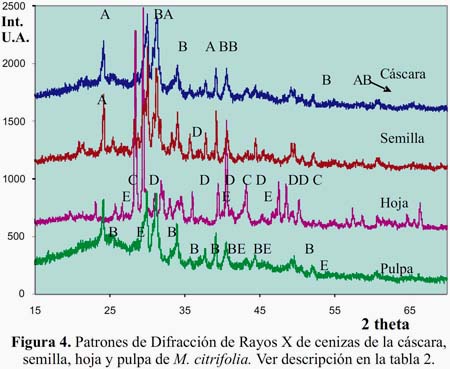
En la semilla se nota la predominancia del oxalato de calcio CaC2O4, bicarbonato de potasio KHCO3 y poca cantidad de carbonato de calcio, CaCO3. En la hoja se nota la abundancia de CaCO3 y KCl y pocas cantidades de SiO2 con una alta cristalinidad en toda la muestra. Finalmente, en la pulpa se ve una abundancia de KHCO3, presencia de SiO2 y una porción considerable de material amorfo. Estos datos están agrupados en la tabla 2.
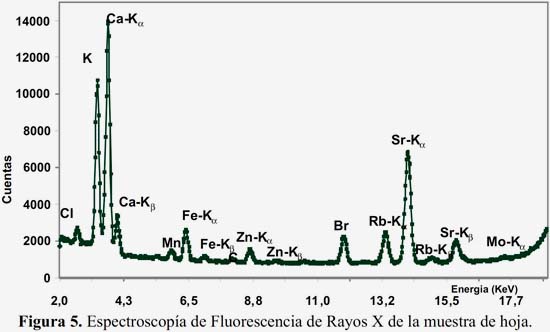
El análisis de las cenizas de las hojas por FRX, figura 5, permite identificar la presencia de potasio, calcio y estroncio y en menor cantidad relativa el cloro, hierro, manganeso, zinc, bromo y rubidio.
CONCLUSIONES
Las cenizas de las cáscaras, semillas, pulpa y hojas del noni son mayoritariamente de naturaleza amorfa, excepto las que provienen de la calcinación de las hojas. Los compuestos principales que han sido identificados son el CaCO3 (semillas y hojas), CaC2O4 (cáscaras y semillas), KHCO3 (en todas las muestras excepto en las hojas), cloruro de potasio KCl (hojas) y óxido de silicio SiO2 (hojas y pulpa). También se ha podido observar estructuras nanoparticuladas, tanto amorfas como cristalinas, de aproximadamente 20 nm en todas las muestras, excepto en las cenizas de hojas.
AGRADECIMIENTOS
Al Dr. José Solís V. de la Dirección de Investigación y Desarrollo del Instituto Peruano de Energía Nuclear y a la Bióloga Joaquina Albán Castillo, del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos.
BIBLIOGRAFÍA
1. Kumar S, Saravanan M, Illanchezian S, Antibacterial, Antifungal and Tumor cell suppression potential of Morinda citrifolia fruit extracts. International Journal of Integrative Biology. 2008; 3(1):44-49. [ Links ]
2. Rodríguez M, Boffill M, Lorenzo G, Sánchez P, López R, Verdecía B, Díaz L, Evaluación preclínica del efecto antiinflamatorio del jugo de Morinda citrifolia L. Revista Cubana de plantas médicas. 2005; 10(3-4). [ Links ]
3. Palu A, Seifulla R,. West B, Morinda citrifolia L. (noni) improves athlete endurance: Its mechanisms of action. Journal of Medicinal Plants Research. 2008; 2(7):. 154-158. [ Links ]
4. Pawlus A, Kinghorn D, Review of the ethnobotany, chemistry, biological activity and safety of the botanical dietary supplement Morinda citrifolia (noni). Journal of Pharmacy and pharmacology. 2007; 59: 1587-1609. [ Links ]
5. Potterat O, Hamburger M, Morinda citrifolia (Noni) Fruit-Phytochemistry, pharmacology, Safety, Planta Medica. 2007; 73: 191–199. [ Links ]
6. González S, Estrada A, del Val R, Rosales T, Andrade I, Hernández A, Determinación de compuestos volátiles en compuestos de Noni (Morinda citrifolia L.) mediante microextracción en fase sólida y cromatografía de gases, XVII Congreso Nacional de Ingeniería Bioquímica. Acapulco, marzo 2010. Disponible en http://biomedbiotec.homelinux.org/congreso2010/Extensos/Prod_naturales/NAT71ALE20091209.pdf [ Links ]
7. García C, Kim N, Bich N, Tillan J, Romero A, Darío O, Fuste V, Metabolitos secundarios en los extractos secos de Passiflora incarnata L., Matricaria recutita L. y Morinda citrifolia L. Secondary metabolites in Passiflora incarnate L., Matricaria recutita L. and Morinda citrifolia L. dry extracts. Revista Cubana de Plantas Medicinales. 2009; 14(2). Disponible en http://scielo.sld.cu/scielo.php?pid=S1028-47962009000200004&script=sci_arttext [ Links ]
8. Simonsen J, Note on the Constituents of Morinda citrifolia. Journal of the Chemical Society Transactions. 1920; 117:561–564. [ Links ]
9. Chunhieng T, Hay L, Montet D, Detailed study of the juice composition of noni (Morinda citrifolia) fruits from Cambodia, Fruits. 2005; 60:13-24. [ Links ]
10. Chan-Blanco Y, Vaillant F, Pérez A, Bellevelle M, Zúñiga C, Brat P, The Ripening and aging of noni fruits (Morinda citrifolia L.): Microbiological Flora and Antioxidant Compounds, Journal of the Science of Food and Agriculture. 2007; 87: 1710–1716. [ Links ]
11. Proctor A, X-ray diffraction and scanning electron microscope studies of processed rice hull silica, Journal of the American Oil Chemists' Society. 1990; 67(9):576-584. [ Links ]
12. Sánchez N, Solache M, Teresa M, Fripiat J, Pacheco G, Saniger J, Bulbulian S, Selectivity of the Cd2+ /Ca2+ exchange on modified rice hull silica. Environmental Technology. 2009; 30(3):269-275. [ Links ]
13. Payá J, Monzó J, Borrachero M, Díaz L, Ordóñez L, Sugar-cane bagasse ash (SCBA): studies on its properties for reusing in concrete production. Journal of Chemical Technology & Biotechnology. 2002; 77 (3):321-325. [ Links ]
14. Frýas M, Villar E, Valencia E, Characterization of sugar cane straw waste as pozzolanic material for construction: Calcining temperature and kinetic parameters. Waste Management 2007; 27:533–538. [ Links ]
15. Batra V, Urbonaite S, Svensson G, Characterization of unburned carbon in bagasse fly ash. Fuel. 2008; 87(13-14):2972-2976. [ Links ]
Recibido el 27-10-2010
Aprobado el 19-01-2011















