Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.2 Lima abr./jun. 2011
TRABAJOS ORIGINALES
Evaluación de la actividad antioxidante del pisco peruano mediante voltametría cíclica
Assessment of the antioxidant activity of peruvian pisco through cyclic voltammetry
Adolfo La Rosa Toro G.1; Fredy Vigo López1; Golfer Muedas Taipe1
1 Laboratorio de Electroquímica Aplicada, Facultad de Ciencias. Universidad Nacional de Ingeniería. Casilla: 31-316. Av. Túpac Amaru 210, Rímac, e-mail: toro@uni.edu.pe
RESUMEN
El pisco es uno de los productos de origen peruano que ha incrementado su demanda en los últimos años. El pisco legítimo, como un producto destilado de la fermentación de la uva muestra actividad antioxidante, atribuido a la presencia de derivados fenólicos, contenidos en las uvas. La voltametría cíclica es una técnica rápida y de alta sensibilidad mediante la cual es posible evaluar la actividad antioxidante de algunas muestras naturales debido a su respuesta electroactiva. El presente trabajo emplea la técnica de voltametría cíclica como un método de identificación de la autenticidad del pisco evaluando su actividad antioxidante, comparándola con el método de neutralización del radical libre 2,2-difenil-1-picrilhidracil (DPPH). Se evaluaron muestras de pisco legítimo y adulterado obtenidas en el mercado nacional.
Palabras clave: Pisco, antioxidante, potencial de oxidación, voltametría cíclica.
ABSTRACT
Pisco is a peruvian beverage which has increased its demand over the last years. Legitimate pisco is a distilled product of the fermentation of grapes; due to this, it shows antioxidant activity attributed to the presence of phenolic derivatives (which are contained in grapes). Cyclic voltammetry is a rapid and high sensitivity technique; this characteristic allows this technique for evaluating the antioxidant activity of some natural samples due to its electroactive response. This technique is used in this research project as a method for identifying the authenticity of pisco by evaluating its antioxidant activity. Results obtained by cyclic voltammetry are then compared with the method of neutralization of free radical 2,2-diphenyl-1-picrylhydrazyl (DPPH). Samples of legitimate and adulterated pisco obtained in the national market were evaluated.
Key words: Pisco, antioxidant, oxidation potencial, cyclic voltammetry.
INTRODUCCIÓN
En la actualidad se están realizando numerosas investigaciones en busca de antioxidantes naturales con la finalidad de ser empleados en la industria de alimentos, cosméticos y atención de la salud con el objetivo de prevenir, aliviar y/o curar procesos degenerativos que ocurren como consecuencia de actividad de los radicales libres en nuestro organismo1. El pisco es un producto con identidad peruana que ha incrementado su venta en forma significativa; sin embargo, la estrategia de comercialización no considera su importante contribución como fuente de antioxidantes naturales. Los antioxidantes son sustancias que retardan el inicio y disminuyen la velocidad de oxidación de las sustancias oxidables en el organismo. Por el modo de acción, los podemos clasificar como: primarios (interrumpen la reacción en cadena generando un radical menos activo) y secundarios (o preventivos)2.
Los antioxidantes fenólicos ocupan una situación privilegiada, pues son excelentes donadores de electrones o de hidrógeno y, además, sus radicales intermediarios son relativamente estables3.
Los trabajos previos, realizados por otros autores, indican que los componentes presentes en los vinos son en su mayoría de origen fenólico4-7. La acción antioxidante de los compuestos fenólicos destacados en el vino es beneficiosa para la salud ya que aportan protección contra la agresión de los radicales libres de nuestro organismo, y que en condiciones aeróbicas conduce a la degradación oxidativa no controlada de moléculas biológicas trascendentales para la vida. Asimismo, el pisco, al ser un producto derivado de la fermentación controlada de la uva, presenta actividad antioxidante debido a los derivados fenólicos provenientes principalmente del proceso fermentativo8. El contenido de compuestos fenólicos y la actividad antioxidante de los mismos es dependiente de muchos factores, entre ellos: el tipo de uva, proceso de fermentación, temperatura del proceso de destilado9, pureza del pisco, etc. Por lo que el análisis de contenido de antioxidantes puede ser un buen indicador de la legitimidad y calidad del pisco.
En el presente trabajo se analiza el contenido de antioxidantes empleando los métodos de neutralización del radical libre 2,2-difenil-1-picrilhidracil (DPPH), (figura 1) y el de voltametría cíclica; este último fue utilizado por otros autores como una técnica para la identificación de vinos10-12.
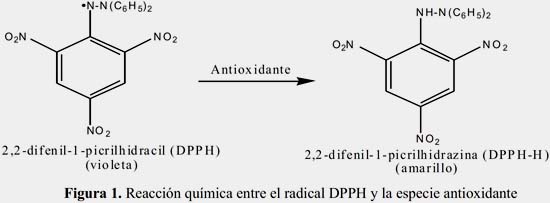
Actualmente, la única prueba de autenticidad de los piscos es el procedimiento de la Norma Técnica Nº 211.001:2006 que involucra varios requerimientos de análisis físicos y químicos, El presente trabajo demuestra que la evaluación de la actividad antioxidante puede diferenciar en forma concluyente el pisco legítimo frente a otros adulterados (licores de fantasía). La evaluación de la actividad antioxidante se realiza aplicando dos métodos: el método electroquímico, mediante la voltametría cíclica (VC) y el método químico, mediante la neutralización del radical libre 2,2-difenil-1-picrilhidracil (DPPH).
PARTE EXPERIMENTAL
Materiales y reactivos
Muestras de pisco:
SA y SB = Pisco legítimo de origen artesanal de la zona de Mala - Perú
SC y SD = Pisco de marcas registradas
SE y SF = Pisco adulterado
Reactivos: El radical libre 2,2-difenil-1-picrilhidracil (DPPH), la rutina y los solventes utilizados fueron de grado para análisis. Asimismo, se utilizó un buffer de fosfato de sodio 0,07 M de pH 7,2/EtOH 1:1 (v/v).
Los voltagramas (VC) fueron obtenidos utilizando un potenciostato PGSTAT 12 equipado con SCAN GEN que opera bajo el sistema GPES 4.9 Eco Chemie B. V. con un sistema de tres electrodos compuesto de carbón vítreo (electrodo de trabajo), platino (electrodo auxiliar) y Ag/AgCl/KCl 3M (electrodo de referencia).
En el análisis de antioxidantes empleando el método de neutralización de radical libre 2,2- difenil-1-picrilhidracil (DPPH) se utilizó el espectrofotómetro UV-Visible LABMED.
Métodos
Voltametría cíclica (VC)
Mediante la técnica de VC es posible la evaluación del potencial rédox de los compuestos electroactivos (fenólicos) mediante un barrido de potencial en un rango previamente definido. La muestra de pisco (4 mL), fue adicionada a 40 mL de una mezcla de etanol y buffer de fosfato de sodio 0,07 M de pH 7,2 (1:1). La solución resultante fue purgada con gas N2 manteniendo la atmósfera inerte durante todo el proceso. Se obtuvo los voltagramas (VC) realizando un barrido de potencial desde -1,00 V hasta 0,92 V a una velocidad de 100 mV/s. El carbón vítreo fue pulido antes de cada experimento utilizando una lija Nº 1200 y alúmina en polvo de 0,3 micras de Buehler micropolish. La reproducibilidad del potencial del pico voltamétrico es del orden de ± 0,01 V, dependiendo del pretratamiento de la superficie del electrodo. Para cada muestra de pisco se han obtenido varios voltagramas obteniéndose así los picos de potencial de oxidación característicos; además, se realizó la voltametría cíclica del estándar de rutina para corroborar la exactitud del método electroquímico.
Neutralización del radical libre DPPH
El método a emplear es el de neutralización del radical libre 2,2-difenil-1-picrilhidracil (DPPH), en este caso, la solución del reactivo de DPPH es de color violeta y presenta un máximo de absorbancia a 515 nm.
La reacción química consiste en que el radical libre DPPH sustrae un átomo de hidrógeno proveniente de un donador (antioxidante); producto de este cambio se desarrolla un cambio de color, de violeta a amarillo, como resultado de la disminución de la concentración del radical libre; esta intensidad fue leída en el espectrofotómetro después de un tiempo de 30 minutos de reacción. La muestra de pisco utilizada, previa a la reacción con DPPH, fue diluida con etanol absoluto en la relación de volúmenes de 1:10. Luego 1250 μL de la solución obtenida se mezcla con 500 μL de DPPH 0,3 mM.
La evaluación de la actividad antioxidante se expresa como porcentaje, y se determina de acuerdo a la siguiente fórmula:

La relación (Am - Ab)/A control nos indica el exceso de DPPH que no ha reaccionado con los compuestos antioxidantes en la muestra.
RESULTADOS Y DISCUSIÓN
Análisis de muestras empleando el método de voltametría cíclica (VC)
Todos los voltagramas fueron obtenidos en solución de Buffer de fosfato de sodio 0,07 M, pH 7,2/EtOH 1:1 (v/v); empleando electrodo de trabajo de carbón vítreo (GC), electrodo auxiliar de platino y electrodo de referencia de Ag/AgCl (KCl 3 M), la velocidad de barrido empleada fue de 100 mV/s.
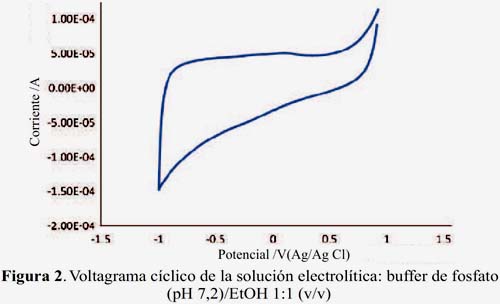
En la figura 2 se presenta el voltagrama del electrodo de GC obtenido en la solución buffer (blanco) que se utiliza como electrolito de fondo para el análisis de las muestras. En el gráfico, en el rango de potencial entre -0,80 a 0,60 V, no se observa reacciones rédox significativas, constituyendo una buena línea base para la evaluación de la actividad antioxidante de las muestras de pisco.
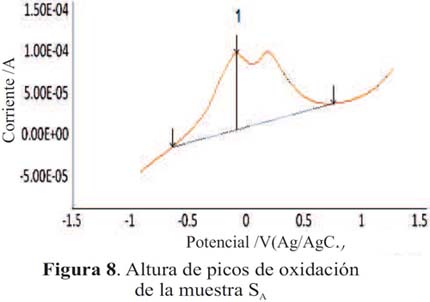
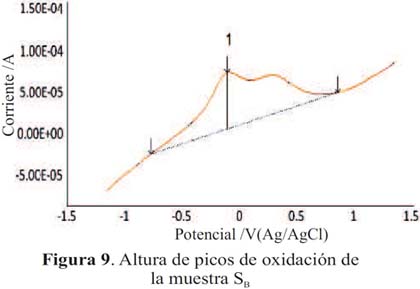
Los voltagramas de las figuras 3 y 4 corresponden a las muestras SA y SB (pisco de origen artesanal) y las figuras 5 y 6, muestran los voltagramas de las muestras SC y SD (pisco de marcas registradas). En todos los casos los voltagramas muestran la formación de dos picos de corriente consecutivos en el barrido de potenciales en sentido anódico. El primer pico aparece entre -0,082 y -0,076 V y el segundo pico de oxidación entre 0,094 y 0,132 V, ambos asignables a la oxidación de los compuestos fenólicos característicos de las sustancias antioxidantes. En el barrido en sentido catódico se observa los correspondientes picos de reducción de las sustancias previamente oxidadas. En la figura 7 se presenta el voltagrama correspondiente a la rutina, un antioxidante tipo flavonoide que se encuentra presenta en las uvas y frutas cítricas13.
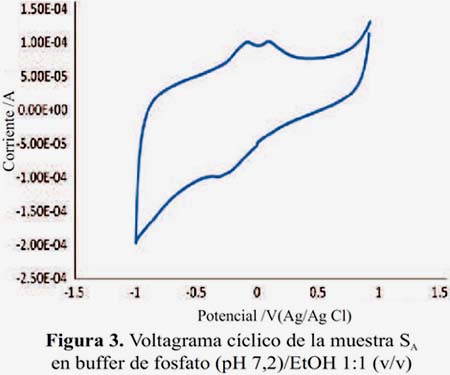
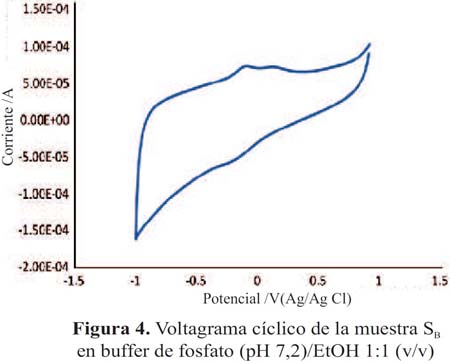
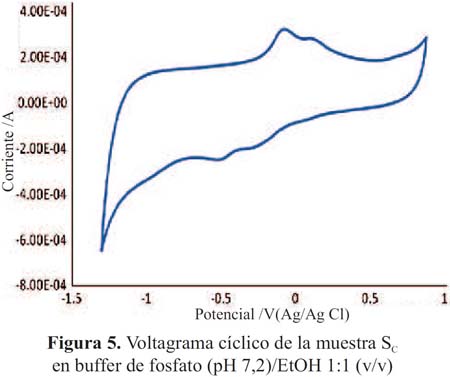
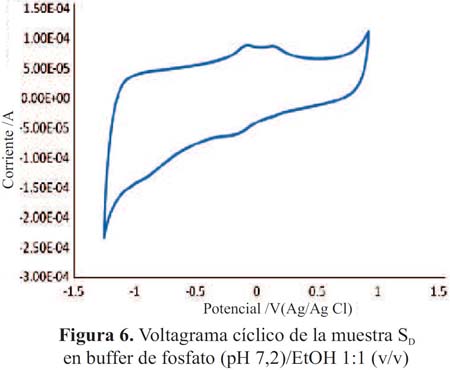
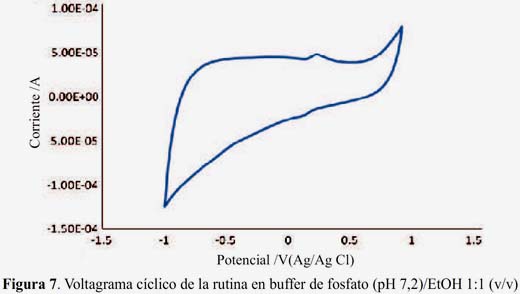
En la tabla 1 se presenta los potenciales de oxidación y sus correspondientes picos anódicos de las muestras de pisco legítimo y los de rutina (0,227 V); este último utilizado con fines comparativos.
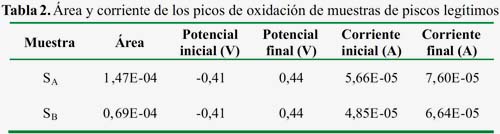
En la tabla 2 se presenta el área integrada de los picos de oxidación de las muestras de piscos SA y SB (figuras 8 y 9) el cual es proporcional a la altura de pico (cantidad de corriente). La muestra SA presenta mayor área por lo que presenta una mayor capacidad antioxidante en comparación de la muestra SB.
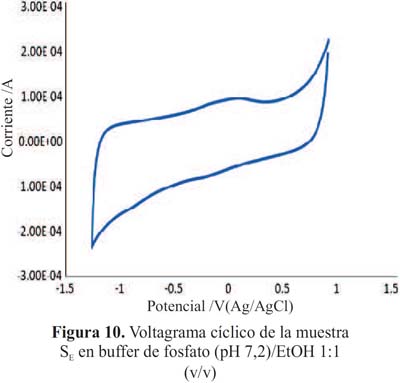
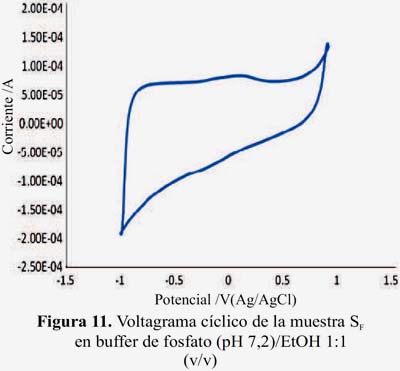
Las figuras 10 y 11 muestran los voltagramas de la muestras de piscos adulterados: SE y SF. En los gráficos no se observan picos de oxidación asignables a procesos rédox debido a la ausencia de componentes electroactivos (antioxidantes).
Análisis de muestras empleando el método de neutralización del radical libre DPPH
Se ha utilizado el método de neutralización del radical libre DPPH con la finalidad de verificar los resultados obtenidos empleando el método electroquímico.
Se ha analizado las muestras de pisco legítimo SA y SB, pisco adulterado SF y etanol absoluto.
De acuerdo a los resultados mostrados en la tabla 3, sólo las muestras de pisco legítimo SA y SB muestran actividad antioxidante. Las muestras de pisco adulterado, así como de etanol absoluto, muestran porcentajes negativos, indicando que en estas dos últimas muestras no contiene antioxidantes.
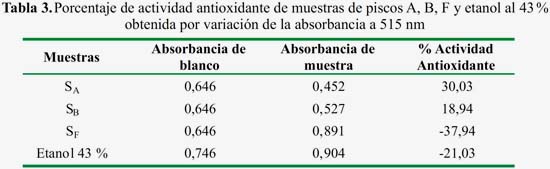
En la tabla 4 se presenta los resultados comparativos de la actividad oxidante de ambos métodos, con el objetivo de normalizar los valores. Los resultados se presentan como la razón de la actividad oxidante de las muestras SA y SB

CONCLUSIONES
- En el análisis electroquímico por voltametría cíclica, el perfil voltamétrico obtenido de las muestras de pisco legítimo (SA-SD) presenta un comportamiento similar, la formación de dos picos de oxidación. El primer pico aparece entre -0,082 y -0,076 V y el segundo pico de oxidación entre 0,094 y 0,132 V, revelando la presencia de más de un compuesto antioxidante. La comparación con el perfil voltamétrico de muestras de pisco adulterado revelan que estos últimos no presentan ninguna señal de oxidación.
- Según el análisis químico por DPPH, las muestras de pisco legítimo presentaron un porcentaje de actividad antioxidante positivo mayor a 18,94 %, mientras que las muestras de pisco adulterado mostraron un porcentaje de actividad antioxidante negativa (-37,94 %), lo que indica la ausencia de compuestos antioxidantes.
- De acuerdo a la tabla 4, los resultados obtenidos mediante el método de DPPH y VC, son cercanos entre sí, mostrando que la voltametría cíclica es una buena alternativa para la identificación del pisco legítimo y cuantificación de su actividad antioxidante.
AGRADECIMIENTOS
Agradecemos al Laboratorio de Investigación en Electroquímica Aplicada y al Instituto de Investigación de la Facultad de Ciencias de la Universidad Nacional de Ingeniería, por el apoyo brindado para la realización y presentación del trabajo.
BIBLIOGRAFÍA
1 Castillo P, Lock O. Rev Soc Quím Perú 2005; 71 (4): 227-236. [ Links ]
2 Lock Sing O. Investigación Fitoquímica. Métodos en el Estudio de Productos Naturales. Lima: Fondo editorial PUCP; 1994. [ Links ]
3 Chávez R, Plaza A, Lock O. Revista de Química 1996; 10 (1): 71-101. [ Links ]
4 Ksenzhek O, Petrova S. Electroanalysis 2007; 19 (2-3): 389-392. [ Links ]
5 Ángeles M A. Eur Food Res Technol 2003; 216: 445-448. [ Links ]
6 Ángeles M A. J. Agric. Food Chem 2002; 50 (11): 3112-3115. [ Links ]
7 Shleev S V. Applied Biochemistry and Microbiology 2004, 40 (3): 304-309. [ Links ]
8 Kanner J, Frankel E, Granit R, German B, Kinsellatss J. J. Agric. Food Chem. 2004; 42: 64-69. [ Links ]
9 Larrauri J, Ruperez P, Saura-Calixto F, J. Agric. Food Chem. 1997; 45: 1390-1393. [ Links ]
10 Born M, Carrupt P, Zini R, Brée F, Tillement J, Hostettmann K, Testa B. et al. Helvetica Chimica Acta 1996; 79: 1147-1158. [ Links ]
11 Kook L, Mbwambo Z, Chung HaSook, Luyengi L, Gamez E, Mehta R, Kinghorn D, Pezzuto J. et al. Combinatorial Chemistry & High Troughput Screening 1998; 1: 35-46. [ Links ]
12 Zielinska D, Wiczkowski W, Konrad Piskula M. J. Agric. Food Chem. 2008; 56: 3524- 3531. [ Links ]
13 Makhotkina O, Kilmartin P. Journal of Electroanalytical Chemistry 2009; 633: 165-174. [ Links ]
Recibido el 16-03-2011
Aprobado el 13-04-2011














