Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.2 Lima abr./jun. 2011
TRABAJOS ORIGINALES
Aislamiento de ácido úsnico y parietina de Caloplaca saxicola Hoffm
Isolation of the usnic acid and parietin of the Caloplaca saxicola Hoffm
Olivio Castro Mandujano1*; Ana Pastor de Abram1; Ingrit E. Collantes Díaz2
1* Pontificia Universidad Católica del Perú, Departamento de Ciencias - Sección Química. Av. Universitaria 1801, San Miguel, Lima 32, Perú ocastro@pucp.edu.pe.
2 Laboratório de Extração da Universidade Paulista. Av. Paulista 900, Bela vista, C.E.P. 01310-100 São Paulo, Brasil.
RESUMEN
En el presente trabajo se investigó la Caloplaca saxicola (Hoffm.), recolectada cerca de la laguna de Chinchaycocha (Carhuamayo - Cerro de Pasco), a una altitud de 4100 msnm. A 240 gramos de muestra, se sometió a una extracción acetónica por maceración; se procedió a separar diversos componentes del extracto, empleando la cromatografía en columna, con el sistema cloroformo-acetona aumentando la cantidad de acetona; luego, las fracciones obtenidas se purifican empleando técnicas cromatográficas y recristalizaciones. Finalmente, se elucidaron y se determinaron las estructuras de los sólidos obtenidos, analizando sus espectros de IR, RMN H1, RMN C13 y EM; éstos son: ácido úsnico y parietina.
Palabras clave: Liquen, Caloplaca saxicola, ácido úsnico, parietina.
ABSTRACTS
In the present work there was investigated the Caloplaca saxicola (Hoffm.), gathered near Chinchaycocha's lagoon (Carhuamayo - Cerro de Pasco), to an altitude of 4100 msnm. To 240 grams sample, it surrendered to an extraction acetonic for maceration; one separated diverse components of the extract, using the chromatography in column, with the system chloroform - acetone increasing the quantity of acetone; then, the obtained fractions they purified using chromatographic techniques and recrystallizations. Finally, they were elucidated and there decided the structures of the obtained solids, analyzing his spectra of IR, H1NMR, C13NMR, and MS; these are: usnic acid and parietin.
Key words: Lichen, Caloplaca saxicola, usnic acid, parietin.
INTRODUCCIÓN
El liquen es un organismo simbiótico conformado por un hongo y un alga; se estima que existen aproximadamente 18500 especies; pueden ser encontrados desde las regiones árticas hasta las tropicales, desde planicies hasta regiones montañosas y bajo condiciones acuáticas y desérticas. Se presenta sobre rocas, corteza, hojas de árboles, suelos, etc. Producen una gran variedad de metabolitos primarios como carbohidratos, aminoácidos y metabolitos secundarios (esteroides, terpenos, cromonas, xantonas, naftoquinonas, antronas, antraquinonas etc). Muchos de ellos son característicos o propios de los líquenes; se les llama compuestos liquénicos, existiendo aproximadamente 1050 metabolitos secundarios ya identificados; ellos son agrupados de acuerdo al tipo de estructura, denominándose dépsidos, depsidonas, ácidos úsnicos y dibenzofuranos2.
Recientemente hay un gran interés en el teñido textil con pigmentos naturales por su alta compatibilidad y su no toxicidad. Las antraquinonas son compuestos empleados para estos fines; por ello, actualmente, se están realizando investigaciones en el cultivo de líquenes a partir de hongos3. En una investigación de la especie Rumex crispus fue aislado la antraquinona parietina, la cual tiene actividad antifúngica de 30 a 10 µg/mL, valor que la hace tan eficiente como el fenarimol y el polioxin4. El ácido úsnico es un metabolito secundario propio de líquenes; presenta actividad inhibidora de tumores; es analgésico, también se usa como conservante de cremas cosméticas5.
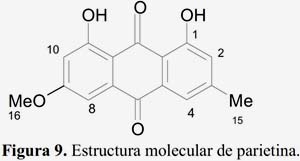
El artículo de revisión del género Caloplaca6 reporta el estudio de antraquinonas en 253 especies, de las cuales 226 de ellas reportan la presencia de parietina y sólo cinco presentaban ácido úsnico; en este estudio no estaba incluido la especie C. saxicola. El objetivo de este trabajo es abordar la identificación de los componentes mayoritarios del liquen C. saxicola porque hasta hoy en día no se encontró estudio fitoquímico de la especie en estudio.
PARTE EXPERIMENTAL
Colecta de la muestra y la identificación taxonómica
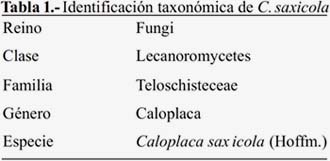
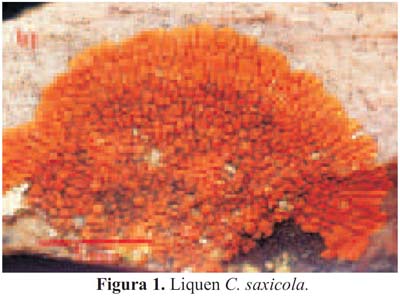
El liquen estudiado se encontró sobre piedras, en el distrito de Carhuamayo, provincia Cerro de Pasco, departamento de Junín, a una altitud de 4100 msnm, cerca de la laguna de Chinchaycocha. La determinación taxonómica (tabla 1) fue realizada por la Dra. Mónica T. Adler de la Universidad de Buenos Aires, Argentina. C. saxicola (figura 1), pertenece a la familia Teloschisteceae, la cual consiste de tres pequeños géneros: Teloschistes, Xanthoria y Fulgensia, y además, de un género amplio, llamado Caloplaca con más de 1000 especies reconocidas. El género Caloplaca tiene seis subgéneros: Pyrenodesmia, Leproplaca, Gasparrinia, Xanthocarpia, Gyalolechia y Caloplaca7. La especie C. saxicola Hoffm., es un liquen crustáceo areolado en el centro y hacia los márgenes, formando lóbulos anaranjados; tiene apotecio circular, plano, sésil de 5 mm diámetro, con borde talino y epitecio anaranjado. Talo con córtex superior, heterómero con clorobionte Trebouxia sp. Apotecio lecanorino asca con ocho ascosporas elipsoidales; paráfisis con septos y ramificación en el ápice. Talo K + (púrpura). Habita en laderas pedregosas y cumbres rocosas8.
Aislamiento del ácido úsnico y parietina
La muestra limpia, seca y molida (240 g), se sometió a una extracción acetónica por maceración por dos veces; el extracto fue concentrado en rotaevaporador hasta un volumen de 25 mL; luego fue concentrado con nitrógeno hasta sequedad (2,35 g), obteniéndose un extracto pastoso, el que fue sometido a cromatografía en columna, usando como fase estacionaria sílica gel y como fase móvil la mezcla de solventes cloroformo:acetona, con polaridad creciente en la siguiente proporción: 10:0, 9:1, 8:2, 7:3, 6:4, , 1:9, 0:10, se calculó 80 fracciones, las cuales fueron sometidas a cromatografía en capa delgada (sobre cromatofolios de sílica gel eluyendo con mezcla de solventes tolueno:acetato de etilo:ácido acético glacial (6:4:1) y se revela con una solución de metanol ácido al 10% con (ácido sulfúrico) seguida de calentamiento; fueron reunidas las fracciones desde 23 hasta 34 y desde 65 hasta 72 por separado, ya que contenían un solo compuesto cada una de ellas, después de sucesivas etapas de purificación se obtuvo dos compuestos cristalinos de color amarillo y naranja, respectivamente.
Determinación del punto de fusión
El punto de fusión del ácido úsnico fue determinado en un aparato Fisher-Johns.
Análisis por Ultravioleta-Visible (UV-Vis)
Los espectros de UV-Visible fueron registrados entre 250 – 700 nm en un espectrofotómetro Ultravioleta-Visible, Lambda 2, L.A, Perkin Elmer. El solvente utilizado para diluir la muestra fue etanol de grado para análisis, de Merck.
Análisis Infra Rojo (IR)
Los espectros de IR fueron obtenidos con el Espectrómetro Infrarrojo, FT - IR, serie 1600, Perkin Elmer. Se prepararon pastillas de bromuro de potasio (KBr) que contenía una muestra al 3,5%.
Análisis por Cromatografía Líquida de Alta Eficiencia (CLAE)
Los cromatogramas fueron hechos en un cromatógrafo de marca Kontron HPLC 450 con detector UV 430 y autoinyector 360; fue usada como fase estacionaria una columna Spherisorb 5 ODS Kontron de 5ìm, 250 x 4,6 mm a temperatura ambiente. La muestra fue inyectada (20 µL de 0,02mg/mL), solubilizada en acetona, usando como fase móvil el solvente A: agua bidestilada 1% H3PO4 y solvente B: MeOH 100%. La corrida para eluir los compuestos usó inicialmente Sol. B al 30% por 1minuto; después de 14minutos alcanzó el 70%; luego en los 15 minutos siguientes, llegó al 100% de sol, eluyendo 18 minutos adicionales. Los compuestos fueron detectados a 245nm.
Análisis por Resonancia Magnética Nuclear (RMN)
Los espectros de Resonancia Magnética Nuclear 1H y de 13C fueron registrados en un espectrómetro Varian INOVA DPX-300, operando a 300 y 75 MHz. Los espectros fueron obtenidos en CDCl3.
RESULTADOS Y DISCUSIÓN
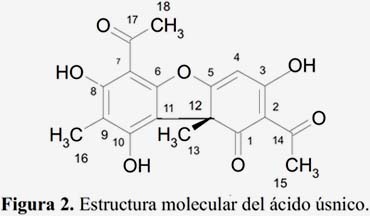
Los cristales en forma de agujas de color amarillo (300 mg) provenientes de las reunión de las fracciones 23-34 son solubles en CHCl3, poco soluble en MeOH y Me2CO, con punto de fusión de 203-204°C. Estos datos preliminares indican que se trataría del ácido úsnico, ya conocido para los autores, figura 2. Se obtuvo un espectro de UV-Vis en etanol, figura 3; comparando este espectro con el de la literatura9 presenta concordantes máximos de absorbancia.
Este compuesto fue inyectado en un equipo CLAE, comparado con un patrón de ácido úsnico siguiendo el método establecido en la literatura10, la comparación con el patrón indicaba que se trataba del ácido úsnico con retención 28,103 min.
El espectro de RMN 1H (figura 4) presenta señales características de grupos metil con desplazamiento químico en 1,76 ppm del C-13; 2,09 ppm del C-16 y 2,67 ppm C-15 y C-18, una señal en 5,98 ppm del hidrógeno de C-4, las señales a 11,02 ppm del hidrógeno OH del C- 10; 13,31 ppm del hidrógeno OH del C-8 y 18,84 ppm del hidrógeno del C-3, tabla 2, compara estos resultados con los de la literatura11,12,13.
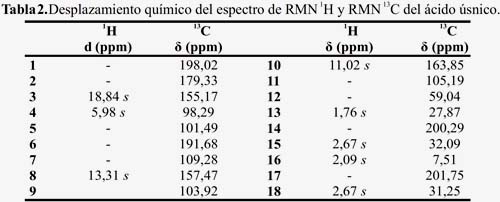
El espectro de RMN 13C (figura 5) presenta 18 carbonos, 4 de ellos de grupos metilos, uno está protegido en campo alto a 7,51 ppm de C-16; 27,87 del C-13; 31,25 del C-18; 32,09 ppm del C-15; un pico en 59,04 ppm, característicos de carbono cuaternario C-12; las señales de los grupos carbonilos en 198,02 ppm C-1; 200,29 ppm C-14 y 201,75 ppm C-17, tabla 2. El análisis espectroscópico confirma que el metabolito aislado es el ácido úsnico.
Los cristales con forma de agujas de color anaranjado (126 mg) provenientes de la reunión de las fracciones 65-72, son solubles en CHCl3, MeOH y Me2CO. El espectro de UV-Vis (figura 6), en etanol (0,01%), dio valores de absorbancia máxima a 223, 251, 264, 287 y 433 nm, confirmando una estructura fuertemente conjugada.
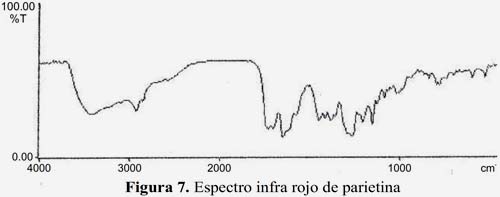
En el espectro IR (en KBr), figura 7, se observan bandas de absorción a 3438 cm-1 OH, 3035 cm-1 vibración C-H aromático, 2921 cm-1 vibración asimétrica del CH3 2844 cm-1 vibración simétrica de CH3, 1691cm-1 C=O; 1630 cm-1 C=C conjugado; 1295 cm-1 y 1035 alargamiento del C-O-C simétrico y antisimétrico16.
Este compuesto fue inyectado en un CLAE (el cromatograma obtenido es la figura 8) y fue comparado con un patrón de parietina siguiendo el método establecido por la literatura10; la comparación de los tiempos de retención (31,732 min) con el patrón, indicaba que se trataba de parietina (figura 9); lo que se comprobó con el análisis de los otros espectros.
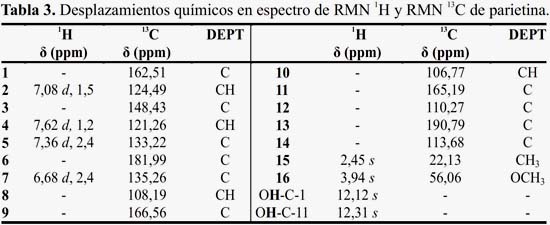
El espectro de RMN 13C (figura 10) presenta 16 carbonos: a 22,13 de CH3 a 56,06 ppm de metoxilo C-16; 190,79 ppm y 181,99 ppm característicos de carbonilos de cetona y 12 picos entre 167 y 106 ppm de carbonos aromáticos. Por esta información se propone que la estructura posea 2 anillos bencénicos, con sustituyentes CH3 y OCH3, pudiendo ser una estructura derivada de antraquinona.
El espectro DEPT (figura 11) proporciona datos de carbonos enlazados directamente con hidrógenos; se confirma la propuesta del metilo y del metoxilo; se observa 4 carbonos aromáticos enlazados a hidrógenos y 10 carbonos cuaternarios; los desplazamientos químicos 124,49; 121,26; 133,22; 135,26 ppm son carbonos CH y a 22,13 y 56,06 ppm se asignan a CH3 y OCH3, respectivamente. Las señales a 162,51; 148,43; 133,22; 181,99; 135,26; 166,56; 165,19ppm corresponden a carbonos cuaternarios. Se propone que el metabolito aislado corresponde a parietina. La comparación con datos bibliográficos lo confirma y esta antraquinona se llama 1,8-dihidroxi-6-metoxi-3-metil-9,10-antracenediona.
En el espectro RMN 1H (figura 12) se observan las señales: CH3 en 2,45 ppm singulete (s); (OCH3) a 3,94 ppm (s); también se observa la presencia de 4 hidrógenos aromáticos a 6,68 ppm H de C-10 duplete (d), con constante de acoplamiento (J) de 2,4 Hz; 7,08 ppm H de C-2 d con J de 1,5 Hz; 7,36 ppm H de C-8 d con J de 2,4 Hz, y 7,62 ppm H de C-4 d con J de 1,2 Hz; estos 4 hidrógenos presentan multiplicidad de hidrógenos acoplando en meta y dos singletes, correspondiente al grupo OH en 12,12 ppm del C-1 y 12,31 ppm del C-11, como mostramos en la tabla 3, donde se observaron los hidrógenos con sus respectivas multiplicidades; la comparación de estas señales con parietina disponibles en la literatura16,17,18, permitió verificar que se trataba del mismo compuesto.
CONCLUSIONES
Hasta el momento, el liquen Caloplaca saxicola Hoffm. no presenta ningún estudio fitoquímico. En este artículo presentamos el aislamiento e identificación por técnicas espectroscópicas de los compuestos mayoritarios presentes: el ácido úsnico (300mg) y la antraquinona parietina (126mg); estos compuestos han sido por primera vez reportados. El aislamiento de los metabolitos tuvo un rendimiento de 12,77% para el ácido úsnico y 5,36% para la antraquinona parietina.
AGRADECIMIENTOS
Esta investigación fue realizada gracias a la colaboración de la Dra. Mónica T. Adler, de la Universidad de Buenos Aires, Argentina, por la identificación botánica del liquen estudiado y al Dr. John Elix de la Universidad Nacional de Australia por los análisis de HPLC.
BIBLIOGRAFÍA
1. Molnár, K.; Farkas, E, Current Results on Biological Activities of Lichen Secondary Metabolites: a Review, Zeitschrift fur Naturforsch C, (2010), 65c, 157-173. [ Links ]
2. Honda, N.K.; Vilegas, W.; A Química dos Liquenes, Química Nova, (1998), 21, 110 - 124. [ Links ]
3. Nagia, F.A.; El-Mohamedy, R.S.R., Dyeing of Wool with Natural Anthraquinone Dyes from Fusarium oxysporum, Dyes and Pigments, (2007), 75, 550-555. [ Links ]
4. Choi, G.J.; Lee, S.W.; Jang, K.S.; Kim, J.S.; Cho, K.Y.; Kim, J.C.; Effects of Chrysophanol, parietin, and nepodin of Rumex crispus on Barley and Cucumber Powdery Mildews; Crop Protection, (2004), 23, 1215-1221. [ Links ]
5. Huneck, S.; The Significance of Lichens and their Metabolites; Naturwissenschaften, (1999), 86, 559-570. [ Links ]
6. Santesson, J.; Anthraquinones in Caloplaca; Phytochemistry, (1970), 9, 2149-2166. [ Links ]
7. Sochting, U. ; Lutzoni, F. ; Molecular Phylogenetic Study at the Generic Boundary between the Lichen-Forming Fungi Caloplaca and Xanthoria (Ascomycota, Teloschistaceae) ; Mycological Research, (2003), 107(11), 1266–1276. [ Links ]
8. Ramírez, A.; Cano, A.; Líquenes de Pueblo Libre, una localidad andina en la Cordillera Negra (Huaylas, Ancash, Perú); Revista Peruana de Biología, (2005), 12(3), 383- 396. [ Links ]
9. Stocker-Wörgötter, E.; Elix, J.A.; Grube, M.; Secondary Chemistry of Lichen-forming Fungi: Chemosyndromic Variation and DNA-analyses of Cultures and Chemotypes in the Ramalina farinaceae Complex; The Bryologist, (2004), 107(2), 152-162. [ Links ]
10. Feige, G.B. ; Lumbsch, H.T. ; Huneck, S. ; Elix, J.A. ; Identification of Lichen Substances by a Standardized High-performance Liquic Chromatographic Method , Journal of Chromatography, (1993), 646, 417-427. [ Links ]
11. Rashid, M.A.; Majid, M.A.; Quader, M.A.; Complete NMR Assignments of (+)-usnic acid, Fitoterapia, (1999), 70, 113-115. [ Links ]
12. König, G.M.; Wright, A.D.; 1H and 13C-NMR and Biological Activity Investigations of Four Lichen-derived Compounds; Phytochemical Analysis; (1999), 10, 279-284. [ Links ]
13. Castro Mandujano, O.N.; Aislamiento del ácido úsnico de Flavoparmelia caperata y su determinación cuantitativa por Espectroscopía UV, en Diez Líquenes; Revista de la Sociedad Química del Perú (2010), 76 (4), 389-399. [ Links ]
14. Scott A.I., Interpretation of the Ultraviolet Spectra of Natural Products, The Macmillan Company, (1964), pag. 288. [ Links ]
15. Chu, X.; Sun, A.; Liu, R.; Preparative Isolation and Purification of Five Compounds from the Chinese Medicinal Herb Polygonum cuspidatum Sieb. Et Zucc by High-speed Counter-current Chromatography; Journal of Chromatography A, (2005), 1097, 33-39. [ Links ]
16. Edwards, H.G.M.; Newton, E.M.; Wynn-Williams, D.D.; Coombes, S.R.; Molecular Spectroscopic Studies of Lichen Substances 1: Parietin and Emodin; Journal of Molecular Structure; (2003), 648, 49-59. [ Links ]
17. Manojlovic, I.; Bogdanovic-Dusanovic, G.; Gritsanapan, W.; Manojlovic, N.; Isolation and Identification of Anthraquinones of Caloplaca cerina and Cassia tora*; Chemical Paper, (2006), 60(6), 466-468. [ Links ]
18. Smetanina, O.F.; Kalinovskii, A.I.; Khudyakova, Y.V.; Slinkina, N.N.; Pivkin, M.V.; Kuznetsova, T.A.; Metabolites from the Marine Fungus Eurotium repens; Chemistry of Natural Compounds, (2007), 43(4), 395-398. [ Links ]
Recibido el 30-11-2010
Aprobado el 03-05-2011





















