Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.3 Lima jul./set. 2011
TRABAJOS ORIGINALES
Estudio de la cinética de biosorción de iones plomo en pectina reticulada proveniente de cáscaras de cítricos
Kinetic studies of lead ion biosorption by crosslinked pectin from citrus peel
Víctor R. García Villegasa* ; Andrea G. Yipmantin Ojedaa,b ; Enrique G. Guzmán Lezamab,c ; Rodolfo Pumachagua Huertasa ; Holger J. Maldonado Garcíab,c
a Escuela de Química, Universidad Nacional Federico Villarreal, Lima 10. Vrgv03@gmail.com
b Departamento de Química, Universidad Peruana Cayetano Heredia, Lima 31
c Facultad de Quím. e Ing. Quím., Universidad Nacional Mayor de San Marcos, Lima 1
RESUMEN
La pectina es una mezcla de polisacáridos que presentan principalmente unidades de ácido galacturónico en su estructura y se encuentra formando parte de la pared celular de vegetales, como los cítricos. Los grupos carboxílicos en su forma aniónica se caracterizan por tener tendencia hacia la captación de especies catiónicas como Pb2+. La fuente empleada para la obtención de pectina, mediante hidrólisis ácida (pH 1,4, temperatura: 80ºC tiempo: 60 min.), fueron las cáscaras de naranja. Para disminuir la capacidad de hidratación e hinchamiento de la pectina cuando se encuentra en medio acuoso se realizó la reticulación empleando formaldehído. El rango de pH en el cual se obtuvo la máxima capacidad de sorción fue 4,5 – 5,5. En la mayoría de los casos el modelo matemático de cinética de pseudo primer orden se ajustó mejor que pseudo segundo orden a la cinética de biosorción de plomo en pectina, tanto para diferentes concentraciones iniciales del metal en la solución, como para diferentes cantidades de biosorbente.
Palabras clave: biosorción, pectina, plomo, reticulacion, cinética.
ABSTRACT
Pectin is a mixture of polysaccharides containing galacturonic acid units, as main compound, into its structure and it is found by forming a part of the vegetables cell wall, such as citrus. Carboxylic groups in their anionic form are characterized for their binding capacity for cationic species, such as Pb2+. Orange peels were used as a source of pectin, through acid hydrolysis (pH 1,4, temperature: 80°C, time: 60 min.). For decreasing the hydration and swelling capacity when pectin is found in aqueous solution medium, crosslinked by using formaldehyde was made. Maximum sorption capacity was obtained at pH between 4,5 and 5,5. The most of the cases pseudo first order mathematic kinetic model fit it better than Pseudo second order to kinetic biosorption of lead in pectin for either different initial metal concentrations in solution or different amounts of biosorbent.
Key word: biosorption, pectin, lead, crosslinked, kinetic.
INTRODUCCIÓN
La contaminación ambiental y el deterioro de algunos ecosistemas han sido intensificados debido al incremento de la actividad industrial, generando una acumulación de metales pesados y compuestos sintéticos. Las aguas residuales provenientes de las actividades mineras y metalúrgicas son consideradas como la mayor fuente de contaminación de metales pesados y la necesidad de métodos económicos y efectivos para la remoción de estos metales ha conllevado al desarrollo de nuevas tecnologías de separación.1 Muchas de estas sustancias tóxicas que contienen metales pesados tienden a persistir indefinidamente en el medio ambiente, comprometiendo la salud de animales y personas mediante su acumulación e ingreso a la cadena alimenticia.2 Para remover materia orgánica de alta masa molecular o sustancias inorgánicas presentes en aguas residuales, se emplea carbón activado como sustancia adsorbente o resinas de intercambio iónico, los cuales son efectivos, pero tienen alto costo. Un adsorbente natural de bajo costo es la pectina, la cual presenta una propensión a adsorber metales pesados, tales como Hg, Cd y Pb, que se encuentran como principales contaminantes de las aguas residuales y de los cuales el plomo es quien presenta mayor afinidad a la biosorción en pectina por quelación.3
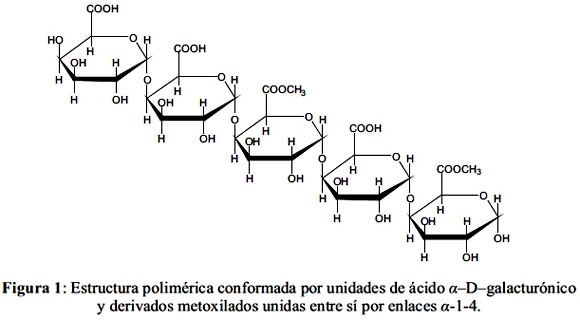
Las pectinas están conformadas por polisacáridos aniónicos heterogéneos que se encuentran en la pared celular de vegetales.4 Estos polisacáridos están conformados, principalmente, por unidades de ácido 1-4
-α-D-galactopiranosilurónico (comúnmente llamado ácido α-D-galacturónico), mediante los cuales algunos de los grupos carboxilo se encuentran metoxilados.5 El mecanismo de biosorción de plomo en pectinas provenientes de cítricos está determinado principalmente por el números de grupos de ácidos carboxílicos presentes, los cuales son mayores en pectina de bajo grado de metoxilación y se encuentran en menor cantidad cuando tienen altos grados de metoxilación.6 En la figura 1 se muestra la unión de las unidades estructurales del ácido α-D-galacturónico y sus derivados metoxilados mediante los enlaces α-1-4.El uso de pectinas como biosorbente natural para el tratamiento de efluentes industriales contaminados con metales pesados puede incrementar su valor. Sin embargo, aunque se puedan dar un uso similar a las de algunas resinas sintéticas u otros biosorbentes, la pectina también presenta un grado de solubilidad e hidratación como para ser usada de manera directa. Dronnet et al. (1998) demostraron que la reticualción con formaldehído reduce la capacidad de hinchamiento y retención de agua en pectina de pulpa de betarraga; no obstante, disminuye la capacidad de adsorción de Zn2+ y Pb2+.
Por otra parte, la rapidez de fijación del soluto en el biosorbente es estudiada por la cinética de biosorción, la cual expresa el cambio de concentración del soluto en el tiempo y es definida por la ley de velocidad. Entre los modelos cinéticos ampliamente empleados por muchos autores se encuentran el modelo de la cinética de pseudo primer orden o ecuación de Lagergren y el modelo de pseudo segundo orden o ecuación de Ritchie7,8.
Modelo de pseudo primer orden
Este modelo asume la biosorción como una reacción de primer orden en cada uno de sus reactantes a partir de:
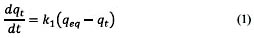
Al resolver la ecuación diferencial tomando en cuenta los límites de integración desde t = 0 hasta t = t se tiene:
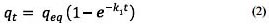
Donde:
-
qeq
qt
k1
La constante k1 se puede determinar por análisis de regresión no lineal de la gráfica:
-
qt
Modelo de pseudo segundo orden
En el modelo de Pseudo Segundo Orden la ecuación cinética está representada por:
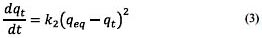
Al resolver la ecuación diferencial tomando en cuenta los límites de integración desde t = 0 hasta t = t se tiene:
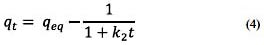
Donde:
-
K2
Las constantes k2 y qeq se pueden determinar por análisis de regresión no lineal de la gráfica: qt vs t.
El objetivo de este trabajo fue encontrar el pH óptimo y el modelo matemático que represente mejor la cinética de biosorción de plomo en pectina reticulada extraída de cáscaras de naranja.
PARTE EXPERIMENTAL
Extracción del material péctico
Se pesó y lavó 100 g de cáscaras de naranja seca y pulverizada hasta tres veces en 2 L de agua caliente. Después del tercer lavado se realizó la hidrólisis en 2 L de agua acidulada a pH 1,4, manteniendo la temperatura en 80º C durante una hora.9 Se empleó HCl para ajustar el pH. Luego se filtró y se retiró el bagazo. El material péctico fue precipitado añadiendo al filtrado un volumen igual de etanol de 96º. La pectina coagulada que se obtuvo después de filtrar el precipitado fue lavada varias veces con etanol de 96º hasta eliminar la mayor cantidad de impurezas. Se dejó secar en placas de vidrio a temperatura ambiente (22º C) y se obtuvo el porcentaje de rendimiento.
Tratamiento con formaldehído
Se suspendió 13 g de pectina seca extraída de la cáscara de naranja en 100 ml de H2SO4 0,1 M y suficiente cantidad de formaldehído hasta obtener una ratio molar (formaldehído/unidades de ácido galacturónico en la muestra) comprendido entre 70 y 100. La suspensión se sometió a reflujo con agitación en baño de agua a 50ºC. Después de 4 horas, se dejó enfriar a temperatura ambiente. El residuo fue filtrado y lavado con agua ultra pura, etanol de 96º y acetona.
Finalmente, se dejó secar como se describe en el apartado anterior.10
Obtención del pH óptimo en biosorción de Pb2+
Se preparó 2 L de solución de Pb(NO3)2 100 ppm y se vertieron a 10 frascos de vidrio hasta un volumen de 100 ml ajustando cada muestra a diferentes pH (1,14; 1,54; 2,02; 2,51; 3,02; 3,42; 3,95; 4,52; 5,03; 5,66). Se añadieron 25 mg de biosorbente
(0-100μm) a cada muestra y se colocaron, seguidamente, en un agitador mecánico a 250 rpm, durante 72 h y a temperatura ambiente. Una vez transcurrido el tiempo, el biosorbente se separó de las muestras mediante filtración; se midió el pH final de las soluciones y se procedió a determinar la concentración residual de plomo (ceq) en dichas soluciones mediante la técnica de Espectrometría de absorción atómica de llama (equipo modelo Perkin Elmer AAnalyst 100).Cinética de biosorción de Pb2+
Para el estudio de la cinética con diferentes concentraciones de metal se prepararon tres soluciones de 1L de sal de plomo (II) cada una de 19,2; 37,8 y 55,7 ppm y se ajustó el pH a 5,5 con HNO3 0,5M. Se colocaron las soluciones en un agitador magnético, poniendo 100 mg de biosorbente (0-100
μm) en contacto con cada solución. Seguidamente se procedió a registrar el tiempo de reacción, considerando t = 0 el instante en que el biosorbente se pone en contacto con la solución. A partir de t = 0 se tomaron muestras de 10 ml periódicamente hasta t = 600 min. Finalmente, se determinó la concentración de plomo (ct) para cada muestra mediante la técnica de espectrometría de absorción atómica de llama (equipo modelo Perkin Elmer AAnalyst 100).Para el estudio de la cinética con diferentes cantidades de biosorbente se prepararon tres soluciones de 1L de sal de plomo (II) de 53,9 ppm y se ajustó el pH a 5,5 con HNO3 0,5M. Se colocaron las soluciones en un agitador magnético, poniendo en contacto, con cada solución, 150,2; 250,4 y 351,7 mg de biosorbente (0-100
μm). Se determinó la cinética de biosorción para cada sistema de la misma forma en que se describe para la cinética con diferentes concentraciones del metal.Procesamiento de datos
La capacidad de adsorción se puede determinar mediante la siguiente relación:
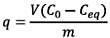
Donde:
-
q:
V:
C0:
Ceq:
m
Para el procesamiento de datos se empleó el programa estadístico Origin 6.0
RESULTADOS Y DISCUSIÓN
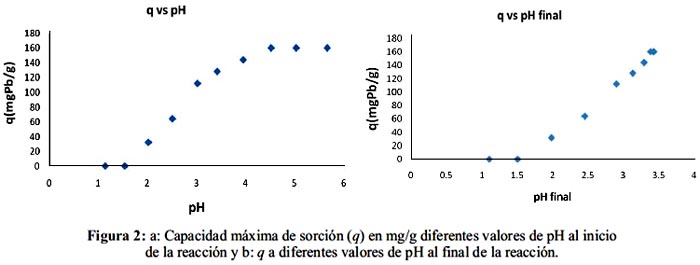
El pH en el cual se produce la mayor adsorción corresponde a la presencia de la mayor cantidad posible de carboxilos en forma aniónica. En la figura 2a se observa que la mayor adsorción se produce a valores de pH inicial de la solución de entre 4,5 y 5,5. Por encima de esos valores el plomo precipita. La figura 2b muestra valores de pH después de haberse producido la quelación de la pectina con el metal. La disminución del pH después de la quelación se debe a la desprotonación de los grupos carboxílicos de ácido galacturónico desde el momento que se ponen en contacto con el medio acuoso. La disminución del pH a valores bajos de pH inicial se hace menos considerable debido a que el exceso de iones H+ en la solución evita que la mayoría de los grupos carboxílicos se desprotonen.
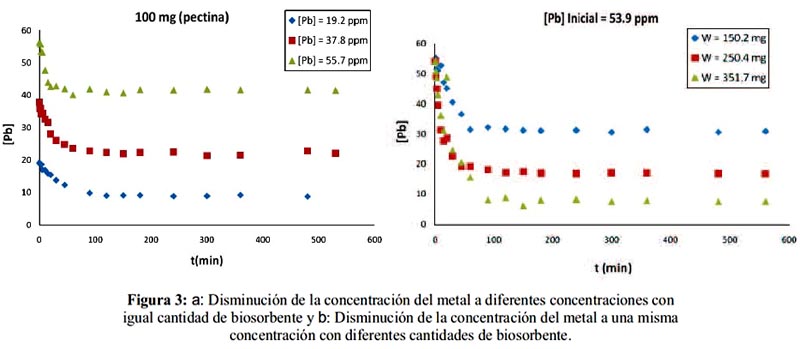
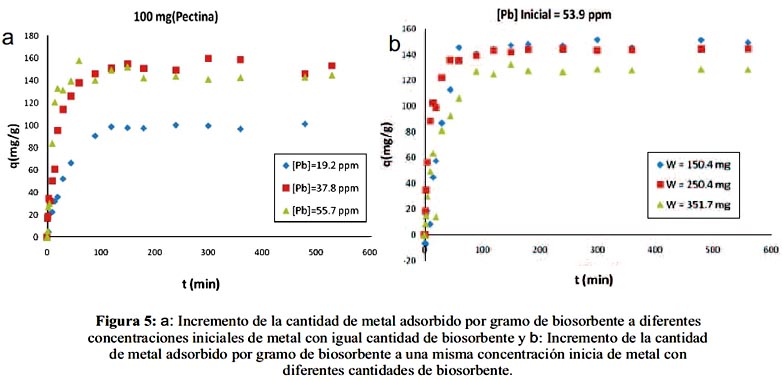
En la figura 3a se observa que el tiempo de saturación del adsorbente es menor para el sistema con mayor concentración de metal ([Pb] = 55,7 ppm) debido a que existe mayor población de iones Pb2+ para ocupar los sitios activos. En la figura 3b se observa que a una mayor cantidad de adsorbente (351,7 mg), también aumenta la cantidad de sitios activos para la adsorción reflejándose mayor disminución en la concentración del metal no adsorbido, en comparación con las otras cantidades de biosorbente.
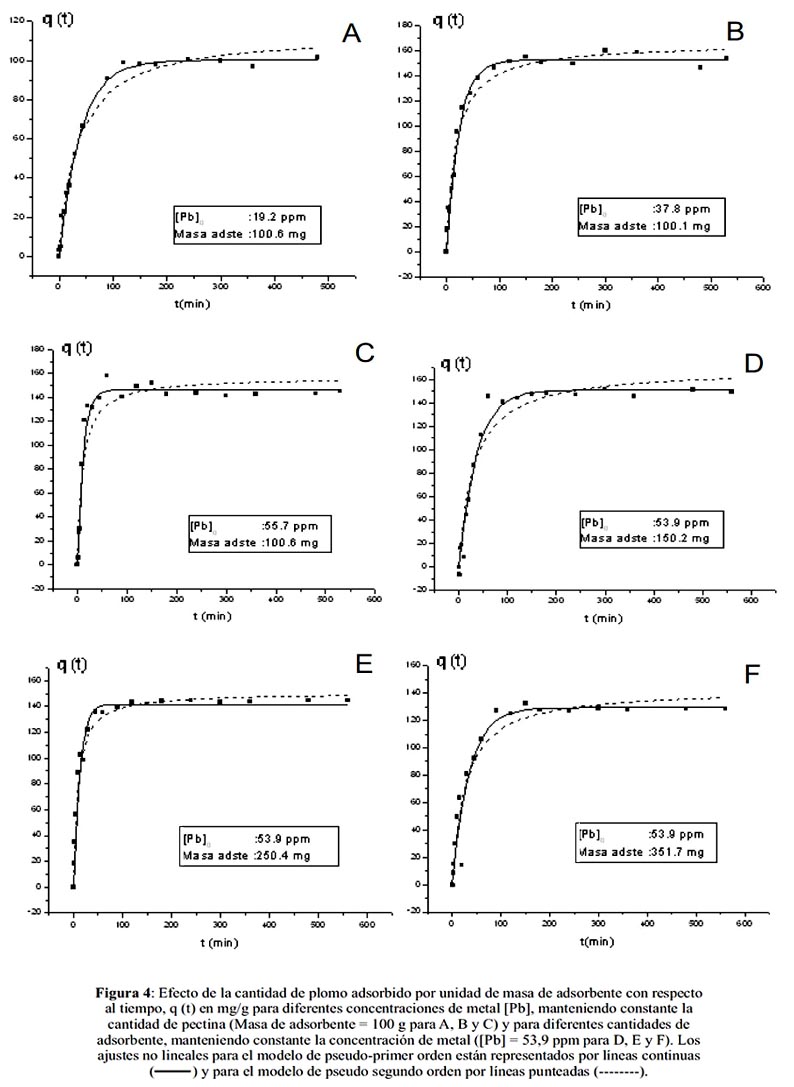
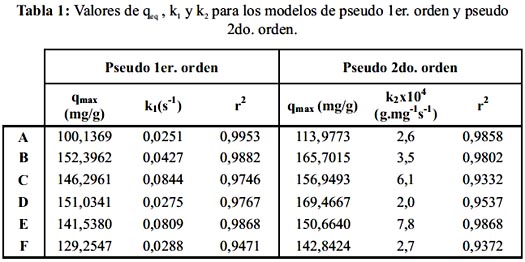
En la figura 4 y la tabla 1 se muestra la cinética y los parámetros cinéticos, respectivamente, tanto para diferentes concentraciones iniciales del metal en la solución, como para diferentes cantidades de biosorbente. De acuerdo a estos resultados la cinética corresponde a una interacción de pseudo primer orden para la mayoría de los casos. El coeficiente de correlación no lineal se ajusta mejor a este tipo de modelo con excepción del sistema E en donde se obtiene el mismo coeficiente de correlación para ambos modelos. La figura 4 también muestra que para los seis casos la concentración en el equilibrio se alcanza en menor tiempo (tiempo de saturación del adsorbente) cuando se aplica el modelo de pseudo primer orden (línea continua), distinguiéndose con mayor exactitud el momento en que se alcanza el equilibrio. En la curva del ajuste para el modelo de pseudo segundo orden la qe no se distingue de manera precisa, por lo que se obtienen mayores valores para qe.
En la figura 5, como consecuencia de lo observado en la figura 3, los incrementos de la cantidad de plomo adsorbido por unidad de masa de pectina en el equilibrio son mayores para los dos sistemas con soluciones de plomo más concentradas (37,8 y 55,7 ppm) (figura 5a) y decrecen cuando se aumenta la cantidad de biosorbente (figura 5b).
Para ambos modelos cinéticos se puede observar que cuando se incrementa el valor de las constantes de velocidad (k1 y k2), el tiempo para alcanzar el equilibrio disminuye, obteniéndose un valor diferente para la constante de velocidad en cada caso. La obtención de un valor de k1 y k2 diferente para cada proporción metal/adsorbente en el sistema demuestra que la cinética de biosorción depende de ambos componentes y no de uno solo como se esperaría en una cinética de primer orden.
CONCLUSIONES
La biosorción de especies catiónicas como el Pb2+ en pectina se ve favorecida con el incremento del pH. La baja cantidad de iones H+ en la solución y la mayor cantidad de grupos carboxílicos en forma aniónica facilitan la quelación con el metal.
Cuando la solución de plomo presenta mayor concentración aumenta la capacidad de sorción de la pectina en el equilibrio debido a que la mayor cantidad de iones del metal que presenta el medio aumenta la probabilidad de ocupación de sitios activos.
El modelo de pseudo primer orden describe con mayor exactitud la velocidad de quelación de la pectina con el metal que pseudo segundo orden; sin embargo, la cinética de biosorción de plomo en pectina reticulada depende de las concentraciones tanto de biosorbente como del metal en la solución, lo que confirma que el proceso no obedece a una cinética de primer orden.
AGRADECIMIENTOS
Los autores agradecen a la Comisión Europea por el financiamiento del Programa Alfa Bioproam y al Departamento de Química de la Facultad de Ciencias y Filosofía de la UPCH por el apoyo brindado en esta investigación.
BIBLIOGRAFÍA
1. Volesky B. & Holan Z. R. Rev. Biosorption of Heavy Metals. Biotechnol. Prog (1995) 11, 235-250.
2. Veglio F. & Beolchini F. Rev. Removal of metals by biosorption. Hydrometallurgy (1997) 44, 301-316.
3. Debbaudt A.L.; Ferreira M.L. & Gschaidera M.E. Theoretical and experimental study of M2+ adsorption on biopolymers. III. Comparative kinetic pattern of Pb, Hg and Cd. Carbohydrate Polymers (2004) 56, 321-332.
4. Aydin Z. & Akbuga J. Preparation and evaluation of pectin beads. International Journal of Pharmaceutics (1996) 137, 133-136.
5. Sharma S.K.; Liptay A. & Le Maguer M. Molecular characterization, physico-chemical and functional properties of tomato fruit pectin. Food Research International (1998) 30, 543-547.
6. Balaria A. & Schiewer S. Assessment of biosorption mechanism for Pb binding by citrus pectin. Separation and Purification Technology (2008) 63, 577-581.
7. Nàcera Y. & Aicha B. Equilibrium and kinetic modelling of methylene blue biosorption by pretreated dead streptomyces rimosus: effect of temperature. Chemical Ingineering Journal (2006) 119, 121-125.
8. Bayramoðlu G.; Çelik G. & Arica, M.Y. Biosorption of Reactive Blue 4 dye by native and treated fungus Phanerocheate chrysosporium: Batch and continuous flow system studies. Journal of Hazardous Materials (2006) 137, 1689-1697.
9. Pagán J.; Ibarz A.; Llorca M.; Pagán A. & Barbosa-Cánovas G.V. Extraction and characterization of pectin from stored peach pomace. Food Research International (2001) 34, 605-612.
10. Dronnet V.M.; Axelos M.A.V.; Renard C.M.G.C. & Thibault J. Improvement of the binding capacity of metal cations by sugar-beet pulp. 1. Impact of cross-linking treatments on composition, hydration and binding properties. Carbohydrate Polymers (1998) 35, 29-37.
Recibido el 27-10-2010
Aprobado el 11-01-2011













