Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.3 Lima jul./set. 2011
TRABAJOS ORIGINALES
Purificación y caracterización de un nuevo principio coagulante del veneno de la serpiente peruana Bothrops pictus
Purification and characterization of a new coagulant principle from the venom of Bothrops pictus peruvian snake
Marco Mesía Guevara1 ; Fanny Lazo Manrique2 y Armando Yarlequé Chocas2*
1 Escuela de Estomatología - Facultad de Medicina Humana y Ciencias de la Salud - Universidad Alas Peruanas.
2 Laboratorio de Biología Molecular - Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. *
RESUMEN
Se ha purificado una proteína coagulante del tipo enzima similar a trombina, del veneno de la serpiente peruana Bothrops pictus mediante dos pasos cromatográficos, sobre Sephadex G-100 SF y CM-Sephadex C-50, en ambos casos utilizando buffer acetato de amonio 0,05M pH 6,0. La enzima fue purificada 18 veces con un rendimiento de 40,74% y por PAGE- SDS se obtuvo una sola banda proteica de 54,4 kDa en condiciones reductoras con 2
β-mercaptoetanol y de 45,4 kDa en condiciones no reductoras, por lo que se estableció que la enzima consta de una sola cadena polipeptídica con al menos un enlace disulfuro. La enzima coagulante mostró tener actividad sobre fibrinógeno bovino así como sobre el substrato cromogénico BApNA; siendo inhibida por heparina y por el inhibidor de serinoproteasa PMSF. La enzima registró un pH óptimo de 8,0 para su actividad amidolítica. Los ensayos térmicos mostraron que es estable hasta los 50 °C. El ion Mn2+, a una concentración final de 10mM, es un potente activador de la enzima, mientras que Ca2+ y Mg2+ no muestran efecto significativo.Palabras clave: Veneno, serpiente, enzima similar a trombina, Bothrops pictus, coagulación.
ABSTRACT
A coagulant protein called trombin like enzyme, was purified from the venom of the Bothrops pictus peruvian snake, using two chromatographic steps: Sephadex G-100 SF and CM Sephadex C-50, equilibrated with 0,05 M ammonium acetate buffer pH 6,0. The enzyme was purified 18 folds with 40,74% of yield and the PAGE-SDS analysis showed an unit protein band with 45,4 kDa and of 54,4 kDa under no reducing and reducing s. Thus it is a single polypeptide chain with at least a S-S bond. The enzyme was capable to clot bovine fibrinogen and attack BApNA chromogenic substrate; being an inhibitor agent as well as PMSF serinoprotease inhibitor. It had a 8,0 as optimum pH on BApNA and it was stable until 50 °C. Mn2+ ion (10 mM) was a activator instead.
Key words: Venom, snake, thrombin like, Bothrops pictus, clot.
INTRODUCCIÓN
Las serpientes del género Bothrops habitan una extensa región de América y en nuestro país viven hasta 17 especies1,2. Bothrops pictus, llamada "jergón de costa", es una serpiente endémica del Perú, que se localiza en la costa central desde el nivel del mar hasta los 2,300 m. Su distribución geográfica abarca la vertiente occidental de los Andes, desde Majes, departamento de Arequipa, hasta el río Moche, departamento de La Libertad. La creciente población que habita esta zona está originando la lenta desaparición de la especie, con el peligro de su extinción.
Los estudios realizados sobre el veneno de esta serpiente muestran que su mordedura causa el típico cuadro de un accidente botrópico: dolor intenso con edema, hemorragia, hipotensión moderada, trastornos en la coagulación y uremia3.
Se han identificado en el veneno enzimas como: hialuronidasa, L-aminoácido oxidasa, fosfolipasa A2, proteolítica, habiéndose evaluado la capacidad del antiveneno botrópico (INS-Perú) para inhibirlas4,5.
Siendo las serpientes un eslabón importante de la cadena biológica y teniendo en cuenta que cada veneno es potencialmente un complejo proteico con características propias, en el presente estudio se ha desarrollado la metodología para purificar uno de los componentes más importantes de la ponzoña de Bothrops pictus que está relacionado con los severos daños al sistema circulatorio, tal como es la enzima similar a trombina (EST).
El estudio de este principio coagulante contribuirá no sólo al conocimiento de su rol durante el envenenamiento sino a considerarlo como un agente promisorio para su futura aplicación terapéutica6.
PARTE EXPERIMENTAL
Materiales
El veneno de Bothrops pictus fue obtenido de ejemplares adultos procedentes de la localidad de Canta-Lima, los cuales fueron mantenidos en el Serpentario Oswaldo Meneses del Museo de Historia Natural de la UNMS. El veneno fue extraído por presión manual de las glándulas venenosas, siendo luego liofilizado y conservado a 4°C hasta su uso.
Fibrinógeno bovino, benzoil arginil p-nitroanilida (BApNA), estándares de peso molecular e inhibidores de proteasas fueron adquiridos de Sigma Chemical Company (USA).
Contenido proteico
La cantidad de proteína fue calculada midiendo la absorbancia de luz UV a 280 nm7 en un espectrofotómetro Shimadzu UV 120-02. Además, se empleó el método de Lowry8 modificado en nuestro laboratorio9 utilizando albúmina sérica bovina como proteína estándar.
Purificación
Veneno total liofilizado (60 mg) fue diluido en 1 ml de buffer acetato de amonio 0,05M pH 6,0 y centrifugado a 4,000 rpm por 15 minutos a 20 °C para remover los componentes insolubles. El sobrenadante fue aplicado a una columna cromatográfica de exclusión molecular sobre Sephadex G-100 SF (19 x 2cm). La columna fue equilibrada con el mismo buffer a un flujo de 15 ml/h, colectándose fracciones de 2 ml. En las fracciones colectadas se determinó la cantidad de proteína por absorbancia a 280 nm y la actividad amidolítica. Las fracciones con mayor actividad fueron juntadas y aplicadas a una columna de CM-Sephadex C-50 (17 x 1,2 cm) usándose como eluente el mismo buffer. La proteína retenida en el sistema fue eluída aplicándose al buffer NaCl 0,2M.
Evaluación de la pureza y peso molecular
Fue llevada a cabo mediante electroforesis en gel de poliacrilamida PAGE-SDS, siguiendo el método de Laemmli10, bajo condiciones reductoras y no reductoras con 2-
β-mercaptoetanol, usando una cámara vertical OMNIPAGE MINI-GEL System y con una fuente de poder OMNIPAC MIDI 300V (Cleaver Scientific Ltd). Las corridas se realizaron a voltaje constante de 100 voltios durante una hora y los geles fueron teñidos con azul brillante de Coomasie. En el mismo sistema se corrieron los estándares de peso molecular: albúmina sérica bovina (66 kDa), ovoalbúmina (45 kDa) y lisozima (14,3 kDa).Actividad coagulante
La mezcla de reacción contenía 0,2 ml de fibrinógeno bovino 5 mg/ml, 0,1 ml de buffer Tris HCl 0,05M pH 7,5 y 25 µl de la enzima, midiéndose el tiempo de formación del coágulo.
Actividad amidolítica
Fue determinada por el método de Erlanger11, empleando benzoil arginil-p-nitroanilida (BApNA) como substrato. La actividad se determinó por absorbancia a 405 nm. Una unidad de actividad amidolítica fue definida como la cantidad de enzima necesaria para hidrolizar 1 µmol de BApNA por minuto, con la consiguiente liberación de nitroanilina.
Efectos del pH y la temperatura
El pH óptimo para la actividad amidolítica fue determinado usando una batería de buffers en el rango de 5 a 9. El substrato BApNA (9x10-2M) se diluyó independientemente en los buffers a sus respectivos pH hasta una concentración de 9x10-4M. La cantidad de enzima empleada fue de 30 µl.
La tolerancia de la enzima a la temperatura fue determinada por calentamiento térmico de la muestra por 10 minutos en un rango de 37 a 90 °C. La actividad amidolítica se midió con 20 µl de la enzima.
Efecto de los inhibidores de proteasas
La enzima purificada (60 µl) fue preincubada con 20 µl del inhibidor proteolítico correspondiente a 37 °C por 10 minutos. La actividad residual fue determinada usando BApNA como substrato y la reacción fue detenida agregando ácido acético al 60%. La absorbancia se midió a 405 nm.
Efecto de iones metálicos
Esta prueba nos permitió determinar si la presencia de algunos iones metálicos bajo la forma de cloruros, como el Ca2+, Mg2+ y Mn2+, a concentraciones finales de 1, 5 y 10 mM, modifican la actividad enzimática; para ello se hicieron mezclas: enzima-ion metálico y se preincubaron por 10 minutos antes de medir la actividad amidolítica.
RESULTADOS Y DISCUSIÓN
Purificación de la EST de Bothrops pictus
La figura 1 muestra el perfil cromatográfico del veneno de Bothrops pictus sobre Sephadex G-100 SF. Se obtuvo tres picos de proteína y se monitoreó las actividades amidolítica y coagulante para las fracciones eluídas. Sólo en el primer pico se registró ambas actividades.
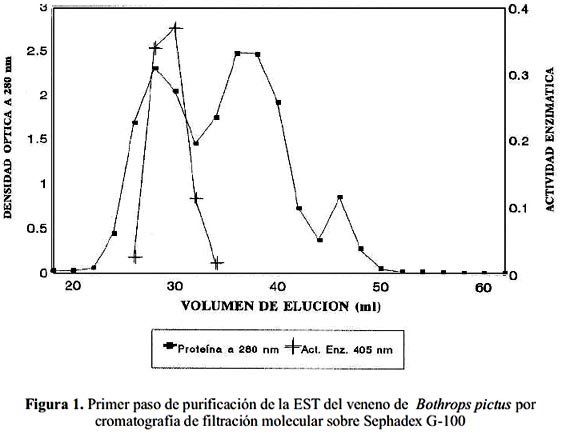
Estas fracciones fueron juntadas para luego ser pasadas a través de una columna de CM- Sephadex C-50, en donde se resolvieron tres picos. La actividad similar a trombina se encontró en el tercer pico (figura 2). Este segundo paso de purificación ha determinado la separación completa de la enzima, lográndose una purificación de 18 veces, un rendimiento de 40,7 % y 2,2 % de proteína activa recuperada (tabla 1).
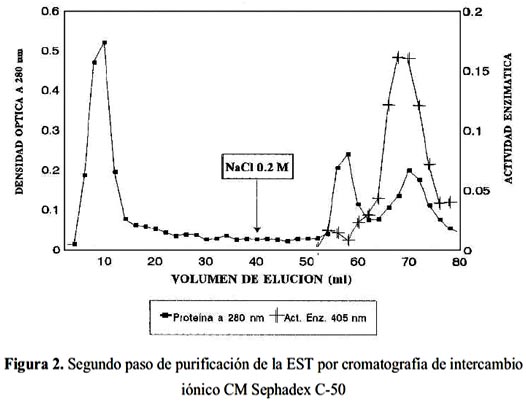
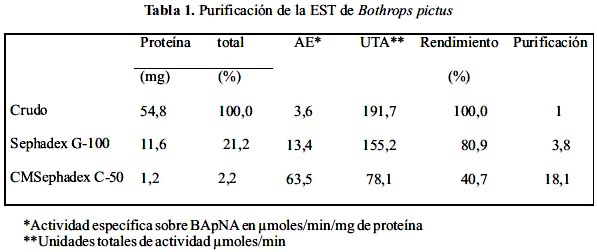
El hecho de que la EST fuera atrapada por el intercambiador catiónico CM-Sephadex C-50, indica que se trata de una proteína con un PI superior a 6, vale decir tiene naturaleza básica.
Peso molecular
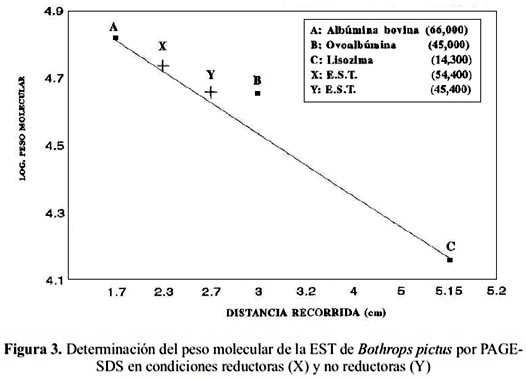
En el análisis de PAGE-SDS bajo condiciones reductoras y no reductoras, la enzima se mostró como una entidad homogénea migrando como una sola banda, lo que indica que se trata de una proteína monomérica. El peso estimado en condiciones no reductoras fue de 45,4 kDa y de 54,5 kDa en condiciones reductoras (figura 3), lo que indica la presencia de, por lo menos, un puente S-S intracatenario.
pH óptimo y temperatura
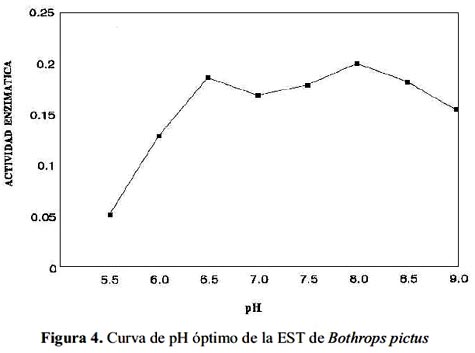
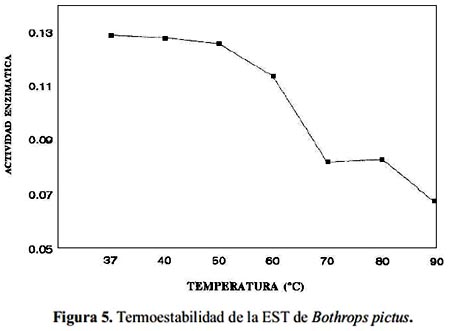
La EST de B. pictus actúa en un rango de pH de 6,0 a 9,0, siendo su máxima actividad amidolítica a pH 8,0 (figura 4). Por otra parte, la exposición de alícuotas de la enzima en estudio, a temperaturas de 37, 40, 50, 60, 70, 80 y 90 °C demostró que la enzima sólo mantiene intacta su actividad hasta los 50 °C . De la misma manera, se puede observar que a 60 °C la actividad amidolítica se reduce en aproximadamente 11,6% y a 90 °C la pérdida de actividad fue de 48% (figura 5).
Inhibidores enzimáticos
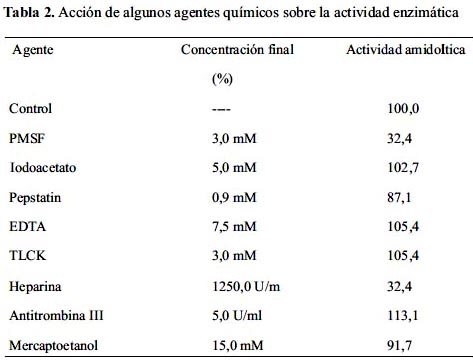
En la tabla 2 se muestra el efecto que algunos inhibidores de proteasas ejercen sobre la actividad amidolítica. Es interesante mencionar que la heparina, a una concentración final de 1,250 U/ml, ejerce una marcada inhibición con un porcentaje aproximado de 67,6%; porcentaje similar de inhibición se observó después del tratamiento con PMSF (3mM). Con respecto al pepstatin podemos indicar que este agente ejerce un efecto leve sobre la actividad (12,9%).
Efecto de iones metálicos
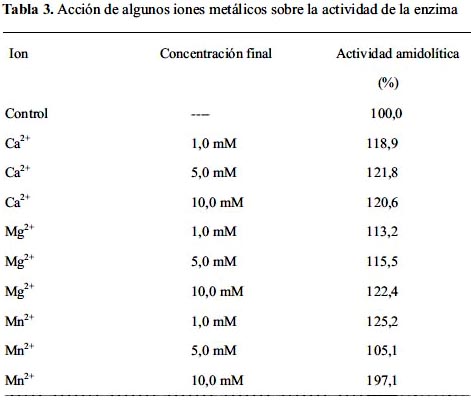
La enzima similar a trombina aislada del veneno de Bothrops pictus presenta una ligera activación con los iones calcio y magnesio en concentraciones de 1 a 10 mM. Sin embargo, el ion manganeso a 10 mM incrementa la actividad en un 97,1% (tabla 3).
Aun cuando las serpientes son reptiles que habitan principalmente en las selvas tropicales y subtropicales, también se han encontrado ofidios en lugares desérticos y costeros. Este último es el caso de B. pictus, cuya presencia en los alrededores de grandes ciudades como Lima, Trujillo e Ica no sólo son motivo de preocupación para las poblaciones sino que, visto desde otro ángulo, significa que los seres humanos desplazan continuamente a muchas especies, entre ellas, las serpientes. Aunque parezca paradójico, las serpientes son los mejores aliados de los agricultores ya que se alimentan de comadrejas, ratas y otros roedores, que en ausencia de ellas causan severos daños a las plantaciones y por ende al equilibrio ecológico1.
Dentro del género Bothrops, B. pictus es una especie importante, ya que la presencia de un principio coagulante señalaría claramente su relación con la actividad tóxica de esta ponzoña, pues generaría serios y rápidos trastornos en la coagulación6.
Con respecto a la purificación de la EST, el método empleado mostró ser idóneo para obtenerla al estado homogéneo, siendo el rendimiento de 40,7% una evidencia de la relativa abundancia de esta proteína en el fluido tóxico, tabla 1. Asimismo, el peso molecular de la enzima aislada está en el rango de 45 a 54 kDa, lo que la ubica entre las enzimas de este grupo con los mayores pesos encontrados12; para el caso de Bothrops atrox el peso de la EST es de 29,6 kDa13 y la de B. barnetti en el rango de 52 kDa y 48 kDa6. La estructura unicatenaria encontrada para esta enzima es semejante a las EST estudiadas14. Sin embargo, se logró evidenciar la presencia de puentes S-S en la proteína, los cuales son reducidos por el â-mercaptoetanol y no revelan un papel crucial en la actividad enzimática, lo que indicaría que dichos puentes estarían ubicados en un dominio alejado del sitio activo. El estudio del efecto del pH y la temperatura sobre la actividad enzimática mostraron que la enzima tendría una alta actividad a pH sanguíneo cuando la ponzoña ingresa a la sangre de su presa o víctima, siendo por ello muy eficiente la conversión de fibrinógeno a fibrina. Adicionalmente, la tolerancia hasta 90 °C es un hecho interesante y frecuente en las enzimas de este tipo, ya que aún en venenos sometidos a calentamiento y luego inyectados a perros, es posible observar su actividad15. Otra especie que registra esta tolerancia es la de B. barnetti 4.
Por otro lado, la fuerte inhibición de la actividad enzimática por parte del inhibidor PMSF y por heparina, sugieren que esta enzima tiene un comportamiento más semejante a la trombina humana que las otras EST, ya que estas últimas no sufren inhibición por heparina aun cuando en esos casos las concentraciones de heparina máximas fueron de 166,66U/ml16. Se trataría entonces de la primera EST de origen ofídico que sufre inhibición por heparina.
CONCLUSIONES
Se ha obtenido al estado homogéneo una proteína coagulante del veneno de la "jergón de costa" Bothrops pictus, la cual es una enzima similar a trombina, de naturaleza básica, unicatenaria y termoestable, capaz de coagular el fibrinógeno bovino, siendo inhibida por heparina y PMSF, y en cambio activada por el ion Mn2+.
AGRADECIMIENTOS
Los autores agradecen a la International Foundation for Science (IFS) de Suecia por el apoyo financiero recibido para el estudio de principios coagulantes de venenos de serpientes peruanas, incluyendo el presente trabajo.
BIBLIOGRAFÍA
1. Campbell J.; Lamar W. The venomous reptiles of Latin America.
New York: Crustock Publishing Associated; 19892. Meneses O. Los animales venenosos y sus peligros. Instituto de Salud Pública, Lima- Perú - 1974; Publicación No. 2. p 3-14
3. Martínez E.; Bonilla C.; Zavaleta A. Actividad fosfolipásica del veneno de serpiente. Bol Soc Quím. Perú 1990; LVI(3):160-166.
4. Yarlequé A.; Vivas D.; Inga R.; Rodríguez E.; Sandoval G.; Pessah S.; Bonilla C. Acción del antiveneno botrópico polivalente sobre las actividades proteolíticas presentes en los venenos de serpientes peruanas. Rev Peru Med Exp Salud Pública 2008; 25(2): 169-173.
5. Mendoza J.; Lazo F.; Yarlequé L.; Ruiz N.; Yarlequé A.; Pessah S.; Flores V.; Bonilla C. Efecto del antiveneno botrópico sobre las actividades de fosfolipasa A2, L-aminoácido oxidasa y hialuronidasa de los venenos de serpientes peruanas. Rev Perú Med Exp Salud Pública 2008; 25(2): 174-178
6. Vivas D.; Inga R.; Mendoza J.; Lazo F.; Yarlequé A. Barnetobina: un nuevo principio coagulante purificado del veneno de la serpiente peruana Bothrops barnetti.
Rev Soc Quím Perú 2010; 76(3): 261-270.7. Warburg O.; Christian W. Isolierung and kristallisation der Garungs ferments enolase. Biochem Z 1941; 310:384-421.
8. Lowry OH.; Rosebrough NJ.; Farr A.L.; Randall R. Protein measurement with the Folin phenol reagent.
J Biol Chem 1951; 193(1):265-275.9. Loayza S.; Morante Y.; Campos S.; Yarlequé A. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox.
Bol Soc Quim Perú 1985; LII(3):151-163.10. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227:680-685.
11. Erlanger B.; Kokowsky N.; Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Arch Biochem Biophys 1961; 95: 271-278.
12. Pirkle H. Thrombin- like enzymes from snake venoms: An updated inventory.
Thromb haemost 1998;79:675-683.13. Sandoval G.; Ruiz N.; Lazo F.; Rodríguez E.; Yarlequé A.; Zingali R. Aislamiento y caracterización parcial de una enzima similar a trombina del veneno de la serpiente peruana Bothrops atrox "jergón". Rev Soc Quím Perú 2010; 76(2): 156-164.
14. Castro HC.; Zingali R.B.; Albuquerque M.G.; Pujol-Luz M.; Rodríguez CR.
Snake venom thrombin-like enzymes: from reptilase to now. Cell Mol Life Sci 2004; 61:843-856.15. Vellard J. El veneno de Lachesis muta. Museo de Historia Natural Javier Prado. 1948; Serie A. Zoología. Publicación No. 1
16. Cahuana Macedo G. Características de una enzima coagulante iaslada del veneno de la serpiente Bothrops bilineatus "loro machaco" y su comparación con una coagulasa bacteriana. Tesis para optar al título profesional de Biólogo. Lima-Perú, UNMSM; 1996.
Recibido el 15-06-2011
Aprobado el 28-06-2011













