Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.77 n.3 Lima jul./set. 2011
TRABAJOS ORIGINALES
Interacción de ácido morín-5- sulfónico (MSA) y el ácido quercetín-5-sulfónico (QSA) con agentes surfactantes de diferente carga
Interaction between morin-5-sulphonic acid and the quercetin-5-sulphonic acid (QSA) with surfactant agents of different charge
Edgar O. Nagles*a ; Roxana Ríosb ; Manuel Otinianoc
*a Facultad de Química, Pontificia Universidad Católica de Chile, Santiago 7820436, Chile. E-mail:
ernagle@uc.cl.b Facultad de Ciencias Naturales y Matemática, Universidad Nacional Federico Villarreal, Perú.
c Facultad de Química e Ingeniería Química, Universidad Nacional Mayor de San Marcos, Perú.
RESUMEN
La interacción del ácido morín-5-sulfónico (MSA) y del ácido quercetín-5-sulfónico (QSA) con los surfactantes dodecilbenceno sulfonato de sodio (SDS) y bromuro de cetilpiridinio (CPB) de carga negativa y positiva, respectivamente, fueron estudiadas por absorción molecular y voltametría cíclica a pH 4,0 y 6,0. Su interacción y localización en los surfactantes fue estudiada por los cambios sufridos en los espectros de absorción y los voltamperogramas cíclicos a diferentes concentraciones de surfactantes, observándose efectos batocrómicos, hipercrómicos, catálisis de los potenciales de oxidación y aumento de la corriente de oxidación.
Palabras clave: Flavonoide, surfactantes, voltametría cíclica.
ABSTRACT
The interaction of morin-4-sulphonic acid and the quercetin-5-sulphonic acid (QSA) with the surfactants sodium dodecil sulphate (SDS) and cetilpiridine bromide (CPB) of positive and negative charge, respectively, were studied by molecular absorption and cyclic voltameter at pH 4,0 and 6,0. Its interaction and localization in the surfactants was studied by the changes suffer in the absorption spectra and the cyclic voltamgrams at different concentrations of surfactants to show effects batochromics, hyperchromics, catalysis of oxidation potentials, and an increase of the oxidation current.
Key words: Flavonoid, surfactants, cyclic voltameter.
INTRODUCCIÓN
Morín y quercetín cuyos nombres IUPAC son: (2, 3', 4', 5, 7-pentahidroxiflavona) y (2', 3, 4', 5, 7-pentahidroxiflavona), respectivamente, son activos flavonoides. Sin embargo, la actividad de quercetín es el doble de la de morín1, lo cual indica la importancia de los 2–OH adyacentes en el anillo B de las hidroxiflavonas. Los potenciales de reducción de los flavonoides dependen de las propiedades donoras de los sustituyentes en los anillos A y B; estos anillos tienen los sitios más activos a pH casi neutros y el anillo A presenta mayor capacidad complejante2.
Son ampliamente usados en química analítica como ligandos para determinar iones metálicos, como plomo y cadmio, por técnicas electroanalíticas de redisolución con pulso diferencial (ASVDP)3,4. En algunos casos su aplicación se ve restringida por la baja solubilidad que presentan en agua. Por otro lado, el derivado sulfónico del morín y quercetín son más solubles en agua y forman complejos con iones metálicos en soluciones acuosas con constantes de formación mucho más grandes2.
El morín y quercetín, como derivados sulfónicos, se presentan en la figura 1. Fueron sintetizados por primera vez por Kopacz en donde se observa el desplazamiento de un hidrógeno del anillo B por un grupo sulfónico (SO3-) del ácido sulfúrico.
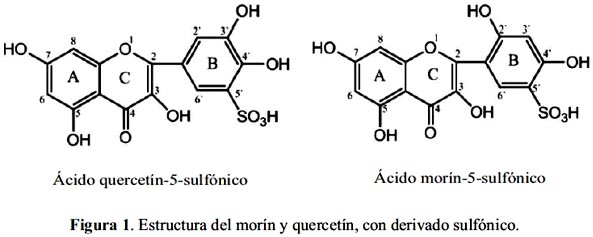
Por otro lado, los surfactantes han sido usados últimamente en procesos de corrosión, electrochapado, celdas eléctricas, electrocatálisis y fotoelectroquímica. La concentración micelar crítica (CMC) es una característica de cada surfactante y corresponde a la concentración donde cambian abruptamente las propiedades físicas de conductividad y tensión superficial, debido a un ordenamiento de las moléculas; ésta varía entre 10-4 a 10-2 mol L-1.
La interacción de surfactantes con flavonoides ha sido estudiada últimamente, principalmente entre quercetín con surfactantes no iónicos (Triton X-100)5 y surfactantes catiónicos y aniónicos6 y morín con surfactantes catiónicos7, mostrando una actividad de interacción principalmente entre los oxígenos nucleofílicos de los anillos aromáticos presentes en su estructura, estudiada por espectrofotometría y voltamperometría cíclica.
PARTE EXPERIMENTAL
Materiales
Morín fue obtenido de Merck (Darmstsdt), quercetín fue obtenido de Sigma. MSA y QSA fueron sintetizados como reporta Kopacz8. CPB y SDS fueron obtenidos de Sigma-Aldrich. Todas las soluciones fueron preparadas con agua Milli-Q (18,2 M
Ω). Las soluciones buffer Britton-Robinson (BR) fueron preparadas por mezcla de iguales volúmenes de 0,4 mol L-1 de ácido fosfórico, ácido acético y ácido bórico y ajustando el pH requerido con NaOH 0,2 mol L-1 y diluyendo 10 veces con agua.Estudio espectrofotométrico
MSA y QSA fueron mezclados con diferentes concentraciones de SDS y CPB; se ajustó el pH a 4,0 y 6,0 con 100uL de buffer B-R 0,04 mol L-1; después se agitó por 1 hora en ultra sonido Branson 2200. Los espectros UV-visible fueron tomados usando un Spectronic Milton Roy 3000 Array con arreglo de diodos en un rango de longitudes de onda de 200-600 nm. Agua destilada fue usada como blanco.
Estudio voltamperométrico
Los voltamperogramas cíclicos se realizaron con un analizador voltamétrico BAS CV50W. Un electrodo de platino fue usado como electrodo de trabajo, una varilla de platino como electrodo auxiliar y un electrodo de Ag/AgCl como electrodo de referencia. El buffer B-R 0,04 mol L-1 fue usado también como electrolito soporte.
RESULTADOS Y DISCUSIÓN
Estudio espectrofotométrico de MSA y QSA a pH 4,0 y 6,0
A un valor de pH 4,0 el MSA se encuentra con dos cargas negativas correspondientes al grupo SO3- y a la desprotonación del OH de la posición 5; por otro lado, el QSA sólo tiene una carga negativa correspondiente al SO3-. A pH 6,0 el MSA presenta tres cargas negativas correspondiendo la tercera a otro grupo OH de la posición 7. A este mismo pH el QSA presenta una carga negativa más correspondiente al OH de la posición 5.
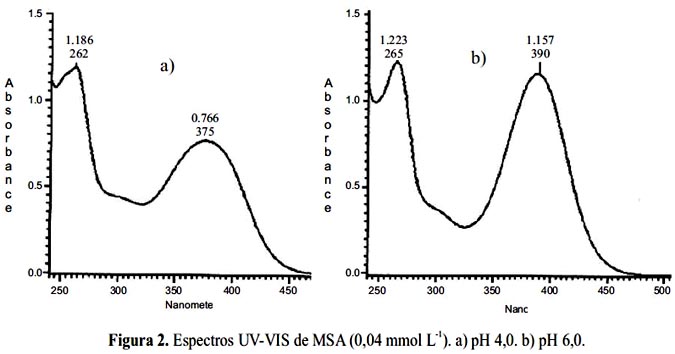
Se observa en la figura 2 que a pH 4,0 y 6,0 se presenta dos máximos de absorción para el MSA a 262-265nm (banda II) y 375-390 nm (banda I) las cuales corresponden a transiciones
π→π* del grupo benzoil formado por los anillos AC y del grupo cinamol formado por los anillos BC, respectivamente2. Se ha reportado que los pKa del MSA son: pK 4,48; pK 769; pK 9,47 y pK 11,40 y para el QSA son: pK1 7,18; pK2 8,02; pK3 9,59 y pK4 10,84 para los grupos 5-OH, 7-OH, 4'-OH, 2'3'-OH y 3-OH, respectivamente2. De acuerdo a estos valores, a pH 4,0 el MSA está en forma monoaniónica (grupo sulfónico) y a pH 6,0 en forma dianiónica. Al subir el pH de 4,0 a 6,0 no se afecta la banda (II); sin embargo, la banda (I) sufre un efecto batocrómico y la absorbancia cambia de 0,766 a 1,157, efecto hipercrómico. Se observó resultados similares para el QSA pero con valores de absorbancia más altos.
Estudio espectrofotométrico del MSA y QSA en presencia de SDS y CPB
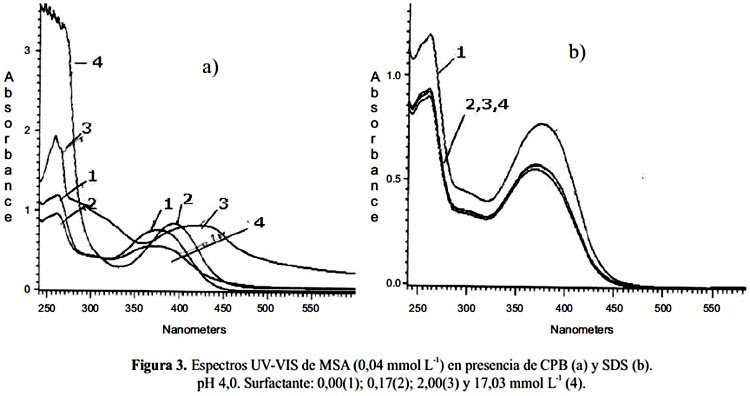
Como se puede apreciar en la figura 3 (a), en presencia de CPB los espectros cambian notoriamente. Al adicionar CPB baja la concentración micelar (0,17 mmol L-1); ambas bandas presentan menor intensidad, debido probablemente a que existen interacciones electrostáticas entre el MSA negativo y el CPB positivo afectando las transiciones (espectro 2). Cuando se alcanza la concentración micelar (2,00 mmol L-1) se produce un aumento de ambas bandas (espectro 3) y un nuevo hombro alrededor de 325 nm. La banda I se desplaza desde 375 a 426 nm. Se ha reportado que la micela tiene forma cilíndrica9. Se encerraría la zona hidrofóbica y queda al exterior la cabeza hidrofílica positiva, lo que "neutraliza" el MSA en su forma monoaniónica, modificando el pKa y facilitando la transición electrónica a longitudes de onda de menor energía. Sobre la concentración micelar nuevamente se observan cambios en los espectros: la banda I vuelve a una posición intermedia de 400 nm sin afectarse su intensidad; en cambio, la banda II sube su intensidad sin producirse desplazamiento (espectro 4). Al adicionar SDS, figura 3 (b), se observa una pequeña disminución de las intensidades de ambas bandas independiente de la concentración de este surfactante aniónico. Esto se explica por la carga negativa del ligando y del surfactante. Por otro lado, la similitud estructural del MSA con el QSA permite que se observe un comportamiento similar. En la figura 4 se presentan los espectros obtenidos a pH 6,0.
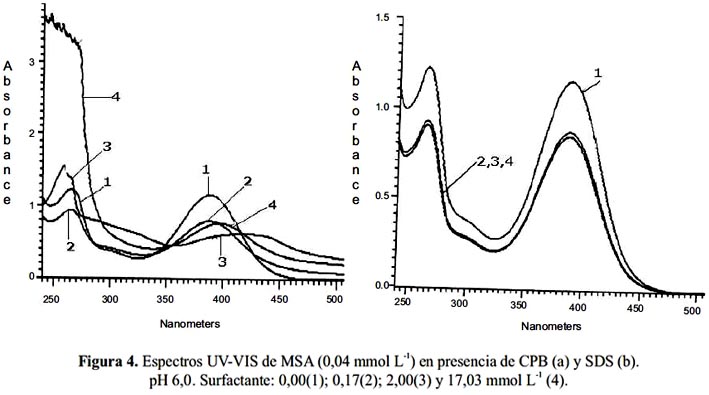
A pH 6,0 el MSA y QSA están en la forma dianiónica y presentan máximos de absorción a 265 y 390 nm como se ve en la figura 2. Al adicionar CPB (espectros 2-4) en las tres concentraciones (pre-micelar, micelar y post-micelar) disminuye la intensidad del máximo de absorción produciéndose desplazamiento batocrómico notable en la concentración micelar (desde 390 a 440 nm) y en la concentración post-micelar de sólo 10 nm. En cambio en presencia de SDS no se producen desplazamientos de las bandas, sino sólo una disminución de la intensidad al igual que lo observado a pH 4,0.
Estudio voltamperométrico del MSA y QSA en presencia de SDS y CPB
La notable actividad electroquímica del MSA se debe al 2'-OH y 4'-OH y para el QSA al 3'-OH y 2'-OH7.
Se preparó disoluciones de MSA 0,04 mmol L-1 ajustando el pH a 4,0 y 6,0 con tampones Britton Robinson (BR) 0,04 mol L-1 y adicionando SDS y CPB en concentración pre-micelar, micelar y post-micelar. Los voltamperogramas cíclicos de MSA a pH 4,0 y 6,0 en ausencia y presencia de SDS se presentan en las figuras 5 (A) y (B). En estas medidas se utilizó un electrodo rotatorio de platino.
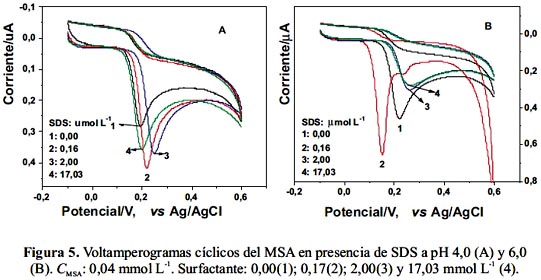
El MSA presenta un proceso electroquímico irreversible a pH 4,0 y pH 6,0 de 0,2 V. Con la adición de pequeñas cantidades de SDS a la solución de pH 4,0, el pico de oxidación se desplaza a potenciales más positivos, aumentando la corriente (curva 2, figura 5 A), lo cual indica mayor polarización del electrodo de platino. Cuando se aumenta la cantidad de SDS el desplazamiento es mayor, pero la corriente baja un poco con respecto a la adición anterior, pero mayor con respecto a la oxidación en ausencia de SDS. En cambio, a pH 6,0 la señal de oxidación se desplaza hacia potenciales menos positivos y aumenta la corriente (curva 2, figura 5 B), lo cual indica que este surfactante favorece la transferencia de carga y además facilita la adsorción en el electrodo de trabajo. Debido a que el SDS tiene carga negativa y a pH 6,0 la carga negativa del MSA aumenta, es probable que la interacción entre SDS y MSA ocurra a través de la parte hidrofóbica del surfactante, de lo contrario la repulsión desfavorecería el proceso electroquímico.
De igual forma se procedió a realizar los estudios en presencia de CPB. Los resultados se presentan en las figuras 6 A y B.
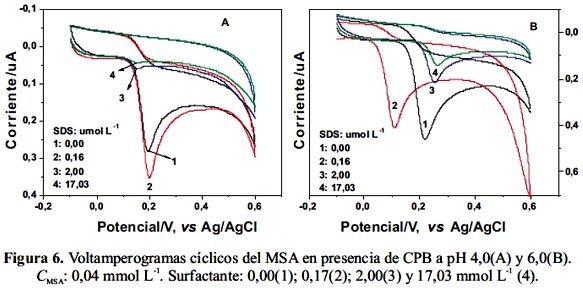
Cuando se agrega pequeñas cantidades de CPB, el pico de oxidación del MSA se mantiene al mismo potencial pero aumenta la corriente (curva 2, figura 6 A). Debido a que el CPB es un surfactante catiónico es probable que interaccione electrostáticamente con el MSA monoaniónico a pH 4,0. En cambio, a pH 6,0 se favorece la oxidación del MSA desplazando la señal hacia potenciales menos positivos (curva 2, figura 6 B). A concentraciones mayores de CPB la corriente disminuye casi en su totalidad debido, probablemente, a adsorción preferencial del surfactante en el electrodo.
Estudio voltamperométrico del QSA en presencia de SDS y CPB
Se preparó disoluciones de QSA 0,04 mmol L-1 ajustando el pH a 4,0 y 6,0 con tampones Britton Robinson (BR) 0,04 mol L-1 y adicionando SDS y CPB en concentración pre-micelar, micelar y post-micelar. Los voltamperogramas cíclicos de MSA a pH 4,0 y 6,0 en ausencia y presencia de SDS se presentan en las figuras 7 A y B. En estas medidas se utilizó un electrodo rotatorio de platino.
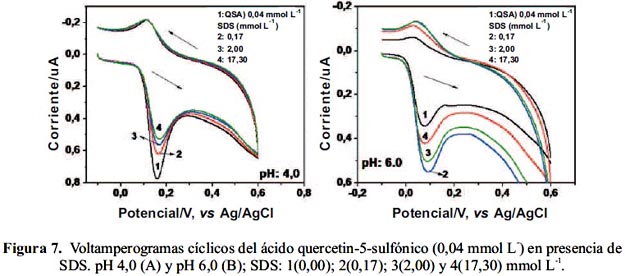
El QSA presenta un proceso electroquímico cuasi-reversible a 0.16-/-0.12 V a pH 4,0 y de - 0,05/0,09 V a pH 6,0. Las corrientes de pico son mayores a pH 4,0 pero es más difícil de oxidar. Posteriormente, se realizaron medidas en presencia de SDS, variando la concentración de éste entre 0,00 y 17,30 mmol L-1. Los voltamperogramas cíclicos a pH 4,0 y 6,0 se presentan en las figuras 6 A y B.
Como se puede apreciar en la figura 6 A, la señal de reducción del QSA se mantiene inalterada en presencia de SDS; en cambio, la señal de oxidación disminuye ligeramente. A este valor de pH el ligando se encuentra en su forma monoaniónica. Por otra parte, no se observaron cambios en el potencial al adicionar SDS. Cuando pequeñas cantidades de bromuro de acetil piridinio (CPB), surfactante catiónico, se adicionaron a la disolución no se observó cambios significativos.
Como se puede apreciar en la figura 6 B, al adicionar SDS bajo la concentración micelar se observa un aumento de la corriente del pico de oxidación; esta señal disminuye al aumentar la concentración de SDS hasta 2,00 mmol L-1 (CMC). De igual forma, sigue disminuyendo al sobrepasar la CMC; sin embargo, el valor aún sigue siendo mayor que en ausencia de SDS. A este valor de pH tampoco se observó cambios en los potenciales de las señales. Debido a que el ligando se encuentra en forma aniónica y el surfactante es aniónico también, es probable que la interacción ocurra a través de la zona hidrófoba y no la hidrofílica porque de lo contrario se observaría una disminución de la corriente por problemas de repulsión. Al adicionar CPB no se observó cambios positivos ni negativos en la corriente de los picos.
CONCLUSIONES
Las propiedades espectroscópicas del MSA y del QSA son muy similares ya que presentan dos máximos de absorción a valores similares de longitudes de onda, Por otro lado, la interacción de MSA y QSA con el surfactante CPB de carga positiva produce cambios en las longitudes de onda (efectos batocrómicos) y aumento en la intensidad de absorbancia (efecto hipercrómico).
El SDS, por ser un surfactante aniónico, puede poseer una CMC de mucha más concentración comparado con el CPB, y esto puede explicar los pocos cambios en los máximos de absorción del MSA y QSA ya que la interacción no se pierde a valores de concentración entre 2,00-17,03 mmol L-1 en donde con el CPB se pierde por la formación de micelas cilíndricas.
En la determinación de MSA y QSA por técnicas electroanalíticas la presencia de SDS entre 0,10 y 0,17 mmol L-1 aumenta la concentración del analito sobre la superficie del electrodo, permitiendo determinar concentraciones bajas que, combinado con técnicas de pulso, se pude llegar a límites de detección de los µg L-1
AGRADECIMIENTOS
Los autores agradecen al proyecto FONDECYT 1080524, apoyo al término de tesis 24100108 y a la Pontificia Universidad Católica de Chile por la beca MECESUP de Doctorado.
BIBLIOGRAFÍA
1. Heijnen C.G.M.; Haenen G.R.M.; Vekemans J.A.J.; Bast A. Environ.
Toxicol. Pharmacol. 10: 199, 2001.2. Kopacz M., J. Anal. Chem. 58: 225, 2003.
3. Shams E.; Babaei A.; Soltaninezhad M. Anal.
Chim. Acta 501:119-124, 2004.4. Fei J.; Li J.; Yi F. Huaxue Fence 38: 166, 2002.
5. Liu E.; Guo R. Colloid and Surfaces A: Physicochem. Eng. Aspects 274: 192, 2006.
6. Liu E.; Guo R. J. Colloid Interface Sci., 302: 625, 2006.
7. Liu E.; Guo R. J. Colloid Interface Sci. 290: 564, 2005.
8. Kopacz M. Polish J. Chem. Sci., 55: 227, 1981.
9. Vittal R.; Gomathi H.; Kang-jim K., Adv.
Colloid Interfase Sci., 119: 55, 2006.
Recibido el 24-05-2011
Aprobado el 07-07-2011













