Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.77 no.3 Lima July/Set. 2011
TRABAJOS ORIGINALES
Actividad antifúngica de cuatro plantas usadas en la medicina tradicional peruana. Aislamiento de 3'- formil – 2',4',6' – trihidroxidihidrochalcona, principio activo de Psidium acutangulum
Antifungal activity of four plants used in peruvian traditional medicine: isolation of the active principle of Psidium acutangulum
Louise Wena ; Mohamed Haddadb,c ; Irma Fernándezd ; Giovana Espinozae ; Candy Ruize ; Edgar Neyraf ; Beatriz Bustamantef ; Rosario Rojasd,e,*
a School of Medicine, Stony Brook University, USA;
b IRD; UMR-152; Mission IRD;
d Dpto. de Ciencias Celulares y Moleculares, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia (UPCH),
e Unidad de Investigación en Productos Naturales, Laboratorios de Investigación y Desarrollo, UPCH;
f Instituto de Medicina Tropical Alexander von Humboldt, UPCH
RESUMEN
En el presente trabajo se evaluó la actividad antifúngica de los extractos etanólicos de Thevetia peruviana (Pers.) K. Schum.
(Apocynaceae), Spondias mombin L. (Anacardiaceae), Calycophyllum spruceanum (Benth.) Hook. f. ex K. Schum. (Rubiaceae) y Psidium acutangulum DC (Myrtaceae), cuatro plantas utilizadas en la medicina tradicional peruana contra las infecciones micóticas de la piel.El extracto etanólico de Psidium acutangulum fue el más activo contra los hongos evaluados (Candida albicans, Sporothrix schenckii y Trychophyton mentagrophytes), por lo que fue sometido a fraccionamiento biodirigido que condujo al aislamiento de 3'-formil-2',4',6'- trihidroxidihidrochalcona. Este compuesto mostró concentraciones inhibitorias mínimas en el rango de 16-512 µg/mL contra los hongos Cryptococcus neoformans, S. schenckii y varias especies de Candida.
Los resultados obtenidos apoyan el uso de Psidium acutangulum en la medicina tradicional peruana. Su actividad antifúngica se debe principalmente a la 3'-formil-2',4',6'- trihidroxidihidrochalcona.
Palabras clave: antifúngico, Psidium acutangulum, plantas peruanas.
ABSTRACT
We report here the antifungal activities of the ethanolic extracts of Thevetia peruviana (Pers.) K. Schum. (Apocynaceae), Spondias mombin L. (Anacardiaceae), Calycophyllum spruceanum (Benth.) Hook. f. ex K. Schum. (Rubiaceae) and Psidium acutangulum DC (Myrtaceae), four plants used in peruvian traditional medicine against skin mycosis. The most active sample against the evaluated fungi (Candida albicans, Sporothrix schenckii and Trychophyton mentagrophytes) was the ethanol extract of Psidium acutangulum, which was submitted to bioassay-guided fractionation, leading to the isolation of 3'-formyl-2',4',6'- trihydroxydihydrochalcone. This compound showed minimum inhibitory concentrations of 16-512 µg/mL against Cryptococcus neoformans, S. schenckii and several Candida species. All these results support the use of Psidium acutangulum in Peruvian traditional medicine. Its antifungal activity is due mainly to the 3'-formyl-2',4',6'-trihydroxydihydrochalcone.
Key words: antifungal, Psidium acutangulum, peruvian plants.
INTRODUCCIÓN
Las enfermedades infecciosas representan un problema crítico para la salud y son una de las principales causas de morbilidad y mortalidad en todo el mundo. La aparición de resistencia de los microorganismos a algunos antibióticos sintéticos, junto con la toxicidad durante el tratamiento prolongado, hace que sea necesario continuar la búsqueda de nuevas sustancias antimicrobianas, antifúngicos en particular1-4 Candida albicans y Cryptococcus neoformans son hongos patógenos frecuentemente implicados en las infecciones que amenazan la vida de seres humanos, particularmente de pacientes con sistemas inmunes comprometidos. Cryptococcus neoformans es un hongo oportunista que causa infecciones mortales en pacientes inmunodeprimidos por el SIDA, la quimioterapia, el trasplante de órganos, o por altas dosis de esteroides. Los tratamientos actuales son la anfotericina B, flucitosina y el fluconazol. La esporotricosis es una enfermedad crónica cutánea y subcutánea causada por el hongo dimorfo Sporothrix schenckii que es el agente más común de las micosis subcutáneas en América Latina. La terapia estándar para esta enfermedad se basa principalmente en el itraconazol; sin embargo, el yoduro de potasio es el fármaco de elección en los países en desarrollo debido a su bajo costo. Aunque los actuales fármacos disponibles suelen ser eficaces, los fracasos terapéuticos y la toxicidad después de la larga duración del tratamiento son comunes, por lo que es necesario explorar nuevas alternativas para el tratamiento de infecciones graves.5-11
Las plantas medicinales y sus extractos son ampliamente utilizados por los practicantes de la medicina tradicional para curar diversas enfermedades. La creciente aceptación de la medicina tradicional como una forma alternativa de atención de la salud y la búsqueda de nuevos agentes antifúngicos a partir de plantas medicinales, se ha vuelto muy importante. 12,13
En el presente estudio se seleccionaron cuatro plantas peruanas que se usan tradicionalmente contra infecciones superficiales de la piel y se les evaluó por su actividad antifúngica in vitro. La planta más activa fue posteriormente sometida a fraccionamiento biodirigido para determinar el compuesto responsable de la actividad antifúngica.
PARTE EXPERIMENTAL
Colecta de las plantas
Las especies Thevetia peruviana (Pers.) K. Schum.
(Apocynaceae), Spondias mombin L. (Anacardiaceae), Calycophyllum spruceanum (Benth) Hook. f. ex K. Schum. (Rubiaceae) y Psidium acutangulum DC. (Myrtaceae) fueron seleccionadas en base a su uso en la medicina tradicional de la tribu shipibo-conibo14 y colectadas por uno de nosotros (I.F.) en el barrio de San Francisco de Pucallpa, Perú. Las muestras botánicas de las plantas fueron depositadas en el Departamento de Ciencias Farmacéuticas de la Universidad Peruana Cayetano Heredia, en Lima.Preparación de los extractos
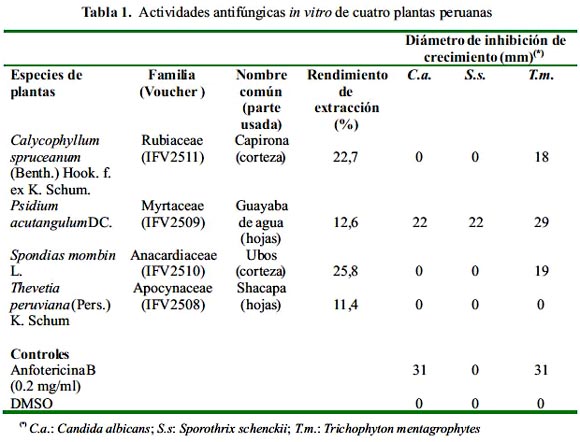
El material vegetal fue secado bajo sombra, molido finamente y posteriormente extraído por percolación a temperatura ambiente con etanol al 95%. El solvente se evaporó a sequedad bajo presión reducida a una temperatura inferior a 40 ºC. Los rendimientos de extracción de cada una de las especies se muestran en la tabla 1. Para los bioensayos, los extractos fueron resuspendidos en DMSO a una concentración de 20 mg/ml.
Ensayos antifúngicos
El ensayo de difusión en agar se utilizó para evaluar la actividad de extractos de plantas y fracciones frente a Candida albicans ATCC 90028, Sporothrix schenckii IHEM 15503 y Trychophyton mentagrophytes IHEM 0584. Se mezcló 20 mL de agar dextrosa Sabouraud (Difco) fundido con 1 mL de una suspensión fúngica (104 CFU/mL para C. albicans y 105 CFU/mL para S. schenckii y T. mentagrophytes). La mezcla se vertió en placas de Petri estériles de 100 mm x 15 mm. Luego que el agar se solidificó, se perforó pozos de 10 mm con un sacabocados estéril.
Sobre los pozos se depositaron 100 µL de los extractos de plantas (20 mg/mL) o de las fracciones (10 mg/mL) y posteriormente las placas se incubaron a temperatura ambiente durante 48 h (C. albicans) o 7 días (S. schenckii y T. mentagrophytes). Anfotericina B (0,2 mg/ml) y DMSO fueron utilizados como controles positivos y negativos, respectivamente. Los ensayos se realizaron por triplicado y la actividad antifúngica se midió por el diámetro (mm) de la zona de inhibición del crecimiento.
Las concentraciones mínimas inhibitorias (CMI) del compuesto activo, anfotericina B y fluconazol se determinaron mediante un ensayo de microdilución en caldo de acuerdo con el International Control Laboratory Standards (ICLS) método de referencia M27-A3 y M-38A. El inóculo fúngico fue visualmente estandarizado a 0,5 de la escala de McFarland (2,4 a 3,5 x 106 CFU/mL de células de levadura y 2,3 x 104 CFU/mL para Sporothrix schenckii). Los pozos se llenaron con 100 L de la dilución de los compuestos. Posteriormente se añadieron 100 L del inóculo a cada pozo y las microplacas se incubaron durante 48 -72 horas a 35 °C. La CMI se define como la menor concentración de la muestra en la que se observó inhibición del crecimiento del hongo.
Fraccionamiento bioguiado del extracto etanólico de Psidium acutangulum
Hojas secas de P. acutangulum (262 g) se percolaron con 2 litros de etanol al 95%. El extracto etanólico (9,7 g) obtenido después de la evaporación del disolvente a presión reducida fue extraído con solventes de diferente polaridad (éter de petróleo, el 90% de metanol 90%, acetato de etilo, agua). La evaluación antifúngica de estas cuatro fracciones en contra de C. albicans mostraron que la actividad se concentró en la fracción de metanol al 90%; esta fracción (4,2 g) fue sometida a fraccionamiento mediante cromatografía en columna de gel de sílice usando un gradiente de cloroformo-metanol. Las 4 fracciones obtenidas (A: 0,20 g; B: 0,36 g; C: 0,16 g; D: 2,45 g) fueron evaluadas a una concentración de 10 mg/mL frente a C. albicans en el test de difusión en agar. La fracción más activa (D: 24 mm de inhibición del crecimiento de diámetro) se purificó aún más, utilizando una columna de fase reversa. Una porción (200 mg) de la fracción D fue sometida a cromatografía de columna de fase reversa con 10 g de gel de sílice RP-18, con MeOH-H2O (1:1) como sistema de solvente, obteniéndose tres fracciones (D1: 8 mg; D2: 72 mg; D3: 53 mg). La fracción con mejor actividad anti C. albicans (D2) fue finalmente purificada por recristalización en diclorometano, obteniéndose 34 mg de un polvo de color rosa claro (compuesto 1, 0,16% de rendimiento).
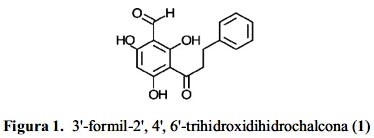
3'-formil-2',4',6'-trihidroxidihidrochalcona (1) (figura 1).
Los espectros de RMN (300 MHz para 1H-NMR y 125 MHz para 13C-NMR) fueron obtenidos con CDCl3 en un espectrómetro Bruker Avance 500. El espectro de masas ESI-MS (3,5 kV en MeOH– CH3CN) se registró en un equipo Perkin–Elmer Sciex API-365; [M-H]-: 285 (de 3 acuerdo con PM=286). 1H-NMR (300 MHz,
CDCl3):δ 3,01 ppm (2H, t, J = 7,5 Hz, H-β), 3,45 ppm (2H, t, J = 7,5 Hz, H-α), 5,77 ppm (1H, s, H-3'), 7,18 ppm (5H, m, Ar), 10,02 ppm (1H, s, OH). 13CNMR (125 MHz, CDCl3): 30,4 ppm (C-), 45,6 ppm (C-β), 94,8 ppm (C-3'), 126,1 ppm (C-4), 128,6 ppm (C-3, C-5), 141,1 ppm (C-1), 192,47 ppm (CHO), 205,4 ppm (C=O).RESULTADOS Y DISCUSIÓN
En nuestra búsqueda de productos naturales con actividad antifúngica, escogimos cuatro plantas utilizadas en la medicina tradicional peruana para el tratamiento de lesiones infecciosas de la piel. La tabla 1 muestra el nombre científico, nombre popular, el número de muestra (voucher) y actividad antifúngica de los extractos etanólicos de las plantas seleccionadas.
En base a los resultados obtenidos, el extracto etanólico de las hojas de Psidium acutangulum fue elegido para los estudios de fraccionamiento biodirigido, que condujo al aislamiento e identificación del compuesto 3'-formil-2',4',6'-trihidroxidihidrochalcona (figura 1). La tabla 2 muestra los valores de CMI de este compuesto contra de diversos hongos
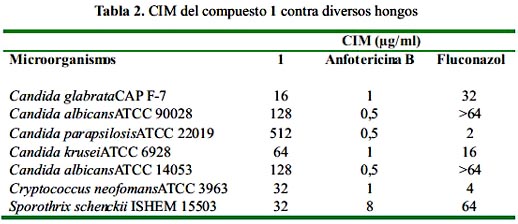
El compuesto 1 fue aislado previamente de Psidium acutangulum, mostrando actividad contra los hongos fitopatógenos Rhizoctonia solani y Helminthosporium teres.15 En el presente trabajo el compuesto 1 fue aislado a través de fraccionamiento bioguiado, evaluando las fracciones obtenidas contra varios hongos patógenos humanos. Interesantemente, el compuesto 1 mostró actividad contra los hongos Candida glabrata y Sporothrix schenckii que fue comparable a la del fluconazol.
CONCLUSIONES
El extracto etanólico de Psidium acutangulum mostró una buena actividad antifúngica in vitro frente a diversos hongos patógenos humanos. Este hallazgo apoyaría el uso de esta planta en la medicina popular para el tratamiento de infecciones de la piel. Los estudios de fraccionamiento bioguiado sobre el extracto etanólico de P. acutangulum mostraron que la actividad antifúngica de dicha especie se debe principalmente a la 3'-formil-2',4',6'- trihidroxidihidrochalcona.
AGRADECIMIENTO
L.W. recibió una subvención de Stony Brook Escuela de Medicina de Barry Coller (Fondo para la Investigación en Salud Internacional). Agradecemos al Dr. Nicolás Fabre de la Universidad de Toulouse, Francia por la asistencia en la obtención de espectros RMN (1H,
13C) y MS.
BIBLIOGRAFÍA
1. Weitzman, I., Summerbell, R., Clinical Microbiology Reviews. 1995, 8, 240–259.
2. Freixa, B., Vila, R., Vargas, L., Lozano, N., Adzet, T., CanÞigueral, S. Phytotherapy Research. 1998, 12, 427–431.
3. Sangeorzan, J.A., Bradley, S.F., He, X., Zarins, L.T., Ridenour, G.L., Tiballi, R.N., Kauffman, C.A., Americal Journal of Medicine. 1994 ,97, 339–346,
4. Debruyne, D., Clinical Pharmacokinetics. 1997, 33, 52–77.
5. Mathew, B.; Nath, M. Chem.Med.Chem. 2009, 4, 310-323.
6. Mukherjee, P.K., Leidich, S.D., Isham, N., Leitner, I., Ryder, N.S., Ghannoum, M.A., Antimicrobial Agents and Chemotherapy. 2003, 47, 82–86.
7. Svetaz, L., Zuljan, F., Derita, M., Petenatti, E., Tamayo, G., Cáceres, A., Filho, V.C., Giménez, A., Pinzón, R., Zacchino, S.A., Gupta, M., Journal of Ethnopharmacology. 2010, 127, 137–158.
8. Redding, S., Smith, J., Farinacci, G., Rinaldi, M., Fothergill, A., Rhine-Chalberg, J., Pfaller, M., Clinical Infectious Diseases. 1994, 18, 240–242.
9. Ruhnke, M., Eigler, A., Tennagen, I., Geiseler, B., Engelmann, E., Trautmann, M., Journal of Clinical Microbiology. 1994, 32, 2092–2098,
10. Goldman, M., Cloud, G.A., Wade, K.D., Reboli, A.C., Fichtenbaum, C.J., Hafner, R., Sobel, J.D., Powderly, W.G., Patterson, T.F., Wheat, L.J., Stein, D.K., Dismukes, W.E., Filler, S.G., Clinical Infectious Diseases. 2005, 41, 1473–1480.
11. Hamza, O.J.M., van den Bout-van den Beukel, C.J.P., Matee, M.I.N., Moshi, M.J, Mikx, F.H.M., Selemani, H.O., Mbwambo, Z.H., Van der Ven, A.J.A.M., Verweij, P. E., Journal of Ethnopharmacology. 2006, 108, 124–132.
12. Cos, P., Vlietinck, A.J., Vanden Berghe, D., Maes, L., Journal of Ethnopharmacology. 2006, 106, 290–302.
13. Maregesi, S.M., Pieters, L., Ngassapa, O.D., Apers, S., Vingerhoets, R., Cos, P., Vanden Berghe, D.A., Vlietinck, A.J., Journal of Ethnopharmacology.
2008, 119, 58–66,14. Arévalo, G., "Medicina Indígena. Las plantas medicinales y su beneficio en la salud Shipibo-Conibo", Editorial AIDESEP, Lima, Perú, 1994.
354 pp.15. Miles, D.H., Rosa del Medeiros, J.M., Chittawong, V., Hedin, P.A., Swithenbank, C., Lidert, Z., Phytochemistry. 1991, 30, 1131-1132
.
Recibido el 20-07-2011
Aprobado el 04-08-2011
* autor de correspondencia:
rosario.rojas@upch.pe,
Av. Honorio Delgado 430,
San Martín de Porres, Lima, Perú,
Tel +51 1 3190000 ext. 2705













