Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.78 n.1 Lima ene./jun. 2012
TRABAJOS ORIGINALES
Aislamiento y caracterización bioquímica de la bilinearina, un factor activador de protrombina del veneno de la serpiente peruana Bothrops bilineatus (loro machaco)
Isolation and biochemical characterization of bilinearin, a prothrombin-activator factor from Bothrops bilineatus (loro machaco) peruvian snake venom
Edith Rodríguez1 , Gustavo A. Sandoval1 , Armando Yarlequé1*
1 Laboratorio de Biología Molecular. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima – Perú.
* E-mail: ayarleque48@gmail.com
RESUMEN
A partir del veneno de Bothrops bilineatus (loro machaco) se ha detectado y purificado un activador de protrombina al cual se le ha designado con el nombre de bilinearina. Su aislamiento se consiguió en dos pasos cromatográficos en columnas de CM Sephadex C-50 y Sephadex G-100 SF, equilibradas con buffer acetato de amonio 0,05 M pH 7,0, purificándola 10,4 veces con un rendimiento de 78,3%, obteniéndose un 7,5% de proteína activa. Asimismo, se determinó que esta enzima es una glicoproteína básica constituida por 2 cadenas polipeptídicas con un peso molecular de 23 kDa, conteniendo 8,4% de carbohidratos asociados. La enzima procoagulante es capaz de atacar directamente la protrombina comercial sin la adición de Ca2+, ni fosfolípidos, produciendo trombina activa con capacidad de coagular el plasma humano citratado. Además, la fuerte inhibición registrada con los agentes quelantes EDTA y EGTA, reveló que la bilinearina es una metaloproteasa, con una marcada reducción en su actividad enzimática empleando 2-mercaptoetanol. Esta enzima es estable sólo hasta 45 ºC, perdiendo 60% de su actividad luego de su exposición a 55 ºC. Finalmente, los ensayos de inmunodifusión e inmunoelectroforesis demostraron que bilinearina es una proteína inmunogénica que produce reacción con el antiveneno botrópico polivalente (INS-Perú).
Palabras clave: Bothrops bilineatus, veneno, protrombina, coagulación.
ABSTRACT
A prothrombin activator, called bilinearin, has been detected and isolated from Bothrops bilineatus (loro machaco) snake venom. For its isolation, a combination of two chromatographical steps, CM Sephadex C-50 followed by Sephadex G-100 SF in ammonium acetate buffer 05 M pH 7,0. This enzyme was purified 10,4 times with a yield of 78,3%, and a recovery of 7,5%. Furthermore, it was determined that its molecular weight is 23-kDa, and is formed by 2 polypeptide chains, and 8,4% of attached carbohydrates. Bilinearin is a procoagulant enzyme capable of attacking commercial prothrombin in a direct manner without addition of Ca2+ or phospholipids, producing an active thrombin with clotting activity on human plasma. It was also determined that bilinearin is a metalloprotease because of its strong inhibition by EDTA and EGTA. This enzyme was also inhibited by 2-mercaptoetanol and after exposition to 55ºC, although it was only active until 45ºC. Finally, bilinearin is an immunogenic protein as demonstrated by its reaction to polyvalent bothropic antivenom (INS-Peru) using immunodiffusion and immunoelectrophoresis.
Key words: Bothrops bilineatus, venom, prothrombin, clotting.
INTRODUCCIÓN
Los activadores de protrombina son proteinasas que promueven la coagulación, actuando en diferentes etapas de este proceso para generar la formación de trombina a partir de la protrombina circulante. El fenómeno de coagulación es el proceso fisiológico de mayor significado como parte de la hemostasis, ya que la formación del coágulo de fibrina es decisiva para evitar el escape de la sangre de un vaso lesionado1. Tanto por la vía intrínseca o "lenta" como por la vía extrínseca o "rápida", se puede formar el complejo activador de protrombina cuyo componente principal es el factor X activado (FXa); es decir, convertido en una proteasa funcional a partir de su zimógeno, siendo los fosfolípidos, el calcio y otros componentes, como los factores V, VII y VIII cofactores del evento, dependiendo de la vía utilizada. Este complejo activador es el responsable de la escisión de la protrombina2.
En los venenos de serpientes se ha encontrado proteínas activadoras de la protrombina, las cuales pueden atacar directamente a esta molécula o producir acción sobre el factor X. Adicionalmente, se han descrito algunas proteínas que tienen acción sobre el factor V, para dar lugar a su activación y consiguiente participación no enzimática en el complejo activador de protrombina. En nuestro país, la serpiente venenosa Bothriopsis bilineata (loro machaco) es un espécimen arborícola distribuido con mayor frecuencia en los departamentos de Amazonas, Loreto, San Martín y Junín. A partir del análisis bioquímico y de la acción tóxica de su ponzoña se ha logrado identificar y caracterizar algunos de sus componentes, tales como la enzima similar a trombina3, la fosfolipasa A y una fibrinogenasa. En el caso de la primera un análisis comparativo entre esa enzima con la de Lachesis muta, señalaba claramente que sólo tenía un 20% de su actividad coagulante, por lo que era necesario explorar la existencia de otras proteínas que participaran en la acción coagulante del veneno, probablemente algunos de los factores procoagulantes4.
Por este motivo, nos propusimos explorar e identificar un factor activador de protrombina al que hemos denominado bilinearina, siguiente las pautas de Subcomité de Nomenclatura para Factores Hemostáticos Exógenos de la Sociedad Internacional de Trombosis y Hemostasis5.
PARTE EXPERIMENTAL
Veneno
Se empleó veneno liofilizado obtenido a partir de especímenes de la serpiente peruana Bothrops bilineatus, procedentes de la región de Pucallpa, departamento de Ucayali y mantenidos en cautiverio en el Serpentario "Oswaldo Meneses" del Museo de Historia Natural (UNMSM). La extracción del veneno se realizó por presión manual de las glándulas, siendo este fluido tóxico liofilizado y conservado a 4 ºC hasta su utilización.
Determinación de proteína
El contenido proteico del veneno crudo así como de las fracciones obtenidas fue cuantificado midiendo la absorbancia de luz UV a 280 nm6 en un espectrofotómetro Shimadzu UV 120-02. Además, se empleó el método de Lowry7 modificado en nuestro laboratorio8 utilizando un fotocolorímetro Spectronic Bausch & Lomb, y empleando albúmina sérica bovina como proteína estándar.
Purificación de la bilinearina
50 mg de veneno liofilizado de B. bilineata fueron resuspendidos en buffer acetato de amonio 0,05 M a pH 7,0 y centrifugados a 3500 rpm durante 10 min. El sobrenadante fue aplicado a una columna de intercambio catiónico en CM Sephadex C-50 (1,1 x 25 cm) equilibrada con el mismo buffer. La elución de los componentes se realizó colectándose fracciones de 1,5 mL en un colector automático LKB. Posteriormente se aplicó el mismo buffer conteniendo NaCl 0,3 M para la elución de las proteínas retenidas en el sistema. En cada fracción obtenida se estimó la actividad procoagulante usando plasma humano citratado. Las fracciones con mayor actividad fueron concentradas y aplicadas a una columna de filtración molecular en Sephadex G-100 SF (1,1 x 25 cm), previamente equilibrada con buffer acetato de amonio 0,05 M a pH 7,0 y se colectaron fracciones de 1,0 mL. Las fracciones con actividad procoagulante fueron analizadas por electroforesis y usadas para la caracterización de la enzima.
Análisis electroforético
Se empleó la Electroforesis en Geles de Poliacrilamida en condiciones denaturantes con SDS (PAGE-SDS)9. La corrida electroforética se realizó aplicando 100 V constantes durante 1 h. Luego el gel fue teñido con azul brillante de Coomassie 0,1% por 10 min, para luego ser decolorado hasta evidenciar las bandas proteicas.
Actividades enzimáticas
Actividad procoagulante.- Se midió la capacidad de coagulación del veneno crudo sobre el plasma humano citratado, obtenido a partir de sangre venosa de personas voluntarias, la cual fue mezclada con citrato de sodio al 3,8% y centrifugada por 20 minutos a 1000 rpm, obteniéndose la fracción sobrenadante correspondiente. Para los ensayos se tomaron 0,2 ml de plasma citratado y 0,1 ml de veneno o de las fracciones obtenidas, incubándose las muestras a 37 ºC hasta la obtención del coágulo total y registrándose los tiempos en segundos10. Asimismo, se probó la actividad de las mismas muestras sobre una solución de fibrinógeno bovino 5 mg/ml. en buffer Tris-HCl 0,05 M pH 7,4. Una unidad de actividad (U) se define como la inversa del tiempo de coagulación en segundos.
Activación del factor II (Formación de trombina).- La conversión de protrombina a trombina por acción de la bilinearina fue ensayado a partir de solución de protrombina comercial en buffer Tris-HCl 0,05 M pH 8,0, la cual fue combinada con la enzima procoagulante e incubada a 37ºC11. A intervalos de 5 minutos, se extrajeron alícuotas de la mezcla para ser analizadas tanto por PAGE-SDS como para medir la actividad coagulante de la trombina formada sobre fibrinógeno, BAPNA y Chromozyn TH.
Actividad sobre sustratos sintéticos.- Se determinó la actividad amidolítica sobre BAPNA (benzoil arginil p-nitroanilida) según el método de Erlanger et al.12, así como sobre el sustrato Chromozym TH (Tos-Gly-Pro Arginil p-nitroanilida)13. Una unidad de actividad (U) se define como la cantidad de proteína necesaria para liberar un µmol de p-nitroanilida por minuto.
Determinación de carbohidratos asociados
Para la determinación de carbohidratos asociados se emplearon las técnicas descritas por Winzler14 para hexosas y hexosaminas, y por Warren15 para ácido siálico.
Inhibición de la enzima por agentes químicos y físicos
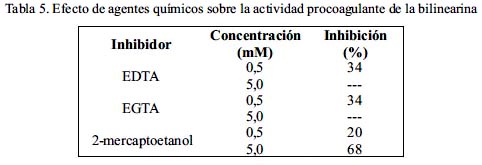
La tolerancia de la enzima purificada a la temperatura fue determinada entre el rango de 37ºC a 70ºC, Asimismo, se evaluó el efecto de inhibidores enzimáticos como el EDTA, EGTA y otros agentes químicos como el 2-mercaptoetanol a concentraciones finales de 0,5 a 5 mM. En ambos casos la enzima fue pre-incubada por 15 min. a determinados valores de temperatura o concentración de inhibidores para luego medir su actividad procoagulante sobre plasma humano citratado.
Ensayos de inmunogenicidad
La inmunogenicidad de la enzima fue valuada mediante las técnicas de inmunodifusión e inmunoelectroforesis de acuerdo a Ouchterlony y Nilsson16, empleando el antiveneno botrópico polivalente (INS-Perú).
RESULTADOS
Aislamiento de la bilinearina
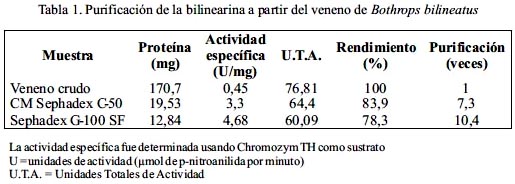
La proteína procoagulante bilinearina fue purificada a través de dos pasos cromatográficos: en CM Sephadex C-50 y Sephadex G-100 SF, respectivamente; a partir del veneno completo de Bothrops bilineatus. En el primer paso se obtuvo 2 picos de proteína eluidos isocráticamente los cuales crecieron de actividad procoagulante y otros 2 picos que eluyeron al aplicarse NaCl 0,3 M, correspondiendo la actividad al segundo pico (figura 1). Al emplearse Sephadex G-100 SF, la enzima fue obtenida en el primer pico de proteína con un Ve/Vo de 2,26 (figura 2). La evaluación de actividad enzimática sobre Chromozym TH reveló que la proteína aislada fue purificada 10,4 veces con un rendimiento de 78,3% y con una recuperación de proteína activa de 7,5% (tabla 1).
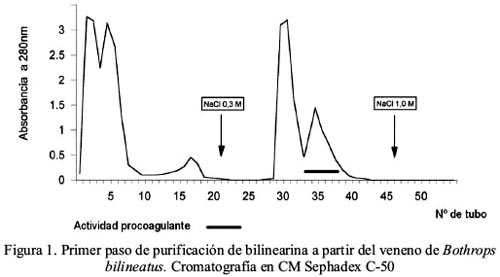
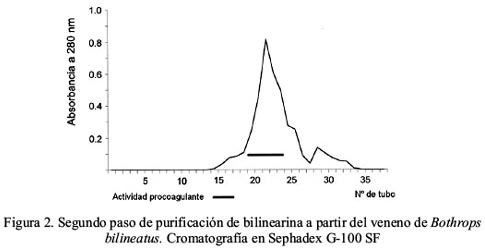
Acción procoagulante de la bilinearina
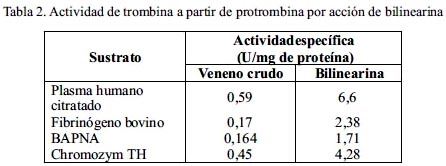
Los ensayos con la proteína aislada para coagular el plasma humano citratado y el fibrinógeno bovino, respectivamente, mostraron que sólo en el caso del plasma se obtenía coagulación total en un tiempo promedio de 60 seg. cuando se utilizaron 2,5 µg de enzima. En cambio, no se observó coagulación cuando se empleó fibrinógeno bovino 5 mg/ml, aun a tiempos mayores de 10 min. Asimismo, los experimentos en los que los productos de hidrólisis fueron capaces de atacar BAPNA, fibrinógeno y Chromozym TH, demostraron que la proteína en estudio es un activador directo de la protrombina, liberando trombina activa sin el requerimiento de Ca2+, fosfolípidos o cualquier otro factor sanguíneo (tabla 2). Estos resultados concuerdan con los ensayos electroforéticos en los que se verificó la desaparición progresiva de la banda correspondiente a protrombina por acción de bilinearina y en cambio, apareció una nueva banda que es la trombina preformada (figura 3). Por esta razón, podemos afirmar que la bilinearina es una proteína procoagulante que activa directamente al factor II o protrombina por lo que pertenece al grupo I de activadores de protrombina23.
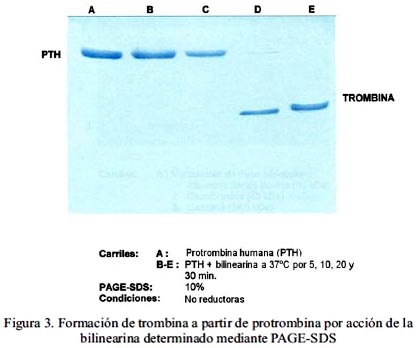
Propiedades bioquímicas de la bilinearina
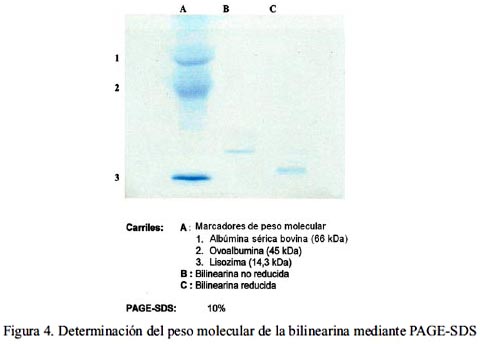
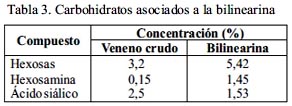
Mediante la técnica de PAGE-SDS se determinó que la bilinearina presenta un peso molecular de 23 kDa, lo que la sitúa en el rango de proteínas de mediano peso molecular. Al realizarse la corrida en presencia de 2-mercaptoetanol, la banda obtenida fue única pero con un peso molecular de 15 kDa (figura 4). Del análisis de carbohidratos asociados a la proteína en estudio, se reveló la presencia de 5,42% de hexosas, 1,45% de hexosaminas y 1,53% de ácido siálico, lo que demuestra que la enzima aislada es una glicoproteína que contiene un total de 8,4% de carbohidratos (tabla 3).
Inhibición por agentes físicos y químicos
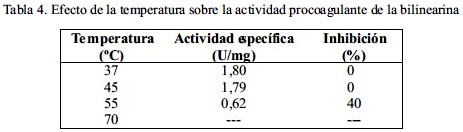
La proteína coagulante no modificó su actividad hasta los 45ºC; sin embargo, a 55ºC se produjo una notable pérdida de actividad al 40% mientras que a 70ºC se anuló completamente (tabla 4). Cuando la bilinearina fue tratada previamente con EDTA y EGTA se reveló que es inhibida parcialmente a concentraciones finales de 0,5 mM, mientras que a concentraciones de 5 mM se observó una inhibición total de la actividad procoagulante. En el caso del efecto del 2-mercaptoetanol, dicha actividad sólo se reduce a un 68% cuando se emplea una concentración de 5 mM (tabla 5).
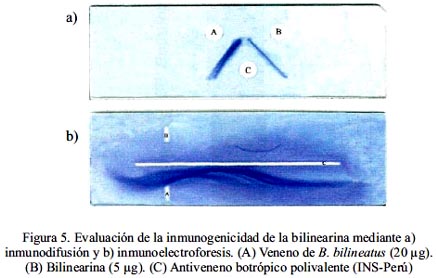
Inmunogenicidad de la bilinearina
Las pruebas efectuadas con el veneno crudo y la enzima purificada de Bothrops bilineatus frente al suero antibotrópico polivalente, demostraron una marcada reactividad del veneno total, tanto en las pruebas de inmunodifusión como inmunoelectroforesis. En cuando a la enzima en estudio, se observó también reactividad frente al antiveneno, lo que indicaría que el suero contiene inmunoglobulinas anti-bilinearina (figura 5).
DISCUSIÓN
El proceso de coagulación sanguínea es parte del fenómeno de la hemostasis, el cual ocurre en los vertebrados como consecuencia de eventos destinados a evitar el sangrado. En este proceso, el fibrinógeno -proteína fundamental del plasma- es atacado enzimáticamente para convertirlo en fibrina y de ese ataque es responsable la trombina, proteína que se encuentra circulante sólo bajo la forma de su zimógeno, la protrombina. Fisiológicamente se ha demostrado que la ruptura enzimática de la protrombina depende de la formación de un complejo activador, en el que participan el factor Xa asociado a: fosfolípidos, iones calcio y ciertos factores procoagulantes. En cambio, en los venenos ofídicos existen proteasas específicas, conocidas como activadores, que pueden atacar directamente a la protrombina resultando ser enzima procoagulantes17. Por otro lado, se puede producir coagulación si una proteína exógena ataca directamente el fibrinógeno, de modo semejante a como lo hace la trombina; estas son las proteínas coagulantes, también denominadas enzimas similares a trombina, contenidas en numerosos venenos de serpientes, principalmente aquellos de la familia Viperidae18. Si consideramos que la coagulación por la vía del ataque del fibrinógeno es un fenómeno directo mientras que, por la vía de la activación de la protrombina requiere por lo menos un paso adicional, podemos asumir que en el caso que un veneno contenga ambos tipos de enzimas, la coagulación no sólo será más intensa sino que probablemente por un tiempo mayor en la circulación1. Esto promueve, entonces, la necesidad de identificar plenamente a las enzimas disponibles en cada veneno para explicar sus efectos sobre la coagulación sanguínea.
Aislamiento de la bilinearina
El procedimiento cromatográfico utilizado permitió purificar a la bilinearina con un valor de 10,4 veces con respecto al veneno crudo, con un elevado rendimiento de 78,3%, habiéndose recuperado 7,5% de proteína activa. En otros venenos de serpientes se ha logrado obtener proteínas activadoras de protrombina de este tipo, por ejemplo a partir del veneno de Bothops atrox; Hofmann y Bon11 separaron a la batroxarina a través de tres pasos cromatográficos con una purificación de 326 veces, un rendimiento de 5,6% y una recuperación de 0,02%.
Asimismo, del veneno de A. halyspallas se aisló una proteína análoga denominada aharina, usando tres pasos cromatográficos con una purificación de 80 veces y un rendimiento de 20%17. Así, el procedimiento empleado resultó idóneo, ya que permitió la separación de una nueva proteína, que en este caso se caracterizó por su acción procoagulante.
Propiedades de la bilinearina
Nuestros experimentos -tratando la protrombina con bilinearina y luego determinando la actividad del producto enzimático sobre los sustratos para trombina (tabla 2) - demuestran fehacientemente que estábamos frente a un activador de protrombina. Dado que bilinearina coagula el plasma sin requerir la adición de Ca2+ ni fosfolípidos exógenos, nuestra enzima correspondería al grupo I de los activadores de protrombina, grupo en el cual también se encuentra la ecarina obtenida de la serpiente africana Echis carinatus, proteína responsable de severos desórdenes en la coagulación por consumo de fibrinógeno20. Se ha demostrado que la acción enzimática de los activadores del grupo I se verifica por cortes en la protrombina humana a nivel de Arg320-Ile321 y en el caso de la protrombina bovina a nivel de Arg323- Ile324, generando en ambos casos meizotrombina, la cual se convierte en trombina por un proceso autocatalítico21. Posteriormente, se determinó que la bilinearina posee un peso molecular de 23 kDa (figura 3) el cual corresponde a las macromoléculas de mediano peso que se encuentran en venenos de serpientes tal como ocurre con las proteinasas I y II de Lachesis muta22. De igual manera, el hecho de que la bilinearina muestre valores de peso molecular marcadamente distintos para la proteína reducida y no reducida es una firme demostración que nuestra proteína es un dímero de 23 kDa conformado por dos cadenas polipeptídicas de aproximadamente 15 kDa cada una. Así también, hemos demostrado que la bilinearina es una glicoproteína que contiene un total de 8,4% de carbohidratos asociados, habiéndose reportado para ecarina un 16% distribuido en proporciones cercanas entre hexosas, hexosamina y ácido siálico20. Adicionalmente, hemos demostrado que la bilinearina es una metaloproteinasa, pues la pre-incubación con los agentes quelantes EDTA y EGTA reducen progresivamente su actividad hasta anularla si se utiliza 5 mM de los reactivos mencionados (tabla 5). Así podemos mencionar una diferencia básica entre los activadores de protrombina, ya que todos los pertenecientes al grupo I, incluyendo ahora la bilinearina, son metaloproteasas a diferencia de las proteínasas de los grupos II y III, que suelen ser serino o tiolproteasas23. Finalmente, las pruebas de inmunogenicidad frente al antiveneno botrópico polivalente han dejado en claro que el veneno total posee determinantes antigénicos capaces de formar líneas o arcos de precipitación con el antiveneno, lo que significa que este antídoto es capaz de neutralizar las proteínas típicas de un veneno botrópico24. Asimismo, la reactividad encontrada con bilinearina bajo las mismas condiciones sugiere que esta proteína es susceptible a la neutralización por el antiveneno25.
CONCLUSIONES
La presente investigación ha permitido purificar y caracterizar un activador de protrombina o bilinearina del veneno de Bothrops bilineatus, el cual ataca a la protrombina convirtiéndola en trombina sin requerimiento de ningún co-factor, por lo que la enzima en estudio pertenece al grupo I de dichos activadores. Se trata de una glicoproteína básica homodimérica y antigénica a juzgar por su reactividad frente al antiveneno botrópico polivalente (INS-Perú).
AGRADECIMIENTOS
Los autores de este estudio agradecen a la International Foundation for Science (Suecia) por el apoyo financiero brindado para la línea de investigación sobre proteínas coagulantes de venenos de serpientes peruanas en la cual está inmersa esta investigación. Con este trabajo experimental, uno de los autores (E.R.) obtuvo su grado de magíster en bioquímica en la UNMSM.
BIBLIOGRAFÍA
1. Kini RM. Toxins in thrombosis and haemostasis: potential beyond imagination. J Thromb Haemost. 2011:9 Suppl 1:195-208.
2. Bon C, Wisner A. Snake venom proteins acting on hemostasis. Biochimie. 2000;82(9-10):851-9.
3. Cahuana G. Características de un enzima coagulante aislada del veneno de la serpiente Bothrops bilineatus "loro machaco" y su comparación con una coagulasa bacteriana. Tesis para optar al título profesional de Biólogo con Mención en Microbiología y Parasitología. 1996. UNMSM. Lima - Perú.
4. Rodríguez E, Cahuana G, Sandoval GA, Yarleque M, Yarleque A. Preliminar evaluation of coagulant activity of Bothrops bilineatus Peruvian snake venom "loro machaco". Rev Soc Quim Peru. 2010; 76(2):131-7.
5. Kini RM. Serine proteases affecting blood coagulation and fibrinolysis from snake venoms. Pathophysiol Haemost Thromb. 2005;34(4-5):200-4.
6. Warburg O, Christian W. Isolierung and Kristallisation der Garungs ferments enolase. Biochem Z. 1941:310:384-421.
7. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951;193(1):265-75.
8. Loayza S, Morante Y, Campos S, Yarlequé A. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox. Bol Soc Quim Perú. 1985;52(3):151-63.
9. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227(5259):680-5.
10. Yarlequé A, Campos S, Escobar E, Lazo F, Sánchez N, Hyslop S, et al. Isolation and characterization of a fibrinogen-clotting enzyme from venom of the snake Lachesis muta muta (peruvian bushmaster). Toxicon. 1989:27(11):1189-97.
11. Hofmann H, Bon C. Blood coagulation induced by the venom of Bothrops atrox. 1. Identification, purification, and properties of a prothrombin activator. Biochemistry. 1987;26(3):772-80.
12. Erlanger BF, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Arch Biochem Biophys. 1961;95:271-8.
13. Friberger P. Chromogenic peptide substrates. Their use for the assay of factors in the fibrinolytic and the plasma kallikrein-kinin systems. Scand J Clin Lab Invest Suppl. 1982;162:1-298.
14. Winzler RJ. Determination of serum glycoproteins. Methods Biochemical Anal. 1955;2:279-311.
15. Warren L. The thiobarbituric acid assay of sialic acids. J Biol Chem. 1959;234(8):1971-5.
16. Ouchterlony O, Nilsson L. Immunodifussion and immunoelectrophoresis. Handbook of Experimental Immunology. 1967;I: 655-660.
17. Lu Q, Clemetson JM, Clemetson KJ. Snake venoms and hemostasis. J Thromb Haemost. 2005;3(8):1791-9.
18. Yarlequé A. Las serpientes peruanas y sus venenos. Lima: Fondo Editorial-UNMSM; 2000.
19. Zhang Y, Lee WH, Gao R, Xiong YL, Wang WY, Zhu SW. Effects of Pallas' viper (Agkistrodon halys pallas) venom on blood coagulation and characterization of a prothrombin activator. Toxicon. 1998 Jan;36(1):143-52.
20. Schieck A, Kobnalik F, Habermann E. The prothrombin-activating principle from Echis carinatus venom. I. Preparation and biochemical properties. Naunyn Schmiedebergs Arch Pharmacol. 1972;272(4):402-16.
21. Stocker K: Snake venom proteins affecting hemostasis and fibrinolysis. In: Stocker K (ed): Medical Use of Snake Venom Proteins. Boca Raton, CRC Press, 1990, pp 97-160.
22. Rodríguez E, Yarlequé A. Purification and biochemical characterization of two proteinases from Lachesis muta, snake. Toxicon. 1990;28:261.
23. Kini RM. The intriguing world of prothrombin activators from snake venom. Toxicon. 2005;45(8):1133-45.
24. Instituto Nacional de Salud. Diagnóstico y tratamiento de los accidentes por animales ponzoñosos. Lima: El Instituto; 2004.
25. Chippaux JP, Goyffon M. Venoms, antivenoms and immunotherapy. Toxicon. 1998;36(6):823-46.
Recibido el 27-12-2011
Aprobado el 19-01-2012













