Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Sociedad Química del Perú
versão impressa ISSN 1810-634X
Rev. Soc. Quím. Perú v.78 n.1 Lima jan./jun. 2012
TRABAJOS ORIGINALES
Estudio comparativo de algunas propiedades bioquímicas de venenos de serpientes de diferentes regiones del mundo
Comparative estudy of some biochemical properties of the venoms snake from diferents world regions
Yarlequé Mirtha1 , Ortiz César1 , Morante Yolanda1 y Yarlequé Armando1
1 Laboratorio de Biología Molecular. ICBAR. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima – Perú.
RESUMEN
Se ha investigado el contenido proteico y algunas actividades enzimáticas de 15 muestras de veneno de serpientes de la familia Viperidae y 4 de la familia Elapidae. El análisis proteico se realizó con los métodos colorimétricos de Lowry y Bradford y además se evaluaron las actividades de 5'nucleotidasa, proteasa, coagulante y amidolítica, así como la acción procoagulante. De la evaluación de estos parámetros se obtuvo valores elevados de proteínas cercanos o iguales al 100 % en los venenos de elápidos tales como en Naja nigricollis y Naja mossambica, así como Crotalus adamanteus, Crotalus atrox y Hemachatus haemachatus (Fam. Viperidae). La actividad 5'nucleotidasa estuvo presente en la mayoría de las muestras analizadas, mientras que, se detectó una elevada actividad procoagulante en el veneno de Dendroaspis angusticeps. La actividad proteolítica fue más elevada en los venenos de la familia Viperidae correspondiendo los de mayor actividad a Crotalus atrox y Calloselasma rhodostoma. En el caso de la actividad amidolítica y de la actividad coagulante los venenos que mostraron una mayor actividad fueron los de Lachesis muta y Bothrops atrox, en tanto que ninguno de los venenos elapídicos mostraron dichas actividad. Esta investigación ha permitido establecer claras diferencias bioquímicas entre todos los venenos estudiados.
Palabras clave: Veneno, serpiente, enzimas, proteínas, regiones.
ABSTRACT
The protein content and some enzymatic activities were investigated in 15 samples of venom snake belong to the Viperidae family and 4 to Elapid family. The protein analysis was performed by Lowry and Bradford colorimetric methods and 5'nucleotidase, protease, amidolytic coagulant and procoagulant activities were evaluated. As results, high protein content close to 100% were registered in venom of Naja nigricolis and Naja mossambica (Fam. Elapidae), as well as Crotalus adamanteus, Crotalus atrox and Hemachatus haemachatus (Fam. Viperidae). 5' nucleotidase activity was detected in the majority of venoms, whilest a high procoagulante activity was observed in the venom of Dendroaspis angusticeps. In regards to, proteolytic activity was the most higher in the venoms of Crotalus atrox and Calloselasma rhodostoma. In the case of amidolytic and coagulant activities, the venoms from Lachesis muta and Bothrops atrox registered the high activities, however, any elapids venoms showed these activities. According to this research, some biochemical characteristics in each samples was determinated.
Key words: Venom, snake, enzymes, proteins, regions.
INTRODUCCIÓN
Las serpientes venenosas abarcan aproximadamente unas 300 especies en todo el mundo, estando distribuidas en 4 familias: Viperidae, Elapidae, Hidrophiiidae y Colubridae, teniendo esta última solo unas pocas especies venenosas1, 2. Las serpientes que ocasionan mayor incidencia de envenenamientos pertenecen a las familias Elapidae y Viperidae, donde las primeras contienen una ponzoña elevadamente neurotóxica, mientras que las serpientes de la familia Viperidae generan severos daños locales y sistémicos que incluyen edema, hemorragia, hipotensión, trastornos en la coagulación sanguínea y necrosis2.
Los efectos biológicos generados en un envenenamiento son consecuencia del tipo de toxinas que contiene la ponzoña del animal. Así tenemos a las enzimas, componentes del veneno cuya acción está estrechamente asociada a la toxicidad. Por ejemplo, se ha detectado en varios venenos actividad 5' nucleotidasa, la cual estaría implicada en procesos como el bloqueo de la síntesis de ATP por degradación selectiva del AMP, hipotensión y lesiones en el músculo cardiaco por acción de la liberación de derivados adenílicos3. Por su parte, las metaloproteasas están ampliamente asociadas a los procesos de hemorragia, degradando a los componentes de la matriz extracelular y favoreciendo la extravasación de fluidos, lo que a su vez genera hipotensión en los vasos sanguíneos4. En cuanto a la acción coagulante, los venenos de vipéridos han mostrado contener enzimas similares a trombina, las cuales coagulan el fibrinógeno plasmático, produciendo microcoágulos que, a su vez, son digeridos por el sistema fibrinolítico del animal o del paciente, dando lugar a una coagulación intravascular diseminada inicial seguida de una desfibrinación y la consecuente incapacidad de la sangre para coagularse5.
Si bien los efectos producidos por los venenos de serpientes indican que en las ponzoñas de las especies de la familia Viperidae existe un elevado contenido enzimático, mientras que en los de la familia Elapidae predominan principalmente polipéptidos no enzimáticos con acción neurotóxica2, muchas especies pueden presentar peculiaridades, por lo que requieren ser analizadas cuidadosamente. Es así que nosotros decidimos realizar un estudio comparativo del contenido proteico y de algunas actividades enzimáticas, en muestras de venenos de serpientes procedentes de América, Asia, Europa y África.
PARTE EXPERIMENTAL
Material biológico
Se emplearon venenos liofilizados de serpientes de las familias Viperidae y Elapidae de diferentes zonas de África, América, Europa y Asia (tabla 1). Los venenos de las serpientes Lachesis muta, Bothrops atrox y Bothrops pictus corresponden a ejemplares peruanos y fueron donados por el Instituto Nacional de Salud de Lima, Perú. Por otro lado, los venenos de Agkistrodon piscivorus, Calloselasma rodhostoma, Crotalus adamanteus, C. atrox, Bitis arietans, Cerastes cerastes, Vipera aspis aspis, Macrovipera deserti (antes Vipera lebetina deserti), Daboia russelli (antes Vipera russelli russelli), Hemachatus haemachatus, Naja mossambica y N. nigricollis fueron donados por los Laboratorios de Toxinas y Animales Venenosos (LATOXAN) de Francia. Con respecto al veneno de Dendroaspis angusticeps fue donado por el Dr. Ever Karlsson del Departamento de Bioquímica de la Universidad de Uppsala-Suecia. Asimismo, los venenos de Bitis gabonica y B. nasicornis fueron donados por el Dr. Neville Marsh, del Departamento de Fisiología del Queen Elizabeth College, de la Universidad de Londres-Inglaterra. Finalmente, el veneno de Crotalus durissus terrificus fue donado por el Dr. JC Vidal, del Instituto de Neurobiología de Buenos Aires, Argentina.
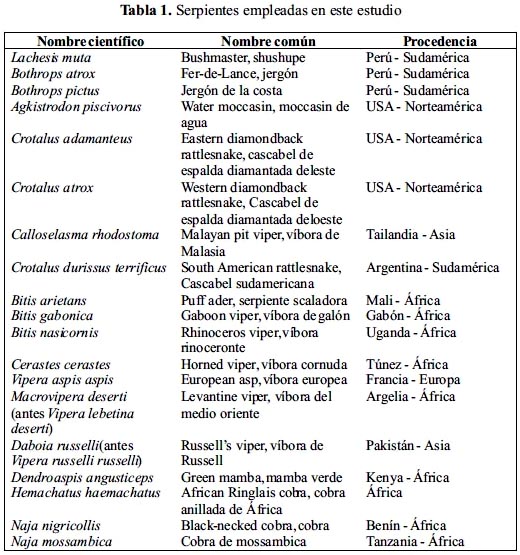
Cuantificación de proteínas
La cantidad de proteína fue calculada midiendo la absorbancia de luz UV a 280 nm en un espectrofotómetro Shimadzu UV 120-026. Además, se empleó el método de Lowry7 y el método de Bradford8 modificados en nuestro laboratorio, utilizando un fotocolorímetro Spectronic Bausch & Lomb y un espectrofotómetro Shimadzu UV 120-02, respectivamente; empleando, en ambos casos, albumina sérica bovina como proteína estándar.
Actividades enzimáticas
Actividad 5' Nucleotidasa
Para esta enzima se empleó el método de determinación de fosfatos modificado en este laboratorio9 en el cual se emplearon: 0,5 ml del sustrato 5'-AMP, 0,5 ml de Buffer Tris-HCl 0,05 M pH 7,4 y 0,1 ml de veneno (1mg/ml). Luego de correr la reacción por 10 minutos a 37°C se adicionó 0,5 ml de ácido perclórico 1 M y para luego agregar 1,5 ml del reactivo de fósforo. Después de 60 minutos de reposo a temperatura ambiente se midió la concentración de fosfatos libres a 820 nm. La actividad específica fue calculada por los microgramos de fósforo liberado por minutos por miligramo de proteína (U/mg).
Actividad proteolítica
Se empleó el método de Takahashi y Osaka10 modificado por Loayza et al.11, para lo cual se utilizó 1 ml de caseína al 2%, 0,5 ml de Buffer Tris-HCl 0,2 M pH 8,5 y 0,1 ml de veneno (1mg/ml), incubándose a 37°C por 15 minutos y deteniéndose la reacción con 1,5 ml de ácido tricloro acético 0,44 M. Luego, se procedió a determinar la presencia de productos ácido- solubles a 280 nm, calculándose la actividad específica midiendo los microgramos de L- tirosina liberados por minuto por miligramo de proteína (U/mg).
Actividad amidolítica
Se determinó por el método de Erlanger12 midiendo la hidrólisis que producen las serinoproteasas, principalmente la enzima similar a trombina, sobre el sustrato cromogénico benzoil-arginil-p-nitroanilida (BApNA). La mezcla de reacción contenía 1 ml de BAPNA 0,9 mM, 0,9 ml de Buffer Tris-HCl 0,05 M pH 8,1 y 0,1 ml de veneno (1mg/ml). Luego de 15 minutos de incubación a 37 °C se adicionó 1 ml de ácido acético al 60% y la liberación de p- nitroanilina fue medida a 405 nm. La actividad específica fue calculada por los micromoles de p-nitroanalina liberados por minuto por miligramo de proteína (U/mg).
Actividad coagulante
Se siguió el método descrito por Copley13, usando plasma humano citratado o fibrinógenos humano o bovino comerciales (5 mg/ml). 0,2 ml del plasma o fibrinógeno y 0,1 ml de solución salina 0,9 % fueron preincubados por 5 minutos a 37 °C para luego agregar 0,1 ml del veneno (1mg/ml) e inmediatamente registrar el tiempo que tarda el sustrato en coagularse. Se determinó la actividad enzimática dividiendo la inversa del tiempo de coagulación entre los mg de proteína utilizados. Además, se calculó la potencia coagulante (NIH unidades/mg) sobre fibrinógeno humano para los venenos que fueron capaces de coagular el fibrinógeno en un tiempo no mayor a 100 segundos14.
Actividad procoagulante
Los venenos que no mostraron efecto coagulante sobre fibrinógeno y plasma humano citratado fueron sometidos al análisis de su acción procoagulante15. Para ello, se midió el tiempo de recalcificación del plasma citratado de los preincubados que contenían la mezcla de reacción para actividad coagulante, adicionándose 0,1 ml CaCl2 25 mM. Se utilizó una regla de tres simple inversa, considerando como 100% el tiempo normal de recalcificación.
RESULTADOS
Cuantificación de proteínas
Los resultados mostrados en la tabla 2 indican que los venenos de serpiente, tanto de la familia Viperidae como Elapidae, corresponden a soluciones de naturaleza proteica, conteniendo en la mayoría de casos un porcentaje de proteína mayor al 50%. El veneno del vipérido con mayor contenido proteico, según los métodos colorimétricos, fue el de C. adamanteus con un 100 y 93% de proteínas según los métodos de Lowry y Bradford, respectivamente; mientras que los venenos de los elápidos con mayor contenido proteico fueron los de N. nigricollis y N. mossambica habiéndose registrado, según los dos métodos colorimétricos usados, valores mayores al 100%. Asimismo, entre todos los venenos analizados, el que registró el menor valor de proteínas fue el de Dendroaspis angusticeps cuyo porcentaje estuvo en el rango de 55-58%.
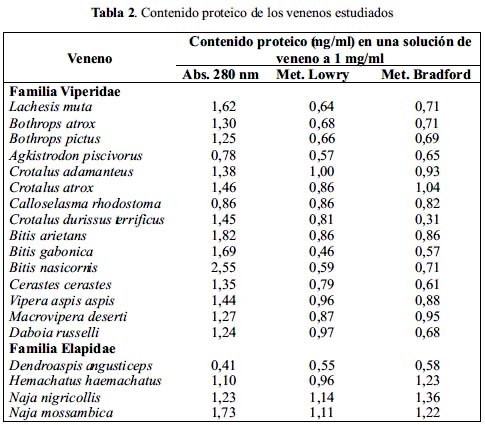
Actividades enzimáticas
Actividad 5'Nucleotidasa
Esta actividad mostró ser más elevada en los veneno de Lachesis muta (65,3 U/mg), N. mossambica (40,5 U/mg) y H. haemachatus (30,2 U/mg), mientras que los venenos de A. piscivorus, C. adamanteus, B. gabonica, V. aspis aspis y D. angusticeps no presentaron esta actividad. En el resto de venenos la actividad vario en el rango de 1,3-17,4 U/mg (tabla 3).
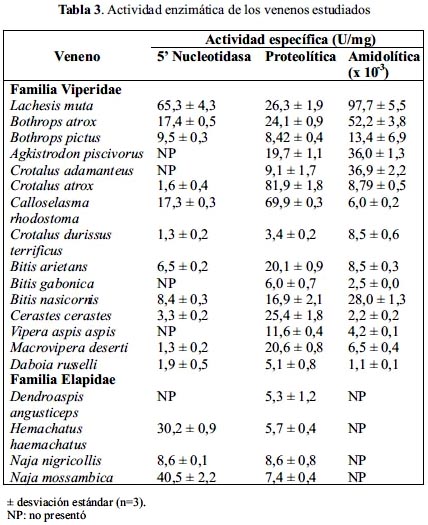
Actividad proteolítica
Como se observa en la tabla 3, la ponzoña de la mayoría de serpientes de la familia Viperidae contiene proteasas cuya actividad es mayor que en la familia Elapidae, los cuales presentan una actividad proteolítica muy limitada. Exceptuando a los venenos de C. adamanteus, C. durissus terrificus, B. gabonica, V. aspis aspis y Daboia russelli que mostraron valores bajos, semejantes a los venenos elápidos en estudio, la de actividad proteolítica de los demás vipéridos estuvo en el rango de 19,7 a 81,9 U/mg, correspondiendo los valores más elevados a C. atrox y C. rhodostoma, los cuales tuvieron una actividad de 81,9 y 69,9 U/mg, respectivamente.
Actividad amidolítica
Esta actividad sólo fue detectada en venenos de serpientes de la familia Viperidae y estuvo en un rango muy variable correspondiendo los valores más elevados a los de L. muta y B. atrox, que fueron de 97,7 x 10-3 y 52,2 x 10-3, respectivamente, mientras que los valores más bajos correspondieron a los venenos de B. gabonica, C. cerastes y D. russelli, los cuales fueron de 2,5 x10-3, 2,2 x10-3 y 1,1 x10-3, respectivamente (tabla 3).
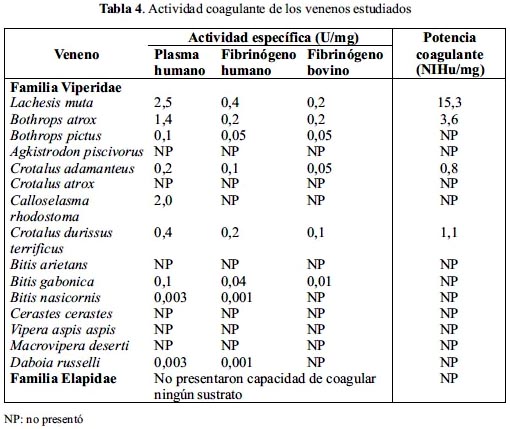
Actividad coagulante
La tabla 4 muestra que la mayoría de los venenos de la familia Viperidae contienen enzimas capaces de coagular el plasma citratado y los fibrinógenos comerciales, aunque algunos venenos muestran afinidad sólo por algunos de ellos. Así, los venenos con mayor actividad coagulante corresponde a los de L. muta y B. atrox, los cuales poseen mayor actividad sobre plasma, siendo sus valores de 2,5 y 1,4, respectivamente, poseyendo, además, una potencia coagulante de 15,3 para L. muta y de 3,6 para B. atrox. Así también, los valores más bajos fueron de los venenos de B. pictus, C. adamanteus, C. durissus terrificus, C. rhodostoma y B. gabonica. En cuanto a los venenos de B. nasicornis y D. russelli no presentaron actividad coagulante, sin embargo, cuando estos venenos fueron sometidos a mayor tiempo de incubación con los sustratos, lograron coagular tanto el plasma como el fibrinógeno humano. El resto de vipéridos, así como todos los elápidos no mostraron actividad coagulante.
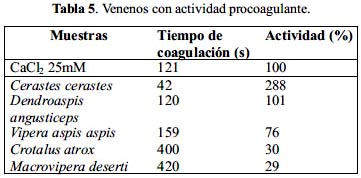
Actividad procoagulante
Se puede observar en la tabla 5 que el veneno de C. cerastes es capaz de acelerar el tiempo de recalcificación del plasma con un valor de 288%, lo que indica una elevada actividad procoagulante. Por otra parte, el veneno de D. angusticeps produce el mismo tiempo de coagulación al obtenido sin adición de veneno (100%), mientras que V. aspis aspis, C. atrox y Macrovipera deserti alargan el tiempo de recalcificación con valores de 159, 400 y 420 segundos.
DISCUSIÓN
El veneno de serpientes se caracteriza por ser una mezcla compleja rica en proteínas, dentro de las cuales destacan las enzimas5. Las toxinas del veneno probablemente evolucionaron a partir de proteínas endógenas con funciones fisiológicas normales que fueron reclutadas dentro del proteoma del veneno antes de la radiación de las serpientes avanzadas16. Nosotros hemos encontrado que este contenido proteico es especialmente elevado en las serpientes de la familia Elapidae (tabla 2), cuya ponzoña se conoce está compuesta principalmente de neurotoxinas2, péptidos de bajo peso molecular que se encuentran en cantidades apreciables en el veneno total.
Si se tiene en cuenta la alta sensibilidad de los métodos de Lowry y Bradford y de que están en función directa con la exposición de los enlaces peptídicos, se puede inferir que proteínas más pequeñas, pero con mayor número de moléculas, darían valores más altos que los que podríamos encontrar con proteínas de alto peso molecular, en las cuales, ocupando el mismo espacio que una cierta cantidad de péptidos, existe una menor proporción de los enlaces CO- NH disponibles para la reacción. Además, hay que considerar que en los venenos de los vipéridos son frecuentes las asociaciones de proteínas con carbohidratos (glicoproteínas), donde estos últimos pueden reducir el grado de sensibilidad de las reacciones colorimétricas. Es necesario considerar que la reacción de Bradford y el método de Lowry cuantifican microgramos de proteína en el orden de 0,5 a 10, por lo que constituye métodos apropiados para esta valoración. En cuanto a la absorbancia UV a 280 nm, si bien es cierto es el procedimiento más rápido y usado para la cuantificación de proteínas, podemos considerarlo como un método referencial en el caso de los venenos ofídicos, puesto que, este material biológico puede contener adicionalmente polinucleótidos, péptidos y pigmentos con anillos heterocíclicos que incrementan la absorbancia a 280 nm17.
En concordancia con estudios previos18, nosotros hemos logrado encontrar actividad de 5'nucleotidasa en las dos familias estudiadas, no hallando ninguna correspondencia entre los niveles de actividad y el grupo de venenos ofídicos analizados. La variabilidad en esta actividad enzimática no sólo parece corresponder a diferencias entre especies, sino también, entre ejemplares de la misma especie, ya que en contraste con lo encontrado por Hurst y Butler19 y Williams et al.20, quienes lograron aislar la 5'nucleotidasa de los venenos de A. piscivorus y C. adamanteus, nosotros no detectamos esta actividad en dichos venenos.
Por su parte, la actividad proteolítica fue más elevada en vipéridos que en elápidos, lo cual es un reflejo de las diferencias en las sintomatologías producidas por cada familia de serpientes. En general, el envenenamiento por vipéridos se caracteriza por sus efectos locales tales como edema, hemorragia y necrosis, además de producir alteración de la hemostasia, procesos en los cuales las proteasas juegan un rol fundamental4. Sin embargo, en elápidos estas alteraciones son menores, preponderando una interrupción de las funciones normales del sistema nervioso en donde la línea de acción de las proteasas es limitada o nula2.
La acción coagulante y procoagulante de los venenos de serpientes corresponden a estrategias evolutivas que colaboran con los procesos de parálisis y digestión de la presa14 y es una característica de muchos envenenamientos ocasionados por mordeduras de vipéridos y algunos elápidos4. Sin embargo, nuestros resultados indican que los venenos analizados de elápidos carecen de acción coagulante, así como de actividad amidolítica. Es interesante remarcar que los venenos de las serpientes L. muta y B. atrox poseen una elevada capacidad de coagular los fibrinógenos y de escindir al BApNA, lo cual estaría evidenciando la presencia serinoproteasas, especialmente enzimas similares a trombina, proteínas que ya han sido aisladas y caracterizadas en nuestro laboratorio14, 21. Por otro lado, la actividad procoagulante de C. cerastes fue elevada indicando que este veneno posee componentes involucrados en la alteración de la cascada de coagulación.
CONCLUSIONES
Los venenos de las serpientes investigadas y que proceden de diferentes regiones del mundo son sustancias con elevado y variado contenido proteico y que poseen varios tipos de enzimas preponderando en el caso de venenos de vipéridos las actividades coagulante y proteolítica, mientras que la actividad 5'nucleotidasa se encuentra tanto en venenos de vipéridos como de elápidos, lo que demuestra la variada estrategia que las serpientes pueden adoptar en favor de su alimentación, y por ende, de su supervivencia.
AGRADECIMIENTOS
Los autores del presente estudio agradecen la colaboración de las instituciones y los científicos que lo apoyaron a través de la donación de los venenos y el asesoramiento que nos brindaron.
BIBLIOGRAFÍA
1. Campbell J, Lamar W. The venomous reptiles of the western hemisphere. Ithaca (NY): Comstock Publishing Associates; 2004.
2. Warrell D. Snake bite. Lancet. 2010; 375: 77-88.
3. Campos S., Yarlequé A. 5'Nucleotidasa en el veneno de la serpiente Lachesis muta L. Boletín de la Sociedad de Química del Perú. 1974; 3, 202-212.
4. Sánchez E., Gabriel L, Gontijo S., Gremski L., Veiga S., Evangelista K, Eble J., Richardson M. Structural and functional characterization of a P-III metalloproteinase, leucurolysin-B, from Bothrops leucurus venom. Arch. Biochem. Biophys. 2007; 468, 193-204.
5. Yarlequé A. Enzimas proteolíticas en los venenos de serpientes peruanas. Boletín del Consejo Superior de Investigaciones. 2004; 54, 12-15.
6. Warburg O, Christian W. Isolierung and Kristallisation der Garungs ferments enolase. Biochem Z, 1941; 310: 384-421.
7. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem. 1951; 193 (1): 265-275.
8. Bradford MM. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle-dye binding. Anal Biochem. 1976; 72: 248-256.
9. Heredia, V.; Campos, S. y Yarlequé, A. Actividad de una 5' Nucleotidasa en el veneno de Bothrops atrox (L) "jergón". Acta Científica Venezolana. 1982; 33: 333-337.
10. Takahashi T, Ohsaka A. Purification and characterization of a proteinase in the venom of Trimeresurus flavoviridis. Complete separation of the enzyme from hemorrhagic activity. Biochem Biophys Acta. 1970; 198(2): 293-307.
11. Loayza, S.; Morante, Y.; Campos, S. y Yarlequé, A. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox. Boletín de la Sociedad Química del Perú. 1985; 52 (3): 151-163.
12. Erlanger, B.; Kokowsky, N. and Ochem, W. The preparation and properties of two new chromogenic substrates of Tripsin. Arch Biochem Biophys. 1961; 95: 271.
13. Copley, A. Studies of snake venoms on the blood coagulation. The thromboserpentin enzyme in the venoms. Thrombos Res. 1973; 2: 487-508.
14. Yarlequé A. Enzima similar a la Trombina del veneno de la serpiente Lachesis muta: Aislamiento, caracterización bioquímica y acción biológica. Tesis doctoral de la UNMSM, Lima-Perú. 1987, 14-17.
15. Yarlequé A., Heredia V., Arbaiza E., Zavaleta A. Estudios electroforéticos y acción procoagulante del veneno de Loxoceles laeta. Diagnóstico. 1986; 17: 39-45.
16. Fry, B.G. From genome to ''venome'': molecular origin and evolution of the snake venom proteome inferred from phylogenetic analysis of toxin sequences and related body proteins. Genome Res. 2005; 15, 403–420.
17. Yarlequé A. Las serpientes peruanas y sus venenos. Fondo Editorial, Universidad Nacional Mayor de San Marcos, Lima-Perú, 2000.
18. Russell F. Pharmacology of animal venoms. Clin Pharmacol Ther. 1967; 8, 849.
19. Hurts R., Butler G. The chromatographic separation of fosfates in snake venoms. J Biochem. 1951; 193, 91-96.
20. Williams E., Sung G., Laskowoski M. Action of venom phosphodiesterase on deoxyribonucleic acid. J Biol Chem. 1961; 236, 1130-1134.
21. Sandoval G., Lazo F., Rodriguez E., Yarlequé A., Zingali R. Identificación molecular y actividad sobre sustratos cromogénicos de la venombina A del veneno de la serpiente peruana Bothrops atrox. Rev Peru Biol. 2010; 17 (3): 365-370.
Recibido el 06-12-2011
Aprobado el 20-01-2012













