Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.78 no.2 Lima Apr./Jun. 2012
TRABAJOS ORIGINALES
Reciclaje químico de desechos plásticos
Chemical recycling of plastic wastes
Mariela Elgegrena, Giulliana J. Tiravantia, Bruno A. Ortiza, Manuel E. Oteroa, Florian Wagnerb, Daniel A. Cerróna, Javier Nakamatsua
a* Pontificia Universidad Católica del Perú, Av. Universitaria 1801, Lima 32, Perú. javier.nakamatsu@pucp.pe
b Universidad de Leoben, Franz-Josef-Straße 18, A-8700 Leoben, Austria
RESUMEN
Mediante el reciclaje químico, los desechos plásticos son una potencial fuente de materia prima de compuestos orgánicos valiosos. En este trabajo se ha estudiado la despolimerización de tres plásticos comúnmente presentes en desechos domésticos: el poli (tereftalato de etileno), el policarbonato y la poliamida Nylon-6. Para cada tipo de polímero se estudió las condiciones para su despolimerización y se cuantificó e identificó el monómero formado utilizando técnicas espectroscópicas. En el caso del PET, se obtuvo el tereftalato de bis (2hidroxietileno), utilizando el calentamiento convencional o microondas. Del policarbonato se obtuvo el bisfenol-A con un rendimiento del 90% y la ε-caprolactama se obtuvo del nylon-6 con un 80% de rendimiento. Los resultados obtenidos demuestran que los desechos plásticos son una potencial fuente de materia prima.
Palabras clave: poli (tereftalato de etileno), policarbonato, poliamida, nylon-6, despolimerización, reciclaje químico.
ABSTRACT
Chemical recycling can turn plastic wastes into a potential source of valuable organic chemicals. This work studied the depolymerization of three plastics commonly found in plastic waste: poly (ethylene terephthalate), polycarbonate and Nylon-6, a polyamide. Different reaction conditions were evaluated for each type of polymer. For each plastic, the yield was determined and the product was characterized by spectroscopic techniques. Good yields of bis (2-hydroxyethylene) terephthalate were obtained after treating PET with conventional and microwave heating. 90% of bisphenol-A was obtained from polycarbonate waste, while 80% of ε-caprolactam was formed from Nylon-6. These results show that plastic wastes can become an interesting source of chemicals.
Key words: poly (ethylene terephthalate), polycarbonate, polyamide, Nylon-6, depolimerization, chemical recycling.
INTRODUCCIÓN
El crecimiento industrial del último siglo ha tenido un rol determinante en el estilo de vida moderno, generando un crecimiento vertiginoso de los niveles de consumo, en general. Este mayor desarrollo conlleva, a su vez, un incremento exponencial en la generación de desechos que constituyen un problema medioambiental que se agrava cada vez más. Una porción importante de los residuos que genera nuestro estilo de vida moderno, está consituida por desechos plásticos provenientes principalmente de envases y empaques, y que, en muchos casos, son desechados luego de ser utilizados una sola vez. Como se sabe, estos plásticos provienen casi en su totalidad del petróleo, un recurso natural no renovable. Así pues, el aprovechamiento de estos desechos para la fabricación de nuevos plásticos u otros fines por medio del reciclaje químico, no sólo contribuye a solucionar el problema de residuos sino que puede convertirse en una fuente renovable de recursos. Este trabajo presenta estudios de despolimerización del PET (poli(tereftalato de etileno)), PC (policarbonato) y Nylon-6 (poli(ε-caprolactama)) para recuperar los monómeros respectivos.
Poli(terftalato de etileno)
Uno de los materiales plásticos que se encuentra con más frecuencia en los desechos domésticos es el poli(tereftalato de etileno), PET. El PET es un termoplástico semicristalino que, gracias a sus propiedades, posee una amplia variedad de aplicaciones; entre ellas: la manufactura de fibras, películas fotográficas, contenedores de cosméticos, detergentes y, principalmente, botellas descartables de bebidas. La producción de botellas de PET se ha venido incrementando considerablemente debido a su poco peso, resistencia, transparencia y facilidad de almacenamiento. Estudios realizados en el año 2005 indicaron que el consumo mundial anual de PET orientado a la fabricación de botellas fue de aproximadamente 10 millones de toneladas, y se estimó un crecimiento de 15% cada año1.
Se ha realizado numerosos estudios sobre la glicólisis del PET con diversos glicoles, principalmente etilenglicol. Por ejemplo, Xi et al. lograron obtener el monómero tereftalato de bis(2-hidroxietileno), BHET, con alto grado de pureza, al variar condiciones como el tiempo de reacción, relación EG:PET y porcentaje de catalizador empleado2. Determinaron que las condiciones óptimas para esta reacción consisten en una relación en peso de EG:PET de 5, un tiempo de reacción de tres horas y 1% en peso de catalizador, bajo las cuales lograron obtener un rendimiento de 86%. La figura 1 muestra la reacción de despolimerización del PET a BHET por glicólisis. En otro estudio, López-Fonseca et al. lograron obtener un rendimiento del 70% a 196°C, con una relación molar de 7,6:1 de EG:PET y 1:380 de acetato de zinc:PET3. Además, estudiaron el efecto de otras sales como catalizadores: bicarbonato de sodio, carbonato de sodio, sulfato de sodio y sulfato de potasio, que son ambientalmente más amigables que el acetato de zinc, que es el que se utiliza normalmente.
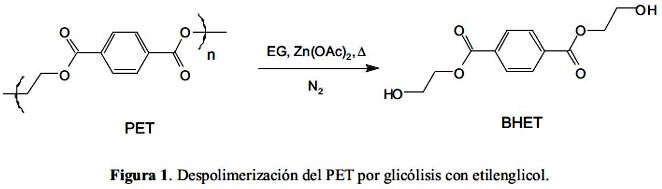
Policarbonato
El policarbonato es un polímero termoplástico transparente, muy liviano y dúctil con una alta dureza y gran resistencia al impacto. Estas propiedades permiten que sea utilizado para una gran variedad de aplicaciones, como en partes de automóviles, computadoras y celulares, en la producción de discos compactos (CD, DVD, blu-ray), en lentes de seguridad como equipo de protección personal y como blindaje para lunas de automóviles. Además, se le utiliza para la fabricación de botellas reusables, biberones y contenedores de alimentos. Otras aplicaciones del policarbonato incluyen ventanas de invernaderos, bandejas de cafeterías, tableros de canastas de básquet, techos ligeros transparentes para terrazas, entre otros. Debido a la gran variedad de aplicaciones, en el 2005 se produjo 3,2 millones de toneladas a nivel mundial4.
Ya se han estudiado diversos métodos de despolimerización del policarbonato virgen. Entre éstos se encuentran propuestas que utilizan solventes en estado supercrítico, como la despolimerización en tolueno o en etanol supercríticos, propuestas por Pan et al.5 y Jie et al.6, respectivamente. Otro método involucra el uso de etilenglicol y propilenglicol con un carbonato de sodio como catalizador (Lin et al.)7. Mormann et al.8 estudiaron la aminólisis del policarbonato a alta presión y temperatura ambiente mientras que Liu et al.4, Piñero et al.9 y Hu et al.10 estudiaron la metanólisis del policarbonato. El primero, en solventes iónicos; el segundo, a alta presión con catalizador de hidróxido de sodio, y el último, con catalizador de hidróxido de sodio y tolueno como solvente. Los tres estudios reportaron rendimientos de BPA superiores a 95%.
La figura 2 muestra la reacción de despolimerización del policarbonato (PC) a bisfenol-A (BPA) y carbonato de dimetilo (DMC) según el método reportado por Hu et al.10.
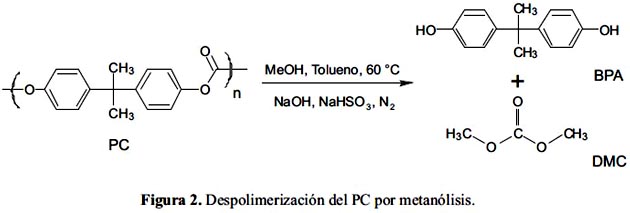
Poliamidas
El Nylon-6 y el Nylon-6,6 son las poliamidas más importantes comercialmente. Sus excelentes propiedades permiten su aplicación como termoplástico y fibra (fibras cortas e hilos). Ejemplos de aplicación del Nylon-6, además de hilos, telas, sogas y filamentos son las cerdas de cepillos dentales, suturas quirúrgicas y cuerdas para instrumentos musicales. Estas fibras también se utilizan como refuerzo en materiales compuestos ya sea en forma de hilos o mallas. La producción mundial de fibras de Nylon en el 2010 fue de 3,6 millones de toneladas, y se espera un crecimiento anual de 2,5% para los próximos años11.
Si bien se ha publicado estudios sobre reciclaje de poliamidas, la mayoría están relacionadas al reciclaje mecánico, es decir, al reprocesamiento, por fusión, de fibras de poliamidas12. Los estudios sobre despolimerización involucran, por lo general, reacciones a altas presiones, hidrólisis y amonólisis13-18. La figura 3 muestra la reacción de despolimerización del nylon-6 a ε-caprolactama.
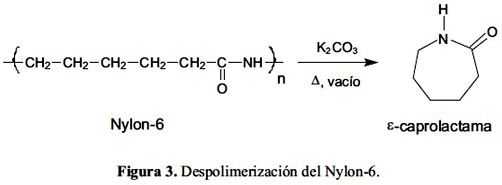
En los últimos años, el uso de equipos y tecnología de microondas ha mostrado un desarrollo impresionante en laboratorios y procesos de producción, debido a las múltiples ventajas y particularidades que presenta frente a los sistemas de reacción usuales, especialmente en términos de selectividad y cinética, además de ser más económicos y menos contaminantes19,20. En el área de despolimerización de plásticos, los estudios de calentamiento por microondas muestran rendimientos comparables a los obtenidos por métodos convencionales y gran disminución del tiempo de reacción para diferentes tipos de polímeros como PET21 y poliamidas22.
PARTE EXPERIMENTAL
Muestras
La muestra de PET provino de desechos plásticos de botellas descartables, que fueron lavadas y cortadas en dimensiones entre 0,4 y 0,8 cm de lado. El policarbonato se obtuvo de un bidón de agua cortado en trozos de tamaño promedio de 7 mm x 7 mm x 1,38 mm. El Nylon-6 provino de hilo de pesca de 0,50 mm de diámetro y fue cortado en trozos de 0,5-2,0 mm de longitud.
Equipos
Se utilizó un espectrómetro de resonancia magnética nuclear Bruker de 300 MHz, con un magneto superconductor Ultrashield de 7,05 T, una sonda de banda ancha de 5 mm capaz de observar núcleos de protón (1H) y carbono (13C), una unidad de temperatura variable Eurotherm B-VT200 (20-200°C) y una consola AvanceIII 300. Los espectros infrarrojo fueron obtenidos con un equipo Perkin-Elmer FT-IR 1600, con una fuente de luz láser de He-Ne, detector DGTS (sulfato de triglicina deuterado) y un filamento enrollado de nicromo (Ni+Cr) como fuente de radiación. El análisis de masas se realizó con un espectrómetro de masas Bruker-Esquire 6000, con una fuente de ionización por electrovaporización y analizador de trampa de iones. El análisis térmico se realizó con un equipo de punto de fusión, Fisher-Johns que alcanza una temperatura máxima de 300°C y un calorímetro diferencial de barrido, Perkin-Elmer DSC 4000.
Despolimerización del PET. Calentamiento convencional
En la glicólisis con calentamiento convencional se utilizó 18 g de PET, 84 mL de etilenglicol, EG (relación en peso EG:PET de 5:1), y entre 0,4 y 1,0% (w/w) de catalizador (con respecto a la masa del PET). La reacción se llevó a cabo en un balón conectado a un sistema de reflujo y se calentó con una manta de calentamiento a una temperatura de 190°C con agitación constante y atmósfera de N2, durante 2,5; 3 y 4 horas. El producto de glicólisis se dejó enfriar hasta la formación de un precipitado. Luego, se filtró al vacío para retirar el EG en exceso y el precipitado se recristalizó con agua a 60°C. Los cristales formados fueron filtrados al vacío y secados. Se hizo pruebas con acetato de zinc y bicarbonato de sodio como catalizadores. Se analizó la pureza del producto por cromatografía de capa delgada utilizando cloroformo-etanol (10:1) como fase móvil. Finalmente, la caracterización del producto se realizó por medición del punto de fusión y por espectroscopía infrarroja (pastilla de KBr), de 1H-RMN (en acetona-d6) y de masas (en metanol).
Despolimerización del PET. Calentamiento por microondas
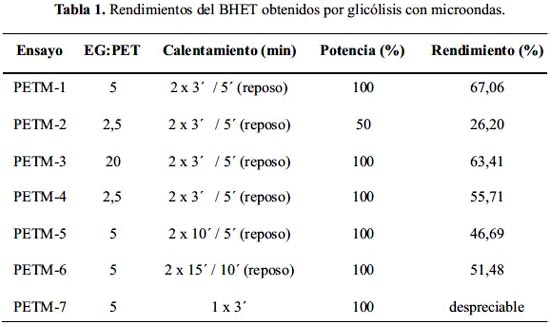
Se utilizó un horno microondas convencional marca Miray, modelo HMM-2590DD, de 2450 MHz de frecuencia y 900 watts de potencia máxima. La reacción se realizó en un reactor Savillex®, de perfluoroalcóxido (PFA), en el cual se colocó 2,23 g de PET, 10 mL de EG (relación 5:1 de EG:PET, en masa) y 0,02 g de acetato de zinc como catalizador (0,7%, w/w, respecto de la masa de PET). La reacción se llevó a cabo bajo atmósfera de nitrógeno; la mezcla se calentó al 100% de potencia del horno (900 W) dos veces por 3 minutos, con un periodo de reposo de 5 minutos entre los calentamientos (ensayo PETM-1, tabla 1). Similarmente a lo realizado en el método convencional, la mezcla de reacción se dejó enfriar y luego fue filtrada al vacío para retirar el exceso de EG. El producto fue purificado e identificado como se mencionó antes. Se realizaron experimentos variando la proporción de EG:PET, secuencias de calentamiento y potencia del horno, manteniendo constante el porcentaje de catalizador. Las condiciones y resultados se muestran en la tabla 1.
Despolimerización del policarbonato
En un balón de dos bocas se colocó 0,19 g de NaOH (catalizador) y 0,025 g de bisulfito de sodio (agente reductor). Se agregó 10 mL de una mezcla de metanol:tolueno (1:1). Luego, se generó una atmósfera de nitrógeno y se mantuvo la mezcla bajo agitación, reflujo y calentamiento (baño a 60 °C). Una vez disueltos los sólidos (o la mayoría de éstos), se procedió a agregar 6,35 g de policarbonato para iniciar la despolimerización. Durante las tres horas de reacción se mantuvo la atmósfera de nitrógeno, cerrando la salida del condensador de reflujo con un globo. Concluido el tiempo de reacción, se retiró el balón del baño de agua y se mantuvo la agitación por 10 minutos más. Luego, se filtró a vacío el contenido del balón sobre 200 mL de agua destilada fría (≈5 °C) bajo agitación. Se mantuvo la agitación por 30 minutos y luego se dejó reposar bajo refrigeración por 30 minutos más. El precipitado obtenido fue filtrado al vacío para recuperarlo, luego, fue purificado por recristalización en tolueno. El producto es un sólido blanco en forma de agujas. La reacción fue repetida aumentando el tiempo de reacción hasta 5 horas y eliminando la atmósfera de nitrógeno o el agente reductor para evaluar la influencia de estos factores. El producto obtenido, antes y después de su purificación fue caracterizado por 1H-RMN en DMSO-d6 y medición de punto de fusión.
Despolimerización del Nylon-6
Se utilizó hilo de pesca YA-FO Rhinoceros, con diámetro de 0,5 cm, de la empresa Lanyard S.A.C. (www.lanyard.com.pe) como muestra a despolimerizar. El hilo de pesca fue cortado en trozos de 0,5 a 2 cm de longitud. A 1,0 g de muestra se le añadió carbonato de potasio como catalizador, en cantidades entre 0,5 y 8,15% en peso, respecto al polímero. Se probó también con acetato de zinc. El catalizador, previamente disuelto en 3,0 mL de agua, fue añadido al reactor junto con el Nylon-6. La mezcla fue calentada para evaporar el agua y lograr que el catalizador se impregne al plástico. Se diseñó un reactor al que se le adaptó un dedo frío para circulación de agua y conexión a una bomba de vacío (figura 4). El reactor fue calentado en un baño de arena a 270-300°C. Se realizaron ensayos a estas condiciones por tiempos de 1 a 3 horas. Al final de cada reacción se detuvo el calentamiento y se cerró la válvula del vacío. Una vez que el producto alcanzó temperatura ambiente, fue raspado con una espátula, tanto de las paredes del reactor como del dedo frío. El producto es un sólido blanco que fue caracterizado por espectroscopía de RMN en DMSO-d6 y calorimetría diferencial de barrido, con calentamiento de 20 a 450°C a 10°C/min.
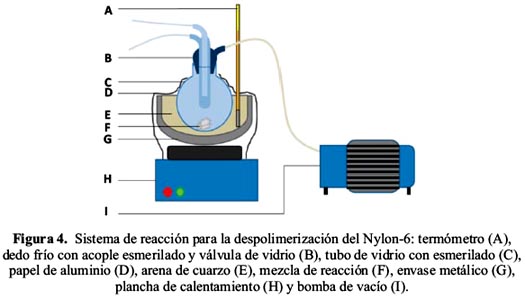
RESULTADOS Y DISCUSIÓN
Despolimerización del PET. Calentamiento convencional
En la tabla 2 se muestra los rendimientos obtenidos para la glicólisis del PET según el catalizador y el tiempo de reacción. Se encontró que el tipo y cantidad de catalizador influyen sobre el rendimiento de la reacción, y éste fue máximo cuando se utilizó 0,7% de acetato de zinc. Los resultados son comparables con los reportados por Xi et al.2, quienes reportan 85,6% de rendimiento. También se comparó los rendimientos de la formación del monómero al variar los tiempos de reacción entre 2 horas con 30 minutos y 4 horas. Se observó que para 0,7% de acetato de zinc, el rendimiento aumentó hasta alcanzar 3 horas y decae al aumentar el tiempo (4 horas); esto podría deberse a la mayor formación de oligómeros en vez del monómero, pues la reacción de despolimerización, en realidad, está en equilibrio con la de polimerización.
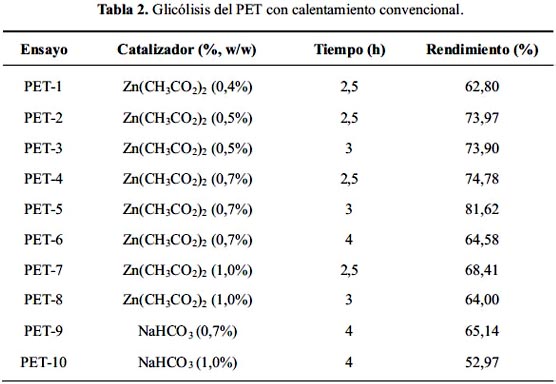
Por otro lado, no se obtuvo los mismos rendimientos utilizando bicarbonato de sodio como catalizador en proporción de 0,7 y 1,0%. Es más, se observó una notoria disminución del rendimiento a mayor porcentaje de catalizador. El tiempo de reacción para este catalizador fue de 4 horas pues los residuos del polímero tomaron más tiempo en desaparecer que con acetato de zinc.
El punto de fusión de los cristales obtenidos fue de 108-109°C, que coincide con el valor de 109-110°C23 reportado en la literatura para cristales del monómero BHET. La cromatografía de capa delgada (TLC) del producto mostró dos compuestos, el primero con un Rf = 0,6 correspondiente al BHET y el segundo compuesto con un Rf = 0,7, cuya presencia se observa como una mancha tenue bajo luz UV a 254 nm y que corresponde al dímero del BHET.
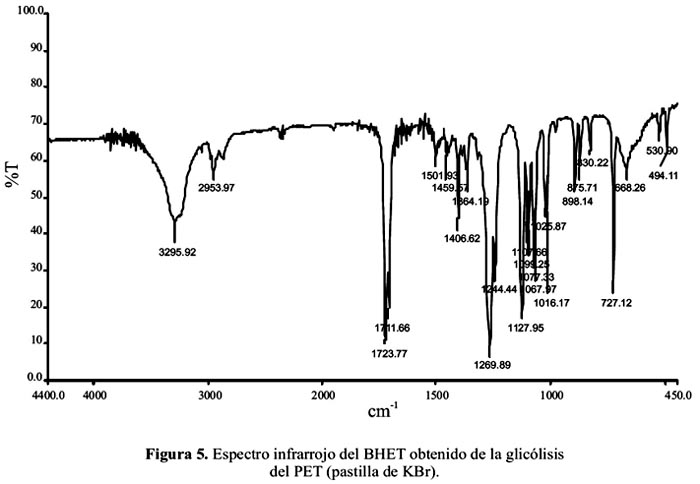
El espectro IR del monómero obtenido se presenta en la figura 5. En él se observa un pico ancho a 3296 cm-1 correspondiente a los grupos -OH del BHET. Además, el pico a 2954 cm-1 indica el alargamiento asimétrico de grupos –CH2- y los picos a 1724 cm-1 y 1712 cm-1 muestran la presencia de un éster aromático. Finalmente, la señal a 1269 cm-1 y 1244 cm-1 muestran la vibración asimétrica del éster (C-O) y las absorciones a 1128 cm-1 y 1068 cm-1 indican la vibración simétrica del éster (C-O).
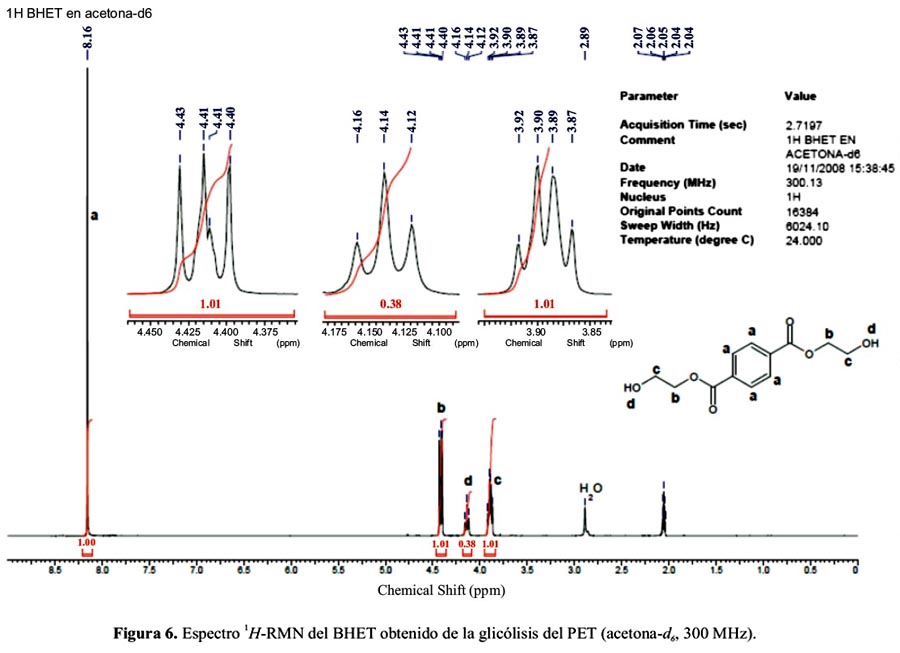
El espectro 1H-RMN del BHET se realizó en acetona-d6, como se muestra en la figura 6. Se observa las señales δ ppm: 3,87-3,92 (metilenos cercanos a los hidroxilos), 4,12-4,16 (hidroxilos), 4,40-4,43 (metilenos cercanos a grupos éster) y 8,16 (aromáticos). La señal a 2,89 ppm corresponde al agua presente y la señal de la acetona aparece a 2,05 ppm.
El espectro de masas del BHET se obtuvo en modo positivo y se muestra en la figura 7, junto con una tabla donde se indica los picos m/z y sus respectivas intensidades. En el espectro se distingue dos picos muy intensos para m/z 277 y 531 que se indica como [M+Na]+ y [2M+Na]+, respectivamente, donde M es la masa molecular del BHET 254 g/mol. Esta técnica permite asegurar que el compuesto analizado es el monómero y no oligómeros superiores.
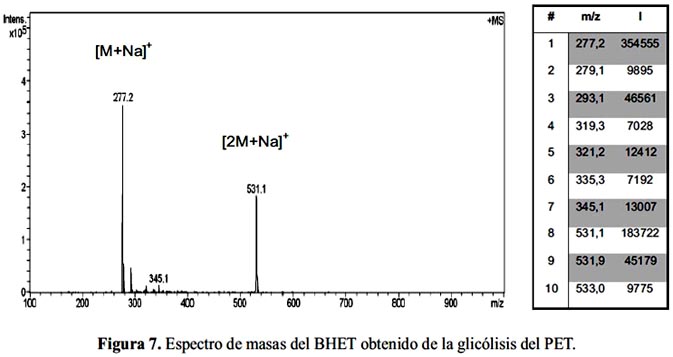
La técnica de electrovaporización como fuente de ionización, como en este caso, favorece la formación de aductos y agregados24, como se observa en el espectro. El pico base de 277 corresponde a un aducto producto de la combinación de una molécula de BHET con un átomo de sodio (Na) de masa 23 g/mol que proviene del recipiente de vidrio (borosilicato de sodio) en donde se preparó la muestra para el análisis. De modo similar, la señal de 531 se debe a un aducto formado entre dos moléculas de BHET con un átomo de sodio.
Despolimerización del PET. Calentamiento por microondas
Los resultados presentados en la tabla 1 muestran un rendimiento mínimo de 26% al usar 2,5 de proporción en masa de EG:PET, 50% de potencia del equipo (450 Watts) y un calentamiento total de 6 minutos: 2 periodos de 3 minutos con un reposo intermedio de 5 minutos (ensayo PETM-2). Por otro lado, el rendimiento máximo de 67% se obtuvo al utilizar la relación EG:PET de 5, potencia del horno al 100% (900 Watts) e igual secuencia de calentamiento, de 6 minutos en total (ensayo PETM-1). Se observó una disminución del rendimiento al reducir la proporción EG:PET (ensayo PETM-4), la cual se acentuó aún más al disminuir la potencia del equipo (ensayo PETM-2). Por otro lado, se encontró que al aumentar la proporción de EG:PET a 20 (ensayo PETM-3) no se produjo una variación considerable en el rendimiento, en comparación con el ensayo PETM-1 (relación EG:PET = 5). Esta misma observación ha sido encontrada en los estudios de despolimerización con calentamiento convencional2,3.
La comparación de los ensayos PETM-1, PETM-5 y PETM-6, con proporción EG:PET de 5, muestran el efecto del tiempo de reacción, obteniendo mejores resultados con el de 6 minutos (ensayo PETM-1). Tiempos de reacción mayores (ensayos PETM-5 y PETM-6) no presentaron grandes diferencias entres sí en el rendimiento, a pesar de llevarse a cabo también a la máxima potencia. Los ensayos PETM-2 y PETM-4 hicieron evidente la marcada diferencia en rendimiento que produjo la reducción de la potencia del equipo a la mitad, a pesar de mantenerse constante la proporción EG:PET y el tiempo de reacción. Trabajos reportados muestran resultados comparables a los obtenidos en este trabajo25-27.
Se realizó un ensayo adicional (PETM-7) con las condiciones del ensayo PETM-1, de mejor rendimiento, pero con la diferencia en el tiempo de reacción: se llevó a cabo un único calentamiento continuo de 3 minutos. Sin embargo, no se logró obtener una cantidad considerable del producto, y la mayor parte del PET quedó sin despolimerizar.
Como se puede notar, las condiciones óptimas para la despolimerización del PET con calentamiento por microondas, guardan cierta similitud con las que se emplean con calentamiento convencional. Además, si bien el rendimiento de BHET al utilizar las microondas es menor (67%) que el obtenido con calentamiento convencional (81,6%), se debe tener en cuenta que el tiempo de reacción se reduce por un factor de más de 16 (180 minutos, en comparación con 11 minutos, incluido los 5 minutos de reposo intermedio sin calentamiento). Esto se traduce en un ahorro sustancial de energía.
Despolimerización del policarbonato
Al llevar a cabo la reacción de despolimerización por 3 horas a 60 °C se obtuvo el BPA, el monómero, con un rendimiento cercano al 90%. El aumento del tiempo de reacción a 4 y 5 horas no produjo un cambio apreciable. No se realizaron pruebas con tiempos menores a 3 horas ya que la desaparición del policarbonato tardó al menos 2 horas en todos los ensayos. Tanto el bisulfito de sodio como la atmósfera de nitrógeno evitan que ocurra una oxidación durante la reacción. Ensayos sin bisulfito de sodio dieron lugar a una tonalidad rosada en el producto, mientras que la presencia de aire en la reacción produjo un color naranja intenso.
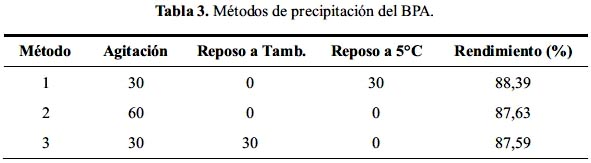
Para mejorar el rendimiento de la reacción y la pureza del producto se probaron distintos métodos de precipitación del BPA. En total, se dejó precipitar el producto por una hora. La tabla 3 muestra el estado de la suspensión durante la precipitación. Los cambios hechos al sistema de precipitación no tuvieron una gran influencia sobre el rendimiento de la reacción por lo que se mantuvo el método 1, que dio un rendimiento levemente mayor.
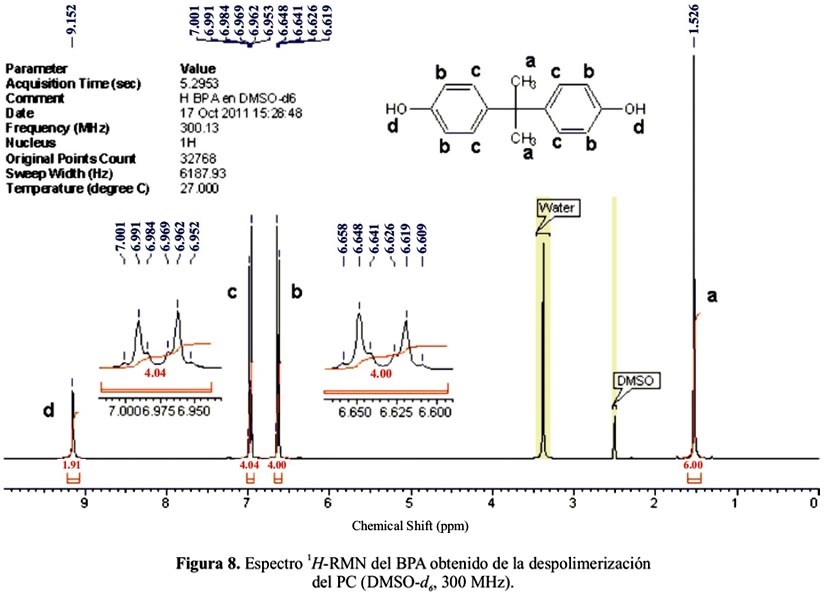
La figura 8 muestra el espectro de 1H-RMN del BPA obtenido por el método señalado. El espectro es el mismo antes y después de la recristalización, lo cual demuestra que el producto obtenido es bastante puro aún antes de recristalizarlo. La asignación de las señales, así como sus integrales, confirman la identidad del producto. Se observan las señales δ ppm: 1,53 (metilos), 6,62-7,00 (aromáticos) y 9,15 (hidroxilos). Aparecen también las señales del agua y del solvente (DMSO) a 3,40 y 2,50 ppm, respectivamente. Además, el punto de fusión del BPA obtenido (156 °C) se acerca mucho al valor teórico (155 °C) 28.
Despolimerización del Nylon-6
La reacción de despolimerización en fase sólida requiere de vacío. Se intentó llevarla a cabo a presión atmosférica, en contacto con aire o con nitrógeno, pero sin éxito. Cuando se utilizó acetato de zinc como catalizador (un catalizador frecuente para esterificaciones e hidrólisis) el producto obtenido fue mínimo. También se llevó a cabo la reacción mezclando el Nylon-6 con el catalizador sin disolver, obteniéndose aun menores rendimientos. Al parecer, es importante que el catalizador esté impregnado homogéneamente sobre el polímero.
Al alcanzarse las condiciones adecuadas, los cristales del monómero empezaron a aparecer en las paredes del dedo frío, lo cual tomó entre de 10 y 20 minutos después de iniciada la reacción. La tabla 4 muestra los resultados de la despolimerización del Nylon-6 con diferentes cantidades de catalizador y tiempos de reacción. Como se puede ver de los ensayos PA-1 y PA2, el prolongar la reacción de 1 a 3 horas no incrementó el rendimiento significativamente (79% a 81%).
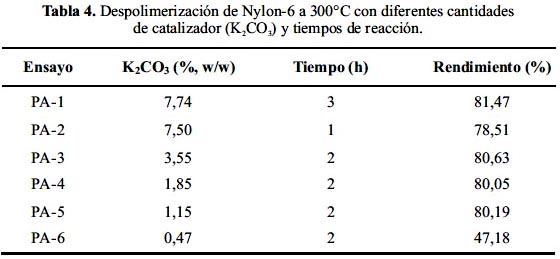
Los experimentos PA-3 al PA-6 sirvieron para determinar la cantidad adecuada de catalizador para alcanzar el mejor rendimiento de despolimerización. Se observó que con 0,47% (en masa) de K2CO3 la despolimerización no se completó, pues se observó que quedó residuo de polímero en el reactor y por lo tanto dio un bajo rendimiento. 1,15% de catalizador es suficiente para alcanzar rendimientos cercanos al 80%.
Rendimientos de ε-caprolactama similares a los obtenidos en este trabajo fueron reportados por Kamimura y Yamamoto (59-86%), al trabajar con líquidos iónicos a presión atmosférica y reducida, y a temperaturas entre 270 y 350°C 29. Por su lado, Klun y Kran lograron la despolimerización de Nylon-6 en 15 a 22 minutos con soluciones acuosas ácidas con calentamiento por microondas 22, sin embargo, el producto de la despolimerización no es solamente ε-caprolactama.
El espectro en la figura 9, correspondiente al producto obtenido de la despolimerización, muestra señales a 7,42 ppm (NH), 3,01-3,10 ppm (metileno próximo al N), 2,26-2,30 ppm (metileno α) y 1,23-1,69 ppm (metilenos restantes), que corresponden a los hidrógenos de la caprolactama. La integración de las señales corresponden también al monómero. La presencia de otras señales de menor intensidad indicaría la presencia de impurezas, o más bien, del ácido 6-aminohexanoico, la forma abierta de la e-caprolactama. La señal del DMSO y del agua aparecen a 2,50 y 3,40 ppm, respectivamente.
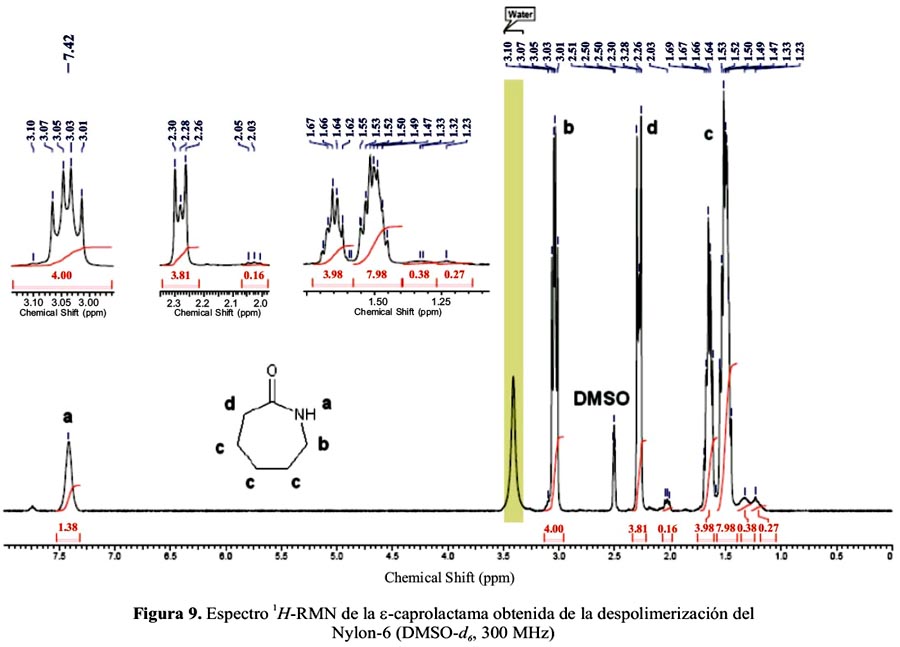
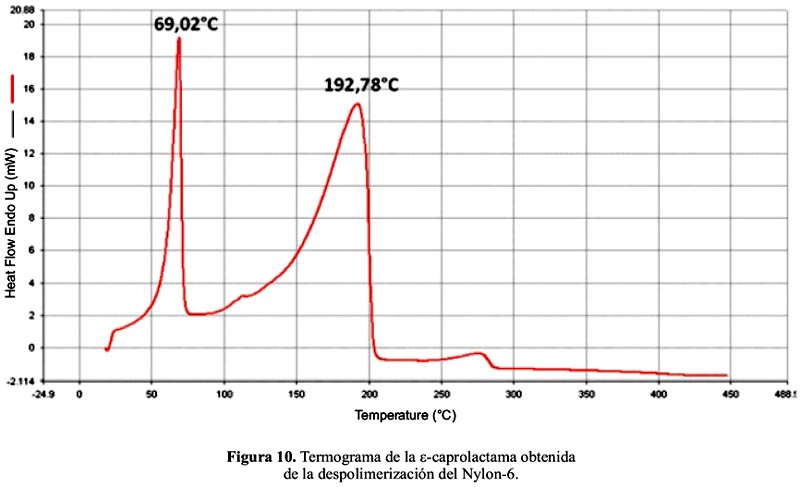
En el termograma del producto de la despolimerización (figura 10) se pueden identificar las señales correspondientes al punto de fusión de la ε-caprolactama a 69,02°C y al punto de ebullición (a cerca de 270°C), que coinciden aproximadamente con lo reportado en la literatura, 70°C para el punto de fusión30 y 267°C para el punto de ebullición31. El pico a 192,78°C correspondería a la forma lineal, el ácido 6-aminohexanoico, cuyo punto de fusión reportado es de 204-206°C30.
CONCLUSIONES
-
La despolimerización de desechos de PET, PC y Nylon-6 produjo los monómeros correspondientes con buenos rendimientos, evidenciando el potencial de los residuos plásticos como fuente alternativa a los productos no renovables derivados del petróleo.
-
En el caso del PET, la reacción de despolimerización con mejor rendimiento (81,62%) se dio al reflujar los desechos plásticos con etilenglicol (proporción glicol/PET de 5) con calentamiento convencional por 3 horas, utilizando 0,7% en peso de acetato de zinc como catalizador. El calentamiento por microondas resulta sumamente eficaz: en 11 minutos (con sólo 6 minutos de calentamiento) logra despolimerizar el PET, aunque alcanza un menor rendimiento de formación del monómero (cerca de un 70%). En ambos casos, el monómero obtenido fue el tereftalato de bis(2-hidroxietileno), el cual fue recristalizado y caracterizado por espectroscopía IR, RMN y de masas.
-
Para la despolimerización del PC de desechos de discos compactos o bidones de agua se necesitó 3 horas de reacción a 60°C en una mezcla de tolueno y metanol, con hidróxido de sodio y bisulfito de sodio, en atmósfera de nitrógeno. El rendimiento de la reacción es de alrededor del 90%. El producto formado, el bisfenol-A, fue recristalizado y caracterizado por espectroscopía de RMN.
-
La despolimerización de Nylon-6 de hilo de pesca, fue realizada sin solventes, en presencia de carbonato de potasio como catalizador. Se diseñó un sistema para llevar a cabo la reacción de manera eficiente con la incorporación de un dedo frío en el reactor y conexión a vacío. Las condiciones óptimas de la reacción fueron 300°C por 2 horas, con lo que se obtuvo la e-caprolactama con un rendimiento del 80%. El análisis por espectroscopía de RMN, y el análisis térmico por DSC confirmaron la identidad del producto.
AGRADECIMIENTOS
Este trabajo pudo ser realizado gracias al apoyo financiero de la Dirección de Gestión de la Investigación de la Pontificia Universidad Católica del Perú.
BIBLIOGRAFÍA
1. Frigione, M. Recycling of PET. European Polymer Journal, 2005; 41, 1453-1477.
2. Xi, G.; Lu, M.; Sun, C. Study on depolymerization of waste polyethylene terephthalate into monomer of bis(2-hydroxyethyl terephthalate). Polymer Degradation and Stability 2005; 287, 117-120.
3. López-Fonseca, R.; Duque, B.; de Rivas, I.; Arnaiz, S.; Gutiérrez-Ortiz, J.I. Chemical recycling of post-consumer PET wastes by glycolysis in the presence of metal salts. Polymer Degradation and Stability 2010; 95, 1022-1028.
4. Liu, F.; Li, Z.; Yu, S.; Cui, X.; Ge, X. Environmentally benign methanolysis of polycarbonate to recover bisphenol A and dimethyl carbonate in ionic liquids. Journal of Hazardous Materials 2010; 174, 872-875.
5. Pan, Z.Y.; Bao, Z.; Chen, Y.X. Depolymerization of Poly(bisphenol A carbonate) in Subcritical and Supercritical Toluene. Chinese Chemical Letters 2006; 17, 545-548.
6. Jie, H.; Ke, H.; Qing, Z.; Lei, C.; Yongqiang, W.; Zibin, Z. Study on depolymerization of polycarbonate in supercritical ethanol. Polymer Degradation and Stability 2006; 91, 2307-2314.
7. Lin, C.H.; Lin, H.Y.; L, W.Z.; Dai, S.A. Novel chemical recycling of polycarbonate (PC) waste into bis-hydroxyalkyl ethers of bisphenol A for use as PU raw materials. Green Chemistry 2007; 9, 38-43.
8. Mormann, W.; Spitzer, D. Ammonolysis of polycarbonates with (supercritical) ammonia: An alternative for chemical recycling en "Advances in Polycarbonates", Brunelle, D.J.;
9. Piñero, R.; García, J.; Cocero, M.J. Chemical recycling of polycarbonate in a semicontinuous lab-plant. A green route with metanol and metanol-water mixtures. Green Chemistry 2005; 7, 380-387.
10. Hu, L.C.; Oku, A.; Yamada, E. Alkali-catalyzed methanolysis of polycarbonate. A study on recycling of bisphenol Aand dimethyl carbonate. Polymer 1998; 39, 3841-3845.
11. Nylon Fibers, Polymers and Fibers, World Petrochemicals, SRI Consulting. http://chemical.ihs.com/WP/Public/Reports/nylon/Diciembre2011.
12. Fattahi Meyabadi, T.; Mohaddes Mojtahedi, M.R.; Mousavi Shoushtari, S.A. Melt spinning of reused nylon 6: structure and physical properties of as-spun, drawn, and textured filaments. Journal of the Textile Institute 2010; 101, 527-537.
13. Bonfield, J.H.; Hecker, R.C.; Snider, O.E.; Apostle, B.G. "Regeneration of caprolactam from polyamides", U.S. Patent 3,182,055 (1965).
14. Sifniades, S.; Levy, A.; Hendrix, J. "Process for depolymerizing nylon-containing waste to form caprolactam", U.S. Patent 5,932,724 (1999).
15. ISASF, International Society for Advancement of Supercritical Fluids. http://www.isasf.net/fileadmin/files/Docs/Arcachon/oraux/c32-CO54 KamimuraProceedings.pdf, December 2011.
16. Braun, M.; Levy, A.B.; Sifniades, S. Recycling Nylon 6 carpet to caprolactam. Polym. Plast. Technol. Eng. 1999; 38, 471-484.
17. McKinney, R. J. "Ammonolysis of Nylon" U.S. Patent 5,302,756 (1994).
18. Bassler, P.; Kopietz, M. "Process for producing caprolactam through hydrolytic cleavage of molten polycaprolactam" U.S. Patent 5,495,015 (1996).
19. Salter, M. Out of the Kitchen. Nature 2003; 421, 571-572.
20. Hayes, B. "Microwave Synthesis: Chemistry at the speed of light". CEM Publishing: North Carolina, pp 11-12, 29-36; 2002.
21. Kran, A. Poly(ethylene terephthalate) glycolysis under microwave irradiation. Polymers for Advanced Technologies 1999; 10, 603-606.
22. Klun, U.; Kran, A. Rapid microwave induced depolymerization of polyamide-6. Polymer 2000; 41, 4361-4365.
23. Chen, J.; Chen, L. The glycolysis of Poly(ethylene terephthalate). Journal of Applied Polymer Science 1999; 73, 35-40.
24. Hoffmann, E; Stroobant, V. "Mass Spectrometry. Principles and applications" Wiley: Londres, pp 43-46, 78-79; 2007.
25. Achilias, D.; Redhwi, H.; Siddiqui, M.; Nikolaidis, A.; Bikiaris, D.; Karayannis, G. Glycolytic depolymerization of PET waste ina a microwave reactor. Journal of Applied Polymer Science 2010; 118, 3066-3073.
26. Li, K.; Song, X.; Zhang, D. Depolymerization of poly(ethylene terphthalate) with catalyst under microwave irradiation. Journal of Applied Polymer Science 2008; 109, 1298-1301.
27. Pingale, J.; Palekar, V.; Shukla, S. Glycolysis of postconsumer poyethylene terephthalate waste. Journal of Applied Polymer Science 2010; 115, 249-254.
28. Merck Chemicals: MSDS: Bisphenol-A. http://www.merck-chemicals.pe/2-2-bis4hidroxifenil-propano/MDA_CHEM-803546/p_uuid?attachments=MSDS, May 2011.
29. Kamimura, A.; Yamamoto, S. An efficient method to depolymerize polyamide plastics: A new use of ionic liquids. Organic Letters 2007; 9, 2533-2535.
30. Merck Index, 11a ed., Merck & Co., Inc.: Rahway, 1989.
31. International Programme on Chemical Safety, INCHEM http://www.inchem.org/documents/icsc/icsc/eics0118.htm, December 2011.
Recibido el 02-05-2012
Aprobado el 08-05-2012













