Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.78 n.2 Lima abr./jun. 2012
HISTORIA DE LA QUÍMICA
Perú, el país de las oportunidades perdidas en ciencia: el caso de los fertilizantes
Peru, the country of missed opportunities in science: the case of fertilizers
Mario Ceroni Gallosoa*
a* Dpto. de Química Inorgánica, Facultad de Química e Ing. Química, UNMSM, Ciudad Universitaria, Av. Venezuela s/n, Lima 01, Perú, mceronig@gmail.com
RESUMEN
Latinoamérica y en especial nuestro país han sido y siguen siendo ricos en recursos naturales; sin embargo, cuando los tuvimos no supimos explotarlos de manera sostenida; tampoco les dimos valor agregado ni hemos previsto qué hacer cuando ese recurso se agote. El caso de los fertilizantes naturales: salitre y guano de islas, marca un hito y es una lección todavía no aprendida por nosotros. Aquí se presenta una breve revisión histórica de la explotación de estos recursos por el estado peruano y, por otro lado, se muestra las investigaciones e innovaciones realizadas en Europa para buscar una alternativa a los fertilizantes naturales provenientes de Latinoamérica.
Palabras clave: fertilizante, guano, salitre, amoniaco.
ABSTRACT
Latin America and especially our country have been and are rich in natural resources; but we did not know exploited sustainably; we gave no value added or anticipate what to do when that resource is depleted. The case of natural fertilizers: Saltpeter and guano islands, is a landmark and a lesson learned for us yet. Here is a brief historical review of the exploitation of these resources by the peruvian state, and on the other hand, shows the search and innovations in Europe made to seek an alternative to natural fertilizers from Latin America.
Key words: fertilizer, guano, saltpeter, ammonia.
INTRODUCCIÓN
El recurso salitre, que fue explotado por Perú y Chile pasados algunos años de independizarse de España, es una mezcla de nitrato de sodio (mayoritario) y nitrato de potasio. El salitre fue usado como fertilizante y en la fabricación de explosivos. Alrededor de 1850 los países europeos importan toneladas de guano de islas y de salitre de Sudamérica para ser utilizados como fertilizante y mejorar la producción agrícola.
La historia comenzó en 1804 cuando Alexander von Humboldt llevó a Europa unas muestras de guano peruano para ser analizadas. El resultado: altas proporciones de nitrógeno y fósforo.1a Los antiguos peruanos ya usaban el guano, práctica que continuó en la colonia, pero su uso no se difundió en Europa. Décadas después, por 1840, se comenzó a explotar este recurso que también se encontraba en otras partes del mundo. Pero lo que le tomó a la naturaleza miles de años crear montañas de guano, éstas, según los cálculos de ese entonces, se acabarían en tan solo unos 50 años de explotación. Los países de Latinoamérica sólo se dedicaron a explotar este recurso natural, pero en Europa por medio de la ciencia y tecnología comenzaron a buscar fuentes alternativas y la búsqueda se centró en la síntesis química.
Justus von Liebig (1803-1873), químico alemán famoso por el condensador que lleva su nombre y también por su libro "Química orgánica y su aplicación a la agricultura y a la fisiología", se doctoró en la Universidad de Erlangen en 1822. Por recomendación de Alexander von Humboldt trabajó en el laboratorio de Joseph Louis Gay Lussac. Von Liebig fue quien demostró la necesidad de compuestos nitrogenados, del dióxido de carbono y de los minerales presentes en el suelo para la agricultura y el inventor de fertilizantes basados en nitrógeno. En la primera edición de su libro (1840) le dio un valor preponderante e importante al amoniaco, pero en la edición inglesa (1856) se retractó.2 Décadas después Hermann Hellriegel, químico alemán, descubrió (1886) que algunas leguminosas tenían nódulos en sus raíces, donde unas bacterias fijaban el nitrógeno.
LA HISTORIA EN LATINOAMÉRICA
Antes de 1840 los fertilizantes usados en Europa eran huesos, sales y yeso. Luego de esa fecha se produjo un cambio que revolucionó la agricultura en todo el mundo: el uso del guano y de los llamados coprolitos (según Raymondi el guano no era un coprolito), ambos curiosamente llamados en esa época fertilizantes artificiales. Pero el guano peruano de las islas de Chincha (habían otros guanos llamados: de Angamos, Chile, Bolivia, de Saldanha Bay, el australiano, entre otros).3a El peruano sobresalía ya que no sólo era el adecuado para una gran variedad de cultivos, sino que tenía nitrógeno, fósforo, potasio, magnesio y otros elementos en cantidades mayores a otros fertilizantes.3b
John Bennet Lawes patentó en 1842 el abono que denominó superfosfato, resultado de tratar fosfatos con ácido sulfúrico (como se muestra en la reacción química siguiente); al año siguiente ya había construido su fábrica en Deptford, Inglaterra; este inglés fue el pionero de la industria de los fertilizantes químicos.
Por cuestiones de intereses comerciales hubo una competencia entre el guano y el superfosfato.4 Unos decían que el guano era mejor, otros que el superfosfato, controversia en la cual participó activamente Antonio Raymondi.
La industria del salitre es antigua. En 1830 el Perú exportaba cerca de 700 toneladas de salitre de la entonces provincia peruana de Tarapacá. Pero como se ganaba más con el guano, al gobierno peruano casi no le importaba mucho el salitre. Terrible error. En el caso de Antofagasta (antes de Bolivia) el salitre era explotado por empresas chilenas, que fueron dadas en concesión con capitales británicos. En estos escenarios, el gobierno peruano manejaba el guano y el chileno, el salitre.
En los años 40 del siglo XIX la firma británica Antony Gibbs & Sons tuvo el monopolio del guano. Pagaba cerca de 15 dólares por tonelada de guano que luego era vendido en Europa a 50 dólares.
En 1845 el Congreso eligió al Gran Mariscal Ramón Castilla y Marquesado presidente de la República y siguieron 6 años de paz interna y de incremento de la riqueza nacional, según cuenta Basadre. Durante ese periodo se desarrollaron exitosamente nuestras grandes fuentes de riqueza: el guano que se encontraba en las desiertas islas costeñas y el salitre, en los desiertos de Tarapacá. El guano ya era conocido por los Incas y en Europa hubo una gran demanda por ser un excelente fertilizante. Se explotaron las tres islas de Chincha. Centenares de barcos cargaban guano, cerca de 400 mil toneladas por año, produciendo un ingreso anual de 14'850,000 pesos.5
En 1868 José Balta asume el gobierno peruano, justo cuando el precio de guano había bajado y la deuda peruana era enorme. Balta ordenó a Nicolás de Piérola, entonces Ministro de Hacienda, tratar de remediar el problema financiero causado mayormente por el despilfarro y la corrupción. Piérola firmaría luego el famoso contrato Dreyfus que otorgó a esa institución parisina el monopolio de las ventas de guano en toda Europa quitando del camino a los consignatarios peruanos.
El salitre de Tarapacá era aparentemente inagotable; lo usaron los españoles en la fabricación de pólvora. En 1826 el francés Héctor Bacque y otros, como Zavala, Smith, Gildemeister establecieron sendas oficinas para comercializarlo.
En la década de 1870 hubo una crisis en la deuda de los países latinoamericanos; entre otros efectos se puede mencionar que los precios de las materias primas, como el cobre, bajaron mucho. En 1875 disminuyó tanto las reservas de guano que el Perú comenzó la nacionalización de las empresas salitreras durante el gobierno de Manuel Pardo. En 1878 Bolivia impuso unos impuestos muy altos a las empresas chilenas que explotaban el guano en Antofagasta. Entre otras causas esto condujo a la guerra del Pacífico, Perú y Bolivia aliados frente a Chile. Poco antes de la guerra el salitre era el recurso que más se exportaba en el Perú, en segundo lugar venía el azúcar.
En 1883 el tratado de Ancón estableció que cederíamos Tarapacá, Arica y Tacna. En 1929 Tacna regresó al Perú. Bolivia perdió Antofagasta y su salida al mar. Las tierras ganadas por Chile, ricas en salitre, fueron inmediatamente explotadas por ese país, por medio de capitales británicos, en 1880 se explotaron 224 000 toneladas y llegó a su máximo en 1920 con 2 794 000 toneladas.
Mariátegui resumió la importancia del guano y el salitre, así como el resultado de su explotación6: "La fácil explotación de este recurso natural dominó todas las otras manifestaciones de la vida económica del país. El guano y el salitre ocuparon un puesto desmesurado en la economía peruana. Sus rendimientos se convirtieron en la principal renta fiscal. El país se sintió rico. El Estado usó sin medida de su crédito. Vivió en el derroche, hipotecando su porvenir a la finanza inglesa."
Pero ya por 1908 el proceso de obtención industrial de amoniaco y, posteriormente nitratos, produjeron los fertilizantes sintéticos, que comenzaron a competir con el salitre. Por los años de 1930 los fertilizantes sintéticos eran más baratos y la agricultura perdió interés por el salitre cuya explotación fue languideciendo hasta extinguirse años después.
Perú, Bolivia y Chile seguíamos siendo tan pobres, después como antes de la explotación de esos recursos. Por el contrario, USA y Europa son más ricos y prósperos. Antes, los europeos eran dependientes de nuestros fertilizantes; después de unas décadas, ya no. ¿Qué hicieron ellos y qué nosotros? ¿En qué nos diferenciamos? Ellos investigaron; nosotros no.
Nosotros nos dedicamos a despilfarrar y en muchos casos a robar el dinero recaudado por la explotación de los recursos. Esto sumado a guerras civiles y a la falta de una política en ciencia y tecnología, nos llevó a una pobreza, como país, desoladora.
LA HISTORIA EN EUROPA
Thomas Malthus (1766-1834) había predicho en su "Ensayo sobre los principios de la población", que el crecimiento poblacional en las ciudades europeas sobrepasaría la oferta de alimentos (1798) y que en unos años, la hambruna sería el peligro a enfrentar. Malthus no acertó porque la industrialización elevó la producción de alimentos en los países europeos y, además, se redujo en ellos la tasa de fertilidad. La ciencia y tecnología salvó a la humanidad de la hambruna en las principales ciudades europeas; pero sólo por un tiempo.
En el siglo siguiente, Sir William Crookes, en un discurso dado en 1898, en la Asociación Británica por el Avance de la Ciencia, señaló que había un déficit de fertilizantes nitrogenados que no se adecuaba al ritmo de producción de alimentos mundial e invocó a los químicos a salvar al mundo de la hambruna. Los depósitos de guano y de salitre de Latinoamérica estaban por agotarse. El salitre, por su contenido de nitrógeno era vital para ser utilizado como fertilizante y como explosivo necesario para la industria minera y la bélica. Durante la década de 1890 a 1900 el mundo se proveía de nitrógeno de los depósitos de nitrato chilenos.
En los años siguientes los químicos respondieron. De hecho Crookes fundó una compañía para procesar restos de animales, en especial de pescados para producir fertilizantes nitrogenados. En 1871 Crookes fue director de la Native Guano Company donde transformaban también los residuos de alcantarillas en estiércol comerciable.
A finales del siglo XIX, tanto en Europa como en Estados Unidos, se formaron varios grupos de investigación para obtener compuestos nitrogenados útiles. Seis fueron los procesos industriales más significantes que resolvieron el problema:
-
El proceso de arco noruego, donde la oxidación directa del nitrógeno con oxígeno produce óxidos de nitrógeno.
-
El método de la cianamida.
-
El proceso Haber-Bosch.
-
La obtención de nitruros metálicos (por reacción de nitrógeno con metales) y su reacción posterior con agua.
-
La reacción del nitrógeno con carbón para dar cianuros.
-
La oxidación del nitrógeno por combustión con gas natural o carbón.
Sin embargo, la búsqueda de un fertilizante para la agricultura comenzó antes que se supiera que el nitrógeno y el fósforo eran necesarios para las plantas, así lo demuestra una patente británica de 1636; investigaciones químicas realizadas entre 1750 y 1789 permitieron que en 1800 se conocieran las siguientes reacciones (figura 1), lo que podría considerarse como una investigación básica.
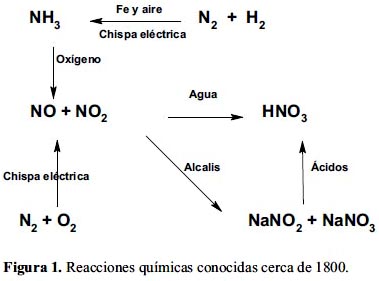
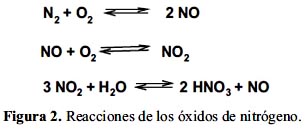
El proceso de arco noruego
Consiste en la oxidación directa del nitrógeno con el oxígeno que produce óxidos de nitrógeno. Tras una reacción posterior con agua, el dióxido de nitrógeno produce ácido nítrico (figura 2).
La historia se remonta al año 1775, cuando Joseph Priestley hizo saltar una chispa eléctrica en un recipiente que contenía aire (que está compuesto de cerca 77,8% de nitrógeno), tras lo cual, seguramente, obtuvo los óxidos de nitrógeno y luego con agua, los ácidos nitroso y nítrico. Estas reacciones fueron demostradas y explicadas por Henry Cavendish. Las reacciones con chispa eléctrica se volvió, con los años, un método más frecuente para descomponer o sintetizar nuevos compuestos químicos. Madame Lefebure, la primera ingeniera química reconocida, patentó en 1859 el proceso para fabricar ácido nítrico por medio de una descarga eléctrica en un gran globo conteniendo aire y absorbiendo los productos en medio alcalino. Sin embargo, el proceso no era eficiente ya que las cantidades producidas eran muy pequeñas; esta patente y otras similares nunca fueron explotadas comercialmente.
Con el tiempo, finales del siglo XIX, la tecnología del método sintético con arco eléctrico mejoró a tal punto, que se podría construir equipos eficientes con una descarga continua de arco eléctrico, pero desde el punto de vista económico el proceso no era rentable por el alto costo de la electricidad.
Con los años se logró mejorar la tecnología, así como generar electricidad barata, de tal forma que ello permitió construir la primera fábrica industrial para producir ácido nítrico en Noruega, en 1903. La historia cuenta que el profesor Kristiam Birkeland, que trabajaba en la mejora de armas (cañones o torpedos), se le ocurrió que podría lograr una rápida expansión de los gases si incrementaba la temperatura a niveles muy altos, para lo cual ideó un dispositivo que funcionaba con una gran cantidad de corriente eléctrica que produciría una chispa. Pero el experimento fracasó. Pocos días después durante una cena de Birkeland con Sam Eyde, un ingeniero estructural y Gunnar Knudsen, conversaron sobre asuntos de sus trabajos. Eyde se dio cuenta que el proceso de descarga eléctrica desarrollado por Birkeland podría ser utilizado para hacer reaccionar el nitrógeno con el oxígeno aprovechando el enorme potencial eléctrico de Noruega que podría producir un arco eléctrico estable a 2 000 ºC. El 20 de febrero de 1903 Birkeland y Eyde presentaron una patente para obtener compuestos nitrogenados basados en las reacciones en un arco eléctrico.1b
El método de la cianamida
El carburo de calcio había sido obtenido por Friedrich Wöhler en 1862, al calentar una mezcla de calcio y zinc con carbón. La reacción del carburo de calcio con agua da lugar a la obtención del acetileno: un combustible.
CaC2 + 2H2O →C2H2 + Ca(OH)2
Luego, en 1892, Henri Moissan en Francia y de manera independiente, Thomas Leopold Willson y J. T. Morehead en USA, desarrollaron un método para obtener el carburo de calcio de manera económica, al calentar óxido de calcio (obtenido de piedra caliza) y coque a temperaturas entre 2 000 a 2 500 ºC en un horno eléctrico.
CaO + 3 C →CaC2 + CO
Este proceso es económicamente rentable donde la energía eléctrica sea barata.
Al presente, nosotros nos iluminamos con energía eléctrica, pero antes era con kerosene, petróleo y gas de agua. Pero mucho antes, finales del siglo XIX e inicios del siglo XX, se usaba acetileno. El acetileno se usó como combustible para iluminar las ciudades europeas y su demanda aumentó. Por ello, desde entonces muchos inversionistas pusieron su dinero en la industria del carburo de calcio.
Tras la industria del carburo de calcio apareció el gas natural como fuente energética más barata y el combustible acetileno, generado por hidrólisis de carburo de calcio, llegó a su fin.
Los inversionistas se preguntaron ¿qué hacer con las toneladas de carburo acumuladas que nadie va a comprar? La respuesta, hacer investigación. Allí entraron a tallar los científicos.
Pocos años después los científicos descubrirían que calentando el carburo de calcio con nitrógeno a 1300 K se obtenía cianamida de calcio y éste era un fertilizante. Problema resuelto.
CaC2 + N2 →CaNCN + C
Pero no fue tan fácil. A los científicos a veces les pasa que buscan una cosa y se encuentran otra más interesante. Este es el caso.1c
En 1887 John Stewart MacArthur y los hermanos Robert y William Forrest, cuando desarrollaron el proceso de cianuro para extraer el oro y la plata en Glasgow (Reino Unido) , que es muy útil para extraer esos metales en menas de baja ley, especialmente en Alaska, Australia y Sudáfrica. La industria minera de esos metales se expandió grandemente y la demanda por el cianuro se incrementó exponencialmente.
4 Au + 8 NaCN + O2 + 2H2O →4 Na[Au(CN)2] + 4 NaOH
Es de resaltar que hasta el presente este proceso es importante para la extracción del oro. En Alemania Adolph Frank y Nikodem Caro diseñaron varios métodos sintéticos para obtener el cianuro. Uno de ellos fue mediante la reacción de carburo de calcio con nitrógeno a temperaturas superiores a 1 000 ºC. Tras muchos experimentos reportaron que lo habían logrado (1895).
CaC2 + N2 → Ca(CN)2
Sin embargo, en 1898 uno de sus colaboradores señaló que a esas altas temperaturas no se había obtenido el cianuro de calcio, sino más bien cianamida de calcio CaNCN. Desde entonces a este compuesto se le llama cianuro negro. Por ello la reacción se corrigió a:
CaC2+ N2 →Ca(NCN) + C
El NaCN fue obtenido por las empresas: American Hamilton Castner (USA) en 1894 y Scheideanstalt (Alemania) por reacción de sodio, amoniaco y carbón.
2 Na + 2 NH3 + 2C → 2 NaCN + 3H2
Unos años después (1901), el hijo de Adolph Frank, Albert, reconoció el potencial uso de la cianamida de calcio como fertilizante de aplicación directa, que de manera industrial posteriormente se produjo en 1908 en Trostberg (Alemania) por la empresa Bayerische Stickstoff-Werke AG.
La cianamida de calcio comercial tiene un color gris oscuro que se presentaba en forma de terrones o en polvo y contenía algo de Ca(OH)2, CaCO3 y carbón. La forma pura son cristales relucientes hexagonales que se descomponen en agua. Se usó como fertilizante, para fabricar amoniaco, en la industria del acero y en síntesis orgánica. En el suelo la cianamida de calcio se descompone en urea y carbonato de amonio, dos potentes fertilizantes. La producción mundial de CaNCN en 1907 fue de 1 700 toneladas.
El proceso Haber-Bosch
En realidad la idea de obtener amoniaco a partir de hidrógeno y nitrógeno no es original de Haber. Más de un siglo antes, otros investigadores ya habían diseñado experimentos para obtener el amoniaco a partir de sus elementos. Priestley, en 1790, había observado la descomposición del amoniaco en nitrógeno e hidrógeno:
NH3 → N2 + H2
Para 1750 ya se comercializaba cloruro de amonio y se conocía al amoniaco en solución acuosa. I. Milner reportó en 1789 que el amoniaco puede ser oxidado en presencia de dióxido de manganeso para dar una mezcla de ácidos nitroso y nítrico.
El hecho de que el amoniaco podía ser obtenido por reacción de hidrógeno y nitrógeno fue realizado por Claude Louis Berthollet en 1785:
N2 + H2 → NH3
quien hizo pasar una chispa eléctrica en una mezcla de nitrógeno con hidrógeno y obtuvo el amoniaco aunque con rendimientos muy bajos.
Hay patentes británicas de 1860 y 1880 que usaban la electricidad para obtener el amoniaco, pero sin resultados prácticos. Se ha encontrado una patente de 1881 donde se obtiene el amoniaco a partir del aire (que tiene el nitrógeno) e hidrógeno, usando hierro o platino como catalizador.1d
En 1884 William Ramsay y S. Young realizaron experimentos mezclando nitrógeno y hidrógeno con un catalizador de limaduras de hierro, pero los resultados no eran muy concluyentes; sin embargo, notaron que debería existir algún tipo de equilibrio (figura 3), tal como se conoce en la actualidad.
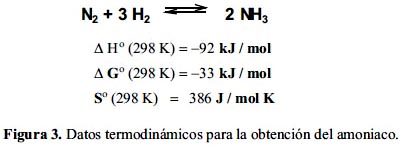
Estos son los antecedentes antes de que Fritz Haber y su colaborador Alois Mittasch realizaran sus experimentos en el laboratorio a inicios del siglo XX.
Fritz Haber, cuya especialidad era la fisicoquímica, fue el más brillante químico de su generación y abordó el problema de la obtención de compuestos nitrogenados desde varios ángulos. Estudió la reacción del nitrógeno con oxígeno, la reacción explosiva de acetileno con el aire (que producía óxidos de nitrógeno), entre otras. Haber pensó que la mejor opción era la reacción directa entre el hidrógeno y nitrógeno e intensificó sus experimentos con la finalidad de obtener un proceso industrial. Se presentaron varios obstáculos: no había una fuente confiable a nivel industrial de hidrógeno, había que separar el nitrógeno del oxígeno a partir del aire, no había un catalizador efectivo y, para colmo, su enemigo, el famoso Walther Nernst, luego de estudiar el equilibrio amoniaco-hidrógeno-nitrógeno, había declarado que no servía para obtener amoniaco industrialmente.7
G. van Oordt, asistente de Fritz Haber, en 1904, realizó varios experimentos tras los cuales obtuvo el amoniaco con un rendimiento de 1% usando un catalizador de hierro a 1 000 ºC. Pero por más presión que hacían, el rendimiento no mejoraba mucho. En 1905 los avances eran mínimos y Haber tenía pensado abandonar este método. Nernst publicó en 1906 el resultado de su investigación sobre el equilibrio amoniaco-nitrógeno-hidrógeno, que eran diferentes a los datos que había obtenido Haber. De hecho, Nernst, al realizar ese experimento, sinterizó el amoniaco a presión alta (30 a 75 atm).8 Fritz Haber, herido en su ego inmediatamente puso a su otro asistente Robert Le Rossignol a revisar los datos y concluyeron que un incremento de presión (200 atm) y temperatura (cerca de 600 ºC), con el catalizador de osmio, mejoraba la transferencia de calor y recirculando el hidrógeno y el nitrógeno sin reaccionar se obtenía un rendimiento cercano al 5%. Sin embargo, estas altas condiciones de presión y temperatura, en esa época, eran sólo posibles a una escala de laboratorio.
En el año 1909 Carl Bosch de la BASF y Alois Mittasch visitaron el laboratorio de Haber y se involucraron en mejorar el proceso para llevarlo a nivel de planta. Mittasch abordó el problema del catalizador, ya que el osmio era escaso y caro. Probó con unos 2 500 catalizadores durante un año de intenso trabajo, tras lo cual obtuvo uno con hierro (Fe3O4), el cual era muy barato. En la actualidad se sabe que el Fe3O4 mezclado con K2O, SiO2 y Al2O3, en las condiciones de reacción, se reduce a hierro
α, el cual es catalizador. El trabajo de Bosch consistía en trasladar el proceso a nivel industrial que traía grandes retos como el construir un equipo que funcionase a altas temperaturas y presiones. Otra contribución fue conseguir una fuente accesible de hidrógeno por medio de la reacción de gas de agua, al pasar vapor sobre carbón al rojo. Pocos años después los esfuerzos de estos científicos rindieron sus frutos. En 1913 se construyó la primera planta industrial de amoniaco con una producción de 11 000 toneladas, en la ciudad de Oppau, Alemania, usando osmio como catalizador. Años después en 1918 Haber recibió el Premio Nobel de Química.9 La revista alemana Zeitschrift für anorganische Chemie, conmemorando sus 120 años, ha puesto a disposición de todos el artículo histórico de Fritz Haber y G. van Oordt publicado en 1905.10CONCLUSIONES
Los peruanos hemos tenido muchos y variados recursos naturales; dos de ellos fueron el guano de isla y el salitre, que tuvieron una gran importancia en nuestra economía. La explotación de estos recursos no fue realizada de la mejor forma; se despilfarró y no se invirtió nada en investigación. Nunca tuvimos una política de estado en ciencia, tecnología e innovación.
Los países europeos que realizaron investigaciones e innovaciones pudieron, con el tiempo, independizarse de estos fertilizantes naturales, produciéndolos sintéticamente como: amoniaco, ácido nítrico, cianamida de calcio y nitratos; primero en el laboratorio y luego, industrialmente.
El caso de los fertilizantes es una lección no aprendida en muchos países de Latinoamérica y muy especialmente en el nuestro. ¿Qué está pasando con otros de nuestros recursos: el gas natural, los minerales y las plantas medicinales?
Necesitamos con urgencia una política de estado en ciencia, tecnología e innovación para el mejor aprovechamiento de nuestros recursos naturales, donde participen el estado a través de los ministerios, las universidades, las empresas y la sociedad civil organizada.
Este artículo no pretende ser negativo ni desalentador. Jóvenes universitarios y algunos no tan jóvenes pueden hacer grandes cambios; muchos de ellos tienen la creatividad, el espíritu científico e innovador, el entusiasmo y dedicación para realizar grandes proyectos. Ello, sumado al trabajo del estado peruano y de las empresas, así como de los promotores de la ciencia química, nos da grandes esperanzas para el futuro de nuestro país, donde sólo la ciencia y tecnología nos sacarán de la pobreza en la que nos encontramos desde nuestra independencia.
BIBLIOGRAFÍA
1. a) Leigh G. J. The World's Greatest Fix: A History of Nitrogen and Agriculture. New York: Oxford University Press; 2004 p. 80. b) Ibid p. 122. c) Ibid p. 125 d) Ibid p. 129
2. Justus von Liebig. On some points in agricultural chemistry. Londres: 1856. [Citado 31 marzo 2012]; p. 79. Disponible en:
3. a) Nesbit J. C. On agricultural chemistry, and the nature and properties of Peruvian guano. [Citado 31 marzo 2012]; p. 104. Disponible en: http://books.google.com.pe/books?id=a0wDAAAAQAAJ&pg=PA83&lpg=PA83&dq=nesbit+peruvian+guano&source=bl&ots=pvA4VYx0ws&sig=8RhhfebTk9bp407bN8LLjmJlloc&hl=es&ei=hYykTtHYNsLbgQfT06ioBQ&sa=X&oi=book_result&ct=result&resnum=1&sqi=2&ved=0CB4Q6AEwAA#v=onepage&q&f=false 3b) Ibid, p. 83.
4. Raimondi A. Informes y polémicas sobre el guano y el salitre. Perú 1854 - 1877, [citado 31 marzo 2012]. Disponible en:
5. Valcárcel C.D. et al. Historia General de los Peruanos. Tomo 3. Lima: Ediciones Peisa; p. 144 (1988).
6. Mariátegui J. C. 7 Ensayos de Interpretación de la Realidad Peruana. Lima: Empresa editora El Comercio; p. 25 (2005).
7. Coffey P. Cathedrals of Science, The Personalities and Rivalries That Made Modern Chemistry. New York: Oxford University Press; p. 151 (2008).
8. Dronsfield A. T. and Morris P. Who really discovered the Haber process? Education in Chemistry [Internet]. Mayo 2007 [citado 31 marzo 2012]. Disponible en: http://www.rsc.org/Education/EiC/issues/2007May/WhoReallyDiscoveredHaberProcess.asp
9. Hitos de la Química. Foro Permanente Química y Sociedad, p 25 [citado 31 marzo 2012]. Disponible en: http://es.scribd.com/doc/2625662/Hitos-de-la-Química.
10. Haber F., van Oordt G. Über die Bildwng von Ammoniak aus den Elementen. Zeitschrift für anorganische Chemie [Internet]. Abril 1905 [citado 31 marzo 2012]; 44 (1): 341-378. Disponible en: http://onlinelibrary.wiley.com/doi/10.1002/zaac.19050440122/pdf
Recibido el 27-10-2011
Aprobado el 26-04-2012













