Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.78 no.3 Lima July/Sep. 2012
TRABAJOS ORIGINALES
Preparación de nanopartículas de magnetita por los métodos sol-gel y precipitación: estudio de la composición química y estructura
Synthesis of nanoparticles of magnetite by sol-gel and precipitation methods: study of chemical composition and structure
Gino Picassoa*, Jaime Vegaa, Rosario Uzuriagaa, Gean Pieer Ruiza
a* Laboratorio de Investigación de Fisicoquímica, Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Rímac, Lima- Perú. E-mail: gpicasso@uni.edu.pe
RESUMEN
En este trabajo se ha preparado muestras nanoparticuladas basadas en magnetita por los métodos sol-gel y precipitación. En el primer caso se aplicaron 2 variantes: por crecimiento del sol a partir de precursor nitrato y etilenglicol como disolvente y agente reductor y por hidrólisis forzada y control estérico a partir de precursor sulfato y citrato de sodio. En el segundo caso se ha empleado como precursor sulfato de hierro, hidróxido de amonio como agente precipitante y etilenglicol como surfactante. Las muestras se han caracterizado mediante las técnicas de difracción de rayos X (XRD), adsorción-desorción de N2 (método BET) y espectroscopía Mössbauer. Los resultados de los difractogramas XRD indicaron la formación mayoritaria de la especie magnetita que se evidenció por la presencia de los picos característicos en las siguientes posiciones: 30,06 º, 35,42 º; 62,55 º. El valor del área superficial promedio medida por la técnica BET de las muestras de magnetita fue entre 40 a 50 m2/g con una isoterma tipo IV correspondiente a una superficie mesoporosa. El espectro Mössbauer de la muestra de magnetita obtenido por sol-gel y realizado a temperatura ambiente detectó la presencia de 2 sextetos conformados por 2 sitios: uno octaédrico (Fe2+, Fe3+) y otro tetraédrico (Fe3+). El tamaño de grano de las muestras de magnetita se estimó a partir del tamaño de la cristalita según la ecuación de Scherrer y de la superficie específica, obteniéndose un diámetro medio en el rango de 2 a 20 nm.
Palabras clave: Nanopartículas de magnetita, sol-gel, precipitación.
ABSTRACT
In this work, nanoparticles based on magnetite have been prepared by sol-gel and precipitation methods. In the first case two variants have been applied: by growing of sol starting from nitrate precursor and ethylene glycol as dissolvent and to control the reduction process and force hydrolysis and steric control prepared from ferrum sulfate precursor and sodium citrate. In the second case the starting material was sulfate precursor, amonium hydroxide as precipitaing agent and ethylene glycol as surfactant. The samples have been characterized by X-ray diffraction technique (XRD), adsorption-desorption of N2 (BET equation model) and Mössbauer spectroscopy. XRD patterns of all samples showed typical peaks of magnetite which were detected in the following positions: 30,06 º, 35,42 º, 62,55 º. Average specific surface quantified by BET method was ranging from 40 to 50 m2/g with isotherm type IV corresponding to mesoporous surface. Mössbauer spectra of sample prepared from sol-gel (gel growing) carried out at home temperature detected the presence of 2 sextets consisting in 2 type of sites: first one due to octaedric positions (Fe2+, Fe3+) and the second one due to tetraedric positions (Fe3+). Grain size of magnetite samples, evaluated by Scherrer equation and specific surface area, was ranging from 2 to 20 nm.
Key words: Nanoparticles of magnetite, sol-gel, precipitation.
INTRODUCCIÓN
La magnetita (Fe3O4) en forma nanoparticulada ha encontrado diversas aplicaciones en el campo de la biomedicina: en fenómenos como la hipertermia y el transporte selectivo de fármacos, ambos de prometedor futuro en la terapia del cáncer, en el mejoramiento por contraste de las imágenes por resonancia magnética, en la reparación de tejidos, como portador de drogas, en la separación celular, en la reducción de la toxicidad de los fluidos biológicos, entre otros1-5. Diversos óxidos nanoestructurados basados en magnetita han resultado ser buenos dispositivos para la manufactura de materiales magnéticos, películas de protección sensibles, catalizadores, pigmentos. De manera particular, la magnetita ha sido usada en aplicaciones biomédicas como un trazador para la reparación de tejidos, para el mejoramiento de las propiedades de fármacos, detección temprana de algunos carcinomas, entre otros6-8.
Por otro lado, diferentes sistemas electroquímicos se han usado en la determinación de trifenilos y derivados, por ejemplo electrodos químicamente modificados con fibras de carbón, usando también electrodos de oro soportado en complejos de fullerenos así como fibra de vidrio y pasta de carbono9-11. Sin embargo, muchas de estas tecnologías son poco accesibles y bastante costosas para su aplicación en gran escala. El uso de sensores más simples basados en polímeros impresos depositados sobre magnetita e incorporados con pasta de carbón podría modificar sustancialmente la detección de colorantes en especial el trifenilmetano, para su posterior degradación.
La investigación de la magnetita nanoparticulada como componente principal de sensores y su interacción con polímeros de impresión molecular (MIP's) para la detección de colorantes es interesante desde el punto de vista ambiental12-15. La aplicación de polímeros sintéticos altamente estables, como los MIP's, en la detección de colorantes, incrementa sustancialmente la selectividad de los sensores químicos por las propiedades de reconocimiento molecular selectivo; ello es debido a que los sitios de reconocimiento dentro de la matriz del polímero son complementarios al analito en la forma y posición de los grupos funcionales16. Algunos de estos polímeros tienen altas selectividades y constantes de afinidad, comparables con los sistemas de reconocimiento que ocurren naturalmente, tales como anticuerpos monoclonales o receptores. La impresión molecular es un método poderoso para preparar sitios de reconocimiento sintético con selectividad predeterminada para varias sustancias como compuestos trifenilmetanos muy aplicados en la industria textil como precursor de tintes y esmaltes para el teñido de algodón, seda y otras fibras17,18.
En los últimos años se han empleado diversos métodos de preparación de la magnetita como sol-gel, precipitación, spry pirólisis considerando algunos parámetros experimentales como la temperatura de reacción, concentración inicial de los reactivos, tiempos de residencia, velocidad de agitación, pH de la solución, tipo de surfactante, entre otras12-14. En particular, el efecto de la presión en la síntesis de las nanopartículas ha sido objeto de estudio por el método de coprecipitación15.
El interés de este trabajo se centra en la preparación de nanopartículas de magnetita como soporte de MIP's para aplicaciones como sensor de colorantes y para aplicaciones biomédicas en la detección temprana de algunas enfermedades. En este primer avance se presenta la preparación de la magnetita por el método sol-gel y precipitación, usando diferentes precursores. La relación de las variables de preparación con las características estructurales de la magnetita obtenida es el objetivo principal de este trabajo.
PARTE EXPERIMENTAL
Materiales de partida
Los materiales de partida fueron los siguientes:
-
nitrato de hierro III, Fe(NO3)3.9H2O (99% pureza Merck, pf=404,00 g/mol).
-
etilenglicol, OHCH2CH2OH (99,5% pureza Merck, pf=62,082 g/mol).
-
sulfato de hierro (II), Fe(SO4).4H2O (97% pureza Merck, pf=224 g/mol).
-
sulfato de hierro (II), Fe(SO4).7H2O (91% pureza Merck, pf=278 g/mol).
-
hidróxido de amonio, NH4OH (80% pureza Merck, pf=35 g/mol).
-
ácido oleico, C18H34O2 (99% pureza Merck, pf=282 g/mol).
-
citrato de sodio, C6H5Na3O7.2H2O (Merck, pf=294,10 g/mol).
-
hidróxido de sódio, NaOH (Merck, pf=40,01 g/mol).
-
nitrato de sódio (Merck, pf=84,99 g/mol).
-
nitrato de potasio KNO3 (Merck, pf=110,11 g/mol).
En este trabajo se ha sintetizado la magnetita por dos métodos: sol-gel y precipitación. En el método sol-gel la magnetita se forma a partir de un sol de metal para luego formar el gel por crecimiento controlado del tamaño de partícula, seguimiento del pH, estabilización del tamaño de partícula, entre otros factores. Se puede partir de soluciones de Fe2+ o de Fe3+. Para obtener la magnetita, la oxidación del Fe2+ o la reducción del Fe3+ debe ser un proceso controlado para obtener la relación molar apropiada de Fe2+/Fe3+ en la espinela inversa. En el método de preciptación, la magnetita se forma a través de la formación de sales de oxo-hidróxido de hierro mediante la agregación lenta y controlada de iones HO- a partir de un agente precipitante. A continuación se describe de manera detallada los procedimientos empleados para la preparación de la magnetita por el método sol-gel 19-22 y por precipitación23-24.
Preparación de la magnetita por sol-gel
Por crecimiento del sol
El precursor metálico usado para la preparación de las nanopartículas de óxido de hierro fue nitrato de hierro III, Fe(NO3)3.9H2O. Se disolvió 14 g de Fe(NO3)3.9H2O en 55g de etilenglicol, empleado como disolvente y agente reductor21. El sol resultante se calentó a 80ºC por 2 horas en atmosfera inerte (flujo de N2) bajo agitación continua. Al finalizar este proceso, el sol formado se calentó a 110ºC hasta la evaporación total del líquido y el secado total del gel. Una vez obtenido el sol seco, se calcinó a una temperatura a 300ºC bajo atmósfera inerte por 2 horas para mantener la presencia del Fe2+ en la espinela. Se dejó enfriar durante 2 h en el recipiente manteniendo el ambiente inerte.
Por hidrólisis forzada
El precursor metálico empleado para la preparación de las nanopartículas de óxido de hierro fue sulfato de hierro II, FeSO4.7H2O. Se disolvió 0,91 g de KNO3 (usado como oxidante intermedio) y 0,26 g de NaOH (usado como agente precipitante) en 90ml de agua destilada en un balón de tres bocas y se mezcló con una solución de Fe2+ que se formó a partir de la mezcla de 0,21 g de FeSO4.7H2O en 10ml 0,01M H2SO4 en atmósfera inerte para obtener una oxidación controlada; esta mezcla se agitó durante 2 horas19. Luego se calentó a 90ºC sin agitación por 24h para después dejarlo envejecer por 24h más. Después del envejecimiento se ha formado la espinela sólida que se dejó enfriar en baño de hielo, acelerando la separación. Finalmente, el precipitado se separó del líquido con un imán por decantación. El sólido obtenido fue lavado tres veces en un baño de agua por ultrasonido y se dejó secar a 60ºC por tres días.
Por control estérico
El precursor metálico empleado para la preparación de las nanopartículas de óxido de hierro fue sulfato de hierro II (FeSO4.7H2O). Se disolvió 0,29 g de citrato de sodio C6H5Na3O7.2H2O (usado como surfactante), 0,16 g de NaOH (agente precipitante) y 17 g de NaNO3 (controlante de la fuerza iónica) en 19ml agua destilada; la mezcla se calentó a 100ºC hasta formar una solución translúcida y se mezcló con 1 ml de solución 0,1M FeSO4.7H2O; la solución obtenida fue calentada a 100ºC por 1h20. Se enfrió luego a temperatura ambiente, se separó el sólido obtenido con un imán y se decantó. Finalmente se redisolvió varias veces en agua destilada por ultrasonido y se dejó secar a 60ºC por tres días.
Se repitió el proceso variando la concentración del precursor FeSO4.7H2O para 0,05M y 0,2M para observar el efecto de la concentración inicial del precursor y el tamaño de partícula en las propiedades magnéticas como se ha comprobado en la literatura22.
Preparación de la magnetita por precipitación
Los precursores metálicos usados para la preparación de las nanopartículas de óxido de hierro fue Fe2(SO4)3.5H2O y Fe(SO4).7H2O. La preparación de las nanopartículas por el método de precipitación consiste básicamente en la precipitación a partir de sulfato de Fe (II) y sulfato de hierro (III) usando NH4OH (100ml) como agente precipitante en constante agitación durante 1h a 90°23-24. Luego se lavó el precipitado y se secó a temperatura ambiental. Posteriormente se añadió 100 ml de ácido oleico (usado como primer surfactante) a una temperatura de 80°C durante 2 horas. Se procedió luego a lavar y secar por 1 día a temperatura ambiental. Se añadió finalmente 30 ml de etilenglicol (usado como segundo surfactante) gota a gota y 30 ml de H2O destilada23. Se dejó envejecer por 1 día a temperatura ambiental para luego lavar el precipitado con agua destilada, secarlo o a 90 ºC y calcinarlo a 200 ºC durante 1 h.
El uso de hidróxido de amonio como agente precipitante fue debido a que presenta una solubilidad elevada e implica condiciones de alcalinidad (pH > 11) por la formación de OH-:
NH3+ H2O ----------> NH4+ + OH-
Esta base genera los iones OH- de una manera lenta (Kd=1,8.10-5) permitiendo obtener una nucleación homogénea con la formación de los oxo-hidróxido de hierro, evitando la agregación de cúmulos desordenados y, por tanto, controlando la velocidad de reacción.
Las condiciones de preparación de las muestras de magnetita se resumen en la tabla 1.
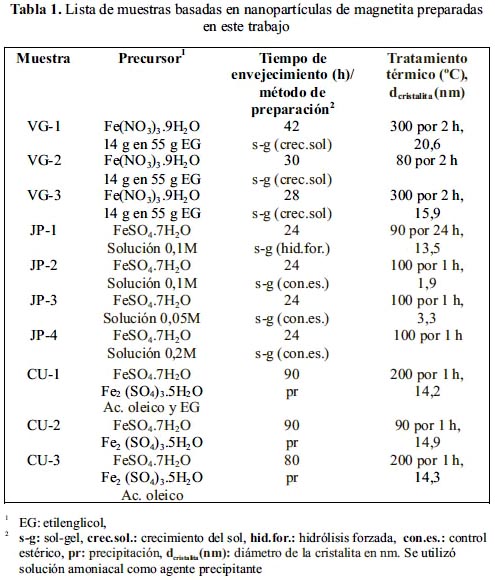
RESULTADOS Y DISCUSIÓN
Caracterización
Análisis por difracción de rayos X (XRD)
Para la identificación cristalográfica de las muestras se utilizó la técnica de difracción de rayos X (XRD). El equipo utilizado fue un difractómetro RIGAKU Modelo Miniflex, con tubo de cobre y filtro de níquel, con 30 kV y 15 mA. El equipo está provisto de un ánodo rotatorio. Se usó un monocromador de grafito con el objeto de seleccionar la radiación CuK del ánodo de cobre y se ha trabajado con ángulos de barrido entre 5 y 100º a una velocidad de 0,04 º/s.
El tamaño medio de los granos cristalinos fue calculado a partir del análisis de los picos de difracción más intensos mediante la ecuación de Debye-Scherrer:
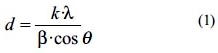
Donde d es el tamaño medio de grano cristalino o cristalita (Å),
λ es la longitud de onda de la radiación incidente CuKα igual a 1,5418 Å, k es una constante que toma el valor de 0,9 (previamente calibrada en el equipo a partir de muestras patrón de tamaño de grano conocido), β es la anchura del pico a la mitad de su intensidad máxima (en radianes) y θ es el ángulo de difracción para dicha intensidad.En general, las muestras sintetizadas han mostrado mayoritariamente los picos característicos de la espinela inversa del Fe3O4 en las posiciones angulares: 30,06 º, 35,42 º; 62,55 º (JCPDS – Internacional Centre for Diffraction Data Nº 33-0664) como se observa en la figura 1. La temperatura de calcinación no ha afectado sustancialmente la cristalinidad en las dos series de muestras y la definición de la fase magnetita se ha obtenido a bajas temperaturas: 50-90 ºC durante la etapa del envejecimiento y secado. Esto también ha sido observado en otros trabajos3, 24. A la temperatura de 80 ºC (muestra VG2) se observa, además de los picos característicos a la magnetita, la presencia de un pico a 33º que puede atribuirse a la fase α-hematita, pero a medida que aumenta la temperatura, los picos son más definidos como se aprecia al comparar las muestras VG2 y VG3; la primera tratada a 80 ºC por 2 h y la segunda a 300ºC por 2 h y las muestras CU1 y CU2, la primera calcinada a 200 ºC por 2 h y la segunda a 90ºC por 1 h.
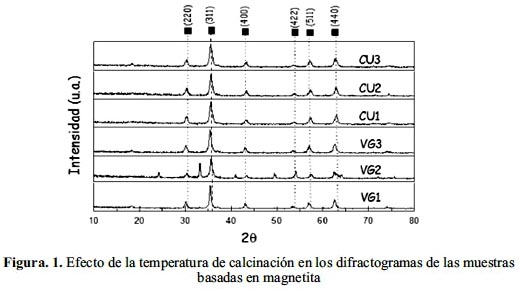
La influencia del método de preparación en la cristalinidad ha sido importante como se observa en la figura 2 al comparar las muestras de la serie CU, VG con los de la serie JP; esta última realizada por el método sol-gel, control estérico, usando citrato de sodio como estabilizante que ha permitido la formación de granos más pequeños: 1,9 nm para JP2 y 3,3 nm para JP3. En las muestras de la serie JP, el tratamiento térmico a 100 ºC, partiendo de Fe2+, ha permitido la oxidación parcial a Fe3+ para formar la espinela inversa, además de controlar la velocidad de los procesos de nucleación. La adsorción de los polímeros estabilizantes en los sitios de crecimiento ha permitido controlar el crecimiento de tamaño de partícula.
Análisis por adsorción-desorción de N2 (superficie BET)
Para la medición de la superficie específica y tamaño de poro se usó el equipo Micromeritics GEMINI-VII serie t del Laboratorio de Investigación de la Facultad de Ciencias (UNI), que permite el registro de la isoterma de adsorción en todo el rango de presiones parciales P/P0. Se utilizó N2 como gas de análisis (gas N2, 99% AGA) y nitrógeno líquido (PRAXAIR) con punto de ebullición a -195,79 °C como refrigerante para la condensación del N2. El área BET se calculó en el rango de presiones P/Ps entre < 0,05 a 0,33> correspondiente a la adsorción de una monocapa. Los puntos de equilibrio se midieron siguiendo el programa GAS MICROMERITICS con un total de 50 puntos y con un tiempo de equilibrio en cada punto de 7 s. Previo a la adsorción, las muestras fueron desgasificadas al vacío durante 2 h a 250 °C con el propósito de eliminar el agua y las impurezas superficiales. A partir del valor de la superficie BET, se ha calculado de manera aproximada el tamaño medio de las nanopartículas como lo sugiere el trabajo de Murbe et al.3, mediante la siguiente expresión: dBET = 6000/ρAs donde: As es la superficie total específica (m2/g) y ρ es la densidad de la magnetita igual a 5,072 (g/cm3).
En la figura 3 se pueden observar las isotermas correspondientes a las muestras VG1, VG3 y CU2; las dos primeras preparadas por sol-gel (crecimiento del sol) y la segunda, por precipitación y en la tabla 2 los valores correspondientes de la superficie específica. De acuerdo al perfil de las isotermas, todas corresponden al tipo IV según la clasificación IUPAC con presencia de histéresis y que describen a un sólido mesoporoso. Las muestras VG1 y VG3 presentan poros de tipo laminar mientras que para la muestra CU2 un tipo cuello de botella considerando la mayor histéresis observada. La magnetita preparada por todos los métodos ha presentado un diámetro medio entre 17 y 30 nm con menor tamaño relativo para la muestra preparada por precipitación, probablemente debido a la acción antiaglomerante del etilenglicol.
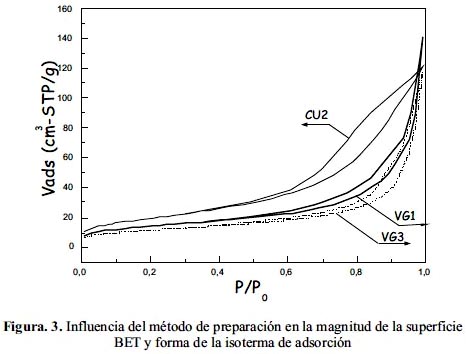

Espectroscopía Mössbauer
Para el análisis por espectroscopía Mössbauer se contó con el servicio de espectroscopía Mössbauer de la Facultad de Ciencias Físicas de la UNMSM. Se usó la técnica convencional en la modalidad de transmisión, con señal sinusoidal y una fuente de 57Co en la matriz de rodio. Se utilizó 25 mg de muestra en polvo en un portamuestra de 1,0 cm de diámetro interno. La velocidad se calibró usando un patrón de hierro metálico con un campo magnético hiperfino de 33 T.
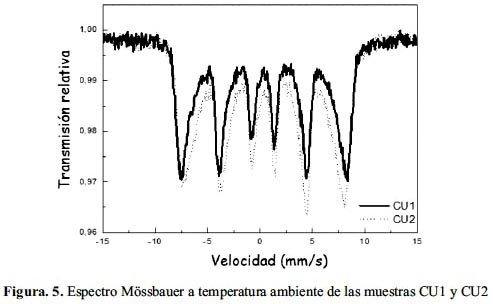
El espectro Mössbauer medido a temperatura ambiente de la muestra VG3 y de las muestras CU1 y CU2 se presentan en las figuras 4 y 5, respectivamente. Los perfiles del espectro Mössbauer en las muestras son similares. A temperatura ambiental el espectro Mössbauer de la magnetita presenta dos componentes magnéticos uno para cada sitio A y B como se muestra en las figuras. El sexteto del campo magnético mayor corresponde al sitio A (tetraedral) y el de campo menor corresponde al sitio B (octaedral). Las líneas de los sitios B son más anchas que la de los sitios A. Este fenómeno ha sido explicado como un "efecto de salto de electrón", es decir, que los cationes de Fe+2 y Fe+3 en los sitios B octaedrales intercambian electrones con frecuencia suficientemente rápida que afecta el ancho de línea. El espectro Mössbauer a temperatura de ambiente de la magnetita contiene 3 componentes espectrales: uno para el Fe (III) en los sitios A, otro para el Fe(II)Fe(III) en los sitios B y un tercero para el Fe(III), en exceso de los sitios B.
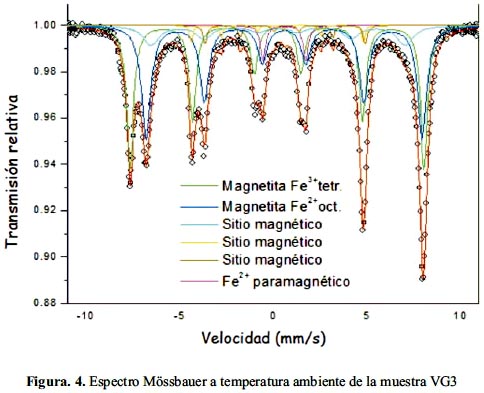
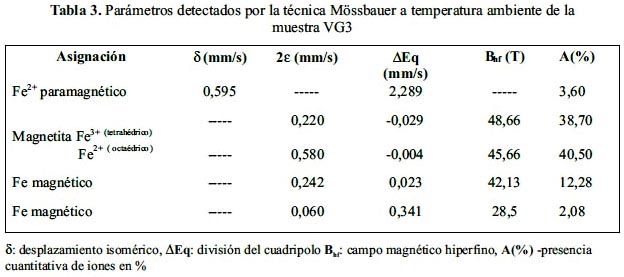
Para la muestra VG3 se ha realizado un análisis de los parámetros hiperfinos (tabla 3). El modelo empleado para los ajustes Mössbauer considera la presencia de un sitio paramagnético (doblete) con una área de 3,6% y cinco sitios magnéticos (sextetos). El sitio paramagnético que es asignado a un sitio de Fe2+ que puede estar localizado en la estructura octaedral de un mineral de Fe. Los sitios magnéticos con campos magnéticos hiperfinos Bhf = 48,57 T y Bhf = 45,66 T, son atribuidos a los sitios tetrahedral y octahedral de la magnetita (Fe3O4), respectivamente, con una área de absorción resonante total relativa de 79,2%. Este resultado indica que no se trata de una magnetita bien cristalizada y/o con posible sustitución isomórfica; además, fue necesario incluir otros tres sitios magnéticos que contienen aproximadamente un 18% del área relativa total. Los valores de los parámetros hiperfinos están listados en la tabla 3.
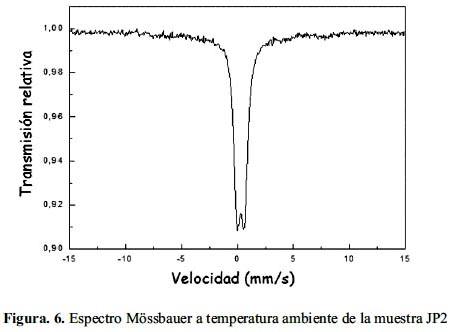
Finalmente, la muestra JP2 presentó un espectro Mössbauer diferente a los de las series VG y CU, como se aprecia en la figura 6. Este consiste en un doblete y no en un sexteto y se puede atribuir al tamaño nanoparticulado de la magnetita que ha modificado la configuración de la distribución de los sitios tetraedral y octaedral de los iones Fe2+ y Fe3+, respectivamente. Se confirma entonces los resultados del análisis XRD obtenidos para la muestras JP2 con diámetro medio de 2 nm (tabla 1). Aunque el espectro Mössbauer permite determinar la distribución atómica de la magnetita, también puede estimar el tamaño de la partícula considerando el efecto de un campo magnético externo en la distribución electrónica de la magnetita.
CONCLUSIONES
-
La influencia del método de preparación de la magnetita en la cristalinidad ha sido importante. Las muestras preparadas por el método sol-gel, control estérico, usando citrato de sodio como estabilizante, ha permitido la formación de granos más pequeños mientras las preparadas por sol-gel, hidrólisis forzada partiendo de Fe2+, ha permitido la oxidación parcial a Fe3+ para formar la espinela inversa.
-
El análisis XRD de las muestras sintetizadas mostraron la presencia mayoritaria de la magnetita en todos los materiales, presentando mayor cristalinidad las muestras calcinadas respecto a sus homólogas envejecidas a temperaturas menores a 100 ºC. El tamaño medio del grano fue afectado por el método de preparación empleado siendo el método sol-gel (hidrólisis forzada), el que permitió obtener granos entre 2 y 3 nm. Las dimensiones de grano obtenidas por el método de precipitación fueron en promedio del orden de 10 a 20 nm.
-
La superficie específica de todas las muestras, medida por la técnica BET, estuvo en el rango de 40 a 70 m2/g y la forma de la isoterma de adsorción obtenida fue del tipo IV según la clasificación IUPAC, que corresponde a una superficie mesoporosa.
-
El espectro Mössbauer obtenido de las muestras de las series VG y CU a temperatura ambiental detectó la presencia de 2 sextetos conformados por 2 sitios: uno octaédrico (Fe2+, Fe3+) y otro tetraédrico (Fe3+) confirmando la formación de la espinela inversa, característico de la magnetita pero con presencia de impurezas de Fe magnético. La muestra JP2, preparada por sol-gel (hidrólisis forzada), presentó un doblete en lugar de un sexteto, que fue atribuido al tamaño pequeño de las nanoparticulas sintetizadas del orden de 2 nm.
AGRADECIMIENTO
Se agradece a la Facultad de Ciencias de la Universidad Nacional de Ingeniería por la ayuda económica concedida para este trabajo durante el año 2011.
BIBLIOGRAFÍA
1. Yang X., Chen L., Han B., Yang X., Duan H., Preparation of magnetite and tumor dual- targeting hollow polymer microspheres with pH-sensitivity for anticancer drug-carriers, Polymer 51, 2010; 2533-2539.
2. Yazdania F., Edrissi M., Effect of pressure on the size of magnetite nanoparticles in the coprecipitation synthesis, Materials Science and Engineering B 171, 2010; 86-89.
3. Murbe J., Rechtenbach A., Synthesis and physical characterization of magnetite nanoparticles for biomedical applications, Materials Chemistry and Physics 110, 2008; 426-433.
4. Li Z., Kawashita M., Araki N., Mitsumori M., Hiraoka M., Doi M., Magnetite nanoparticles with high heating efficiencies for application in thehyperthermia of cancer, Materials Science and Engineering C 30, 2010; 990-996.
5. Grande Antonio H., Nanotecnologíay nanopartículas magnéticas: la física actual en lucha contra la enfermedad, Rev.R.Acad.Cienc.Exact.Fís.Nat. (esp.), vol. 101, Nº. 2, 2007; pp 321-327.
6. Alexiou C, Diehl D, Henninger P, Iro H, Rockelein R, Schmidt W, Weber H, A high field gradient magnet for magnetic drug targeting. IEEE Trans. Applied Supercond, 2006; 16(2): 1527-1530.
7. Bedanta S, Kleemann W, Supermagnetism. Journal of physics.D, Applied physics, 42(1). ID: 65. Brigger, I., Dubernet, C., & Couvreur, Nanoparticles in cancer therapy and diagnosis. Adv. Drug Delivery Rev. 2009; 54(5): 631.
8. Fukumori Y, Ichikawa H, Nanoparticles for cancer therapy and diagnosis. Adv. Powder Technology, 2006; 17(1): 1.
9. Oliveira Mariana C.Q., Lanza Marcos R.V, Tanakac Auro A., Taboada Sotomayor P., Flow injection analysis of paracetamol using a biomimetic sensor as a sensitive and selective amperometric detector, Anal. Methods, 2010; 2, 507-512.
10. Moreira Luiz Fernando, de Vasconcelos Lanza M.R., Tanaka A.A., Taboada Sotomayor M.P., Selective UV-filter detection with sensors based on stainless steel electrodes modified with polyaniline doped with metal tetrasulfonated phthalocyanine films, Analyst 134, 2009; 1453-1461.
11. Jacometo Castilho T., Taboada Sotomayor M.P., Kubota Lauro Tatsuo, Amperometric biosensor based on horseradish peroxidase for biogenic amine determinations in biological samples, Journal of Pharmaceutical and Biomedical Analysis 37, 2005; 785-791.
12. Valero-Navarro A., Medina-Castillo A., Fernández-Sánchez J., Fernández-Gutiérrez A., Synthesis of a novel polyurethane-based-magnetic imprinted polymer for the selective optical detection of 1-naphthylamine in drinking water, Biosensors and Bioelectronics, v. 26, Issue 11, 2011; p. 4520-4525.
13. Qiang Yu, Shubo Deng, Gang Yu, Selective removal of perfluorooctane sulfonate from aqueous solution using chitosan-based molecularly imprinted polymer adsorbents, Water Research, volume 42, Issue 2008; 12, p. 3089-3097.
14. Alizadeh T., Akhoundian M., A novel potentiometric sensor for promethazine based on a molecularly imprinted polymer (MIP): The role of MIP structure on the sensor performance, Electrochimica Acta, v. 55, Issue 2010; 10, p. 3477-3485.
15. Abdalla M.A., Jaafar M.H., Al-Othman Z.A., Alfadul S.M., Ali Khan M., New route of preparation and characterization of magnetite nanoparticles, Arabian Journal of Chemistry, v. 4, Issue 2, 2011; p. 235-237.
16. Fajaroh F., Setyawan H., Widiyastuti W., Winardi S., Synthesis of magnetite nanoparticles by surfactant-free electrochemical method in an aqueous system, Advanced Powder Technology, 23, 2012; p. 328-333.
17. Galeotti F. Bertini F., Scavia G., Bolognesi A. A controlled approach to iron oxide nanoparticles functionalization for magnetic polymer brushes, Journal of Colloid and Interface Science, v. 360, 2, 2011; p. 540-547.
18. Shen Wu, Aizhi Sun, Fuqiang Zhai, Jin Wang, Wenhuan Xu, Qian Zhang, Alex A. Volinsky, Fe3O4 magnetic nanoparticles synthesis from tailings by ultrasonic chemical co-precipitation, Materials Letters, v. 65, Issue 12, 2011; p. 1882-1884.
19. Xu, Haibin Yang, Wuyou Fu, Kai Du, Yongming Sui, Jiuju Chen, Yi Zeng, Minghui Li, Guangtian Zou, Preparation and magnetic properties of magnetite nanoparticles by sol–gel method, J. Magnetism and Magnetic Materials 309, 2007; p. 307-311.
20. Itoh Hiroyuki, Sugimoto Tadao, Systematic control of size, shape, structure, and magnetic properties of uniform magnetite and maghemite particles, J. Colloid and Interface Science 265, 2003; 283-295.
21. Da Costa G.M., De Grave E., De Bakker P.M., Vandenberghe R.E., Synthesis and characterization of some iron oxides by saol.gel, J. Solid State Chemistry 113,1994; 405-412.
22. Vergés M Andrés, Costo R., Roca A.G., Marco J.F., Goya G.F., Serna C.J., Morales P.M., Uniform and water stable magnetite nanoparticles with diameters around the monodomain–multidomain limit, J. Phys. D: Appl. Phys. 41, 2008; 134003.
23. Jiwon Lee, Tetsuhiko Isobe, Mamoru Senna, Magnetic properties of ultrafine magnetite particles and their slurries prepared via in-situ precipitation, Colloids and Surfaces A: Physicochemical and Engineering Aspects 109, 1996; p. 121-127.
24. Wang Xuman, Zhang Caining, Wang Xiaoliang, Gu Hongchen, The study on magnetite particles coated with bilayer surfactants, Applied Surface Science 253, 2007; p. 7516-7521.
Recibido el 18-06-2012
Aprobado el 25-07-2012













