Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.78 no.4 Lima Oct./Dec. 2012
TRABAJOS ORIGINALES
Acción neutralizante de la toxicidad del veneno de Bothrops atrox por extracto de plantas amazónicas
Neutralizing action from the venom of Bothrops atrox sanke by amzonic plants
Armando Yarlequé* , Mirella Clavo2 , Fanny Lazo1 , Betty Millán3 , Julio Mendoza1 , Dan Vivas1 , César Ortiz1
1* Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, UNMSM, Av. Venezuela Cuadra 34 s/n, Lima 1. E-mail: ayarleque48@gmail.com
2 IVITA-Pucallpa, Facultad de Medicina Veterinaria, UNMSM
3 Museo de Historia Natural, UNMSM
RESUMEN
Se ha realizado un estudio de neutralización con extractos vegetales de la Amazonía peruana contra el veneno de la serpiente Bothrops atrox "jergón". Para ello, se preparó extractos acuosos: hervidos, sin hervir e infusión de diez especies de plantas y con ellos se realizó pruebas de destoxificación del veneno empleando ratones albinos, haciéndose en paralelo el análisis bioquímico del veneno y calculándose su toxicidad. El veneno de B. atrox tuvo un porcentaje de proteína de 76,4%, mostrando 8 y 9 bandas electroforéticas en condiciones no reductoras y reductoras, respectivamente, con un rango de pesos moleculares de 56-12 kDa y 73-15 kDa. El análisis enzimático mostró la presencia de L-aminoácido oxidasa, fosfolipasa A2 y actividades proteolítica y coagulante. La toxicidad (DL50) fue de 3,38 µg/g de ratón. Los ensayos extracto acuoso sin hervir-veneno no neutralizan la toxicidad de la ponzoña; en cambio, los extractos hervidos de Dracontium sp. (MC 5990), Philodendro ernestii (MC 6807) y Philodendron sp. (MC 5984) fueron capaces de neutralizar una cantidad equivalente a 3DL50 del veneno. Por otro lado, los extractos obtenidos por infusión de Cordia nodosa (MC 6810) y Philodendro ernestii (MC 6807) fueron los únicos que tuvieron acción neutralizante contra el veneno en estudio.
Palabras clave: plantas, Amazonía, veneno, serpiente, neutralización.
ABSTRACT
A neutralizing study against Bothrops atrox venom was carried aout using different preparations from amazonic plants referred as antiofidic properties. Mixture of plants heated and non heated in distillate water were assayed in order to neutralize toxicity from the venom using mice to calculated LD50 and some enzymatic activities. The protein content into the venom was 76,4%, showed 8 and 9 protein bands by SDS-PAGE in non reducting and reducting conditions being the range of molecular weights: 56-12 kDa and 73-15 kDa. Some enzymatic activities are present in this venom: L- amino acid oxidase, phospholipase A2, coagulant and proteolytic actions, being its LD50 3,38 µg/g mouse. Heated extract from Dracontium sp. (MC 5990), Philodendro ernestii (MC 6807) and Philodendron sp. (MC 5984) are capable to blocked 3LD50 until 48 hours. Other extracts by infusion Cordianodosa (MC 6810) and Philodendro ernestii (MC 6807) were neutralizing action against the venom too.
Key words: plants, Amazonia, venom, snake, neutralization.
INTRODUCCIÓN
En países tropicales y subtropicales, como es el caso del Perú, los accidentes ofídicos u ofidismo constituyen un problema de salud por las graves consecuencias evidenciadas en lesiones irreversibles e inclusive la muerte1,2. El único tratamiento reconocido internacionalmente hasta la fecha, para atender exitosamente estos accidentes, es el uso del antiveneno o suero antiofídico, el cual se obtiene por hiperinmunización de equinos y otros mamíferos3. Sin embargo, las plantas amazónicas con propiedades antiofídicas son una alternativa promisoria en este campo.
Los estudios etnobotánicos, realizados en los últimos años, nos brindan información seleccionada y probada por diversos grupos étnicos en un tiempo tan grande como su existencia; el tratamiento antiofídico usando plantas es fuente para investigaciones básicas y aplicadas. Las pruebas biológicas iniciales para probar actividad antiofídica en el Perú se hicieron del pedúnculo floral de Dracontium loretense4, quienes probaron en ratones el extracto acuoso preincubado con el veneno de Bothrops atrox; los resultados mostraron una severa reducción de la actividad hemorrágica y la mionecrosis. En el 2006, Lovera et al.5, demostraron que el extracto acuoso de D. loretense neutraliza la actividad letal del veneno de B. atrox. Mejía y Rengifo6, en el año 2000, indican que plantas como Persea americana, Spondias monbin, Eleutherine bulbosa, Uncaria tomentosa son usadas contra accidentes ofídicos, ya sea por ingestión o aplicaciones tópicas. Clavo et al.7, reportaron que Hura crepitans se usa como atenuante de los efectos por mordedura de serpientes.
La presente investigación es el inicio de un programa destinado a explorar la actividad neutralizante y otras propiedades antiofídicas de plantas propias de la región amazónica de nuestro país como un recurso potencial para el tratamiento precoz de accidentes ofídicos en complemento con el antiveneno comercial.
PARTE EXPERIMENTAL
Material biológico
Se empleó veneno de Bothrops atrox de especímenes adultos procedentes de Pucallpa, departamento de Ucayali y mantenidos en cautiverio en el Serpentario "Oswaldo Meneses" del Museo de Historia Natural de la UNMSM. El veneno obtenido, fue liofilizado y conservado a 4°C.
Animales de experimentación
Se emplearon ratones albinos cepa Balb C machos de (18-20g), adquiridos en el bioterio del Instituto Nacional de Salud, Lima.
Plantas en estudio
Procedieron de las comunidades nativas asháninka y shipibo-conibo de la región Ucayali. En la tabla 2 se listan las 10 especies de plantas usadas en esta investigación.
Análisis bioquímico
-
Cuantificación proteica del veneno.- Se realizó por el método de absorción ultravioleta a 280 nm y por el método de Lowry modificado por Loayza et al.8, usando como proteína estándar albúmina sérica bovina.
-
Análisis electroforético.
- La electroforesis por PAGE-SDS fue llevada a cabo usando el método de Laemmli 9 en condiciones reductoras y no reductoras, con una cámara vertical Mini Gel System (Sigma). Las corridas se realizaron por una hora usando 15 mA por carril y las bandas proteicas se revelaron con azul brillante de Coomasie.
Actividades enzimáticas:
-
Proteolítica.- Fue estimada empleando el método modificado por Takahashi y Ohsaka10, para lo cual se usó caseína al 2% en buffer Tris HCl 0,2M pH 8,5 y 0,1 mL de veneno 1 mg/mL. La mezcla de reacción fue incubada durante 10 minutos a 37 °C; se detuvo la reacción con la adición de ácido tricloroacético 0,44M y se midió la actividad por la formación de productos ácido-solubles a 280 nm.
-
Coagulante.
- Fue medida mediante el método de Oshima11, empleando como sustrato fibrinógeno bovino 5 mg/mL en buffer Tris HCl 0,05M pH 7,4. La mezcla de reacción fue pre-incubada por 10 minutos y luego se adicionó 0,1 mL de veneno a concentraciones de 0,2 a 1 mg/mL, midiéndose los tiempos de coagulación en segundos. -
L-aminoácido oxidasa.
- Se determinó por el método descrito en el Worthington Enzyme Manual12. En 2,9 mL de buffer Tris HCl 0,2M pH 7,5 conteniendo L-Leucina 0,1% y O- dianisidina 0,0065%, se agregó 10 µL de peroxidasa al 0,001%. La mezcla se preincubó durante 5 minutos a 37 °C y luego se agregó 100µL de veneno registrándose el incremento de la absorbancia a 436 nm -
Fosfolipasa A2.-
Se empleó como sustrato 1,5 mL de una emulsión lipoproteica de yema de huevo al 45% en buffer Tris HCl 10 mM con CaCl2 10 mM a pH 7,4. Luego de adicionar 100 µL de veneno se preincubó por 10 minutos a 37 °C. Después la mezcla fue sometida a un baño de temperatura a 100 °C, midiéndose el retardo del tiempo de coagulación de la yema de huevo 13.
Pruebas de toxicidad y neutralización:
-
Cálculo de la DL50.- El veneno de B. atrox fue previamente evaluado para determinar su toxicidad calculándose su dosis letal 50 (DL50), es decir, la cantidad de veneno que produce la muerte de un 50% de ratones usados en el ensayo, en un lapso de 48 horas. Para ello se usaron lotes de seis ratones, a los cuales se les inoculó 0,2 mL de veneno disuelto en solución salina 0,9% a diferentes concentraciones por vía intraperitoneal. Los cálculos se efectuaron por el método computarizado de Probits14.
-
Preparación de los extractos.
- En el estudio se utilizó 10 plantas y con cada una se preparó tres tipos de extractos: extracto acuoso con agua destilada hervida y sin hervir e infusión. Para el primer caso, un gramo pulverizado de la planta en estudio se diluyó en 12 mL de agua destilada, sometiéndola a ebullición (100°C) por 10 minutos, luego que la muestra se enfrió fue filtrada con ayuda de una gasa para su utilización. Para el segundo caso, un gramo pulverizado de la planta en estudio se diluyó en 12 mL de agua destilada a temperatura ambiente y con ayuda de un mortero se preparó una mezcla que fue filtrada por medio de una gasa. Para el tercer caso, un gramo pulverizado de la planta en estudio se diluyó en 12 mL de agua destilada hirviente dejándose en reposo por 5 minutos. Luego que la muestra se enfrió fue filtrada por medio de una gasa como en los casos anteriores. -
Ensayos extracto-veneno.
- Para la prueba de neutralización con los extractos vegetales, se preparó diluciones equivalentes a 6 DL50 del veneno y se mezclaron (V/V) con los extractos en estudio, de modo que la muestra de veneno correspondiera a 3 DL50. Las mezclas fueron preincubadas por 30 minutos a 37 °C y luego se inoculó 0,2 mL a los ratones por vía intraperitoneal. Cada prueba se efectuó por triplicado, usándose ratones controles con: solución salina, veneno (3DL50) y extracto vegetal, respectivamente.
RESULTADOS Y DISCUSIÓN
-
Concentración proteica y análisis enzimático del veneno de Bothrops atrox De acuerdo con las técnicas usadas, se determinó que 1 mg de veneno de B. atrox tiene una densidad óptica a 280 nm de 1,2 en tanto que la cantidad de proteína analizada por el método de Lowry, modificado por Loayza8, correspondió a un valor de 76,4% del peso total.
Por otro lado, el análisis electroforético del veneno en condiciones no reductoras
mostró 8 bandas con un rango de pesos moleculares de 56-12 kDa; mientras que en condiciones reductoras el número de bandas fue de 9 con un rango de 73-15 kDa (tabla 1). Estos resultados concuerdan con estudios previos en relación con esta ponzoña. Así, Mendoza et al.15 reportaron una cantidad de proteína equivalente a 1,3 unidades de absorbancia a 280 nm y 78% por el método de Lowry modificado8; mientras que en un estudio comparativo de varios venenos de diferentes regiones del mundo, Yarlequé et al 16 señalaron valores de 1,3 unidades de absorbancia a 280 nm y 68% de contenido proteico por Lowry. En relación con el análisis electroforético es conveniente aclarar el número de bandas proteicas encontradas, que en este caso fue de 8 y 9 en condiciones no reductoras y reductoras, respectivamente, las cuales pueden variar ligeramente con la edad de los individuos, el tipo y frecuencia alimentaria, así como la región geográfica17,18.
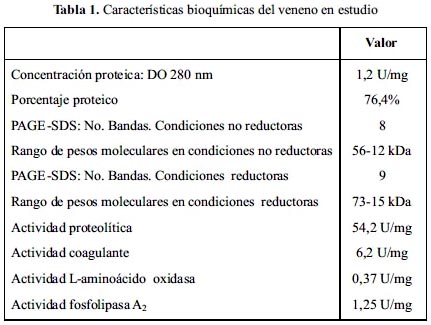
En cuanto a los ensayos enzimáticos con el veneno en estudio, los datos de la tabla 1 señalan la presencia de las cuatro enzimas exploradas en esta ponzoña. Los valores encontrados están en concordancia con datos previos reportados para este veneno, especialmente el trabajo de Ortiz et al.17. Asimismo, se ha reportado la variada sensibilidad de estas enzimas a la acción del antiveneno comercial equino producido por el INS-Perú; en el caso de la actividad proteolítica es la más resistente a la inhibición por el antiveneno botrópico polivalente mientras que, la actividad coagulante es fuertemente inhibida 19. Asimismo, la actividad de la L-aminoácido oxidasa fue inhibida casi en su totalidad con dos dosis del antiveneno botrópico, en tanto que con esta misma dosis sólo se alcanzó el 80% de inhibición para la fosfolipasa A del veneno de B. atrox 20.
-
Toxicidad del veneno.- Los cálculos de la DL50 establecieron un valor de 3,38 µg de veneno/g de ratón (18-20g) para el veneno de B. atrox. Estos valores fueron obtenidos al aplicar el método computarizado de Probits14, luego de efectuar las inoculaciones del veneno a diferentes concentraciones en ratones albinos y verificar la mortalidad a las 48 horas. García et al.21 reportaron, para este mismo veneno, una DL de 3,33 µg/g ratón. Asimismo, Segura et al.22, en un estudio de varios venenos del género Bothrops de Centro y Sudamérica, mostraron las variaciones de la DL50 en un rango de 21 a 76 µg y específicamente para B. atrox del Perú fue de 74 µg y para B. atrox de Colombia fue de 76 µg; estos últimos valores corresponden a una DL50 de 3,7 y 3,8 µ/g ratón, respectivamente. Por tanto, la toxicidad encontrada para el veneno en estudio está en relación con los valores reportados. Adicionalmente, es necesario indicar que para los estudios de neutralización con antivenenos comerciales, se utilizan los siguientes parámetros preclínicos: toxicidad, hemorragia, miotoxicidad, coagulación y defibrinogenación; ya que los venenos de vipéridos y potencialmente el de B. atrox poseen estas propiedades biológicas, aunque en grado variable15,16.
Acción neutralizante de los extractos.

Todos los ratones inoculados con el extracto acuoso sin hervir de las 10 plantas en estudio, murieron en un tiempo máximo de 27 horas, al igual que los inoculados con el extracto tipo infusión a excepción de los obtenidos con Cordia nodosa y Philodendro ernestii.
Con respecto al extracto hervido los ratones inoculados con Dracontium sp., Philodendro ernestii y Philodendron sp. sobrevivieron a las 48 horas y en los otros casos murieron en tiempos de cero a 48 horas (tabla 3).
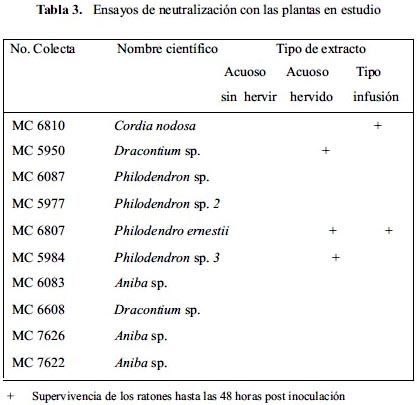
El análisis post mortem mostró una severa hemorragia, tanto en los ratones inyectados con veneno y también con las mezclas de extracto más veneno, inclusive aquellos que sobrevivieron a las 48 horas.
Estas pruebas efectuadas demuestran que si bien es cierto los extractos ya indicados poseen capacidad neutralizante sobre la toxicidad del veneno de B. atrox, dicha capacidad es relativa puesto que, en todos los casos, se producen daños internos severos y por tanto la supervivencia a las 48 horas sólo sería un índice de retardo en el efecto tóxico. Los datos señalados por los miembros de las comunidades nativas acerca de la utilidad de plantas ofídicas en el tratamiento de los accidentes deberían ser considerados entonces en el sentido de retrasar el grado de envenenamiento y por ende el efecto letal del veneno, lo que podría dar lugar a un mayor tiempo para que el paciente pueda ser atendido con el antiveneno específico en un servicio de salud. Teniendo en cuenta que Morante et al.4 reportaron la reducción de la actividad hemorrágica y mionecrosis por el uso de extracto de Dracontium sp y que en esta investigación Dracontium loretense aparece entre las plantas con acción neutralizante, es importante considerar la necesidad de un estudio profundo, no sólo sobre las cuatro plantas que neutralizan la toxicidad del veneno sino, en particular, sobre D. loretense que, al parecer, es la más promisoria en este tipo de trabajo.
CONCLUSIONES
Tomando como punto de partida la información ancestral de comunidades nativas del departamento de Ucayali sobre plantas con posible acción antiofídica, en la presente investigación se ha podido determinar la capacidad de los extractos hervidos e infusión de Dracontium sp., Philodendro ernestii, Philodendron sp. y Cordia nodosa para neutralizar el envenenamiento experimental con el veneno de B. atrox . Sin embargo, este efecto neutralizante está dirigido a retardar el cuadro de envenenamiento, lo que podría ser una ventaja a favor de la víctima de un accidente ofídico para su tratamiento con el antiveneno comercial.
AGRADECIMIENTOS
Los autores agradecen al VRI-UNMSM por su apoyo en la ejecución de este trabajo a través de un proyecto multidisciplinario.
BIBLIOGRAFÍA
1. Yarlequé A. Las serpientes peruanas y sus venenos. Lima Perú: Fondo Editorial UNMSM; 2000.
2. Zavaleta A. Mordedura de serpiente (ofidismo): Un problema de salud en el Perú. Rev Med Hered. 2004;15(2):61-63.
3. Mendoza J, Vivas D, Rodríguez E, Inga R, Sandoval G, Lazo F, Yarlequé A. Eficacia experimental de anticuerpos IgY producidos en huevos, contra el veneno la serpiente peruana Bothrops atrox. Rev Perú Med Exp Salud Pública 2012; 29(1): 69-75.
4. Morante HY, Málaga O, Yarlequé A; Clavo Z, Millán B. Antídotos naturales: Investigación preliminar sobre extracto vegetal neutralizante de veneno de serpientes. Lima - Perú: Informe del Proyecto al Consejo Nacional de Ciencia y Tecnología. Programa de Apoyo al Investigador.1988.
5. Lovera A, Bonilla C, Hidalgo J. Efecto neutralizador del extracto acuoso de Dracontium loretense (jergón sacha) sobre la actividad letal del veneno de Bothrops atrox. Rev Perú Med Exp Salud Pública 2006; 23(3):177-181
6. Clavo ZM, Seijas Z, Alegre J. Plantas medicinales usadas por mujeres nativas y mestizas en la región Ucayali. Pucallpa, Perú: IVITA-INIA-ICRAF 2003.
7. Mejía K, Rengifo E. Plantas medicinales de uso popular en la Amazonía Peruana. Lima- Perú: Agencia Española de Cooperación Internacional; 2000
8. Loayza S, Morante HY, Campos S, Yarlequé A. Enzimas proteolíticas en el veneno de la serpiente peruana Lachesis muta y Bothrops atrox.
Bol. Soc Quím Perú 1985; 52(#):151-163.9. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 1970; 227 (5259):680-685.
10. Takahashi T, Ohsaka A. Purification and characterization of a proteinase in the venom of Trimeresurus flavoviridis. Complete separation of the enzyme from hemorrhagic activity. Biochim Biophys Acta 1970; 198(2): 293-307.
11. Oshima G,Sato-Ohmori T, Suzuky T. Proteinase, argininester hydrolase and a kinin releasing enzyme in snake venoms. Toxicon 1969; 7(3): 229-233.
12. Worthington Biochemical Corporation. L-amino acid oxidase. The Worthington Enzymes Manual. Enzymes related Biochemicals. New Jersey 1993.
13. Vidal JC, Stoppani AO. Isolation and purification of two phospholipases A from Bothrops venom. Arch Biochem Biophys 1971; 145(2): 543-555.
14. Castro de la Mata R, Zavaleta Martínes-Vargas A. Programa en "Basic" para el cálculo de la DL50 por el método de Probits. Rev Med Exp 1998; 15(1/2): 45-54.
15. Mendoza JC, Vivas D, Inga R, Arbaiza E, Rodríguez E, Yarlequé A. Patrones electroforéticos de los venenos de serpientes peruanas de los géneros Bothrops sp. Y Lachesis sp. Rev. Soc. Quím. Perú 2009; 75(2): 235-42.
16. Yarlequé M, Ortiz C, Morante H, Yarlequé A. Estudio comparativo de algunas propiedades bioquímicas de venenos de serpientes de diferentes regiones del mundo. Rev. Soc Quím Perú 2012; 78(1):27-36
17. Ortiz C, Lazo F, Bellido C, González E, Yarlequé A. Variaciones en las actividades enzimáticas del veneno de la serpiente Bothrops atrox "jergón", de tres zonas geográficas del Perú. Rev. Perú Med Exp Salud Pública 2012; 29(2): 198-205.
18. Málaga O, Pantigoso C, Morante Y, Heredia V, Cárdenas J, Yarlequé A. Variaciones de la composición proteica, actividades enzimáticas y biológicas del veneno de la serpiente Bothrops atrox (vipéridae) en relación a la edad. Rev Perú Biol 2000; 7(2): 161-170.
19. Yarlequé A, Vivas D, Inga R, Rodríguez E, Sandoval G, Pessah S, Bonilla C. Acción del antiveneno botrópico polivalente sobre las actividades proteolíticas presentes en los venenos de serpientes peruanas. Rev Med Exp Salud Pública 2008; 25(2): 169-173.
20. Mendoza J, Lazo F, Yarlequé L, Ruiz N, Yarlequé A, Pessak S, Flores V, Bonilla C. Efecto del antiveneno botrópico sobre las actividades de fosfolipasa A2, L- aminoácido oxidasa y hialuronidasa de los venenos de serpientes peruanas. Rev Med Exp Salud Pública 2008; 25(2): 174-178
21. García P, Yarlequé A, Bonilla C, Pessah S, Vivas D, Sandoval G, Lazo F. Características Bioquímicas y evaluación preclínica de un antiveneno botrópico liofilizado contra el veneno de la serpiente Bothrops atrox. Rev Med Exp Salud Pública 2008; 25(4): 386-390.
22. Segura A, Castillo M, Núñez N, Yarlequé A, Gonçalves L, Villalta M, Yano MY, Araujo HP, Boller MA, León P, Tintaya B, Sano-Martins JS, Gómez A, Fernández GP, Geoghegan P, Higashi HG, León G, Gutiérrez JM. Pre-clinical assessment of the neutralizing capacity of antivenoms produced in six Latin American countries against medically-relevant Bothrops snake venoms. Toxicon 2010; 56(6): 980 - 989.
Recibido el 13-09-2012
Aprobado el 11-10-2012













