Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.78 no.4 Lima Oct./Dec. 2012
TRABAJOS ORIGINALES
Síntesis y estructura cristalina de dos complejos de coordinación de plomo (II) con 1,10-fenantrolina y nitratos
Synthesis and crystal structure of two lead (II) complexes with 1,10-phenathroline ligand
Fiorella L. Olivera1 , Guillermo A. Santillán1*
1 Laboratorio de Química de Coordinación y Materiales, Laboratorios de Investigación y Desarrollo, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia, Lima, Perú.
* Autor de correspondencia: guillermo.santillan.z@upch.pe, Av. Honorio Delgado 430, San Martín de Porres, Lima, Perú, Tel +51 13190000 Anexo 2403.
RESUMEN
Se ha sintetizado dos complejos de coordinación mediante la reacción del nitrato de plomo (II) con la 1,10-fenantrolina en una mezcla de solventes (1:1) metanol/agua. Los cristales de estos complejos fueron obtenidos usando el método de difusión y caracterizados estructuralmente por difracción de rayos X. Ambos complejos cristalizaron en el grupo espacial monoclínico P21/c. El análisis mediante difracción de rayos X muestra que en ambos complejos, la coordinación alrededor del ion plomo (II) es una estructura octaédrica distorsionada, donde el ion está unido a dos átomos de nitrógeno de la 1,10-fenantrolina, a tres átomos de oxígeno de los tres grupos nitrato y a un oxígeno de la molécula de agua. La diferencia entre los complejos radica en el modo de coordinación del ion nitrato cuando están presentes ácidos carboxílicos aromáticos. Debido al modo de coordinación de los nitratos, los complejos de plomo forman diferentes polímeros de coordinación, interacciones Pb-O, puentes de hidrógeno e interacciones π-π.
Palabras clave: complejos de plomo (II); 1,10-fenantrolina; coordinación por nitratos; puentes de hidrógeno; interacciones π-π; polímeros de coordinación.
ABSTRACT
Two coordination complexes have been synthesized by the reaction of lead nitrate (II) with 1,10-phenanthroline in methanol/water. The crystals of these complexes were obtained by using the diffusion method and structurally characterized by X–ray single crystal diffraction. Both complexes crystallized in the monoclinic space group P21/c. The analysis by crystal X-ray diffraction reveals that in both complexes the coordination around the lead (II) ion is a distorted octahedral structure where the ion is bonded to the heterocyclic nitrogen atoms of chelating ligand 1,10-phenanthroline, three oxygen atoms of three nitrate groups and one oxygen from the water molecule. The difference between the complexes lies in the way of nitrate ion in presence of carboxylic acid aromatics. In addition, the crystal structure of complexes can be regarded as a 3D coordination polymer through Pb-O weak interactions, hydrogen bonds and π-π stacking interactions.
Key words: Lead (II) complex; 1,10–phenanthroline; nitrate coordination; hydrogen bonding; π-π stacking interaction; coordination polymers.
INTRODUCCIÓN
En la actualidad existe un gran interés en el desarrollo de nuevos polímeros de coordinación debido a sus potenciales aplicaciones en diferentes áreas, como magnetismo molecular,1–3 conductividad electrónica,4 química supramolecular,5–8 sensores9 y propiedades ópticas.10 La construcción de estos nuevos compuestos se da a partir de centros metálicos conectados a través de ligandos orgánicos; además, involucra interacciones covalentes11 o contactos supramoleculares (como puentes de hidrógeno y/o interacciones π-π
),12 los cuales permiten que se extiendan a varias dimensiones.13,14 Los ligandos que contienen grupos carboxilos y nitrógenos heterocíclicos han sido ampliamente usados en el desarrollo de complejos de coordinación.15,16 En la actualidad, la capacidad para predecir y controlar las interacciones metal–ligando y producir polímeros de coordinación, es todavía un gran reto por lo que se requiere mayor investigación.Los compuestos de coordinación de plomo (II) han sido considerablemente estudiados debido a que este metal tiene aplicaciones en aditivos, baterías, minería y soldadura.16 El plomo, al ser un metal pesado y estar presente en diferentes procesos industriales, es uno de los 10 principales contaminantes ambientales en el mundo.17 La mayor parte de los casos de intoxicación por plomo, ya sea por inhalación o ingestión, se da por exposición a la especie catiónica de plomo (II).18,19 Un estudio más amplio de los compuestos de coordinación de plomo (II) permitiría determinar qué ligandos son selectivos y estables en su unión a este metal. A su vez, estos ligandos podrían ser usados en la detección y cuantificación del ion plomo (II).20
En la actualidad, se ha desarrollado numerosos complejos de coordinación de plomo (II) con ligandos que contienen átomos de nitrógeno heterocíclico debido a su afinidad con metales blandos.21-24 Uno de estos ligandos es la 1,10–fenantrolina, que posee una gran capacidad para quelarse. Además, tiene una alta solubilidad en medio acuoso y baja toxicidad.25 Debido a las propiedades mencionadas anteriormente, este ligando es factible para ser usado en la detección y captación del ion plomo (II) en medio acuoso.
En el presente trabajo se ha demostrado que el ion plomo (II) con la 1,10–fenantrolina y el ion nitrato pueden formar dos complejos de coordinación diferentes en presencia de distintos tipos de ácidos carboxílicos: ácido gálico, ácido salicílico y ácido p–nitrobenzoico, manteniendo las demás condiciones constantes, como pH, temperatura, anión y solvente. A su vez, estos ácidos aceleran de manera significativa la velocidad de cristalización de los complejos.
PARTE EXPERIMENTAL
Materiales
Todos los experimentos fueron realizados en condiciones ambientales T= 25°C, P = 1 atm. Las sales de nitrato de plomo (II) y el ácido gálico fueron adquiridos de Merck; el ácido salicílico de Riedel de Haen; la 1,10–fenantrolina de Mallinckrodt, y el ácido p–nitrobenzoico de Aldrich.
[Pb(phen)(NO3)2H0O]n (1)
La solución metanólica de 1,10–fenantrolina (270,17 mg, 1,5 mmol) se agregó por difusión (gota a gota) a una solución acuosa de Pb(NO3)2 (563,06 mg, 1,7 mmol). A la solución resultante se le agregó por difusión la solución metanólica de ácido gálico (204,20mg, 1,2 mmol). Se obtuvo cristales incoloros luego de 1 hora, aproximadamente, con un rendimiento del 58 %. Estos complejos también se pueden obtener reemplazando el ácido gálico por el ácido salicílico.
[Pb(phen)(NO3)2H2O]n (2)
Este complejo se preparó de manera análoga al complejo 1, pero se utilizó ácido p–nitrobenzoico en lugar del ácido salicílico o ácido gálico. Se obtuvo cristales incoloros luego de 1 hora, aproximadamente. El rendimiento de la reacción fue del 64 %.
Métodos físicos
Cristalografía de rayos-X
Los cristales de los complejos 1 y 2 fueron montados en loops de nylon usando aceite Paratone (Hampton Research) y puestos en el vapor frío (200–240 K) del difractrómetro Bruker X8 APEX CCD que opera a 50 k V y 30 m
Å usando una radiación de Mo-Kα (λ = 0,71073). Las estructuras fueron resueltas usando métodos directos o por la función de Patterson; se completaron con la función de Fourier y fueron refinados usando el método de mínimos cuadrados en F2. Todos los átomos que no son hidrógenos fueron refinados usando los coeficientes de desplazamiento anisotrópicos. Los átomos de hidrógenos fueron tratados como contribuciones idealizadas usando un modelo de conducción. Todos los cálculos fueron realizados usando el paquete de software cristalográfico SHELXTL 5.1 (G.Sheldrick, Siemns XRD, Madison, WI). Los datos cristalográficos y los parámetros de refinamiento son presentados en la tabla 1.
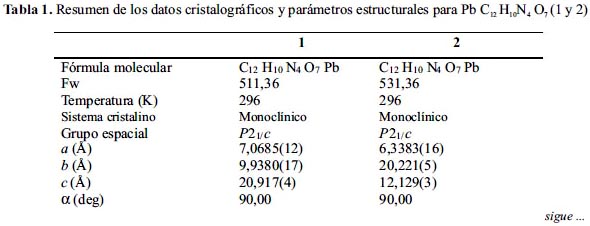
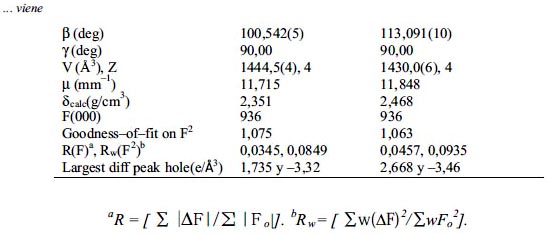
RESULTADOS
Síntesis y caracterización
El primer complejo se obtuvo de la reacción del nitrato de plomo (II) con la 1,10–fenantrolina y ácido gálico, usando como solvente una mezcla (1:1) metanol/agua. Cabe señalar que este mismo resultado se obtiene reemplazando el ácido gálico por ácido salicílico. El complejo obtenido tiene la fórmula C12 H10 N4 O7 Pb. En cambio, el segundo complejo se obtuvo con el procedimiento anterior pero reemplazando el ácido gálico o ácido salicílico por ácido p–nitrobenzoico. No obstante la fórmula química de este complejo es similar al complejo anterior, existen marcadas diferencias en los modos de coordinación de los ligandos. La disposición de los ligandos en la esfera de coordinación del plomo es completamente diferente. Estas diferencias en los modos de coordinación producen diferentes polímeros de coordinación: en el primer complejo están unidos por grupos nitrato y en el segundo complejo están unidos por interacciones intermoleculares, tales como puentes de hidrógeno e interacciones π-π. Adicionalmente, se ha observado que la adición de ácido carboxílico acelera en ambos casos la cristalización de los complejos.
Estructura del estado sólido y el empaquetamiento cristalino
[Pb(phen)(NO3)2H2O]n (1)
Las distancias y ángulos de enlace seleccionados para este polímero de coordinación se muestran en la tabla 2, mientras que la figura 1 contiene el diagrama térmico elipsoidal probabilístico (ORTEP). El compuesto 1 cristaliza en el grupo espacial monoclínico P21/c. La estructura cristalina revela que la coordinación alrededor del ion plomo es una estructura octaédrica distorsionada, que se debe a la diferencia de las distancias de enlace del Pb-N y Pb- O, donde los cuatro átomos O1, O6, N1, y N2 son coplanares a la base plana. O2 y O7 son cercanos a la posición axial. El átomo central está unido a dos átomos de nitrógeno heterocíclico del ligando quelante 1,10–fenantrolina con longitudes de enlace Pb–N de 2,491 Å y 2,569 Å; tres átomos de oxígeno de los tres grupos nitrato coordinados en forma monodentada con distancias de Pb–O entre 2,725 Å y 2,747 Å y un oxígeno de la molécula de agua con una longitud de enlace de 2,445Å. Los ángulos de enlace alrededor del Pb (II) están en el rango de 65,92(13)° y 142,70(13)°. El ángulo diedro entre los planos del N1-Pb-O5 y O2-Pb-O3 es 85,77°.Además, de los enlaces de Pb-O mencionados anteriormente, hay tres interacciones Pb---O: Pb---O6 (2,973 Å), Pb---O5 (2,945 Å) y Pb---O7 (3,03 Å), donde las distancias de los enlaces Pb-O son demasiados largos para ser considerados como enlaces de coordinación, pero sí como interacciones débiles.
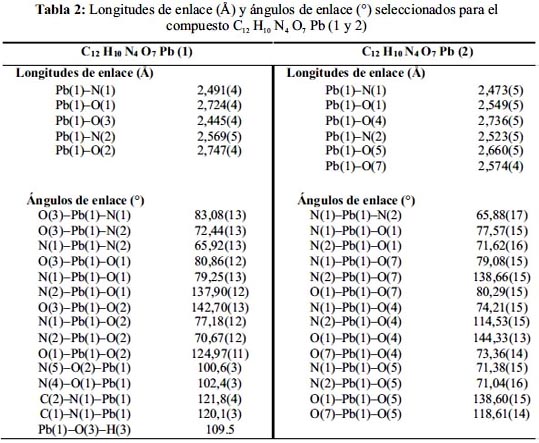
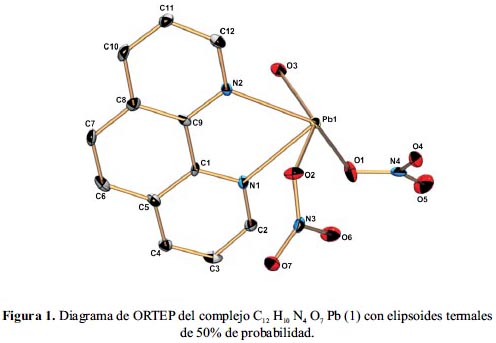
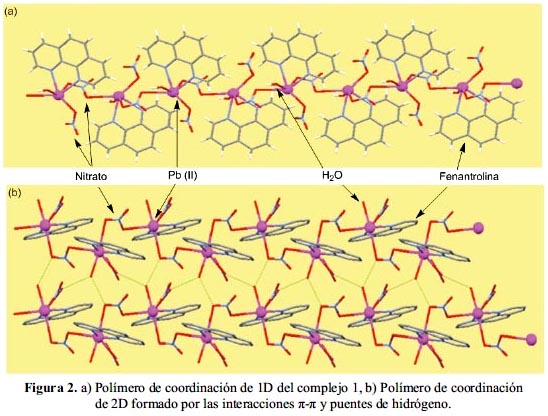
El empaquetamiento cristalino del complejo 1 muestra que las unidades que las conforman están unidas por los átomos O1, N3 y O3 del grupo nitrato, lo que resulta en la formación de una cadena de una dimensión (figura 2a). Existen otras interacciones débiles entre las unidades adyacentes del polímero de coordinación (figura 2b): a) Hay tres tipos de enlaces de puentes de hidrógeno en el compuesto: Una es la que proviene del átomo de oxígeno del grupo nitrato con el átomo de hidrógeno de la 1,10–fenantrolina ((NO3)O...H(C–phen)) con una distancia 2,54 Å. El otro, de un átomo de oxígeno del grupo nitrato y el átomo de hidrógeno de la 1,10-fenantrolina del otro átomo de plomo adyacente ((NO3)O...H(C–phen)) con una distancia 2,73 Å, y el tercero es el que proviene del átomo de oxígeno del grupo nitrato y el oxígeno de la molécula de agua ((NO3)O...H(H2O)) con una distancia 2,145 Å. b)
Interacciones π-π que se forman debido al solapamiento de los orbitales p del sistema π conjugado de la 1,10-fenantrolina con una distancia 4,25 Å. Por lo tanto, la estructura cristalina tridimensional de este complejo se forma debido a las interacciones débiles Pb-O, interacciones puentes de hidrógeno y las interacciones π-π.
[Pb(phen)(NO3)2H2O]n (2)
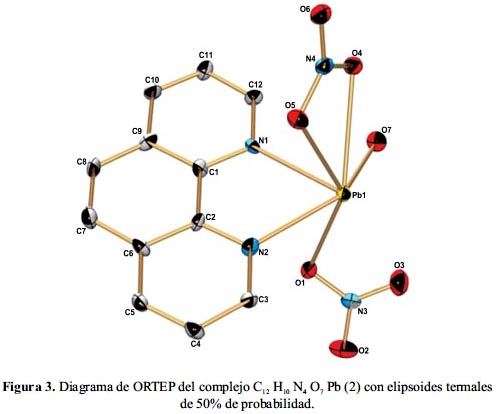
Las distancias y ángulos de enlace seleccionados para este polímero de coordinación se muestran en la tabla 2, mientras que la figura 3 contiene el diagrama térmico elipsoidal probabilístico (ORTEP). El compuesto 2 cristaliza en el grupo espacial monoclínico P21/c. La estructura cristalina revela que la coordinación alrededor del ion plomo es una estructura octaédrica distorsionada. Donde el átomo central está unido a los átomos de nitrógeno heterocíclico del ligando quelante 1,10–fenantrolina con longitudes de los enlaces Pb–N de 2,473 Å y 2,523 Å, con tres átomos de oxígeno de los aniones nitrato con longitudes de enlace Pb-O de 2,54 Å, 2,659 Å y 2,736 Å; y un átomo de oxígeno de la molécula de agua con una longitud de enlace de Pb-O de 2,574 Å. Es importante mencionar que los dos aniones nitratos muestran dos modos de coordinación diferentes: Mientras que un nitrato está coordinado de forma monodentada, el otro nitrato lo hace de forma bidentada. El ángulo diedro entre los planos del N2-Pb1-O7 y el O5-Pb1-O1 es 61,87°.
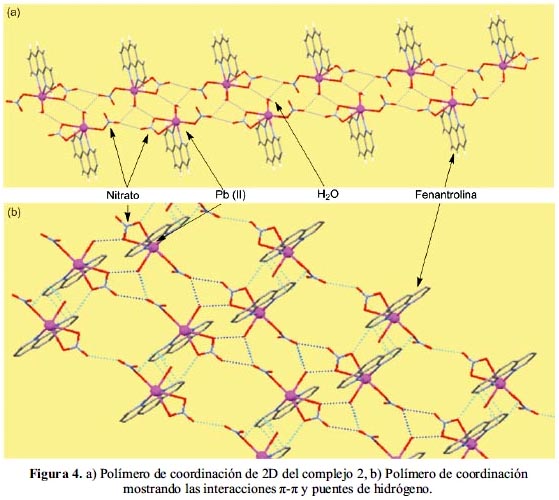
El empaquetamiento cristalino del complejo 2 consiste en: Primero, la presencia de dos interacciones débiles entre los átomos de plomo y los átomos de oxígeno de los aniones nitrato entre dos celdas unitarias adyacentes. Cada átomo de plomo forma dos enlaces débiles Pb---- O, donde las distancias del enlace del Pb con el oxígeno del mismo monómero es 2,981 Å y con el oxígeno bidentado del otro monómero es 3,096 Å. Segundo, los puentes de hidrógeno ocurren entre el hidrógeno de la molécula de agua y el átomo de oxígeno (O3) del anión nitrato monodentado con una longitud de enlace de O_H---O de 2,865(6) Å (figura 4a). Las interacciones
π-π entre los anillos, paralelos entre sí, es de 3,51(6) Å (figura 4b). Por lo tanto, debido a la presencia de enlaces de hidrógeno e interacciones π-π, se forma un polímero de coordinación de tres dimensiones.
DISCUSIÓN
Tratemos de encontrar una explicación razonable de porqué los ligandos en los complejos de coordinación de plomo se distribuyen espacialmente de forma diferente. La teoría del par inerte, el cual se refiere la resistencia del par de electrones del último nivel de energía en el plomo (II) para ser removidos o participar en la formación de enlaces covalentes, resulta ser una explicación razonable. Este par de electrones no compartidos puede causar una distribución de carga no esférica alrededor del plomo (II); esto es, la disposición de los ligandos alrededor del catión resulta en un espacio vacío identificable, por lo que la geometría de coordinación alrededor del plomo muestra dos estructuras distintas: holodireccionado y hemidireccionado.26
Ambos complejos de plomo presentan una geometría hemidireccionada; ya que poseen un número de coordinación seis y tienen ligandos que presentan átomos donadores como oxígeno y nitrógeno. Además, las estructuras hemidireccionadas están favorecidas cuando los átomos del ligando están conectados uno con otro; como es el caso de 1,10-fenantrolina.
La distorsión que presenta el complejo 1 debido a las diferentes distancias en los enlaces Pb-O y Pb-N se debe a la presencia del par de electrones no compartidos del ion plomo (II). Además, la disposición del ligando 1,10-fenantrolina y los dos aniones nitrato con ángulos de enlace de O(2)---Pb(1)---O(1), O(1)---Pb(1)---O(8) de 124,97(11)° y 130,35°, respectivamente, sugiere la presencia de un espacio que es ocupado por el par de electrones no compartidos. Por otro lado, en el complejo 2 la disposición del ligando 1,10-fenantrolina y los dos aniones nitrato (en posición trans) O(1)---Pb(1)---O(4), O(1)---Pb(1)---O(5) con ángulos de 144,33(13)° y 138,60(15)°, respectivamente, sugieren también la presencia de un espacio ocupado por el par de electrones no compartidos en el plomo(II); ésta podría ser la razón por lo que las interacciones entre el átomo de plomo y de oxígenos de los grupos nitratos adyacentes no sean tan fuertes. El conocimiento de los factores que afectan la geometría de coordinación del ion plomo (II) puede ser beneficioso para diseñar agentes complejantes que permitan remover al ion plomo divalente y lo distingan de otros iones metálicos.
La cristalización de estos complejos se lleva a cabo de una forma sorprendentemente rápida. Esta metodología de cristalización resulta novedosa y se realiza usando los ácidos carboxílicos aromáticos sustituidos, que inicialmente se pretendía usar como ligandos. En el primer caso se ha reportado que el complejo se obtiene bajo las mismas condiciones sin la presencia del ácido carboxílico en seis días25 mientras que en nuestro método se obtienen cristales en una hora, aproximadamente. Con respecto al segundo complejo se ha descrito la síntesis en condiciones diferentes; estas condiciones requieren usar ácido tricloroacetico, hidróxido de sodio y como solvente agua. Dicha mezcla fue llevada a un recipiente de acero inoxidable y sometida a una temperatura de 170 °C por cuatro días, para luego ser enfriada lentamente a 6°C/hora.27 En nuestro caso los cristales fueron obtenidos a temperatura ambiente en una hora, aproximadamente.
Es interesante notar que, aunque las condiciones en las cuales se llevó las reacciones para la formación de ambos complejos, son similares i.e. solvente, pH, temperatura, sólo la diferencia de coordinación está dictada por la presencia de los ácidos carboxílicos en la solución. Para el primer complejo se usó el ácido gálico o ácido salicílico, y en el segundo caso se usó el ácido p- nitrobenzoico. Resulta interesante y, a su vez difícil de explicar, cómo estos ácidos carboxílicos influyen en el modo de coordinación de los iones nitrato y la disposición de la fenantrolina en la esfera de coordinación del plomo (II). En el primer complejo, el ácido gálico tiene sustituyentes en posición orto, meta y para; y el ácido salicílico sólo sustituyentes en posición orto, por lo que los sustituyentes en posición orto podrían explicar la coordinación en el complejo 1. Por otro lado, en el caso del complejo 2 el ácido utilizado presenta sustituyentes en posición para; lo cual podría explicar la diferencia de coordinación en este segundo complejo.
CONCLUSIONES
En este trabajo, dos complejos de coordinación de plomo (II), fueron sintetizados y caracterizados por difracción de rayos-X. Los complejos 1 y 2 muestran diferentes estructuras poliméricas, las cuales están sostenidas mediante interacciones débiles de Pb-O, puentes de hidrógenos e interacciones π-π. Además, ambos complejos presentan una geometría octaédrica hemidireccionada debido a la presencia del par de electrones no compartidos del átomo de plomo (II). Se ha reportado una nueva metodología de cristalización en base a la presencia de ácidos carboxílicos aromáticos sustituidos a temperatura ambiente, pH ácido y solvente polar. Está claro que la rapidez en la cristalización y el modo de coordinación de los iones nitratos en estos complejos de plomo está influenciado por la naturaleza de los ácidos carboxílicos aromáticos sustituidos en la solución.
AGRADECIMIENTO
Los autores de este estudio agradecen a la Ph.D. Gina M. Chiarella del Departamento de Química de la Universidad de Texas A & M por los análisis de los cristales por difracción de rayos X y al Departamento de Química, Facultad de Ciencias de la Universidad Peruana Cayetano Heredia por el uso de los materiales y reactivos.
BIBLIOGRAFÍA
1. Caneschi, A.; Gatteschi, D.; Lalioti, N.; Sengregorio, C. Cobalt(II)-Nitronyl Nitroxide Chains as Molecular Magnetic Nanowires. Angew. Chem., Int. Ed. 2001; 40(9): 1760-1763.
2. Clerac, R.; Miyasaka, H.; Yamashita, M.; Coulon, C. Evidence for Single-Chain Magnet Behavior in a MnIII- NiII Chain Designed with High Spin Magnetic Units: A Route to High Temperature Metastable Magnets. J. Am. Chem. Soc. 2002; 124(43): 12837-12844.
3. Ichikawa, S.; Kimura, S.; Mori, H.; Yoshida, G.; Tajima, H. Antiferromagnetic Interaction Achieved by a 3-D Supramolecular CuII Complex with Pyrazino-Fused TTF as the Ligand, [CuCl2(BP-TTF)]. Inorg. Chem. 2006, 45(19): 7575-7577.
4. Kitagawa, H.; Onodera, N.; Sonoyama, T.; Yamamoto, M.; Fukawa, T.; Mitani, T.; Seto, M.; Maeda, Y. Charge Ordering with Lattice Distortions in a Conductive MMX-Chain Complex, Pt (dta) I (dta = CH CS -). J. Am. Chem. Soc.1999; 121(43): 10068-10080.
5. Albrecht, M.; Janser, I.; Burk, S.; Weis, P. Self-assembly and host–guest chemistry of big metallosupramolecular M4L4 tetrahedra. Dalton Trans. 2006; 23: 2875-2880.
6. Seeber, G.; Tiedemann, B.; Raymond, K. N. Supramolecular Chirality in Coordination Chemistry. Top. Curr. Chem. 2006; 265: 147-183.
7. Leung, D. H.; Bergman, R. G.; Raymond, K. N. Scope and Mechanism of the C- H Bond Activation Reactivity within a Supramolecular Host by an Iridium Guest: A Stepwise Ion Pair Guest Dissociation Mechanism. J. Am. Chem. Soc. 2006; 128(30): 9781-9797.
8. Yeh, R. M.; Raymond, K. N. Supramolecular Asymmetric Induction in Dinuclear Triple- Stranded Helicates. Inorg. Chem. 2006; 45(3): 1130-1139.
9. Wuerthner, F.; You, C.; Saha-Moeller, C.; Chantu, R. Metallosupramolecular squares: from structure to function. Chem. Soc. Rev. 2004; 33(3): 133-146.
10. Evans, O. R.; Lin, W. Crystal Engineering of NLO Materials Based on Metal- Organic Coordination Networks. Acc. Chem. Res. 2002; 35(7): 511-522
11. (a) Fujita, M.; Kwon, Y. J.; Washizu, S. Ogura, K. Preparation, clathration ability, and catalysis of a two-dimensional square network material composed of cadmium(II) and 4,4-bipyridine.J. Am. Chem. Soc. 1994; 116(3): 1151-1152; (b) Fan, Y. T.;Li, G.; Li, Z. F.; Hou, H. W.; Mao, H. R. Synthesis, structure and third-order nonlinear optical properties of 1,3,5-triazine-based Zn(II) three-dimensional supramolecule. J. Mol. Struct. 2004; 693: 217-224; (c) Ding, D. G.; Yin, M. C.; Lu, H. J.; Fan, Y. T.;Hou, H. W.; Wang, Y. T. A novel copper diphosphonate complex Cu4(aedp)2(4,4´-bpy)(H2O)4 with three- dimensional framework structure. J. Solid State Chem. 2006; 179 (3): 747-752.
12. Hagrman, P. J.; Hagrman, D.; Zubieta, J. Organic-inorganic hybrid materials: from "Simple" coordination polymers to organodiamine-templated molybdenum oxides. Angew. Chem., Int. Ed. 1999; 38 (18): 2639-2684.
13. Holliday, B. J.; Mirkin, C. A. Strategies for the Construction of Supramolecular Compounds through Coordination Chemistry. Angew. Chem., Int. Ed. 2001; 40(11): 2022-2043.
14. Moulton, B.; Zaworotko, M. From Molecules to Crystal Engineering: Supramolecular Isomerism and Polymorphism in Network Solids. J. Chem. Rev. 2001; 101(6): 1629-1658.
15. Steel, P. J. Ligand Design in Multimetallic Architectures: Six Lessons Learned. Acc. Chem. Res. 2005; 38(4): 243-250.
16. Eddaoudi, M.; Moler, D. B.; Li, H.; Chen, B.; Reineke, T. M.; O'Keeffe, M.; Yaghi, O. M. Modular Chemistry: Secondary Building Units as a Basis for the Design of Highly Porous and Robust Metal- Organic Carboxylate Frameworks. Acc. Chem. Res. 2001; 34(4): 319-330.
17. (a) Magyar, J. S.; Weng, T. C.; Stern, C. M.; Dye, D. F.; Rous,B. W.; Payne, J. C.; Bridgewater, B. M.; Mijovilovich, A.; Parkin, G.; Zaleski, J. M.; Penner-Hahn, J. E.; Godwin, H. A. Reexamination of Lead(II) Coordination Preferences in Sulfur-Rich Sites: Implications for a Critical Mechanism of Lead Poisoning. J. Am. Chem. Soc. 2005; 127(26): 9495-9505. (b) Ghering, A. B.; Jenkins, L. M. M.; Schenck, B. L.; Deo, S.; Mayer, R. A.; Pikaart, M. J.; Omichinski, J. G.; Godwin, H. A. Spectroscopic and Functional Determination of the Interaction of Pb2+ with GATA Proteins. J. Am. Chem. Soc. 2005; (11):127, 3751-3759. (c) Payne, J. C.; Horst, M. A.; Godwin, H. A. Lead Fingers:?Pb2+ Binding to Structural Zinc-Binding Domains Determined Directly by Monitoring Lead- Thiolate Charge-Transfer Bands. J. Am. Chem. Soc. 1999; 121(29): 6850-6855. (d) Fan, S.-R.; Zhu, L.-G. Influence of the Reaction Conditions on the Self- assembly of Lead(II) 5-Sulfosalicylate Coordination Polymers with Chelating Amine Ligands. Inorg.Chem. 2006; 45(19); 7935-7942. (e) Fan, S.-R.; Zhu, L.-G. Syntheses, Structures, and Characterizations of Four New Lead(II) 5-Sulfosalicylate Complexes with both Chelating and Bridging Neutral Ligands. Inorg. Chem. 2007; 46(16): 6785-6793.
18. Spiro, T. G.; Stigliani, W. M. Chemistry of the Environment; Prentice Hall: Upper Saddle River, NJ, 1996.
19. Kessel, I.; O'Connon, J. T. Getting the lead out: the complete resource on how to prevent and cope with lead poisoning; Plenum Press: New York, 1997.
20. Claudio, E. S.; Horst, M. A.; Forde, C. E.; Stern, C. L.; Zart, M. K.; Godwin,H. A.207Pb-1H Two-Dimensional NMR Spectroscopy: A Useful New Tool for Probing Lead (II) Coordination Chemistry. Inorg. Chem. 2000; 39(7): 1391-1397.
21. (a) Mao, J.-G.; Wang, Z.-K.; Clearfield, A. New Lead Inorganic- Organic Hybrid Microporous and Layered Materials: Synthesis, Properties, and Crystal Structures. Inorg. Chem. 2002; 41(23): 6106-6111. (b) Sui, B.; Zhao, W.; Ma, G.; Okamura, T.; Fan, J.; Li, Y. Z.;Tang, S. H.; Sun,W. Y.; Ueyama, N. Novel Pb(II) coordination frameworks: synthesis, crystal structures and unusual third-order nonlinear optical properties. J. Mater. Chem. 2004; 14(10): 1631-1639.(c) Buston, J. E. H.; Claridge, T. D. W.; Heyes, S. J.; Leech, M. A.;Moloney, M. G.; Prout, K.; Stevenson, M. Structural investigations of a lead(IV) tetraacetate-pyridine complex. Dalton Trans. 2005; 19: 3195.
22. Li, H. H.; Chen, Z. R.; Li, J. Q.; Huang, C. C.; Zhao, B.; Ni, Z. X. Lewis-base adducts of lead(II) compounds: synthesis, structure and quantum chemistry calculation of mononuclear Pb(phen)(SCN)2. Chin. J. Struct. Chem. 2005; 24(1): 39-43.
23. Yang, B. P.; Sun, Z. M.; Mao, J. G. Syntheses, characterizations and crystal structures of two lead(II) diphosphonates:Pb2[NH(CH2PO3)2].2H2O and Pb3 [HO2C(CH2)3NH(CH2- PO3)2]2.2H2O. Inorg. Chim. Acta. 2004; 357(5): 1583-1588.
24. Wang, X. B.; Vittal, J. J. Self-assembly of a 1D helical coordination polymeric lead(II) complex with Pb--O(perchlorate)--Pb scaffoldings. Inorg. Chem. Commun. 2003; 6(8): 1074-1077.
25. Jin-An Zhao, Yu-Ling Wang, Yu-Ting Wang, Yao-Ting Fan, and Hong-Wei Hou, Syntheses, Crystal Structure and Characterizations of a New Lead (II) Coordination Compound [Pb(phen)(NO3)2(H2O)]n. J. Synthesis and Reactivity in Inorganic, Metal-Organic and Nano-Metal Chemistry, 2007; 37(2):109-113.
26. Liat Shimoni-Livny, Jenny P. Glusker, and Charles W. Bock, Lone Pair Functionality in Divalent Lead Compounds, J. Inorg. Chem. 1998; 37(8): 1853-1867.
27. Quanzheng Zhang and Canzhong Lu, Synthesis and characterization of a lead (II) complex [Pb(phen)(H2O)(NO3)2] (phen = 1,10-phenanthroline), Journal of Chemical
Crystallography. 2005; 35(10): 795-798.
Recibido el 23-10-2012
Aprobado el 30-10-2012













