Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.78 no.4 Lima Oct./Dec. 2012
REVIEW
Complejos de cinc como potenciales metalofármacos antidiabéticos: avances recientes en su desarrollo y mecanismo molecular de acción
Zinc complexes as potential antidiabetic metallopharmaceuticals: recent advances in its development and molecular mechanism of action
Zoila Moreano Villena1 , Nora Alvino De La Sota1 , Carla Galli Rigo-Righi1*
1* Sección Química. Departamento de Ciencias. Pontificia Universidad Católica del Perú. Av. Universitaria 1801 San Miguel. Lima-Perú. cgalli@pucp.edu.pe
RESUMEN
El descubrimiento del estrecho vínculo entre el cinc y la insulina propició numerosos estudios sobre los posibles efectos terapéuticos del cinc en el tratamiento de la diabetes mellitus. Se encontró así que la suplementación con cinc ejercía no solo un efecto normoglicémico sino una amplia acción insulinomimética, aparte de desempeñar un rol en la prevención de la enfermedad y en la protección de las células β encargadas de la producción de la insulina.
Las limitaciones de los fármacos antidiabéticos actuales, de origen orgánico, y el éxito clínico alcanzado por metalofármacos de uso anticancerígeno y antirreumático, estimularon las investigaciones orientadas al desarrollo de complejos de cinc que resultaran más efectivos que las sales originalmente usadas. En este artículo se presenta una revisión de complejos representativos de cinc con diversos modos de coordinación que han sido sintetizados y evaluados en su actividad insulinomimética, comprobándose que la complejación del cinc con ligandos orgánicos incrementa la efectividad a través de una mejora en la bioabsorción del agente activo. Se discute, además, la interrelación entre el metabolismo del cinc y la diabetes, así como los mecanismos moleculares a través de los cuales el cinc ejerce su efecto insulinomimético y protector de las células β.
Palabras clave: Diabetes mellitus, complejos de Zn(II), actividad insulinomimética, estudios in vitro e in vivo.
ABSTRACT
The discovery of the close link between zinc and insulin led to numerous studies on the potential therapeutic effects of zinc in the treatment of diabetes mellitus. It was found that zinc supplementation exerted not only a normoglycemic effect, but also a broader insulin-mimetic action besides of playing a role in disease prevention and protection of β cells, responsible for insulin production.
The limitations and side effects of organic drugs used in oral diabetes therapy on one side, and the clinical success achieved by several metallopharmaceuticals, such as anticancer and antirheumatic drugs on the other stimulated research directed to the development of antidiabetic zinc compounds, that would prove more effective at low doses and shorter treatment periods than the originally used simple salts. This article presents a review of representative zinc complexes, with different coordination modes that have been synthesized and evaluated for their insulin-mimetic activity to date; the results confirm that zinc complexation with organic ligands increases effectiveness through an improvement in the bioabsorption of the active agent. We also discuss the relationship between zinc metabolism and diabetes, as well as the molecular mechanisms through which zinc exerts its insulin- mimetic effect and protective role of β cells.
Key words: Diabetes, diabetes mellitus, Zn(II) complexes, insulinmimetic activity, in vitro and in vivo studies.
INTRODUCCIÓN
Una de las enfermedades con mayor incidencia en la población mundial actual es la diabetes mellitus (DM). El número de personas que padecen DM reportado para el 2003 fue 194 millones y se estima que esta cifra se incremente hasta aproximadamente el 4,4% de la población mundial o sea 366 millones para el 2030.1,2 Esta enfermedad se caracteriza por desórdenes en el metabolismo de la glucosa, proteínas y lípidos derivados de una absoluta (DM tipo 1) o relativa (DM tipo 2) deficiencia de la hormona reguladora insulina. Si bien es considerada una enfermedad crónica no mortal, debido a sus graves complicaciones micro y macro vasculares, representa la quinta causa de muerte en los países más desarrollados.
La diabetes mellitus tipo 1, es de carácter hereditario y causada por la destrucción de células pancreáticas responsables de la producción de la insulina; mientras que la tipo 2, además de una eventual predisposición genética, está relacionada con un estilo de vida sedentario, la obesidad, estrés y edad. El tratamiento de la DM tipo 1 involucra la aplicación de inyecciones diarias de insulina, mientras que para la DM tipo 2, aparte del ejercicio y una dieta especial, existen actualmente en el mercado diversos medicamentos orales de origen orgánico que controlan la hiperglicemia. Sin embargo, estas drogas adolecen de algunas limitaciones como pérdida progresiva de su acción terapéutica y diversos efectos secundarios como hipoglicemia, hepatotoxicidad, trastornos gastrointestinales y ganancia de peso.
De lo anterior, se deduce que existe una necesidad urgente de desarrollar nuevos medicamentos, no solo para el tratamiento de la DM sino también para mejorar la calidad de vida de los pacientes. En este contexto, el rol esencial de los iones metálicos y sus compuestos biomoleculares en el desarrollo y funcionamiento de los seres vivos estimuló un creciente interés en el campo de los metalofármacos con actividad antidiabética. Numerosas investigaciones han demostrado que una variedad de iones metálicos, entre ellos el tungsteno, cromo, magnesio, vanadio y cinc exhiben una considerable actividad insulinomimética (IM).3,4
Desde inicios de la década de los años 80 las investigaciones sobre la aplicación de metalofármacos al tratamiento de la diabetes se concentraron en el uso de compuestos de vanadio, y a partir del 2000 se han extendido de sales a complejos de cinc. Este metal posee una notoria ventaja sobre los demás, ya que se trata de un elemento esencial y ampliamente distribuido en todo organismo vivo como una gran variedad de biomoléculas, por lo que resulta menos tóxico que cualquier otro metal. Además, a diferencia del vanadio, posee un único estado de oxidación estable lo que facilita su estudio.
En 1980, Coulston y Dandona reportaron por primera vez la actividad insulinomimética del Zn(II), al demostrar que el cinc estimula, además, la lipogénesis en adipocitos de ratas.3. Por sucesivos estudios in vitro se comprobó que el cinc, al igual que la insulina, estimula la oxidación y el transporte de glucosa. Posteriormente se encontró que, la administración de ZnCl2 por vía intraperitoneal a modelos animales de DM tipos 1 y 2 producía una reducción considerable de los niveles de glucosa en sangre; sin embargo, se requerían dosis extremadamente altas y/o largos plazos de tratamiento.5
Desde el descubrimiento de Song y colaboradores (2001) de que la administración oral de cinc coordinado con ciclo(His-Pro) a modelos animales de diabetes tipo 1 producía una disminución más pronunciada de la hiperglicemia, que la de una sal de cinc, los estudios en este campo se orientaron hacia complejos de cinc con ligandos orgánicos.3 Estos compuestos han mostrado ser más efectivos que las sales de Zn(II) en términos tanto de absorción por el sistema gastrointestinal como de baja toxicidad. A partir de entonces se han sintetizado numerosos complejos de cinc con distintos ligandos y modos de coordinación, muchos de los cuales han resultado efectivos como agentes insulinomiméticos en estudios in vivo e in vitro. Esto, a su vez, ha estimulado la investigación del mecanismo molecular de acción del cinc y a la fecha se han logrado avances significativos que demuestran que el cinc actúa en múltiples puntos de la cascada enzimática de la insulina, lo cual se conoce como "mecanismo ensemble", además de cumplir un rol en la inhibición de la destrucción de las células β.5,6
CINC, INSULINA Y DIABETES: EFECTOS METABÓLICOS Y TERAPÉUTICOS DEL CINC
El cinc es el segundo oligoelemento más abundante en el organismo, superado tan sólo por el hierro. Es un elemento esencial en animales y humanos y un metal ubicuo en numerosas proteínas y metaloenzimas. Se presenta como cofactor en más de 300 enzimas implicadas en el metabolismo energético y de los hidratos de carbono, en las reacciones de biosíntesis como las de ácidos nucleicos y compuestos hemo, en degradación de proteínas, en el transporte de CO2, etc.6,7,8,9
En la figura 1 se presenta una visión general de los diversos roles fisiológicos y bioquímicos del cinc en células y órganos. Además, se ha encontrado que posee importantes funciones farmacéuticas, entre ellas cabe destacar su actividad antidiabética.1
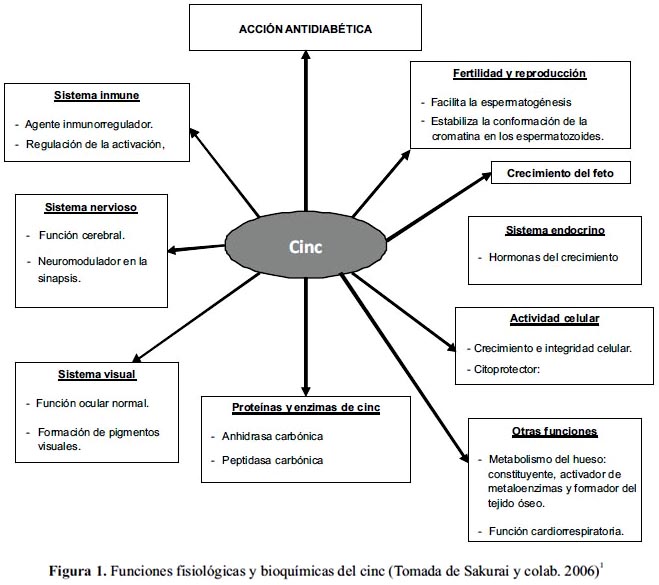
La mayor parte del cinc de la dieta se absorbe en el intestino delgado. Una vez absorbido es transportado por la albúmina del plasma y se concentra en el hígado, de donde se distribuye a otros tejidos. Las concentraciones más elevadas aparecen en el hígado, páncreas, riñones, huesos y músculos,10 siendo varios de estos órganos sitios claves de la acción de la insulina.
Interacciones entre el cinc y la insulina
Existe una estrecha relación entre el cinc y la insulina; este metal juega un rol fundamental en la síntesis, estructura, estabilidad conformacional, almacenamiento y secreción de la insulina, tanto en condiciones fisiológicas normales como en la patología de la diabetes. Desde la década de los treinta, poco después del descubrimiento de la insulina y su rol fundamental en el tratamiento de la diabetes, el cinc ha sido relacionado con esta hormona. Se demostró entonces que la adición de cinc retardaba la absorción subcutánea de la insulina, prolongando la duración de su acción y disminuyendo el número de dosis requeridas.11
Sin embargo, recién en la década del setenta, al elucidarse la estructura y acción bioquímica de la insulina, se logró determinar el rol estructural del cinc en la conformación cuaternaria, almacenamiento y secreción de esta hormona. La insulina es una proteína de relativamente bajo peso molecular (5,9 kDa) constituida por dos cadenas de aminoácidos, denominadas A y B, que están unidas por tres puentes disulfuro. Se sintetiza en forma de su precursor, la proinsulina, en el interior de las células β de los islotes de Langerhans en el páncreas. En el momento de su liberación a la sangre, la proinsulina se rompe en sus dos componentes, que son la insulina propiamente dicha y el péptido C. En presencia de cinc intracelular, los monómeros de insulina se acoplan a una forma dimérica para su almacenamiento y secreción como cristales de cinc. Existe también una forma hexamérica cristalina de la insulina, que resulta de la unión in vitro, en presencia de cinc y a pH neutro, de tres dímeros. Esta forma de insulina es la que se usa comúnmente en farmacia.11
Efectos de la diabetes en el metabolismo del cinc
A raíz de la comprobada relación entre el cinc y la insulina, se especuló que este metal debía estar íntimamente vinculado con la diabetes mellitus, por lo que se iniciaron numerosos estudios sobre el metabolismo del cinc en modelos animales y pacientes humanos diabéticos. Se encontró así un consistente aumento en la excreción urinaria del Zn en sujetos diabéticos respecto a los controles. Aunque la causa de la hipercincuria no está aún bien identificada, varios estudios la correlacionan con la poliuria (aumento de volumen de orina) característica de la DM, la que a su vez es consecuencia de la alta concentración plasmática de glucosa. Otras pérdidas fisiológicas de cinc se producen por aumento en la excreción intestinal del metal y por sudoración.6
El aumento de la excreción urinaria de cinc en pacientes diabéticos sugirió una probable deficiencia de dicho metal de no existir algún mecanismo compensatorio. Si bien se ha comprobado este déficit en el plasma, suero y tejidos para la DM tipo 2, en caso de la DM 1 se ha observado más bien un aumento. Esto ha sido atribuido a que en la fase inicial de la enfermedad la liberación de cinc derivada de la destrucción de las células β domina sobre la hipercincuria. En cambio, conforme progresa la DM 1, esta situación se invierte, observándose la esperada disminución en la concentración de cinc.
El hecho que tanto el aumento en la excreción urinaria de cinc como la alteración de su concentración en el organismo sean atenuados o incluso normalizados por tratamiento de la DM, indicaría una estrecha relación de ambos efectos metabólicos con la alta concentración de glucosa en sangre de los pacientes diabéticos. Esto a su vez resulta consistente con el descenso observado en el nivel de cinc en sujetos diabéticos y controles luego de una administración oral de glucosa.
Efectos terapéuticos del cinc en la diabetes
El descubrimiento de los efectos adversos de la diabetes mellitus sobre el metabolismo del cinc sugirió que una normalización del nivel fisiológico de cinc constituiría una buena alternativa terapéutica. Numerosos estudios tanto en modelos animales de DM tipo 1 y DM tipo 2, como humanos, han demostrado efectos beneficiosos de una dieta enriquecida en cinc tanto en la prevención como en la mejora de la condición diabética y sus complicaciones.
La suplementación con cinc antes de la inducción de la enfermedad con drogas diabetogénicas en ratas y ratones previno la hiperglicemia y la destrucción de células β; esto último mediante una reducción de la secreción de insulina lo que disminuyó la vulnerabilidad de las mismas. Incluso, en animales genéticamente predispuestos, se observó una reducción de la incidencia de la DM y un mejor control glicémico. En pacientes humanos, el cinc presentó efectos particularmente favorables con respecto a una mejora en la condición diabética para la DM tipo 2, donde condujo a una disminución de la resistencia a la insulina y a una reducción del índice histórico de glucemia a plazo, HbA1C.6
Por otro lado, muchas de las complicaciones de la diabetes estarían relacionadas al aumento de oxidantes intracelulares y radicales libres producidos por la disminución del cinc intracelular y de las enzimas antioxidantes dependientes de cinc.11 Estudios recientes sugieren además que la generación de especies reactivas de oxígeno (ROS) es causante de la muerte de las células β que conduce a la DM tipo 1.12 En este contexto, se ha encontrado que el cinc, gracias a su conocida acción antioxidante, reduce el estrés oxidativo en la DM, lo que explica en parte su efecto protector frente a diversas complicaciones de la enfermedad como la retinopatía, cardiomiopatía y neuropatía.
EVALUACIÓN DEL EFECTO HIPOGLICEMIANTE E INSULINOMIMÉTICO DEL CINC
Un método de comprobada eficacia para la medición de la actividad insulinomimética in vitro de un potencial agente antidiabético, y que posee una buena capacidad predictiva para posteriores ensayos in vivo, consiste en determinar simultáneamente el grado de inhibición de la liberación de ácidos grasos libres (FFA) y de toma de glucosa, en adipocitos aislados de ratas en presencia de un potencial agente IM.13
La deficiencia de glucosa intracelular, característica de sujetos diabéticos, fuerza al organismo a recurrir como fuente alternativa de energía a la hidrólisis de triglicéridos y consiguiente liberación de ácidos grasos. Esta situación es emulada in vitro en los adipocitos al tratarlos con epinefrina; ésta al unirse al receptor β de los mismos activa a la adenilato ciclasa que transforma ATP en adenosina 3´,5´-monofosfato cíclico (cAMP), la que a su vez activa algunas proteínas quinasas y lipasas. La lipasa activada cataliza entonces la hidrólisis de triglicéridos a ácidos grasos libres (FFA) que son liberados por la célula. Por efecto de un agente insulinomimético, que actúa en uno o más puntos de la cascada enzimática de la insulina, se desencadena un proceso bioquímico similar al de la insulina misma que culmina en un aumento de la toma de glucosa a nivel intracelular y consiguiente inhibición de la liberación de los FFA.5
Para medir el efecto inhibitorio de la liberación de los FFA se usa el parámetro IC50 que se define como la concentración de compuesto requerida para alcanzar un 50% de la inhibición con respecto a la máxima observada para el compuesto en estudio. La toma de glucosa por su parte, se expresa en términos de EC50, definida como la concentración del compuesto necesaria para lograr un 50% de captación de glucosa con respecto al máximo alcanzable por dicho compuesto. En presencia de insulina o un agente insulinomimético, existe una buena correlación directa entre el grado de toma de glucosa por la célula y el grado de inhibición de la liberación de los FFA.
Para evaluar la actividad IM in vivo de un potencial agente antidiabético se recurre a diversos modelos animales que ya sea por inducción con una droga diabetogénica (estreptozotocina, aloxano) o por modificación genética (ratas Zucker, ratones KKAγ) desarrollan la enfermedad. El eventual agente antidiabético puede ser administrado tanto por inyección intraperitoneal (i.p) o intravenosa (i.v) como por vía oral, ya sea en el agua de beber o directamente al estómago mediante una cánula. Se debe tener en cuenta las diferencias en efectividad propias de cada método uno para una adecuada dosificación.14
En cuanto a la medida de concentración de glucosa en sangre se suele usar el test de tolerancia oral a la glucosa (TOG), que evalúa la respuesta a corto plazo del organismo hacia un repentino aumento en la concentración de glucosa. Un método integral de monitoreo de la glucosa que mide por su parte el nivel de glucosa durante un periodo prolongado (2 a 3 meses anteriores al análisis) consiste en el análisis del porcentaje de la hemoglobina glicosilada, HbA1C, en una muestra de sangre.
EFECTOS DE LA COMPLEJACIÓN DEL CINC Y EVALUACIÓN DE LA ACTIVIDAD INSULINOMIMÉTICA EN COMPUESTOS CON DIFERENTES MODOS DE COORDINACIÓN
En general, el uso de complejos en vez de sales de cinc como potenciales metalofármacos antidiabéticos favorece la actividad oral del metal, aumenta su efectividad y lo estabiliza en los fluidos corporales a condiciones fisiológicas normales. Esto conduce a requerimientos de menores dosis, con la consiguiente disminución de los efectos colaterales adversos observados para las sales, y periodos más cortos de tratamiento.
Una apropiada complejación del cinc con ligandos orgánicos introduce mejoras tanto en la bioabsorción gastrointestinal inicial del metalofármaco como en la toma por los tejidos, haciéndolo oralmente activo. En caso de complejos metálicos, la absorción ocurre por un mecanismo de difusión pasiva que requiere una buena permeabilidad de los mismos a través de la doble membrana celular. Para que esto ocurra, los ligandos deben ser seleccionados de modo tal que los complejos resultantes cumplan con ciertos requisitos básicos que favorezcan la difusión del complejo hacia el interior de la célula donde se ejerce su acción insulinomimética. Deben poseer un peso molecular relativamente bajo y un buen balance lipofílico-hidrofílico para lo cual el número de átomos O y N, que incluyan algunos grupos OH y NH, no debe exceder de diez.15 Por otro lado, debe evitarse la introducción de algún tipo de toxicidad por parte del ligando.
Otro aspecto importante a tener en cuenta en el desarrollo de un complejo de cinc que sea efectivo como agente insulinomimético es su relativa estabilidad frente a las proteínas transportadoras y otras biomoléculas que puedan actuar como potenciales ligandos. Debe ser lo suficientemente estable para asegurar un adecuado tiempo de permanencia en el organismo que le permita, por un lado, ejercer su función y llegar hasta sitios claves de la acción de la insulina como lo son el hígado, tejido muscular y adiposo, mas no ser tan prolongado como para volverse tóxico.1,16
A continuación se revisa la estructura, la actividad insulinomimética y el efecto normoglicémico de complejos de cinc diversas esferas de coordinación alrededor del Zn(II). En la tabla 1 se presentan ejemplos representativos de complejos de cinc para los principales modos de coordinación.
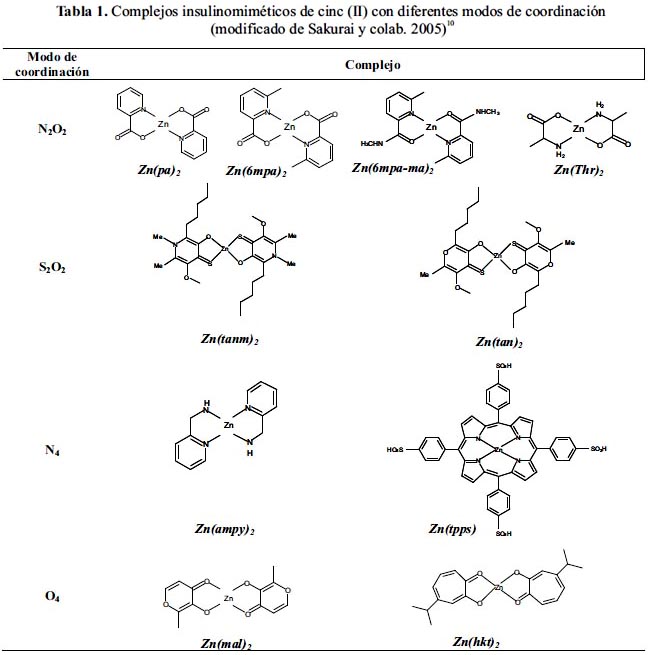
Modo de coordinación Zn(O4)
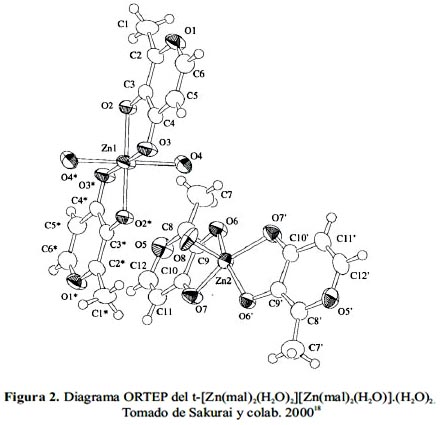
Uno de los primeros complejos de cinc que resultó oralmente activo, específicamente en ratas GK, que constituyen modelos animales de la DM tipo 2, fue el bis(maltolato)Zn(II),
Zn(mal)2.17Por análisis de Rayos X del Zn(mal)2 se encontró que la celda unitaria del compuesto contiene dos moléculas del complejo con diferentes geometrías alrededor de los átomos de Zn(II) centrales. En una de ellas dos maltolatos y dos H2O coordinan a un Zn(II) de forma trans en una conformación octaédrica mientras que la segunda exhibe una coordinación pirámide cuadrada, donde dos maltolatos coordinan en el plano basal y un H2O ocupa la posición apical18 (figura 2).
La actividad insulinomimética in vitro del complejo Zn(mal)2 fue estimada por inhibición de la liberación de FFA en adipocitos de ratas aislados tratados con epinefrina, obteniéndose un valor de IC50 de 0,59 mM, lo que demuestra un aumento del efecto inhibitorio y consiguiente acción IM con respecto a la sal ZnSO4 (IC50 = 0,81 mM).
Estos resultados positivos motivaron posteriores ensayos in vivo en ratones KK-Aγ, un modelo genéticamente modificado de DM tipo 2. Se les aplicó diariamente por vía intraperitoneal (i.p) una dosis variable de 4,5 mg Zn/kg de masa corporal al inicio de tratamiento, que fue disminuida a 2,0 e incluso suspendida según que el nivel de glucosa estuviera próximo o igual al nivel normal (<150 mg/dl). De esta manera, se consiguió regular el nivel de glucosa a un valor por debajo de los 200 mg/dl durante las dos semanas de tratamiento. Durante el tratamiento, la masa corporal de las ratas KK-Aγ solo se incrementó ligeramente y no se observaron disturbios en las funciones renal y hepática. Asimismo, se determinó una mejora significativa en los índices de resistencia a la insulina en los ratones tratados con respecto a los controles. Sin embargo, los niveles de FFA no cambiaron. Por último, se observó en los ratones tratados una mejora significativa en el test de tolerancia oral a la glucosa (OGTT).4
La comprobada actividad IM del Zn(mal)2 condujo a la búsqueda de nuevos complejos de cinc con derivados del ligando base que pudieran superarlo en efectividad. Se sintetizaron así los complejos bis(3-hidroxipirinato)Zn(II), Zn(3hp)2; bis(2-etilmaltolato)Zn(II), Zn(ema)2; bis(kojato)Zn(II), Zn(ka)2 y bis(alixinato)Zn(II), Zn(alx)2 (figura 3). Se estudió la relación estructura-actividad in vivo y en in vitro del Zn(mal)2 y los derivados mencionados.5,10
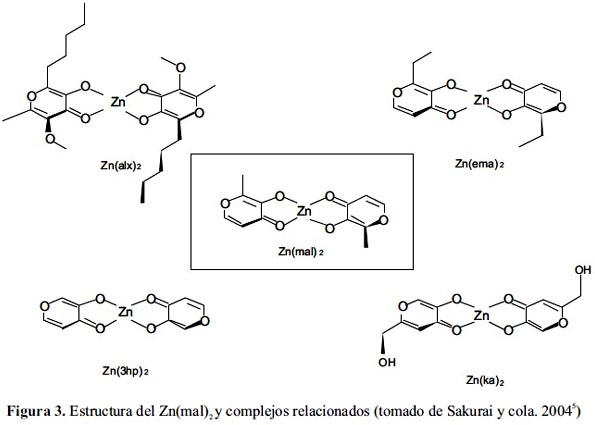
Se examinó la actividad insulinomimética in vitro de los cinco complejos en términos de inhibición de liberación de los FFA y consiguiente mejora de la toma de glucosa, encontrándose que su efectividad estaba estrechamente relacionada con el coeficiente de partición (log P) del sistema cloroformo/solución salina del ligando, índice de la lipofilicidad/hidrofilicidad relativa de los ligandos. En general, se halló una buena correlación lineal entre la actividad IM del complejo y la lipofilicidad del ligando; el complejo más lipofílico Zn(alx)2 (log P= 1,65) mostró el mayor efecto inhibitorio (IC50= 0,37 mM) y por consiguiente la más alta actividad insulino-mimética entre todos los complejos considerados en este estudio (figura 4).
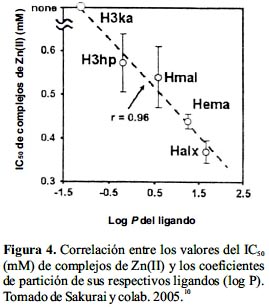
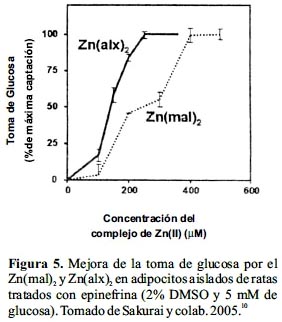
En un estudio in vivo comparativo entre el Zn(mal)2 y Zn(alx)2 en ratones KK-Aγ, utilizando una dosis variable entre 2 y 4,5 mg Zn/ kg de masa corporal por dos semanas, ambos complejos bajaron dramáticamente la hiperglicemia y redujeron la insulinemia. Sin embargo, el Zn(alx)2 tuvo un efecto antidiabético más pronunciado que el Zn(mal)2, al bajar de manera más significativa los niveles de HbA1c y mejorar la tolerancia oral a la glucosa, suprimiendo además, el progreso de la obesidad en los ratones modelo. Asimismo, el efecto hipoglicemiante del Zn(alx)2 fue más prolongado, manteniéndose por diez días después del término del tratamiento (figura 5). Por otro lado, se evaluó la metalocinética del Zn(mal)2 en ratas sanas y se encontró que, consistente con su mayor lipofilicidad, la bioabsorción del complejo (37,3%) era mayor a la de la sal ZnCl2 (23,6%), lo que a su vez explica el incremento de la incorporación de Zn(II) en las células de los tejidos. Se concluye que la mayor efectividad tanto in vitro como in vivo del Zn(alx)2 respecto al Zn(mal)2 para la DM tipo 2 sería consecuencia de un mayor carácter lipofílico.
Otro complejo con esfera de coordinación O4 que resultó ser de gran eficacia en cuanto a actividad IM, fue aquel del Zn(II) con hinoquitiol (hkt), un compuesto natural con conocidas propiedades preservantes en alimentos, antimicrobiales y antitumorales. Estudios analíticos de la estructura del complejo revelaron que la razón Zn(II)/ligando es 1:2. La actividad insulino mimética fue evaluada a través de la mejora en la toma de glucosa y la inhibición de los FFA. En un estudio comparativo in vitro este complejo resultó ser dos veces más efectivo que el Zn(alx)2 y cuatro veces más que el Zn(mal)2.
Ensayos in vivo con el mismo tipo de modelos animales de DM tipo 2, usando condiciones similares a las utilizadas para el Zn(mal)2 y sus derivados, mostraron una marcada acción normoglicémica del complejo Zn(hkt)2 así como efectos comparables en otros parámetros indicadores de mejoras en el control de la enfermedad.19
Modo de coordinación Zn(N2O2)
Se ha sintetizado y evaluado en cuanto a su actividad IM también un buen número de complejos de Zn(II) con esfera de coordinación N2O2. La investigación se ha orientado principalmente a los complejos con ligandos del tipo picolinato así como aminoácidos y derivados. Los complejos con α-aminoácidos presentaron una variedad de estructuras tanto pentacoordinadas con geometría bipirámide trigonal o pirámide cuadrada como octaédricas. El estudio de su actividad IM in vitro reveló la existencia de una relación entre los valores de IC50 y las constantes de estabilidad (log
β). Se encontró que, en general, los complejos con log β menores a 10,5 exhibían actividad IM y esta era superior o por lo menos comparable a la del ZnSO4, mientras que aquellos cuyas constantes superaban el valor de 11 esencialmente no mostraban actividad.20Es muy conocido que la absorción de cinc es promovida por la albúmina y se han reportado valores de log
β para complejos de Zn(II) con albúmina entre 7,6 y 9,6. Si la estabilidad del complejo de Zn(II) evaluado, reflejada por un alto valor de log β, es significativamente mayor que la del complejo de Zn(II) con albúmina el ligando no podrá ser reemplazado por la albúmina en el proceso de absorción. Esto explica porque los complejos con log β mayor a 11 no presentaron actividad insulinomimética.1Entre los complejos estudiados, aquél con treonina como ligando presentó mayor actividad IM in vitro (IC50 = 0,54 y log
β = 8,46), por lo que se realizaron pruebas in vivo para evaluar su desempeño como paliativo de la hiperglicemia en ratones KK-Aγ con DM tipo 2. Un tratamiento por dos semanas con una dosis diaria i.p de 3 mg Zn/kg de masa corporal condujo a un nivel de glucosa casi normal y a una mejora general en el estado diabético de los animales; en contraste no se observó ningún cambio en los controles o aquellos tratados con ZnCl2. Este resultado, al igual que en los otros complejos evaluados, fue independiente de la configuración D o L del aminoácido.20El hecho que el ácido picolínico promueva la absorción del Zn(II) en el cuerpo a través del intestino delgado motivó la elección de este compuesto como ligando base para la síntesis de complejos bis(picolinato) con lipofilicidad variable por introducción de grupos electro donadores, específicamente metil y en las posiciones 3 y 6. La introducción del grupo metil aumentó la lipofilicidad del picolinato significativamente, lo que se comprobó por medida de los coeficientes de partición (log P = 0,018 vs. 0,07 y 0,075 para el 3-mpa y 6-mpa respectivamente).21
Por cristalografía de rayos X se determinó que el complejo base [Zn(pic)2(H2O)2].2H2O presenta una geometría octaédrica con los ligandos H2O en posición trans. Por otro lado, la geometría del complejo con 6-metil-picolinato, Zn(6-mpa)2, resultó ser una bipirámide trigonal distorsionada con los dos átomos de nitrógeno en posición apical.
Por otro lado, los estudios in vitro revelaron que, consistente con su mayor lipofilicidad, los valores del IC50 son más favorables para los complejos con ligandos metil sustituidos, Zn(6-mpa)2 y Zn(3-mpa)2, que para el Zn(pic)2 (0,31 y 0,4 vs. 0,64 mM).21 Asimismo, las pruebas in vivo con el complejo Zn(6-mpa)2 en ratones diabéticos en condiciones análogas a las anteriormente mencionadas para los complejos de á-aminoácidos demostraron su eficacia como agente antidiabético.21
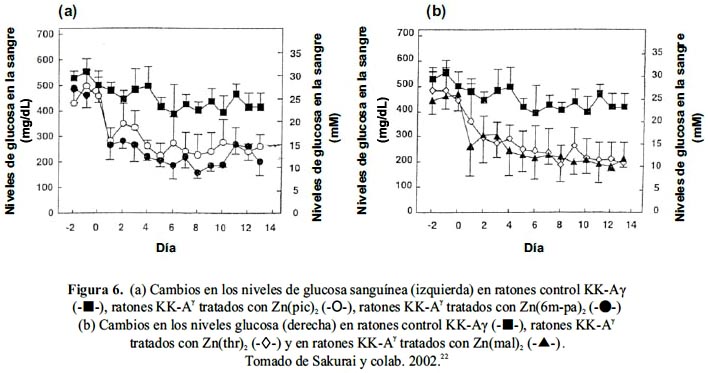
Finalmente, se realizó un estudio comparativo in vivo de los complejos con esfera de coordinación N2O2 Zn(pic)2, Zn(6-mpa)2 y Zn(Thr)2 con el Zn(mal)2, representativo de los O4, en ratones KK-Aγ a condiciones similares a las ya descritas para el Zn(mal)2 con la única diferencia que se usó una dosis fija de 3 mg Zn/kg de masa corporal durante el tratamiento completo de dos semanas. Se encontró que para los cuatro complejos los niveles de glucosa descendieron hasta un valor promedio de 250 mg/dl, muy cercano al normal, durante el periodo de tratamiento (figura 6). Al igual que en el estudio llevado a cabo con dosis variable en Zn(mal)2, no se observó aquí tampoco variación significativa en el peso corporal ni disturbios renales ni hepáticos. Además, no solo se observó una mejora en el test de tolerancia oral a la glucosa sino también en los valores de HbA1C, índice de un efecto hipoglicemiante prolongado, respecto a los controles.22
Modo de coordinación Zn(N4)
Desde el resultado negativo en cuanto a actividad IM del complejo [N,N,N´,N´-tetrakis(2- piridilmetil)etilendiamina]Zn(II) se han sintetizado y evaluado algunos otros con este modo de coordinación que, en general, ha resultado poco prometedor.21 Entre ellos, el bis(2- aminoetilpiridinato)Zn(II), [Zn(2-ampy)2]2+, mostró cierta actividad hipoglicemiante (superior al ZnSO4) en modelos animales de DM tipo 2 administrado intraperitonealmente mas no por vía oral. Sin embargo, recientemente se sintetizó un complejo porfirínico hidrosoluble, el [meso-tetrakis(4-sulfonatofenil)porfirinato]Zn(II), que resultó más efectivo in vitro que el Zn(alx)2. Además, administrado oralmente, a dosis de 10-20 mg Zn/kg de masa corporal por cuatro semanas a ratones KK-Aγ, normalizó la hiperglicemia, mejorando a la vez varios síndromes metabólicos de la DM tipo 2 tales como la resistencia a la insulina, y los grados de alteración renal y hepática. Asimismo la mejora del estado diabético se evidenció a través de los resultados del OGTT y una disminución en el nivel del HbA1C.23
Modo de coordinación Zn(S2O2)
La alta efectividad del bis(alixinato)Zn(II) como agente IM llevó al desarrollo de nuevos complejos con ligandos derivados de la alixina con el fin de evaluar una ulterior mejora en su actividad. Para esto se introdujeron ciertos cambios en el ligando base, a saber, el reemplazo de un átomo coordinante de oxígeno por su homólogo azufre y la sustitución del oxígeno del éter en la posición O1 de la alixina por N-CH3.24 En total se estudiaron los complejos de los cuatro ligandos mostrados en la figura 7.
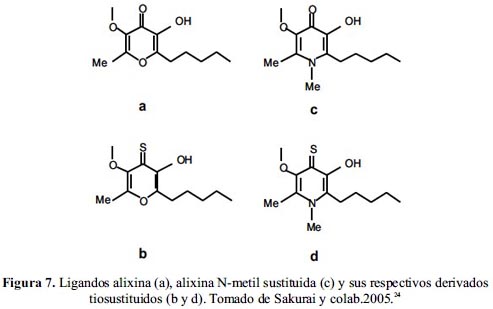
Una evaluación in vitro comparativa de actividad insulinomimética de estos complejos mostró una extremada alta efectividad de los complejos con el modo de coordinación S2O2 respecto a aquellos con coordinación O4. Mientras que el valor del IC50 para los complejos con modo de coordinación O4, a y c, se encuentra en el orden de 150 µM, el complejo del ligando b presenta un IC50 de 31 µM y aquel del ligando d es aun más bajo, 11 µM. Esta clara ventaja del último complejo se ve respaldada por el valor del coeficiente de partición de d que supera a los demás, lo que indica que la sustitución del O1 del ligando c por N-CH3 mejoró la lipofilicidad, y por consiguiente, la actividad insulinomimética.24
Con estos resultados positivos se decidió evaluar la efectividad oral del complejo del ligando d, Zn(tanm)2, en modelos animales de DM tipo 2, previo examen de su absorción gastrointestinal. Se administró oralmente el complejo Zn(tanm)2 a ratones KK-Aγ, observándose una gran mejora en la bioabsorción en relación a las sales de cinc y al Zn(alx)2. Esto se atribuye a la alta estabilidad del Zn(tanm)2 (log β= 22,11) respecto a la del Zn(alx)2 (log β= 12,59) lo que limita su nivel de captura por diversas proteínas presentes en el tracto gastrointestinal.
Consistente con lo anterior, el tratamiento oral de ratones diabéticos KK-Aγ con una dosis diaria de 15mg Zn/kg de masa corporal de Zn(tanm)2 durante cuatro semanas, condujo a un efecto hipoglicemiante más pronunciado que el Zn(alx)2. Además, a diferencia del Zn(alx)2, el complejo en cuestión logró normalizar los elevados niveles de HbA1C y mejoró la tolerancia oral a la glucosa. Por otro lado, la patogénesis de la DM tipo 2 es caracterizada por la resistencia a la insulina en tejidos receptores de insulina tales como el adiposo, los músculos, y el hígado. Los altos niveles de insulina en el plasma de los ratones KK-Aγ decrecieron significativamente luego del tratamiento con Zn(tanm)2, lo que sugiere que el complejo mejora también la sensibilidad por la insulina en la DM tipo 2.18
Otro descubrimiento favorable acerca este complejo es su aparente papel regulador en el metabolismo de las grasas que evita la obesidad en la DM tipo 2. Recientes avances en biología celular y molecular han revelado que los tejidos adiposos no solo sirven como almacén de grasas sino que también secretan sustancias activas llamadas adipocitoquinas. Una de ellas es la leptina la cual controla la homeostasis de la energía a través de la inducción de la reducción de la ingesta de alimentos y el fomento de la pérdida de grasa. Por lo tanto, la hiperleptinemia observada en ratones KK-Aγ sugiere un estado de resistencia a la leptina en la obesidad.18
La administración oral del Zn(tanm)2 redujo significativamente la hiperleptinemia en ratones KK-Aγ, indicando una mejora en la sensibilidad a la leptina y un alivio en el problema de la obesidad en los animales. Aunque no disminuyó la masa corporal de de las ratas, la excesiva ingesta de comida fue considerablemente suprimida.18
Modo de coordinación Zn(S4)
Recientemente se sintetizaron cuatro nuevos complejos Zn(II)-ditiocarbamato con el metal coordinado exclusivamente a átomos de azufre. El más activo como agente IM, que a la vez resultó ser el más lipofílico del grupo, fue el bis(pirrolidona-N-ditiocarbamato)Zn(II). Los estudios in vitro indicaron una actividad unas cincuenta veces mayor que para complejos de Zn(II) con modos de coordinación N2O2 y O4. Sin embargo, el efecto hipoglicemiante exhibido por este complejo durante su administración oral a ratones diabéticos y obesos KK-Aγ, por 25 días a una dosis variable de 10 a 15 mg Zn/kg de masa corporal, fue considerablemente más modesto que aquel del complejo Zn(tanm)2 con esfera de coordinación S2O2. Asimismo, se observó una mejora en una serie de parámetros indicadores del estado diabético.25
MECANISMO MOLECULAR DE LA ACCIÓN INSULINOMIMÉTICA Y PROTECTORA DE LAS CÉLULAS β DEL CINC
Cascada enzimática de la insulina6,26
El metabolismo regulador de la glucosa se inicia en el receptor enzimático de la insulina situado en la membrana plasmática que consiste de dos subunidades α ubicadas en la superficie extracelular de la misma y dos subunidades β en el lado citosólico. La cascada enzimática se desencadena con la unión de la insulina al receptor enzimático en la subunidad α lo cual estimula la fosforilación en el residuo tirosina de la subunidad β con el concomitante cambio conformacional que promueve su actividad quinasa. Como consecuencia, proteínas cercanas como las pertenecientes a la familia del substrato receptor insulínico (IRS) son fosforiladas. Una vez activado, el IRS actúa como puerto de proteínas con dominio SH-2 como la subunidad regulatoria p85 de la proteína fosofoinositol-3-quinasa, PI3K. Al activarse esta última promueve la fosforilación de la proteína quinasa fosfoinositol-dependiente-1, PDK1, lo que a su vez activa la proteína quinasa B (PKB), por fosforilación de su residuo serina. Esto último estimula la translocación del transportador de glucosa GLUT 4 en los adipocitos, logrando mejorar así la captación de glucosa. La PKB también juega un rol importante en la cascada enzimática al fosforilar y consecuentemente inhibir la glicógeno sintasa 3 quinasa (GSK3), permitiendo así la activación de la glicógeno sintasa (GS), la enzima responsable de la síntesis de glicógeno.
Es importante mencionar dos efectos negativos dentro de la cascada enzimática de la insulina. Uno de ellos es la fosforilación del residuo serina en la subunidad β del receptor y la proteína IRS que compite con la fosforilación de la tirosina. El segundo, es la rápida defosforilación del receptor enzimático y sus sustratos por una proteína tirosina fosfatasa 1B (PTP1B).
Múltiples efectos del cinc en la cascada enzimática6
Desde el descubrimiento de los efectos terapéuticos de la suplementación con cinc a pacientes diabéticos, el mecanismo de la acción insulinomimética del cinc a nivel bioquímico ha sido objeto de intenso estudio. Al examinar los posibles puntos de acción del cinc en la cascada enzimática, se vio que este juega un importante papel regulador en el estado de fosforilación del receptor insulínico. Por un lado estimula la fosforilación de la tirosina de la subunidad β del receptor enzimático, aunque en menor medida que la insulina, y por otro inhibe la acción de la PTP1B.
Además, el cinc activa la PI3K, incrementando así de manera indirecta la actividad de la PKB, que como ya se mencionó promueve la captación de glucosa mediante la translocación del GLUT 4 hacia la membrana celular (figura 8). Asimismo, el cinc favorece la normoglicemia al formar parte de la aminopeptidasa insulino-sensible (IRAP), biomolécula que al parecer es requerida para el mantenimiento de un nivel normal del transportador GLUT 4. La translocación del IRAP inducida por la insulina, que opera de modo similar al del GLUT 4 se ve desfavorecida en la diabetes mellitus tipo 2.
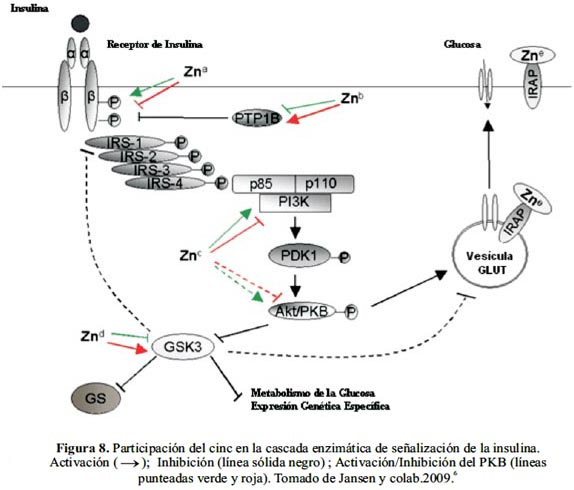
De acuerdo con este modelo, que propone la activación a nivel post receptor de la PI3K sin intervención de la IRS, el cinc podría inducir la producción de agua oxigenada por las células epididymal; esto causa la activación de la quinasa de adhesión focal (FAK) lo que a su vez activa la ruta de señalización PI3K/PKB de la insulina. El incremento en los niveles de H2O2 ejerce un efecto normoglicémico al favorecer la oxidación la glucosa.
Se ha observado, además, en los pacientes con DM tipo 2 un elevado nivel de GSK3, lo que ejerce un efecto perjudicial sobre la actividad de la GS y la sensibilidad a la insulina. Se ha probado que el cinc inhibe la actividad de la GSK3, probablemente por fosforilación de la PKB, favoreciendo así la activación de la GS y el consiguiente incremento de la toma de glucosa. Este efecto inhibitorio del cinc sobre la GSK3 conduce también a la reducción de la apoptosis de las células β inducida por una alta concentración de glucosa así como a un aumento en su replicación, dado que se ha comprobado que ciertos inhibidores de la GSK3 exhiben tales propiedades. Un efecto negativo adicional de la elevada concentración de GSK3 en la DM tipo 2 es la inhibición de la IRS1 mediante la fosforilación de su residuo serina, afectando en un estadio inicial la cascada enzimática.
Aparte de los efectos beneficiosos del cinc por su intervención en la cascada enzimática de la insulina, se ha encontrado que el este metal estimula el oxidación de la glucosa a CO2, ácidos grasos y glicerol, así como el ciclo de la pentosa fosfato; esto ha sido relacionado con una inhibición selectiva de la glutationa reductasa.
En resumen, los efectos insulinomiméticos del cinc son principalmente consecuencia de un conjunto de efectos positivos en la cascada enzimática de la insulina, que se agrupan bajo el nombre de "mecanismo concertado". Por tanto, se considera que el cinc representa una alternativa terapéutica efectiva para el tratamiento de la DM.
Cinc y sus efectos en la protección de las células β pancreáticas6
La acción insulinomimética del cinc no se limita solamente a su importante participación a nivel post-receptor en la cascada enzimática de la insulina, sino que también evita la destrucción de las células β productoras de insulina garantizando así un normal nivel de insulina en el plasma.
Se ha demostrado que la interleucina IL-1β, una citocina derivada de un macrófago, está involucrada tanto en la inhibición de la liberación de insulina generada por hiperglicemia y la conversión de la proinsulina, como también en la destrucción de las células β en la diabetes mellitus tipo 1 y 2. Estos efectos se originan al parecer principalmente por la activación del factor de transcripción factor nuclear kappa B (NFκB), una molécula clave en la ruta de señalización del 1L-1β. En humanos, la acción de esta citocina en la inducción a apoptosis de las células β requiere de una potenciación por otras citocinas.
Se ha demostrado que un bloqueo de la señalización de la IL-1 β mejoró la función secretora de insulina de las células β en la DM tipo 2 y previno su muerte, así como también optimizó la tolerancia a la glucosa y la secreción de insulina en modelos animales, lo que indica su rol destructivo y diabetogénico. Esto resulta consistente con el hecho que la inhibición de NFκB en humanos y roedores confirió resistencia a las células β frente a la apoptosis (figura 9).
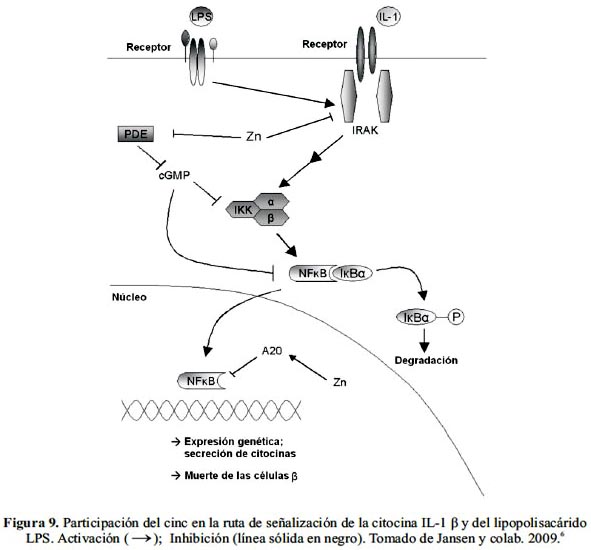
La cascada de señalización que resulta en la muerte de las células β se inicia con la unión de la interleucina IL-1 β a su correspondiente receptor. Esto desencadena la activación del factor inhibitorio kappa B quinasa β (IKK β), lo que a su vez conduce a la liberación del factor de transcripción factor nuclear kappa B (NFκB) mediante hiperfosforilación de su factor inhibitorio kappa B (IκB) el que finalmente se degrada. El factor NFκB liberado es traslocado al núcleo donde activa a los genes responsables de la secreción de las citocinas que presumiblemente inducen la apoptosis de las células β. La cascada puede ser también iniciada por un lipopolisacárido (LPS) de origen bacteriano que al ser reconocido activa a la quinasa asociada al receptor de la IL-1 β (IRAK).
Numerosos estudios in vitro e in vivo han demostrado que el cinc interviene en varios puntos de esta cascada, tanto a nivel endo como exonuclear, protegiendo a las células β productoras de insulina y asegurando una concentración efectiva de esta hormona. En el interior de la célula, el cinc activa un ARNm de la proteína tipo dedos de cinc A20 la cual ejerce una acción inhibitoria sobre el factor NFκB.
Por otro lado, se ha descubierto que a nivel extranuclear existen dos mecanismos por los que el cinc bloquea la transducción de la señal que conduce finalmente a la activación del factor clave NFκB. Por uno de ellos el cinc interviene directamente en la cascada al inhibir el IRAK mientras que por el otro inhibe de modo indirecto al factor IKK β. Esto último lo logra por inhibición de la fosfodiesterasa (PDE) con el consiguiente aumento de la concentración del monofosfato de guanosina cíclico (GMPc) y concurrente inhibición de los factores IKK y NFκB.
Los aspectos mecanísticos recién discutidos de la acción insulinomimética y la protección de las células β ejercida por el cinc justifican el importante rol terapéutico de dicho metal tanto en la diabetes mellitus tipo 1 como la 2.
CONCLUSIONES Y PERSPECTIVAS
La diabetes mellitus es considerada como una enfermedad causada por diversos factores; la DM tipo 1 involucra una respuesta autoinmune del organismo que destruye las células β productoras de insulina y la tipo 2 se relaciona con factores asociados al estilo de vida como la obesidad y el estrés, además del envejecimiento, entre otros. Sin embargo, en ambos casos e independientemente de los mecanismos causales que desencadenen la enfermedad, ya sea en su etapa inicial o durante su desarrollo, la homeostasis del cinc resulta considerablemente perjudicada. Por esta razón, se ha considerado al cinc como una fuente de nuevas posibilidades de diagnóstico, prevención y terapia.
Numerosos estudios en pacientes humanos y modelos animales de diabetes mellitus tipo 1 y 2 han demostrado los efectos beneficiosos de la suplementación con cinc, especialmente si este se encuentra complejado a ligandos orgánicos apropiados, en el control glicémico y mejora del estado diabético general así como sus diversas complicaciones; esto último mediado en parte por una reducción del estrés oxidativo. Asimismo, el cinc desempeña una función importante en la protección de las células β del daño provocado por células inmunes y citocinas.
Existen dos posibilidades básicas de aumentar la efectividad de potenciales metalofármacos antidiabéticos como los basados en compuestos de cinc. La primera consiste en continuar introduciendo mejoras en el diseño de complejos de cinc mediante el uso de ligandos no tóxicos que propicien un balance lipofílico-hidrofílico óptimo y una estabilidad adecuada del complejo en el organismo que aumenten su biodisponibilidad y potencien su actividad insulinomimética a bajas dosis, minimizando así los efectos colaterales adversos.
Otro modo de aumentar la biodisponibilidad del agente activo es recurriendo a sistemas alternativos de administración, algunos de los cuales ya fueron ensayados con éxito para el vanadio. Uno de ellos es el sistema de encapsulamiento entérico de sales simples que permite la liberación del metal directamente en el intestino delgado; esto favorece su biodisponibilidad y actividad farmacológica oral. Por otro lado, un método novedoso y con resultados farmacológicos prometedores, que ya ha sido ensayado con resultados positivos incluso con el cinc27, es el uso de vehículos poliméricos para la complejación y transporte del metalofármaco en el organismo.
El alto peso molecular del componente polimérico unido a su carácter hidrosoluble, biodegradable y no tóxico, produce un cambio radical en la farmocinética del agente activo asegurando su liberación lenta y controlada en el organismo. El polímero, al coordinar firmemente y de modo bioreversible al metal, cumple un eficiente papel protector, evitando su prematura degradación bioquímica lo que permite que llegue intacto hacia los órganos claves en el metabolismo de la glucosa. Su carácter hidrosoluble favorece una rápida distribución en el sistema circulatorio y mejora su bioabsorción28.
Finalmente, si se considera dentro de una perspectiva global el estado de la investigación actual sobre los efectos positivos de los compuestos de cinc en el tratamiento y prevención de la diabetes mellitus así como el avance paralelamente logrado en la comprensión de los mecanismos moleculares responsables, se avizora un futuro prometedor en el desarrollo de fármacos antidiabéticos de cinc.
BIBLIOGRAFÍA
1. Sakurai, H.; Katoh, A.; Yoshikawa, Y. Bull. Chem. Soc. Jpn. 2006; 79, 1645-1664
2. Basuki, W.; Hiromura, M.; Sakurai, H. J. Inorg. Biochem. 2007; 101, 692-699
3. Ueda, E.; Yoshikawa, Y.; Ishino, Y.; Sakurai, H.; Kojima, Y. Chem. Pharm. Bull. 2002; 50, 337-340
4. Yoshikawa, Y.; Ueda, E.; Miyake, H.; Sakurai, H.; Kojima, Y. Biochem. Biophys. Res. Commun. 2001; 281, 1190-1193
5. Adachi, Y.; Yoshida, J.; Kodera, Y.; Kato, A.; Yoshikawa, Y.; Kojima, Y.; Sakurai, H. J. Biol. Inorg. Chem. 2004; 9, 885-893
6. Jansen, J.; Karges, W.; Rink, L. J. Nutr. Biochem. 2009; 20, 399-417
7. Medicamentos orales. http://www.diabetesaldia.com/Default.aspx?SecId=73 Noviembre, 2010.
8. Kaji, M. Trib. Med. 2002; 102, 39-49
9. Rubio, C.; Gonzales, D.; Martín-Izquierdo, R.E.; Revert, C.; Rodriguez, I.; Radisson, A. Nutr. Hosp. 2007; 22, 101-107
10. Sakurai, H.; Adachi, Y. BioMetals 2005; 18, 319-323
11. Chausmer, A. B. J. Am. Coll. Nutr. 1998; 17, 109-115
12. Quraishi, I.; Collins, S.; Pestaner, J.P.; Harris, T.: Bagasra, O. Medical Hypothesis 2005; 65. 887-892
13. Adachi, Y.; Sakurai, H. Chem. Pharm. Bull. 2004; 52, 428-433
14. Galli, C.; Alvino, N.; Pacheco, J. Revista de Química 2007; 21, 37-48
15. Leeson, P.; Davis, A.; J. Med. Chem. 2004; 47, 6338-6348
16. Thompson, K.; Orvig, C.; J. Chem. Soc. Dalton Trans. 2000; 2885-2892
17. Yoshikawa, Y.; Ueda, E.; Kojima, Y.; Sakurai, H. Life Sciences 2004; 75, 741-751
18. Yoshikawa, Y.; Ueda, E.; Kawabe, K.; Miyake, H.; Sakurai, H.; Kojima, Y. Chem. Lett. 2000; 874-875
19. Yamane, M.; Adachi, Y.; Yoshikawa, Y. Sakurai, H. Chem. Lett. 2005; 34, 1694-1695
20. Yoshikawa, Y.; Ueda, E.; Suzuki, Y.; Yanagihara, N.; Sakurai, H.; Kojima, Y. Chem. Pharm. Bull. 2001; 49, 652-654
21. Yoshikawa, Y.; Ueda, E.; Kawabe, K.; Miyake, H.; Takino, T.; Sakurai, H.; Kojima, Y. J. Biol. Inorg. Chem. 2002; 7, 68-73
22. Sakurai, H.; Kojima, Y.; Yoshikawa, Y.; Kawabe. K.; Yasui, H. Coordination Chemistry Reviews. 2002; 226, 187-198
23. Saha, T.; Yoshikawa, Y.; Sakurai, H. Chem. Med. Chem. 2007; 2, 218-225
24. Adachi, Y.; Yoshida, J.; Kodera, Y.; Sakurai, H. Chem. Lett. 2005; 34, 656-657
25. Yoshikawa, Y.; Adachi, Y.; Sakurai, H. Life Science. 2007; 80, 759.766
26. Galli, C.; Salas, P.; Pacheco, J. Revista de Química 2006; 20, 3-10
27. Karmaker, S.; Saha, T.; Yoshikawa, Y.; Sakurai, H. Macromolecular Bioscience 2009; 9, 279-286
28. Neuse, E. W. Metal-Based Drugs 2008; 1-19
Recibido el 27-09-2012
Aprobado el 10-10-2012













