Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.79 n.1 Lima ene./mar. 2013
TRABAJOS ORIGINALES
Evaluación in vitro de la actividad antimicrobiana de un extracto oleoso de poro (Allium ampeloprasumVar. porrum)
In vitro evaluation of antimicrobial activity of a pore oil extract (Allium ampeloprasum Var. Porrum)
Rosa María Dávila-Márquez*, Raúl Ávila Sosa-Sánchez1, Addí Rhode Navarro-Cruz1, Viridiana Téllez-Ruiz1, Martín Álvaro Lazcano-Hernández1
1 Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla, México. * rosamadavila@yahoo.com.mx
RESUMEN
Se probó la actividad antimicrobiana de extractos del poro (Allium ampeloprasum Var. porrum) obtenidos por métodos discontinuos (Tintura) y continuos (Soxhlet), empleando la prueba de difusión en agar y cinéticas de crecimiento bacteriano. Los resultados de la prueba de difusión en agar descartaron el extracto alcohólico por no presentar actividad antimicrobiana. En las cinéticas de crecimiento bacteriano se probaron diferentes concentraciones del extracto oleoso logrando la inhibición de Escherichia coli (91%), Staphylococcus aureus (72%,) y Bacillus cereus (65%). Se concluye que el extracto oleoso del poro representa un antimicrobiano natural eficaz in vitro.
Palabras clave: extracto, tintura, extracto oleoso, cinética de crecimiento bacteriano.
ABSTRACT
We tested the antimicrobial activity of extracts of the pore (Allium ampeloprasum Var. porrum) obtained by discontinuous method (Dye) and continuous (Soxhlet) using the agar diffusion test and kinetics of bacterial growth. The results of the agar diffusion test ruled out the alcoholic extract it not present antimicrobial activity. In the kinetics of bacterial growth are tested different concentrations of oil extract achieving inhibition of Escherichia coli (91%), Staphylococcus aureus (72%) and Bacillus cereus (65%). We conclude that the oil extract of the pore is a natural antimicrobial effective in vitro.
Key words: extract, dye, oil extract, kinetics of bacterial growth.
INTRODUCCIÓN
El uso de agentes químicos para prevenir o retardar el deterioro de alimentos deriva en parte del hecho, que tales compuestos son empleados en el tratamiento de enfermedades del hombre, animales y plantas lo cual no implica que todos los agentes quimioterapéuticos puedan ser empleados como conservadores de alimentos. Por otra parte, hay algunos compuestos químicos empleados en la preservación de alimentos que son inefectivos o tóxicos como quimioterapéuticos. Excepto algunos antibióticos, ninguno de los conservadores de alimentos empleados actualmente, tiene uso quimioterapéutico para personas o animales. Aunque un gran número de compuestos han sido descritos como potenciales conservadores, sólo un pequeño número se han empleado en alimentos debido a las estrictas reglas de seguridad dictadas por la Food and Drug Administration (FDA) o por el hecho que no todos los compuestos que presentan actividad antimicrobiana in vitro la conservan al ser adicionados a los alimentos.
Se han aislado alrededor de 12 000 compuestos con actividad antimicrobiana procedentes de organismos vegetales y se estima que constituyen sólo el 10% de los metabolitos secundarios.1
Probablemente los extractos con poder antimicrobiano mejor caracterizados del reino vegetal son los obtenidos de ajos (Allium sativum) y cebollas (Allium cepa). Walton y Lovell (1936) indicaron que los agentes volátiles tanto de la cebolla como del ajo inhibían a B. subtilis, Serratia marcenscens y algunas micobacterias en medios microbiológicos. Desde entonces se ha demostrado que el crecimiento y producción de toxinas de muchos microorganismos entre ellos B. cereus, C. botulinum tipo A, E. coli, Salmonella spp, Shigella spp y S. aureus, entre otros, son inhibidos por el ajo y la cebolla2. Cavallito y Barley en 1944 aislaron los principales compuestos antimicrobianos del ajo; identificaron el componente antimicrobiano como alicina. La alicina se forma por acción de la enzima aliinasa sobre la aliína. La reacción ocurre sólo cuando las células del ajo están desintegradas liberando la enzima para que actúe sobre el sustrato; una reacción similar ocurre en la cebolla2
El poro o puerro (Allium ampeloprasum Var. porrum) pertenece a la familia de las Liliáceas en donde están incluidos el ajo y la cebolla, pero a diferencia de los extensos estudios a los han sido sometidos el ajo y algunas variedades de cebolla3 casi no existen referencias al poro, razón por la cual en el presente trabajo se presenta la evaluación antimicrobiana in vitro de un extracto oleoso del poro.
PARTE EXPERIMENTAL
Material biológico
Los poros (Allium ampeloprasum Var. porrum) se obtuvieron en la central de abastos de la ciudad de Puebla. Los criterios de selección para la adquisición de los poros fueron: buen aspecto (sin magulladuras), buen color (blanco en el bulbo y verde glauco las hojas) y sin contaminación. La determinación de género y especie fue realizada por botánicos de la Facultad de Biología de la BUAP por comparación con sus bases de datos. Se empleó la parte comestible del poro (bulbo) al cual se le eliminó la primera capa de hojas; se lavó con agua destilada estéril, cortó en rodajas de entre 0,5 y 1cm. A una muestra se le determinó humedad en una termobalanza; al resto se le sometió a desecación química (sílica gel), hasta reducir la humedad al 60% para evitar pérdida de compuestos volátiles. El poro desecado se guardó en frascos secos que se almacenaron a temperatura ambiente en un lugar seco y obscuro hasta su empleo.
Las cepas bacterianas utilizadas se adquirieron del cepario de la Facultad de Ciencias Químicas de la BUAP, a las cuales se les realizaron antibiogramas (BIO – RADSA), tinción de Gram y pruebas bioquímicas4, 5 para asegurar la identidad de las mismas. Las cepas empleadas fueron: Escherichia coli, Staphylococcus aureus y Bacillus cereus.
El cloranfenicol empleado para los controles positivos fue un estándar secundario proporcionado por el área de farmacia de la Facultad de Ciencias Químicas.
Preparación de los extractos
El extracto etanólico (tintura) se obtuvo por maceración del poro desecado en etanol 96% en una relación 1:1 p/v; la maceración se realizó a temperatura ambiente durante cinco semanas en un frasco ámbar; al término se filtró la muestra con papel filtro Whatman número 1.
El extracto oleoso se realizó empleando 250 ml de éter etílico y 10 g del poro desecado, en el equipo Soxhlet6 hasta completar 12 reflujos, el extracto se evaporó en un rotavapor a sequedad; se pesó un gramo y se le agregó agua hasta obtener un peso final de 10 g, se sonicó por 2 tiempos de 30 minutos a 60 Hertz a fin de obtener una dispersión homogénea.
Actividad antimicrobiana
Las cepas fueron sincronizadas7 por pases sucesivos en caldo nutritivo y estandarizadas empleando como referencia el tubo número 1 del nefelómetro de McFarland.5
Difusión en agar
Se realizó siguiendo el método de Kirby- Bauer8 en agar Müeller–Hinton, empleando penicilindros en lugar de discos de papel; usando un asa de hockey se esparcieron 0,5 ml del cultivo estandarizado en la superficie del agar, en cada penicilindro se colocó 100 l del extracto respectivo (10%); en la misma placa se corrió un blanco y un control positivo con el antibiótico al que fue sensible la cepa (cloranfenicol).
Cinética de crecimiento
Para realizar la prueba de cinéticas de crecimiento microbiano8 se utilizó un baño con agitación (50 rpm), a temperatura constante de 37 ºC y matraces nefelométricos estériles; se utilizó un control positivo (bacterias + antibiótico + caldo nutritivo), un testigo (bacterias + caldo nutritivo) y para probar el extracto (bacterias + extracto + caldo nutritivo); el volumen final de cada matraz fue de 50 ml, se probó diferentes concentraciones del extracto y todas se realizaron por triplicado. Se midió la absorbancia cada hora durante un periodo de 9 horas continuas, con la ayuda de un espectrofotómetro a 520 nm (Leitz, Modelo M. serie Nº 33812). Los porcentajes de inhibición se obtuvieron comparando el promedio de las absorbancias de la última hora del testigo y el promedio de las absorbancias de la última hora de los matraces con extracto
Análisis estadístico
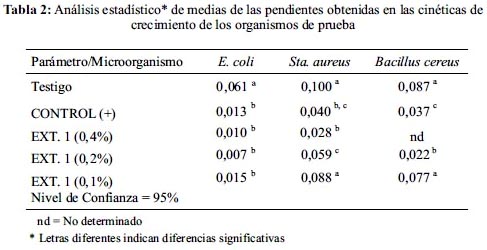
A los datos obtenidos se les realizó un análisis de varianza de una vía (ANOVA) con la ayuda del software MINITAB 14 (LEAD Technologies Inc.); se trabajó a un nivel de confianza del 95 % en el cual se analizó las medias de las pendientes de la parte logarítmica de cada una de las curvas de crecimiento y se determinó las diferencias significativas con la prueba de Tuckey.
RESULTADOS
La prueba por difusión en agar demostró que en la fase alcohólica no se encontraban principios activos antimicrobianos, no así en el extracto oleoso que demostró actividad contra las cepas probadas. En el caso de Bacillus cereus no se realizó el ensayo de difusión en agar; en la tabla 1 destaca el halo de inhibición con un valor de 8,4 cm contra E. coli.

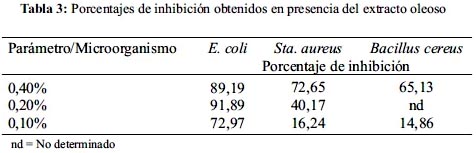
En el caso de las cinéticas de crecimiento se probaron concentraciones de 0,4%, 0,2% y 0,1% (v/v) de las cuales la mejor concentración varió con el microorganismo de prueba; para E. coli la más efectiva fue de 0,2% con un porcentaje de inhibición de 91,89%; el análisis estadístico demostró diferencia significativa entre el matraz testigo y los adicionados con el extracto, no así entre las diferentes concentraciones del extracto. En el caso de Staphylococcus aureus y Bacillus cereus la mejor concentración fue de 0,4% con un 72,65% y 65,13% de inhibición, respectivamente. (figuras 1, 2 y 3).
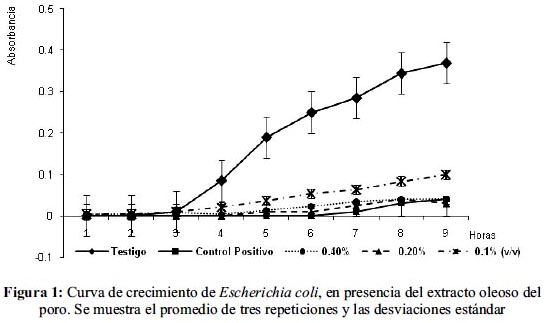
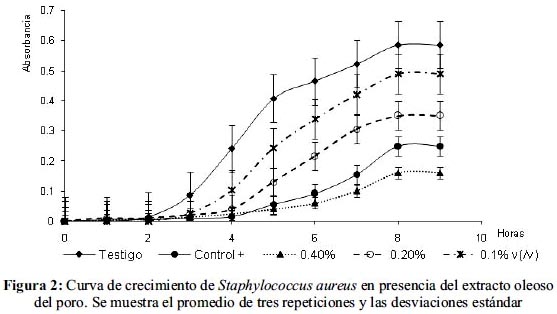
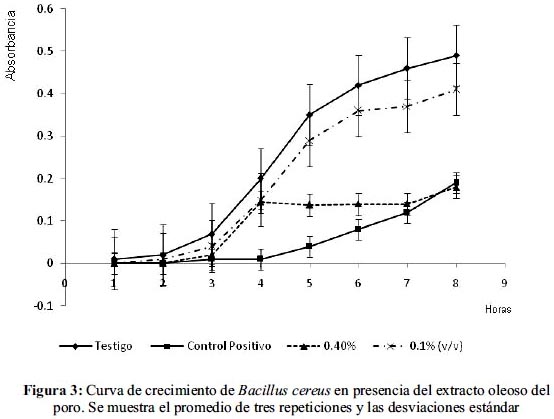
El análisis estadístico del crecimiento de Staphylococcus aureus demostró que la diferencia entre las pendientes es significativa entre las concentraciones 0,2% y 0,4% del extracto y respecto del control positivo; para Bacillus cereus existe una diferencia significativa entre la concentración de 0,4% y el control positivo y el testigo. (tablas 2 y 3)
DISCUSIÓN
Los halos de inhibición obtenidos en el ensayo de difusión en agar superan en mucho los marcados por la casa comercial del sensidisco (BIO – RADSA) ya que esta marca 2,4 cm para una cepa sensible lo que nos indica la alta actividad antimicrobiana del extracto del poro; esta técnica es muy utilizada para determinar la efectividad de un antimicrobiano; Burt y Reinder9 prueban la actividad antibacteriana de cinco aceites esenciales mediante la prueba de difusión en agar contra E. coli y obtuvieron que el aceite de orégano es efectivo contra esta bacteria con 2,4 cm de diámetro en el halo de inhibición; Bayramoglu et al10 encuentran resultados similares al utilizar aceite de orégano contra Bacillus cereus y Staphylococcus aureus utilizando la misma técnica obteniendo halos de inhibición de 4 y 4,5 cm de diámetro, respectivamente; la diferencia entre los halos de inhibición obtenidos tanto por Burt como por Bayramogluy y en este trabajo, radica en las concentraciones utilizadas ya que en el primer trabajo se utilizó el aceite esencial al 1%, mientras que en el segundo al 2% y en este trabajo al 10%; Echemendía et al11 demuestran la actividad in vitro del propoaromiel contra cepas aisladas de muestras clínicas, entre ellas Escherichia coli y Sta. aureus, mediante difusión en agar; utilizaron concentraciones similares a las aquí empleadas con resultados satisfactorios.
Las cinéticas de crecimiento presentadas por los microorganismos de prueba presentan, en general, un alargamiento en la fase de latencia y una disminución en la velocidad de reproducción, características de un comportamiento bacteriostático.
La inhibición demostrada contra E. coli es muy eficaz ya que comparada con trabajos previos como el de Marroquín et al12, que probaron la actividad antimicrobiana del apio contra esta bacteria, obtuvieron 55% de inhibición, porcentaje que es superado por todas las concentraciones aquí empleadas. Respecto a las concentraciones empleadas, Gutiérrez et al13 hacen una investigación con aceites esenciales y la combinación de éstos para potenciar el efecto inhibidor sobre bacterias como E. coli, Bacillus cereus, Lysteria monocytogenes y Pseudomona aeuriginosa, utilizando concentraciones que van desde 300 ppm hasta 50,000 ppm; las concentraciones empleadas en este trabajo están en este rango, incluso más bajas que las utilizadas por Gutiérrez et al; además, el poro por sí sólo presenta buenos porcentajes de inhibición.
El extracto provocó en Staphylococcus aureus que la fase de latencia se alargara por tres horas, aproximadamente, y la fase exponencial disminuyera; en las tres concentraciones empleadas sigue un comportamiento similar; por lo tanto se evidencia el efecto bacteriostático: a mayor concentración del extracto disminuye más la velocidad de crecimiento de la bacteria; sin embargo, aunque lento, sigue habiendo crecimiento. Lara et al14 prueban el extracto oleoso de tomatillo contra la misma bacteria obteniendo 23% de inhibición; comparado con el ejemplo anterior el extracto oleoso del poro es más efectivo.
En el caso de Bacillus cereus la concentración de 0,4% el extracto logró alargar la fase de latencia hasta las tres horas, disminuir la fase logarítmica y mantenerla casi constante durante casi 4 horas, demostrando una acción bacteriostática efectiva. Manzo et al15 prueban la efectividad del extracto oleoso de brócoli contra esta bacteria utilizando la misma técnica y obteniendo 8% de inhibición; porcentaje que es fácilmente superado por el extracto oleoso del poro; Demo et al16, probaron la actividad antimicrobiana de plantas aromáticas de Argentina contra diversas bacterias mediante la técnica de difusión en agar y encontraron que Bacillus cereus es susceptible a Aloysia triphylla con una concentración mínima inhibitoria de 0,5 mg/ml, por otro lado, Bonyadian y Moshtaghi17 obtienen una concentración mínima inhibitoria contra Bacillus cereus de 0,3% al probar el aceite esencial de menta por el método de dilución en caldo, provocando alargamiento en la fase de latencia y disminución en la fase logarítmica; lo mismo sucedió en el caso del extracto del poro a 0,4%; además, demuestra que la potencia con que se ejerce el efecto microbiano puede variar de acuerdo a las condiciones que se utilicen, la técnica, la planta, el tipo de extracto y que al utilizarse como un antimicrobiano in vivo podría haber otro tipo de factores que intervengan en su acción antimicrobiana.
CONCLUSIONES
Se demostró que el poro presenta principios activos antimicrobianos, que además son de naturaleza no polar, debido a que fue el extracto oleoso del poro, obtenido con un solvente orgánico de baja polaridad, el que demostró mejores resultados.
Las cinéticas de crecimiento bacteriano, corroboraron que las bacterias que se probaron, todas fueron sensibles a los extractos oleosos del poro, siendo la más sensible E. coli al inhibirla en un 91%; además, debido al comportamiento que siguieron las bacterias al estar en contacto con el extracto, se puede decir que la acción que ejerce el extracto es bacteriostática.
Estos resultados permiten proponer la necesidad de comprobar si el efecto es realmente bacteriostático o bactericida; además, de realizar estudios in vivo e in situ empleando sistemas modelo o directamente alimentos.
AGRADECIMIENTOS
Agradecemos a los departamentos de Microbiología y Farmacia de la Facultad de Ciencias Químicas de la BUAP, los apoyos brindados para la realización de este trabajo.
REFERENCIAS
1. Schultes, R. E. The kingdom of plants. En: Thomson, W.A.E. (Ed.) Medicines from the Earth. McGraw-Hill Book Co., New York.1978.
2. Doyle M. P., Beuchat L. R., Montville T. J. Microbiología de los alimentos. Fundamentos y fronteras. Ed. Acribia. España. 2001.
3. García, R. R.O., Herrera, A. F. C. Evaluación de la inhibición del crecimiento de cinco cepas bacterianas por extractos acuosos de Allium sativum, Allium fistulosum y Allium cepa: estudio preliminar in vitro. BISTUA 2007; 5 (2): 68-79
4. Macfaddin, M.F. Pruebas Bioquímicas para la Identificación de Bacterias de Importancia Clínica. 3a ed. Ed. Médica Panamericana. 2003.
5. Finegold, S. M.; Baron, E. J. Diagnóstico microbiológico. Editorial Médica Panamericana. Argentina.1989.
6. Kuklinski, C. Farmacognosia. Estudio de las drogas y sustancias medicamentosas de origen natural. Ediciones Omega. España.2003
7. Jawetz E., Melnick J. L., Adelberg E. A. Manual de microbiología. Ed. El manual moderno S. A. México.1975
8. Madigan M. T. Martinko J. M. Parker J. Biología de los microorganismos. Ed. Prentice Hall. USA. 2000.
9. Burt S.; Reinder R. Antibacterial activity of selected of plant essential oils against Escherichia coli O157: H7. Letters in applied microbiology. 2003;36: 162-167
10. Bayramoglu E.; Gülümser G.; Karaboz I. The investigation of antibacterial activities of some essential oils in Wet Blue Leather. International journal of natural and engineering sciences. 2008; 2 (1): 32-36
11.- Echemendía A.; Martínez M.; Carballo L.; Álvarez F.; Gutiérrez M.; Lago A.; Hidalgo P. Actividad "In Vitro" del propoaromiel contra cepas aisladas de muestras clínicas. Revista CENIC Ciencias Biológicas número especial 2005;36: sin número
12.- Marroquín G. I., Dávila M. R. M., Ávila S-S. R., Lazcano H. M. Identificación de sustancias con actividad antimicrobiana en apio (Apium graveolens). RESPYN Edición Especial 2006;2:6
13. Gutiérrez C., Barry R., Bourke P. The antimicrobial efficacy of plant essential oil combinations and interactions whit food ingredients. International journal of food microbiology. 2008; 124: 91-97
14. Lara S. A., Dávila M. R., Navarro C. A., Ávila S. R. Determinación de la actividad antimicrobiana del tomatillo (Physalis ixocarpa). RESPYN Edición Especial 2008; 2: 103
15. Manzo. M. J., Dávila M. R. M., Ávila S-S. R., Navarro C. A. R. Evaluación antimicrobiana del brócoli (Brassica oleracea Var. Itálica.)XIV XVI Seminario latinoamericano y del Caribe de Ciencia y Tecnología de los alimentos. Presentación en cartel. Habana, Cuba. 2006.
16. Demo M.; Oliva M.; López M.; Zunino M.; Zygadlo J. Antimicrobial activity of essential oils obtained from aromatic plants of Argentina. Pharmaceutical biology. 2005; 43(2):129-134
17. Bonyadian M.; Moshtaghi H. Bactericidal activity of some plants essential oils against Bacillus cereus, Salmonella typhimurium, Listeria monocytogenes and Yersinia enterocolitica. Research journal microbiology. 2008; 3 (11): 648-653.
Recibido el 10-12-2012
Aprobado el 08-02-2013













