Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú v.79 n.1 Lima ene./mar. 2013
TRABAJOS ORIGINALES
Análisis proximal, antinutrientes, perfil de ácidos grasos y de aminoácidos de semillas y tortas de 2 especies de Sacha inchi (Plukenetia volubilis y Plukenetia huayllabambana)
Proximate analysis, antinutrients, fatty acids and amino acids profiles of seeds and cakes from 2 species of sacha inchi: Plukenetia volubilis and Plukenetia huayllabambana
Candy Ruiza, Camilo Díazb, José Anayac, Rosario Rojasa,b*
a Unidad de Investigación en Productos Naturales, Laboratorios de Investigación y Desarrollo, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia. Av. Honorio Delgado 430, Lima 31, Perú, rosario.rojas@upch.pe
b Departamento de Ciencias Celulares y Moleculares, Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia.
c ALINAP SAC.
RESUMEN
Se determinó la composición proximal, perfil de aminoácidos, perfil de ácidos grasos y el contenido de antinutrientes (saponinas y taninos) de las semillas y tortas (residuos después de la extracción del aceite) de las especies Plukenetia huayllabambana y Plukenetia volubilis. Las semillas de P. huayllabambana, proveniente de la provincia Rodríguez de Mendoza, poseen mayor contenido de aceite (54,3 versus 49,0%), mientras que las procedentes de la provincia de San Martín (P. volubilis) mostraron mayor contenido de proteínas (29,6 versus 24,5 %). Asimismo, el contenido proteico de la torta de P. volubilis es mayor que el de P. huayllabambana (59 y 46%, respectivamente). El contenido de aminoácidos esenciales de las semillas de ambas especies de Plukenetia es el adecuado de acuerdo a lo recomendado por la FAO/OMS, a excepción de los aminoácidos lisina y leucina. Tanto en semillas como en tortas, la concentración de ácido linoleico (omega-6) es mayor en P. volubilis, mientras que el linolénico (omega-3) se encuentra en mayor proporción en P. huayllabambana.
Palabras clave: Ácidos grasos, aminoácidos, Plukenetia volubilis, Plukenetia huayllabambana, sacha inchi.
ABSTRACT
We determined the proximate composition, amino acid profile, fatty acid profile and antinutrients contents (saponins and tannins) of seed and cakes (residues after oil extraction) of Plukenetia huayllabambana and Plukenetia volubilis. The seeds of P. huayllabambana, from the province of Mendoza Rodríguez, has higher oil content (54.3 versus 49.0%), while those from the province of San Martín (P. volubilis) showed higher protein content (29.6 versus 24.5%). Furthermore, protein content of P. volubilis´cake is greater than the one of P. huayllabambana (59 and 46%, respectively). The essential amino acid content of the seeds of both Plukenetia species is adequate, as recommended by the FAO/WHO, except for the amino acids lysine and leucine. In cakes, as well as seeds, the concentration of linoleic acid (omega-6) was larger in P. volubilis, while linolenic acid (omega-3) was found in greater proportion in P. huayllabambana.
Key words: Aminoacids, fatty acids, Inka peanut, Plukenetia huayllabambana, Plukenetia volubilis.
INTRODUCCIÓN
El género Plukenetia L. (Euphorbiaceae) está constituido por 19 especies, de las cuales 12 se encuentran en el neotrópico y las restantes en el viejo mundo. En el Perú se ha reconocido las especies Plukenetia volubilis, P. brachybotrya, P. polyandenia, P. loretensis y, más recientemente, se ha descrito la nueva especie P. huayllabambana.1-3
La especie más cultivada en el Perú es P. volubilis, la cual crece entre los 30 a 2110 msnm en los departamentos de Amazonas, Cusco, Junín, Loreto, Pasco, San Martín y Madre de Dios. Esta especie es muy reconocida por sus semillas con alto contenido de proteínas, tocoferoles y aceite rico en ácidos grasos omega-3 y omega-6.4-10 Luego de la extracción del aceite por medio de solventes o prensado queda un residuo ("torta") que es rico en proteínas de alto valor nutricional.11
Otra especie que se está cultivando principalmente en la provincia de Rodríguez de Mendoza (Amazonas) es P. huayllabambana, la cual crece a más altura (1 300 a 2 200 msnm) y posee semillas de mayor tamaño que P. volubilis. Un estudio técnico menciona que P. huayllabambana poseería mayor contenido de ácidos grasos monoinsaturados que P. volubilis.12
El presente trabajo tuvo como objetivo conocer el potencial nutricional de las semillas y residuos de extracción del aceite ("tortas") de las especies Plukenetia volubilis y Plukenetia huayllabambana determinando la composición proximal, perfil de ácidos grasos, perfil de aminoácidos y antinutrientes (saponinas y taninos) de dichas muestras.
PARTE EXPERIMENTAL
Equipos. Espectrofotómetro Shimadzu UV/Vis 1240. Cromatógrafo líquido de alta performance (HPLC), Elite LaChrom: bomba L-2130, detector DAD L-2455, Software EZChrom Elite Client/Server versión 3.2. La columna analítica utilizada fue Superspher® STAR RP-18e (250 mm x 4,6 mm, 4 µm de tamaño de partícula). Cromatógrafo de gases Agilent Technologies 7890A acoplado a un detector selectivo de masas Agilent Technologies 5975C. Se empleó una columna capilar polar HP-FFAP (30 m x 250 µm x 0,25 µm).
Reactivos. Ácido tánico, reactivo de Folin–Ciocalteu, kit de L- aminoácidos y cloruro de dabsilo, fueron adquiridos de Laboratorios SIGMA-Aldrich.
Muestras. Las muestras botánicas y semillas de P. huayllabambana y P. volubilis fueron colectadas e identificadas por el biólogo Camilo Díaz en marzo del 2011. Las muestras de herbario de cada especie fueron depositadas en el Herbario de la Sección de Ciencias Farmacéuticas de la Universidad Peruana Cayetano Heredia. Los respectivos residuos ("tortas") obtenidos de cada una de las especies luego de la extracción del aceite por medio de prensado fueron suministrados por la empresa ALINAP SAC (Sr. José Anaya). Las 4 muestras obtenidas fueron codificadas de la siguiente manera:
-
AI-RM-05
TRM
AI-SM-062
TSM
Análisis proximal
El análisis proximal de cada una de las muestras fue realizado según los métodos recomendados por la AOAC13: Humedad, por secado de las muestras a 105 °C durante 3 h en una estufa; proteínas (N x 6,25) por método de Kjeldahl; grasas por método de Soxhlet; cenizas por incineración en mufla; fibra por tratamiento con ácido y base; carbohidratos por diferencia (100 – porcentaje de cada uno de los anteriores).
Determinación de taninos
Se siguió la metodología descrita por Lastra et al14, según la cual las muestras son previamente extraídas con una mezcla de acetona – agua (7:3) durante 4 horas en un equipo Soxhlet. Luego de filtrar y evaporar el solvente en un rotaevaporador, se cuantificó el contenido de taninos en el residuo por medio de una curva de calibración, teniendo como estándar al ácido tánico a concentraciones de 0,025 – 0,15 mg/ml. Se midió la absorbancia de las soluciones en un espectrofotómetro a la longitud de onda de 700 nm.
Determinación del contenido de saponinas
Cada una de las muestras fue sometida a una extracción con metanol por 4 horas en un equipo Soxhlet. Luego de filtrar y evaporar el solvente en un rotaevaporador, el residuo fue distribuído en una mezcla de agua y diclorometano (1:1). La fase acuosa fue extraída con 1- butanol, separando luego la fase orgánica para concentrarla a sequedad en un rotaevaporador. El residuo se disolvió con agua destilada en una fiola de 100 ml y 1 ml de esta solución fue mezclado con 1 ml de ácido sulfúrico concentrado y 1 ml de cloruro de cobalto al 0,2%. Se dejó reposar la mezcla por 10 minutos y se midió su absorbancia en un espectrofotómetro a la longitud de onda de 284 nm15. Para la cuantificación de saponinas en la muestra problema se preparó una curva de calibración con soluciones de saponina a concentraciones de 0,025 a 0,15 mg/ml.
Determinación del perfil de aminoácidos
Se pesó aproximadamente entre 1 a 6 mg de los 20 L–aminoácidos (Sigma-Aldrich) en una fiola de 10 ml y se enrasó con agua destilada. Se tomó 0,5 ml de la solución y se agregó 0,5 ml de HCl 12N, 30 μl de 2-mercaptoetanol y se burbujeó la mezcla con gas nitrógeno, calentando a 110 °C por 24 horas.
De igual manera, se tomó 0,5 ml de la mezcla de aminoácidos y añadió 0,5 ml de NaOH 8 N y se burbujeó la mezcla con gas nitrógeno y se calentó a 110 °C por 24 horas.
Ambas soluciones hidrolizadas se neutralizan y concentran; después se traspasa a una fiola de 10 ml y se enrasa con solución de bicarbonato de sodio 50 mM.
Para preparar la curva de calibración de aminoácidos se tomó alícuotas de 20, 40, 80 y 160 µl de la solución stock de mezcla de aminoácidos y se llevó cada solución a un volumen final de 160 µl con solución de bicarbonato de sodio 50 mM. Se adicionó luego a cada tubo 260 µl de la solución de cloruro de dabsilo 12,4 mM. Se calentó las mezclas a 70 °C por 10 minutos, luego de los cuales se agregó 580 µl de solución buffer de fosfato: etanol (1:1). Se inyectó 10 µl de las mezclas derivatizadas en el HPLC.
Se pesó aproximadamente 1-3 mg de muestra y se hidrolizó y derivatizó de manera similar al procedimiento para la mezcla de estándares de aminoácidos. Se inyectó 10 µl de la muestra derivatizada en el HPLC.16
Perfil de ácidos grasos
Los ácidos grasos fueron extraídos usando pentano como solvente y esterificados con KOH al 0,1% en metanol. Luego de filtrar, se inyectó 1 µl de la muestra en el cromatógrafo de gases acoplado a espectrómetro de masas.17 Las condiciones cromatográficas fueron las siguientes: split ratio 20:1; temperatura de inyección 250 °C; temperatura del horno se mantuvo a 150 °C por 1 minuto, para luego iniciar un gradiente de temperatura (2,5 °C/min) hasta alcanzar 230 °C, manteniendo esta temperatura final por 1 minuto. El gas de arrastre usado fue helio a un flujo de 0,63 ml/min.
RESULTADOS Y DISCUSIÓN
Los resultados del análisis proximal muestran que las semillas de Plukenetia huayllabambana se destacan por su mayor contenido de grasas en comparación con las de P. volubilis (54 y 49%, respectivamente). Ambas especies presentan, inclusive, mayor contenido de aceite que otras semillas oleaginosas, como por ejemplo las de soya (19%), maní (45%), algodón (16%) o girasol (48%).4
Además del aceite, las semillas contienen un alto porcentaje de proteínas; pero en este caso más bien se observa que el contenido proteico es mayor para P. volubilis (29,6%) que para P. huayllabambana (24,5%).
Algo similar ocurre para las tortas, donde el mayor contenido de aceite sigue siendo para la especie P. huayllabambana y el mayor contenido de proteínas para P. volubilis (tabla 1), lo cual implicaría que para la extracción de proteínas o elaboración de hidrolizados proteicos a partir de semillas o tortas, la especie más promisoria sería P. volubilis.
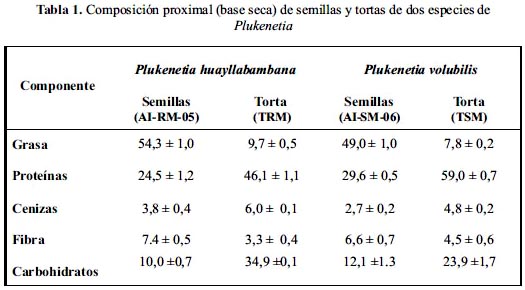
El porcentaje de proteína (29,6%) y grasas (49,0%) hallado por nosotros para P. volubilis es mayor al reportado por Gutiérrez (24,7% y 42%, respectivamente), para una muestra procedente de Colombia. Por otro lado, Pascual reporta un mayor contenido de grasas (54,9%), pero menor porcentaje de proteínas (25,9%).5 Las diferencias observadas en la composición proximal de P. volubilis pueden deberse a diversas variables, como por ejemplo, el lugar de procedencia, tipo de almacenamiento de las semillas y su tratamiento post-cosecha. El análisis proximal de los residuos de extracción del aceite (torta) realizado por Pascual5 muestra resultados muy similares a los nuestros (tabla 1); sin embargo, Mondragón11 reporta para la torta de P. volubilis un contenido residual de aceite mucho mayor (37,3%), lo cual implicaría que el método de extracción utilizado no fue el óptimo.
No se ha encontrado reportes previos en la literatura científica sobre la composición proximal de semillas y torta de P. huayllabambana.
En la tabla 2 se observa que, para ambas especies, el perfil de ácidos grasos de las semillas es prácticamente igual al de las tortas, denotando que el proceso de extracción utilizado no degradó dichos componentes. No se encontró diferencias en la concentración de ácidos grasos saturados, monoinsaturados o poliinsaturados en las 4 muestras analizadas; pero cabe destacar que el contenido de ácido linoleico (omega-6) es mayor en P. volubilis, mientras que el linolénico (omega-3) se encuentra en mayor proporción en P. huayllabambana.
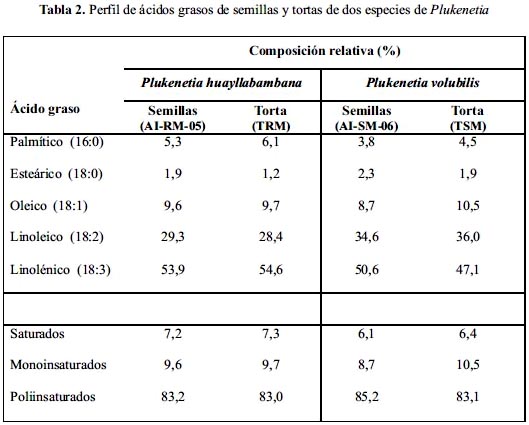
El perfil de ácidos grasos reportado para semillas de P. volubilis procedente de Colombia6 es similar a lo encontrado por nosotros; sin embargo, Pascual y Mejía5 y Hamaker et al4 y encontraron menor porcentaje de ácido linolénico (43,8-45,2%).
En la tabla 3 se muestra el perfil de aminoácidos de semillas y tortas de ambas especies de Plukenetia. Se puede observar, que a excepción de lisina y leucina, ambas semillas estarían cumpliendo con los requerimientos de aminoácidos en la dieta recomendados por la FAO para todos los grupos etáreos, excepto los infantes.
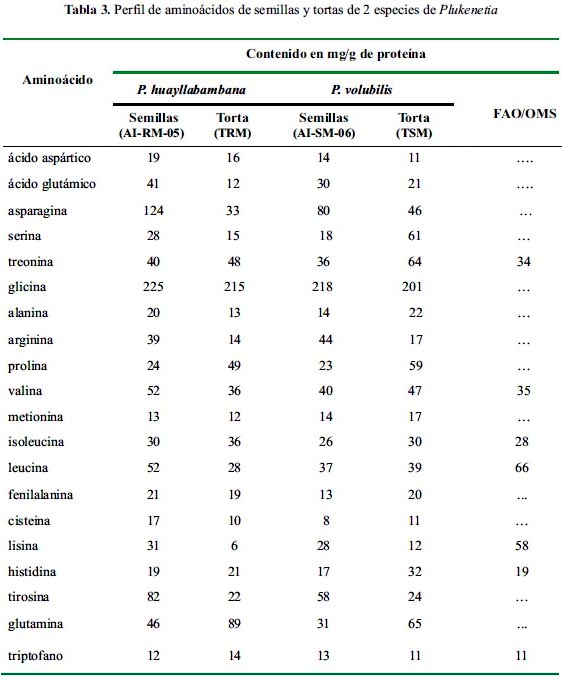
En el caso de las tortas nosotros encontramos una deficiencia en los aminoácidos lisina, leucina, metionina+cisteína y fenilalanina+tirosina. Estas mismas deficiencias fueron reportadas en el trabajo de Mondragón, aunque en mayor proporción.
Si bien, las semillas y tortas de ambas especies de Plukenetia son promisorias para la alimentación humana, es necesario confirmar que el contenido de anti-nutrientes no sea elevado. Los anti-nutrientes como los taninos pueden unirse o precipitar las proteínas digestivas disminuyendo su capacidad de digerir los alimentos. En el caso de las saponinas, se ha visto que algunas de ellas pueden ser hemolíticas.
En la tabla 4 se observa que las semillas de P. volubilis presentan mayor concentración de taninos que las de P. huayllabambana; aunque a valores menores a lo reportado en semillas de soya (34,9 mg/100 g muestra).18
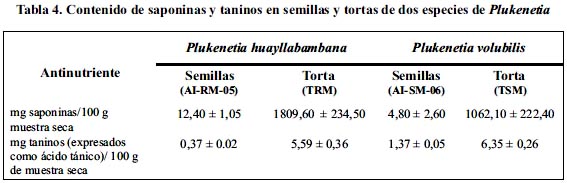
El mayor contenido de saponinas lo poseen las semillas de P. huayllabambana (tabla 4); pero no supera el valor encontrado para la soya (34,6 mg/100 g muestra).18
CONCLUSIONES
Las semillas de Plukenetia huayllabambana se destacan por su mayor contenido de grasas en comparación con las de Plukenetia volubilis (54 y 49%, respectivamente); por el contrario, el contenido proteico de esta última es mayor (29 versus 25%). Asimismo, el contenido proteico de las tortas es más alto en P. volubilis (59%) en comparación con P. huayllabambana (46%). Sin embargo, ambas especies son deficientes en los aminoácidos esenciales lisina y leucina. La concentración de ácidos grasos saturados, monoinsaturados o poliinsaturados es similar en las tortas y semillas de ambas especies; pero cabe destacar que el contenido de ácido linoleico (omega-6) es mayor en P. volubilis, mientras que el linolénico (omega-3) se encuentra en mayor proporción en P. huayllabambana.
AGRADECIMIENTO
El presente trabajo de investigación fue llevado a cabo gracias al auspicio del FIDECOM- Innóvate Perú (Proyecto 160-FINCYT-FIDECOM-PIPEI-2010: Aprovechamiento de la torta de sacha inchi (Plukenetia volubilis y Plukenetia huayllabambana) en la obtención de hidrolizados proteicos, mediante un proceso enzimático estandarizado, para su uso en la industria alimentaria, farmacéutica y cosmética).
REFERENCIAS
1. Rodríguez, A., Corazon-Guivin, M., Cachique, D., Mejía, K., Del Castillo, D., Renno, J- F., García-Dávila, C. Revista Peruana de Biología, 2010; 17, 325.
2. Dostert, N., Roque, J., Brokamp, G., Cano, A., La Torre, M.I., Weigend, M. Factsheet: Datos botánicos de Sacha Inchi. Plukenetia volubilis L. Proyecto Perú Biodiverso. GTZ- SECO-MINCETUR. 2009.
3. Bussmann, R., Tellez, C., Glenn, A. Nordic Jounal of Botany, 2009; 27, 313.
4. Hamaker, B.R., Valles, C., Gilman, R., Hardmeier, R.M., Clark, D., García, H.H., et al. Cereal Chemistry, 1992; 69, 461.
5. Pascual, G., Mejia, M. Extracción y Caracterización de aceite de sacha inchi. Anales Científicos, 2000; XLII, 146.
6. Gutiérrez, L-F., Rosada, L-M., Jiménez, A. Grasas y aceites., 2011; 62, 76.
7. Maurer, N.E., Hatta-Sakoda, B., Pascual-Chagman, G., Rodriguez-Saona, L.E. Food Chemistry, 2012; 134, 1173.
8. Follegatti-Romero, L.A., Piantino, C.R., Grimaldi, R., Cabral, F.A. Journal of Supercritical Fluids, 2009; 49, 323.
9. Castaño, D.L., Valencia M.P., Murillo, E., Mendez, J.J., Joli, J.E. Revista Chilena de Nutrición, 2012; 39, 45.
10. Fanali, C., Dugo, L., Cacciola, F., Beccaria, M., Grasso, S., Dacha, M., et al. Journal of Agricultural and Food Chemistry, 2011; 59, 13043.
11. Mondragón, I. Estudio farmacognóstico y bromatológico de los residuos industriales de la extracción del aceite de Plukenetia volubilis L. (Sacha inchi), Tesis para optar el título profesional de Químico Farmacéutica, Universidad Nacional Mayor de San Marcos. Lima, Perú, 2009.
12. Estudio Técnico sobre los Ácidos Grasos de Sacha Inchi – Amazonas, http://es.scribd.com/doc/80846345/Estudio-Tecnico-sobre-los-Acidos-Grasos-de-Sacha-Inchi-Amazonas (último acceso 29 de octubre 2012).
13. AOAC Official Methods of Analysis, 18th Edition (2005), métodos 925.40, 981.10, 942.05, 978.10.
14. Lastra, H., Rodríguez, E., Ponce, H., Gonzáles, M. Revista Cubana de Plantas Medicinales, 2000; 51, 17.
15. Vigo, C., Narita, E., Marqueza, L. Revista Brasilera de Farmacognosia, 2003; 14, 46.
16. Ribeiro, P.B., Andrade, B.M., Silva, P., Baptista, R.M., Seabra, R.M., Valentão, P. Journal of Agricultural and Food Chemistry, 2008; 56, 10973.
17. Frank, D., Pat, S., Allen, V. Agilent Column Selection for the Analysis of Fatty Acid Methyl Esters, Agilent Technologies, 2005.
18. Odumodu, C.U. Continental Journal of Food Science and Technology, 2010; 4, 38.
Recibido el 20-12-2012
Aprobado el 17-01-2013













