Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.1 Lima Jan./Mar. 2013
TRABAJOS ORIGINALES
Efecto in vitro del cromo (VI) sobre un biomarcador tumoral p53 y daño al ADN en hepatocitos murinos
In vitro effect in murine hepatocytes of chromium (VI) on a p53 tumor biomarker and DNA damage
Pavel Delgado Sarmiento1*, Corina Vera Gonzales2, Carlos Arenas Chávez3
1* Escuela de Ingeniería Química, Universidad Nacional de San Agustín, Av. Venezuela s/n Arequipa. pavelds1@yahoo.com
2 Escuela de Química, Universidad Nacional de San Agustín, Av. Venezuela s/n Arequipa
3 Facultad de Ciencias Farmacéuticas, Bioquímicas y Biotecnológicas, Universidad Católica Santa María, Urb. San José s/n Umacollo Arequipa.
RESUMEN
El cromo es un metal pesado de uso múltiple en las diferentes especialidades que abarca la ciencia y tecnología en el mundo. Sin embargo, el cromo (VI) provoca daños en el ser humano por ingestión en dosis concentradas; produciendo anomalías en diferentes tipos de células; lo cual ha sido reportado por el Organismo Panamericano de Salud y Organismo Mundial de la Salud.
En el presente trabajo se plantea el estudio de los efectos del cromo (VI) in vitro en hepatocitos murinos, los cuales fueron cultivados en diferentes concentraciones (10, 20, 50 y 100 µM) de cromo (VI) y se evaluó el efecto sobre la viabilidad celular, DNA y la formación o expresión de la proteína p53. Los resultados de la investigación confirman que los hepatocitos tratados con el cromo (VI), inducen una disminución de la viabilidad celular en una relación: tiempo y dosis dependiente y en cuanto al estudio de la proteína p53 se observó que a partir de la concentración de 20 µM de cromo (VI), se inició la expresión de la proteína p53 incrementándose ésta a mayores concentraciones.
Se concluye, que el efecto citotóxico del cromo (VI) sobre los hepatocitos, implica el incremento de la expresión de la proteína p53 e inducción de muerte celular por apoptosis. Por otro lado, los resultados muestran que el cromo (VI) promueve la fragmentación del DNA, siendo ésta, dependiente de la concentración.
Palabras clave: Cromo, hepatocitos, viabilidad celular, proteina p53, DNA.
ABSTRACT
Chromium is a heavy metal of multiple use in different areas of science and technology in the world. Nevertheless by information of organizations like the Health Ministry, it has been reported that chromium causes damage in the human being by ingestion in concentrated doses; producing anomalies in different types of cells, which has been reported by the Pan American Health Organization and World Health Organization.
This paper focuses on the study of the effects of chromium (VI) in murine hepatocytes, which were cultured in vitro in different concentrations (10, 20, 50 and 100 M) of chromium (VI) and assessed its effects on cell viability, DNA and expression of p53 protein.
The results of in vitro research confirm that hepatocytes treated with the chromium (VI), induces a decrease in cell viability in its form and dose-dependent and time for the study of p53 protein was observed that as the concentration of 20 M of chromium (VI) started p53 protein expression at higher concentrations this increase.
The conclusion is that the cytotoxic effect of chromium (VI) on hepatocytes, involves Increased expression of p53 and induction of apoptotic cell death. Furthermore, the results show that chromium (VI) promotes DNA fragmentation, this being dependent on the concentration.
Key words: Chrome, hepatocytes, cell viability, p53 protein, DNA.
INTRODUCCIÓN
Un aspecto importante a tener en cuenta cuando se aborda el estudio de la toxicología del cromo, son las especies químicas que presenta y la doble relación que a través de ellas ejerce sobre la salud del individuo. El cromo (III), se comporta como un elemento esencial para la vida, al intervenir en procesos bioquímicos y fisiológicos indispensables. Pero el cromo (VI), se comporta como un elemento altamente tóxico para la salud del individuo1,2.
El cromo (VI) y sus compuestos, son sustancias que se han venido estudiando desde hace aproximadamente 30 años en varios países, en relación con sus efectos adversos en la salud del individuo al entrar en contacto con ellos, especialmente en el medio ocupacional y también por exposiciones de carácter ambiental3.
La proteína p53 se la conoce como el guardián del genoma, debido a que es fundamental para mantener su integridad, impidiendo la acumulación de mutaciones originadas ya sea por mecanismos propios en la célula como por la acción de agentes externos a ella y puede activarse y desactivarse en distintos tejidos y fases de la enfermedad. La proteína se activa como respuesta a determinadas señales, como las fragmentaciones del ADN. Esta activación implica una ralentización del ciclo celular para permitir a la célula reparar este daño. En el caso de que el daño no sea reparado a tiempo, la activación de p53 conduce a una muerte celular programada (apoptosis). Esto hace que el gen que la codifica, llamado Tp53 en los humanos, sea considerado un gen supresor de tumores, ya que su inactivación puede facilitar la progresión de muchos tipos de células tumorales.4-8.
Con el fin de estudiar con mayor amplitud los efectos de las diferentes concentraciones del cromo (VI) en células hepáticas de murinos, se planteó el siguiente trabajo de investigación a nivel celular y molecular, para conocer el efecto sobre la viabilidad celular, el DNA y la activación de la proteína p53. Los resultados de la investigación permitirán ser proyectadas a células humanas, y desarrollar medios de prevención.
PARTE EXPERIMENTAL
Aislamiento de hepatocitos
Los hepatocitos fueron extraídos del hígado de ratas blancas (Rattus norvegicus) de la variedad Wistar, de tres meses de edad, a las que se les proporcionó agua y alimento ad libitum. El aislamiento de los hepatocitos se realizó según Yu-I et al.9 Se aisló 5 x 106 células, las cuales fueron cultivadas en medio Roswell Park Memorial Institute Medium (RPMI)-1640 y sembradas en diferentes pocillos para los tratamientos respectivos.
Tratamiento de hepatocitos para el estudio del efecto de la concentración y tiempo
Para esta evaluación fueron sembrados 1 x 106 hepatocitos por cada pocillo en medio RPMI-1640 y tratados con diferentes concentraciones (5, 10, 20 y 50 µM) de cromo (VI) y NaCl 0,9% (control) durante 24 horas. Por otro lado se evaluó diferentes tiempos de incubación (1, 3, 6, 12 y 24 horas) con una concentración de cromo VI (10 µM) y NaCl 0,9% (control).
Determinación de la viabilidad celular
Para determinar la viabilidad celular se hizo recuentos en una cámara de Neubauer utilizando la técnica de exclusión con Azul de Tripán (0,04%)10. En un tubo eppendorf se agregó 85 µl de NaCl al 0,9%, 5 µl de Azul de Tripán y 10 µl de la suspensión de hepatocitos de los diferentes tratamientos. Se consideró las células coloreadas de azul como células muertas y las no coloreadas como células vivas; se realizó tres repeticiones por cada ensayo.
Extracción del ADN
Las células fueron lisadas en 0,4 mL de buffer de lisis e incubadas a 37C durante 12 horas. Transcurrido el tiempo de incubación se agregó a cada una de las muestras un volumen igual de la mezcla fenol/cloroformo/alcohol isoamílico (25:24:1). Se mezcló bien por inversión durante 10 segundos. Se centrifugó las muestras por 5 minutos a 13,500 rpm.
Se transfirió la fase acuosa a un nuevo tubo eppendorf y se precipitó el ADN adicionando 2 volúmenes de etanol absoluto frío. Luego se recuperó el ADN por centrifugación a 13,500 rpm durante 1 minuto. Se enjuagó el pellet con etanol a 70%, luego se decantó el etanol y se secó el pellet a medio ambiente. Se resuspendió el ADN en buffer Tris/EDTA(TE) (1mL/mg de tejido); para facilitar la solubilidad se incubó con agitación a 65 C. Luego se guardó el ADN a –20 C.
Cuantificación y determinación de la pureza del ADN
Se preparó una dilución 1:200 del ADN en buffer TE obtenido y se realizó lecturas por espectrofotometría a 260 y 280 nm. El cociente de la absorbancia a 260 y 280 nm debe ser mayor a 1,8; si el cociente es menor a esta cantidad nos estaría indicando que el ADN está contaminado con proteínas. Se determinó la concentración de ADN teniendo en cuenta que:
Abs260 1=50 μg/ml de ADN de doble cadena.
Electroforesis del ADN
Se preparó el gel de agarosa al 1,8%. Una vez preparado el gel se colocó en la cámara de electroforesis y se cubrió con el buffer Tris/Borate/EDTA (TBE) 0,5X. Las muestras de ADN se mezclaron con el loading buffer 6X y se cargó 10μg de ADN por cada pozo del gel. Se cargó también 5L del marcador de peso molecular. La corrida electroforética se realizó a 130 V durante 50 min; terminada la electroforesis, se visualizaron las bandas de ADN iluminando el gel con una lámpara de luz ultravioleta y se tomó fotos al gel para su análisis.
Identificación de p53
Electroforesis de proteínas
Se preparó un gel poliacrilamida al 10%11. Se colocó 10 µg de proteínas totales12 obtenidas (para cada una de las muestras) en los pozos del gel. La corrida electroforética se realizó a 150 V durante 1 hora.
Western Blot
Se preparó el sistema utilizando el casette de transferencia. Se ensambló los componentes en el siguiente orden: sobre la rejilla roja del casette se colocó la esponja / papel filtro / membrana / gel / papel filtro / esponja / rejilla negra.
Se transfirió las proteínas a 350 mA durante 3 horas. Todo el proceso de transferencia se realizó entre 15-20 °C.
Inmunodetección
Una vez terminada la transferencia se colocó la membrana en la solución de bloqueo (albúmina 3% o leche en polvo descremada 5% en Buffer Fosfato Salino –Tween (PBS-T)) y se incubó a temperatura ambiente durante toda la noche en refrigeración.
Luego se adicionó el primer anticuerpo (anti-p53 de ratón) diluido 1:1000 y se incubó la membrana con el anticuerpo durante toda la noche en refrigeración. Seguidamente se lavó la membrana con Buffer fosfato salino y se adicionó el segundo anticuerpo (anti-mouse IgG- HRP) diluido 1:5000 y se incubó durante 1 hora a temperatura ambiente con agitación suave. Finalmente, las membranas fueron reveladas por el método Quimio-luminiscencia Intensificada. (ECL).
Cuantificación de óxido nítrico (NO)
Se evaluó la concentración de nitritos en cada uno de los sistemas como un indicador de la producción de óxido nítrico por los hepatocitos. Se midió 500 L de sobrenadante y se mezcló con 500 μL del reactivo de Griess; dejándolo en reposo durante cinco minutos, luego las muestras fueron leídas en un espectrofotómetro a 540 nm; se utilizó el NaNO2 como estándar.
RESULTADOS Y DISCUSIÓN
Efecto de la concentración de cromo (VI) sobre la viabilidad celular de hepatocitos murinos
Se cultivó hepatocitos en medio RPMI-1640 en presencia de NaCl 0,9% (control) con concentraciones variables de cromo (5, 10, 20 y 50 µM) y se evaluó en un tiempo de 24 horas empleando el método Azul de Tripán. La tabla 1 muestra las repeticiones de los porcentajes de viabilidad celular en los diferentes sistemas.
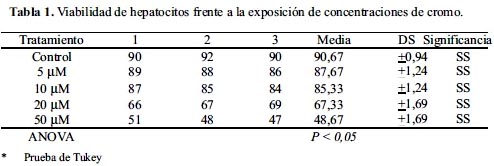
De la tabla 1 se tiene que en el lapso de 24 horas la viabilidad en el cromo (VI) a la concentración de 5 y 10µM promueve una disminución significativa con respecto al control; pero el cromo (VI) a 20 µM promueve una disminución más significativa de la viabilidad celular con respecto al control.
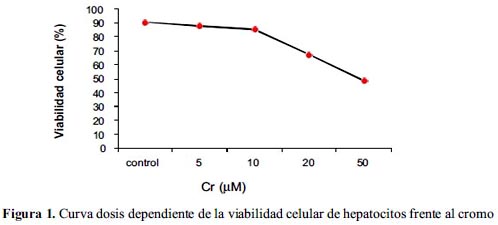
El cromo (VI) a 50 µM produce menor viabilidad celular con respecto a los controles de todos los sistemas de estudio, lo que significa que la viabilidad celular disminuía a medida que se incrementaba la concentración de cromo (VI); se hizo en tres muestras iguales y paralelas teniendo de base un control.
En la figura 1, se observa una disminución de la viabilidad celular de hepatocitos conforme aumenta la concentración de cromo; es decir, que existe una relación inversa entre ambas variables.
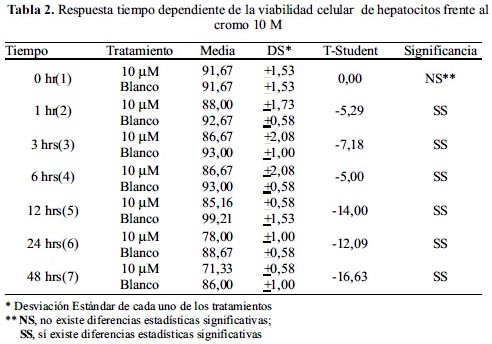
Efecto del tiempo de incubación con cromo (VI) sobre la viabilidad celular de hepatocitos murinos
Se cultivó hepatocitos en medio RPMI-1640 en presencia de NaCl 0,9% (control) a una concentración de cromo (VI) 10 µM y se evaluó el porcentaje de viabilidad empleando el método de Azul de Tripán en tiempos de 1, 3, 6, 12, 24 horas.
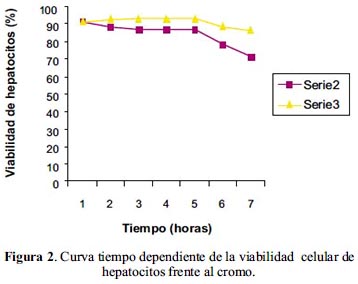
Como se observa en la tabla 2, la viabilidad celular en diferentes lapsos de tiempo pero a igual concentración de cromo, a una hora, no presenta mucha diferencia con respecto al control; de igual manera a 3 y 6 horas de tiempo transcurrido. Al cabo de 12 horas la disminución en la viabilidad celular se hacía más significativa, y finalmente, al transcurso de 24 horas, la disminución de la viabilidad celular era más significativa de todos los sistemas de estudio.
En la figura 2, se observa una disminución de la viabilidad de los hepatocitos conforme aumenta el tiempo de incubación, guardando una relación inversa entre ambas variables.
Influencia del cromo (VI) sobre la fragmentación del ADN
Los hepatocitos en un número de 5 x 106 fueron incubados en presencia de NaCl 0,9 % (control) y a concentraciones variables (10, 20, 50 y 100 µM) de cromo (VI) por 24 horas.
El ADN aislado de los hepatocitos murinos de los diferentes sistemas fueron electro- separados en un gel de agarosa al 1,5%; los resultados en la figura 3 muestran que el NaCl 0,9% (control) no indujo la fragmentación del ADN, mientras que el tratamiento de células con cromo (VI) sí indujo la fragmentación, como lo muestra el patrón en escalera (ladder pattern) de los fragmentos de ADN múltiplos de 180 pares de bases; los cuales son producto del clivaje internucleosomal propio del proceso apoptótico.
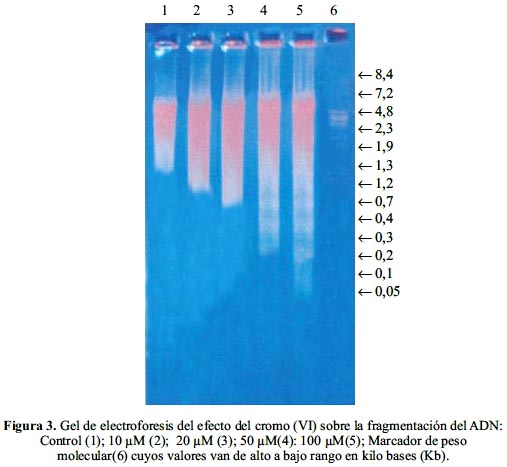
Las bandas del patrón en escalera del ADN se intensifican conforme aumenta la concentración de cromo (VI), como se puede observar en la línea que corresponde a 100 µM en donde la intensidad y número de los fragmentos es mayor con relación al control y los demás sistemas. Estos resultados sugieren que el cromo (VI) induce a la fragmentación del ADN en una manera dependiente de la concentración.
Estudio de la expresión de p53
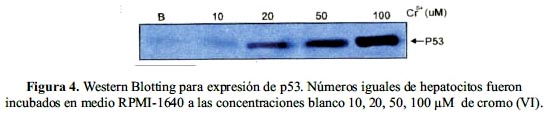
Fueron cultivados 5 x 106 células hepáticas en medio RPMI-1640 a concentraciones de 10, 20, 50 y 100 µM de cromo (VI); se realizó una extracción de proteínas totales y luego se separó en geles al 10% de poliacrilamida SDS-PAGE. Las proteínas separadas fueron transferidas a membranas de difluoruro de polivinilo (PVDF), a la que se le agregó el anticuerpo contra la proteína p53 (anti-p53), y finalmente, se procedió al revelado quimio-luminiscente.
En la figura 4 se observa la expresión de la proteína p53; donde aparecen las bandas de expresión correspondientes a las concentraciones 10, 20, 50 y 100 µM de cromo (VI) las que se hacen más intensas a medida que la concentración aumenta, manteniéndose activas luego de 12 horas de evaluación.
Resultados de cuantificación de óxido nítrico en hepatocitos
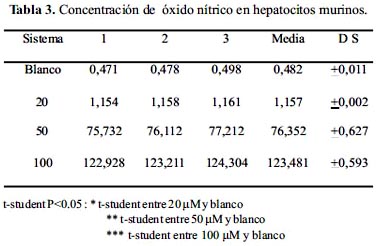
Un número de 5 x 106 hepatocitos fueron cultivados en medio RPMI-1640 a concentraciones de 10, 20, 50 y 100 µM de cromo (VI) durante 12 horas; luego se centrifugó y se midió 500 μL del sobrenadante y se mezcló con 500 μL del reactivo Greiss; observándose un cambió de color que fue de incoloro a violeta; se le dejó reposar 15 minutos y se realizó lecturas en el espectrofotómetro; los resultados se muestran en la tabla 3.
En la figura 5 se observa un incremento de radicales libres de óxido nítrico (NO) conforme aumenta la concentración de cromo.
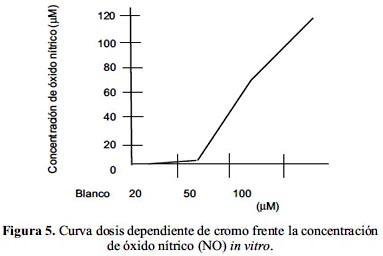
En la tabla 3 y figura 5 se muestra los valores de óxido nítrico (NO) generados por los macrófago murinos, expuestos a diferentes concentraciones de cromo. Se puede apreciar que la producción de óxido nítrico guarda una relación directa con la concentración de cromo; obteniéndose la mayor producción de óxido nítrico (123,481 uM) para la concentración de 100 μM de cromo
CONCLUSIONES
-
El cromo (VI) disminuye la viabilidad celular de hepatocitos murinos expuestos a las concentraciones desde 5 a 100 µM en una manera dependiente de la concentración.
-
La proteína p53 se evidenció a partir de una concentración de 20 µM de cromo (VI) incrementándose esta expresión a mayor concentración del metal.
-
La fragmentación del ADN de hepatocitos murinos in vitro se observó a partir de concentraciones de 20 µM de cromo (VI).
-
El efecto del cromo (VI) en hepatocitos va acompañado de una producción de radicales de óxido nítrico.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Nacional de San Agustín y a la Sociedad Química del Perú.
BIBLIOGRAFIA
1. Capo M. Principios de Ecotoxicología, Diagnóstico, Tratamiento y Gestión del Medio Ambiente. Madrid: Mc Graw Hill; 2002.
2. Enciclopedia de salud y seguridad en el trabajo. Productos Químicos. 3a ed. Madrid: Ministerio de trabajo y asuntos sociales; 2001.
3. Téllez Mosquera J, Carvajal Roxs M, Gaitan Ana M. Aspectos toxicológicos realcionados con la utilización del cromo en el proceso productivo de curtiembres. Rev Fac Med Univ Nac Colomb 2004; 52 (1): 50-61.
4. Campbell M, Farrel S. Bioquímica. México: Thomson Editores; 2004. 352-353.
5. Voet D, Voet J. Bioquímica. Buenos Aires; Editora Médica Panamericana S.A. 2006. p. 1558.
6. Harvey L. Biología celular y molecular. Buenos Aires; Editora Médica Panamericana S.A. 2006. 958-961
7. Landolph J. Molecular mechanism of transformation of C3H/10T1/1C1 8 mouse cells and diploid human fibroblast by carcinogenic metal compounds. Environmental Health Perspectives. 1994; 102 (3): 119-124.
8. Manning C, Blankenship L, Wise J, Xu J, Bridgewater L, Patierno S. Induction of internucleosomal DNA fragmentation by carcinogenic chromate: relationship to DNA damage, genotoxicity, and inhibition of macromolecular synthesis. 1994; 102 (3):159-176.
9. Yu-I W, Shivendra D. Ethanol alters angiotensin II stimulated mitogen activated protein kinase in hepatocytes: agonist selectivity and ethanol metabolic independence. European journal of pharmacology 2000; 398(3):323-331.
10. Bernabé JC, Tejedo J, Rincón P, Cahuana G, Ramírez R, Sobrino F, and Bedoya F. Sodium nitroprusside-induced mitochondrial apoptotic events in insulin-secreting rinm5f cells are associated with map kinases activation. Experimental cell Research. 2001; 269: 222–229.
11. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227(5259):680-685.
12. Bradford MM. Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976; (72): 248–254.
Recibido el 17-01-2013
Aprobado el 18-02-2013













