Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.2 Lima Apr./Jun. 2013
TRABAJOS ORIGINALES
Evaluación teórica de la reactividad química en especies indólicos 5-sustituido
Theoretical evaluation of chemical reactivity in species 5-substituted indole
Ronald Ruiz1, Luis G. Calvo1, Jean P. Incháustegui1, Rodolfo Pumachagua1*
1 Universidad Nacional Federico Villarreal, Facultad de Ciencias Naturales y Matemáticas, Jr. Chepén s/n (El Agustino) Perú. rpumachagua@gmail.com
RESUMEN
En este trabajo se determina las propiedades estructurales y electrónicas en especies indólicas como: geometrías de mínima energía, energía electrónica (E), potencial químico (µ), dureza molecular (η) e índice de nucleofilia (N) de moléculas tipo indoles 5-sustituido, así como la aplicación de la función de Fukui para determinar el carácter nucleofilico de moléculas tipo indólico. Los datos fueron obtenidos mediante métodos derivados de la Teoría del Funcional de Densidad utilizando el funcional híbrido B3LYPy la base 3-21G.
Palabras clave: Teoría del funcional de densidad, función de Fukui, indol, carácter nucleofílico.
ABSTRACT
In this paper are reported the theoretical calculations of structural and electronic properties in indoles species (type molecules indoles 5–replaced) such as minimum energy geometries, electronic energy (E), chemical potential (µ), molecular hardness (η) and nucleophilicity index (N); additionally the Fukui function is evaluated to determine the nucleophilicity character of indole-like molecules. The data were collected using methods derived from Density Functional Theory using the hybrid functional B3LYPand the 3-21G basis.
Key words: Density functional theory, Fukui function, indoles, nucleophilicity character.
INTRODUCCIÓN
La Teoría Funcional de Densidad (DFT) ha tenido una fuerte influencia en la evolución de la Química Cuántica durante los pasados 25 años. Basada sobre los teoremas de Hohenberg y Kohn, el DFT provee una base para el desarrollo de estrategias computacionales para obtener información sobre la energía, estructura y propiedades de átomos y moléculas a un costo mucho más bajo que las técnicas tradicionales ab initio 1-3.
Los programas utilizados en química computacional están basados en diferentes métodos de la química cuántica que resuelven la ecuación de Schrödinger asociada al Hamiltoniano molecular. Métodos que no incluyen ningún parámetro empírico o semi-empírico en sus ecuaciones (siendo derivadas directamente de principios teóricos, sin la inclusión de datos experimentales), son llamados métodos ab initio. Esto no implica que la solución sea exactamente una; son todos cálculos aproximados de mecánica cuántica. Esto significa que una aproximación está rigurosamente definida en base a los primeros principios (teoría cuántica) y su resolución es con un margen de error que es cualitativamente conocido de antemano. El tipo más simple de cálculo de estructura electrónica ab initio es el método de Hartree-Fock (HF) empleado en este estudio, una extensión de la teoría de orbitales moleculares, en la cual la correlacionada repulsión electrón-electrón no es específicamente tomada en cuenta; sólo su efecto promedio es incluido en los cálculos. Como el tamaño de las bases de conjunto es incrementado, la energía y la función de onda tienden a un límite llamado el límite Hartree-Fock 4.
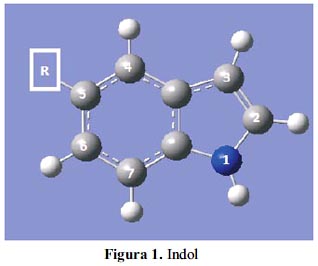
La estructura del indol (figura 1) se halla en muchos productos naturales, tales como las proteínas y los alcaloides. Diversos pigmentos, como el índigo y la púrpura de Tiro, son dímeros del indol. El objetivo de este trabajo es evaluar índices globales de reactividad derivados dentro del formalismo de la DFT, utilizando modelos computacionales sencillos. Nuestra motivación radica en poder evaluar la viabilidad y confiabilidad de la utilización de estos modelos y así poder expandir nuestros estudios a sistemas de mayor complejidad. Como parte de nuestro estudio presentamos un análisis comparativo con otros datos teóricos obtenidos de la literatura, además de comparar, cuando es posible, con datos experimentales. Nuestro estudio nos permite establecer que incluso modelos teóricos muy económicos y sencillos nos permiten una adecuada descripción cualitativa y una aceptable descripción cuantitativa acerca de la reactividad en los sistemas estudiados.
FUNDAMENTOS TEÓRICOS
La teoría del funcional de la densidad (DFT)5-6 postula que la densidad de estados electrónicos, tanto para el núcleo v(r), como para los electrones se encuentra relacionada con el número total de electrones (N), a partir de la normalización de la función de densidad electrónica, tal como:
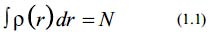
Donde, el número de electrones N y el potencial externo núcleo-electrón v(r) permiten obtener el Hamiltoniano molecular óptimo, teniendo en cuenta la aproximación de Born-Oppenheimer y sin efectos relativistas.
Por tanto, la DFT proporciona una base para el desarrollo de estrategias computacionales, donde es posible obtener información sobre las propiedades energéticas y estructurales de átomos y moléculas. De esta manera, es posible abordar la reactividad química teóricamente, ya que esta teoría presenta el formalismo matemático para la descripción cualitativa y cuantitativa de las respuestas de un sistema químico frente a diferentes perturbaciones
Descriptores globales
Estos descriptores permiten medir la respuesta global de un sistema a diferentes perturbaciones manteniendo el potencial externo constate. Entre las propiedades electrónicas globales se tiene el potencial químico electrónico µ, (identificado como el negativo de la electronegatividad -χ, la dureza química η, y la blandura S, las cuales se definen como:
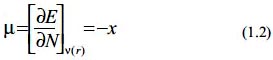
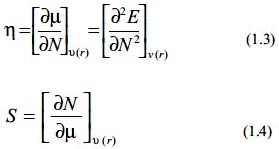
Descriptores locales
Por otro lado, las propiedades locales están descritas a través de índices como la densidad electrónica, la función de Fukui f(r) y la blandura local s(r), los cuales se definen como:
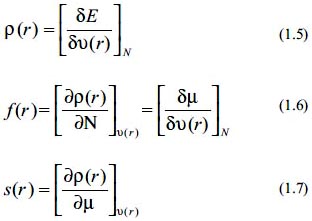
Respecto a la función de Fukui se ha demostrado que está relacionada con la blandura local mediante la siguiente expresión:
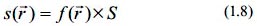
De esta manera la función de Fukui actúa como un proyector local o regional de la blandura global entregando la información acerca de la reactividad local del sistema definido. En la función de Fukui se representa la sensibilidad del potencial químico debido a una perturbación externa.

La función de Fukui representa el cambio de la densidad electrónica cuando el número de electrones cambia.
Para un ataque por parte de una especie nucleofílica se calcula de la siguiente manera:
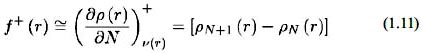
Para un ataque por parte de una especie electrofílica se desarrolla:
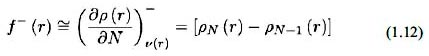
Para un ataque por parte de un radical:
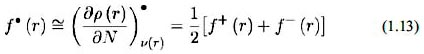
ASPECTOS COMPUTACIONALES
Todos los cálculos fueron llevados a cabo en el programa Gaussian 09. Los cálculos DFT fueron ejecutados utilizando el funcional B3LYP, con la función base 3-21G. Las optimizaciones de geometría se realizaron empleando el método por gradiente analítica de Berny, que consiste en el caso más simple en minimizar una función real eligiendo sistemáticamente valores de entrada tomados de un conjunto permitido y luego computando el valor de la función, logrando así elegir el mínimo más estable energéticamente en la molécula.
Todos los valores de la función de Fukui fueron calculados a partir de diferencias de cargas de Mulliken para el grupo de moléculas.
Esto parte del análisis poblacional de Mulliken en el cual se obtiene la siguiente integral que nos representa el número de electrones que hay en cada orbital atómico; es decir, que cada elemento de la diagonal del producto (PS) en la sumatoria, es el número de electrones en el orbital atómico.
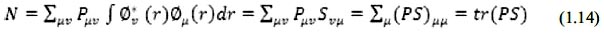
Es fácil ver que podemos asignar así una carga efectiva por cada átomo si sumamos el número de electrones en cada orbital atómico asociado a un átomo menos la carga positiva del núcleo.
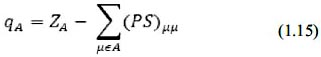
RESULTADOS Y DISCUSIÓN
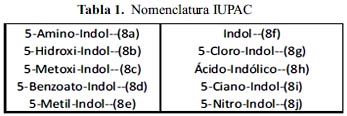
Estudio de reactividad a través de los índices de Fukui (tablas 1 y 2)
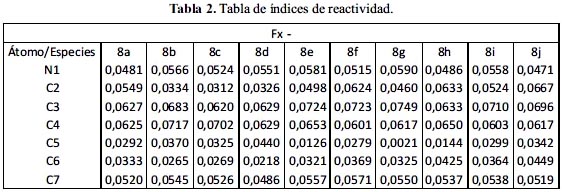
Para determinar las zonas más susceptibles a un ataque electrofílico, calculamos los índices de Fukui utilizando la ecuación (1.12)
En el 5-amino-indol se observa la zona de ataque electrofílico en los carbonos: 2, 3 y 4; lo mismo ocurre en el 5-hidroxi-indol.
Para el 5-metoxi-indol observamos que el ataque electrofílico sucede sobre los carbonos: 4, 3 y 2; pero el carbono 4 presenta una diferencia mucho más notoria en comparación con la de los carbonos: 3 y 2, por lo que el ataque se realizaría con una mayor probabilidad sobre el carbono 4. Para el benzoato-5-indol, los carbonos: 4, 3 y 2 presentan el mismo índice de reactividad para el ataque electrofílico, con una diferencia de milésimas favoreciendo al carbono 4.
En el 5– metil–indol, el carbono 3 presenta mayor susceptibilidad a ser atacado; presenta un poder nucleofílico mucho mayor en comparación con los otros carbonos. En el indol se observa en los carbonos: 3 y 2.
Para el 5-cloro-indol se observa un gran poder nucleofílico en el carbono 3, es decir, presenta más susceptibilidad electrofílica en comparación con otros sistemas.
En el caso del ácido indólico la posición más propensa a sufrir un ataque electrofílico es la posición 4, a diferencia de la posición 6 que está más cercana al pirrol; debido a ello aumenta su capacidad para donar electrones por la deslocalización electrónica de esta posición en particular.
Para el 5-ciano-indol se obtuvo que los carbonos más nucleofílico son los carbonos: 3 y 4; este sustituyente no ejerce influencia marcada sobre las características del núcleo indol.
Para el 5-nitro-indol las posiciones más reactivas son los carbonos: 3 y 2, muy similares a las características del indol.
Las especies indoles 5-sustituido a través de los índices locales de reactividad de Fukui, muestran los sitios reactivos para el ataque electrofílico y/o mayor capacidad nucleofílica, que difieren por efecto del sustituyente en la posición 5.
Esta característica se debe en gran parte a la deslocalización electrónica del anillo bencénico y pirrólico que muy claramente afecta a las cargas que componen estos sistemas. Se observa que al sustituir con estos grupos funcionales, la reactividad en el caso del núcleo indólico varía entre el carbono 4, 3 y 2, dando como consecuencia los sitios con más tendencias a sufrir el ataque.
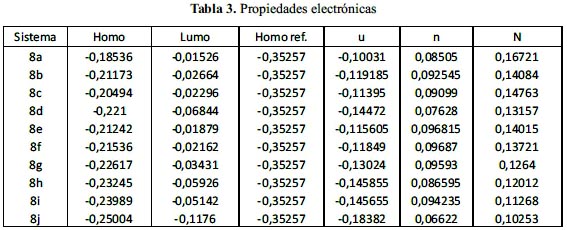
Propiedades electrónicas de las moléculas (figura 2)
Discusión y análisis de especies indólicas versus datos experimentales
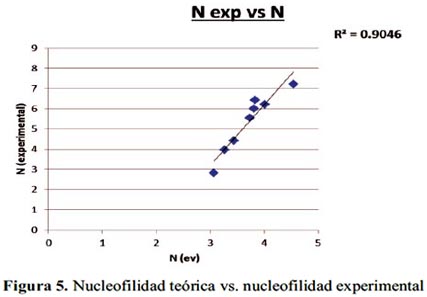
En la tabla 4, los sistemas d y j no son considerados para realizar el gráfico; ellos no disponen de valores experimentales.
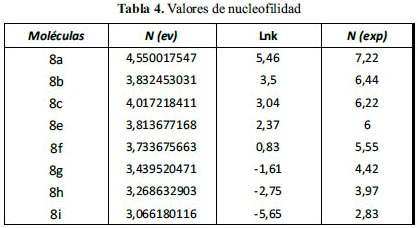
Para confirmar la veracidad de nuestras observaciones discutimos los valores del índice de nucleofilia N (eV), obtenidos por las energías del HOMO, con los valores experimentales disponibles7-8 para moléculas indólicas mono sustituidas.
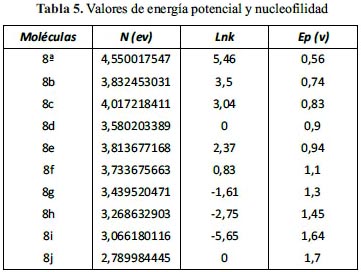
En la tabla 3, se reporta las propiedades calculadas como la energía de los orbitales de frontera, el potencial químico (µ), la dureza química (η) y los valores de la nucleofilia (N) expresados en Hartree.
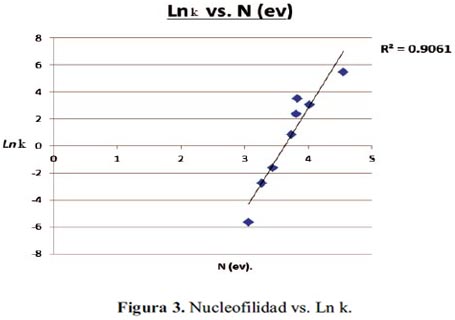
En la figura 3, se observa los valores de la nucleofilia versus Ln k (constante de velocidad). La correlación entre ambos es aceptable, obtenemos una constante de regresión de 0,9061.
En la figura 5 se grafica los valores de la nucleofilidad experimental versus la nucleofilidad teórica, observando buena correlación. Los cálculos presentan mínima variación en comparación con la figura 3.
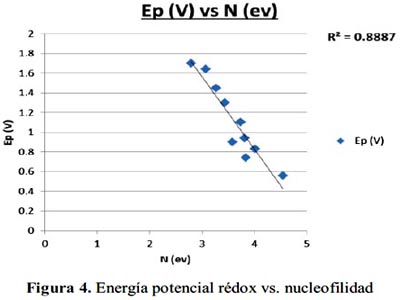
Finalmente, en la figura 4 se analiza los valores de la nucleofilidad versus la energía potencial rédox, en voltios, presentando una constante de correlación de 0,8887.
CONCLUSIONES
Los resultados muestran la utilidad del modelo teórico (B3LYP) con la función base 3-21G, que permiten una adecuada descripción de la reactividad en sistemas derivados indólicos.
La evaluación de la energía del orbital de frontera HOMO como escala teórica de nucleofilia, ademas de descriptores locales como la función de Fukui, correlaciona aceptablemente el índice de nucleofilia con los valores reportados en la literatura para sistemas indolicos sustituidos.
Encontramos un patrón de referencia de la reactividad química entre el núcleo indólico y variados grupos sustituyentes.
AGRADECIMIENTO
Los autores agradecen al Dr. William Tiznado Vásquez de la Universidad Andrés Bello, Santiago de Chile, por brindarnos soporte computacional.
REFERENCIAS
1. Hohenberg P. & Kohn. W., Phys. Rev, 1964; 136:B864-B871.
2. P. Geerling, F. De Proft & W. Langenaeker, Chem. Rev., 2003;103: 1793-1873.
3. Pratim Kumar Chattaraj, Utpal Sarkar & Debesh Ranjan Roy, Chem. Rev., 2006; 106:2065-2091.
4. Attila Szabo & Neil S. Ostlund, Modern Quantum Chemistry: Introduction to Advanced Electronic Structure Theory, Dover Publications, Inc., New York, 1996.
5. Robert G. Parr & Weitao Yang, Density-Functional Theory of Atoms and Molecules, Oxford University Press, New York, 1989.
6. Robert G. Parr & Weitao Yang, Density-Functional Theory of the Electronic Structure of Molecules, Annu. Rev. Phys. Chem., 1995; 46:701-728.
7. Thanh Binh Phan, Martin Breugst & Herbert Mayr, Angew. Chem. Int. Ed., 2006; 45:3869-3874.
8. Luis R. Domingo & Patricia Pérez, Org. Biomol. Chem., 2011; 9:7168-7175.
Recibido el 18-03-2013
Aprobado el 09-04-2013













