Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.2 Lima Apr./Jun. 2013
TRABAJOS ORIGINALES
Variación de la capacidad antioxidante y compuestos bioactivos durante el procesamiento del néctar de zarzamora (Rubus fructicosus L.)
Variation of the antioxidant capacity and bioactive compounds during processing of wild blackberry (Rubus fructicosus L.) nectar
Cristina E. Valencia Sullcaa* , Américo Guevara Pérezb
a * Mg.Sc. Ingeniero Agroindustrial. cristina.valencia.sullca1@gmail.com
b Dr. Ingeniero en Industrias Alimentarias. Universidad Nacional Agraria La Molina, Lima.
RESUMEN
Se estudió la variación de la capacidad antioxidante, compuestos fenólicos totales, antocianinas y vitamina C durante el proceso de elaboración del néctar de zarzamora. Se encontró una reducción del contenido de compuestos fenólicos totales (mg de ácido gálico /100 g de muestra b.s) y antocianinas (mg cianidina 3- glucósido / 100 g de muestra b.s.), de 2234,15 y 640,81 (materia prima), a 2086,54 y 472,08 debido al pulpeado-refinado; 914,40 y 188,24 en el estandarizado, a 974,866 y 181,96 por efecto del homogeneizado, 860,71 y 190,85 en el pasteurizado, respectivamente. Asimismo, el néctar reduce su capacidad antioxidante (µmol Trolox/g b.s.) y vitamina C (mg de ácido ascórbico / 100 g muestra b.s.) durante el proceso de 217,66 y 84,41 (materia prima) a 188,48 y 68,13 en el pulpeado -refinado, a 130,09 y 59,86 en el estandarizado, 152,57 y 47,84 en el homogeneizado y a 92,21 y 30,50 en el pasteurizado, respectivamente.
Palabras clave: Compuestos fenólicos, capacidad antioxidante, antocianinas, vitamina C, pulpeado, estandarizado.
ABSTRACT
It was studied the variation of antioxidant capacity, total phenolic compounds, anthocyanins and vitamin C during the process of elaboration of wild blackberry nectar.
It was found a reduction in total phenolic compounds 400.67 (mg gallic acid/100 g sample d.b.), and anthocyanins (mg cyanidin 3-glycoside/100 g sample d.b.) from 2234.15 and 640.81 (raw material) to 2086.54 and 472.08 during pulping-refined, 914.40 and 188.24 standardized, 974.866 and 181.96 by effect of homogenized, 860.71 and 190.95 in pasteurized, respectively. Also, the néctar decreased its antioxidant capacity (µmol Trolox/g d.b.) and vitamin C (mg ascorbic acid/100 g sample d.b.) during processing from 217.66 and 84.41 (raw material) to 188.48 and 68.13 in pulping-refined, 130.09 and 59.86 in standardized, 152.57 and 47.84 in homogenized, 92.21 and 30.50 in pasteurized, respectively.
Key words: Phenolic compounds, antioxidant capacity, anthocyanins, vitamin C, pulping, standardized.
INTRODUCCIÓN
La zarzamora (Rubus fructicosus L.) es un fruto que contiene vitaminas C, E, Ay complejo B, principalmente niacina, tiamina y riboflavina, lo cual la convierten en una fruta muy útil para el tratamiento y la prevención de enfermedades circulatorias1. Lo que en realidad caracteriza a esta fruta es la abundancia de pigmentos naturales (antocianinas) que además de conferirle su color y sabor característico, tienen acción antioxidante y por tanto neutralizan los radicales libres evitando los efectos dañinos en el organismo. Para esto será necesario evitar las pérdidas de los compuestos químicos durante el procesamiento, lo que conlleve a realizar investigaciones para determinar el grado de conservación de tales compuestos por efecto de las operaciones unitarias a la que se expone la materia prima.
Por lo expuesto, la investigación se orientó a determinar la influencia de las condiciones de procesamiento en la capacidad antioxidante y compuestos bioactivos durante el procesamiento de esta fruta y obtener un producto natural que conserve los compuestos funcionales favorables para el consumidor; para tal efecto se plantearon los siguientes objetivos:
-
Evavaluar la variación de los compuestos fenólicos, la capacidad antioxidante, antocianinas y vitamina C, debido al efecto del proceso durante la elaboración del néctar.
-
Determinar la composición fisicoquímica de la zarzamora y del néctar obtenido.
PARTE EXPERIMENTAL
Lugar de ejecución
Las pruebas experimentales se realizaron en los Laboratorios de Análisis de Alimentos, Microbiología y Planta Piloto de Tecnología de Alimentos y Productos Agropecuarios (TAPA), de la Universidad Nacional Agraria La Molina.
Materia prima e insumos
Zarzamora orgánica proveniente del distrito de Mala -Cañete, azúcar blanca refinada, estabilizante grado alimentario: Carboximetilcelulosa (CMC).
Equipos
Refinadora marca Reeves (tipo 100 – IV 1F-18), molino coloidal tipo A11ZMA: 5,4 HP, potenciómetro marca Schott5 Garate (CG 728. USA), refractómetro manual (Atago 0-32 0Brix. Japón), vortex Mixer (Wizard & Classic Velp), balanza analítica marca (And, FX – 300 MK II, máximo 310 g, d= 0,1 mg. USA), centrífuga (Hettich Zentrifugen), espectrofotómetro (Espectronic. Génesis S. Milton Roy), refrigeradora (General Electric), agitador de tubos, selladora de bolsas manual (Marca Machintek. KF-300 H), centrífuga y agitador magnético (Cimarec, Thermolyne).
Reactivos
Ácido gálico (Sigma Aldrich), carbonato de sodio (Mallinckrodt), persulfato de potasio de grado analítico de Harleco 7575®, etanol absoluto al 96%, reactivo de Folin Ciocalteu 2N (Sigma Aldrich), metanol 99,8% (Sigma Aldrich), 2,2`- azino – bis (3- etilbenzotiazolina – 6 – ácido sulfónico) o ABTS (Sigma Aldrich) y otros especificados en los métodos de análisis.
Análisis físico-químicos
Análisis proximal2: Humedad (Método AOAC 942 -15), ceniza ( Método AOAC 940-26), proteína (Método AOAC 920-152), grasa ( Método AOAC 986-25), fibra bruta (Método AOAC 930 -10), carbohidratos (diferencia), determinación de pH (Método AOAC 981-12), sólidos solubles (Método AOAC 931-12).
Azúcares reductores3: Método AOAC 941.9 -942.9
Vitamina C3: Método AOAC 967.21.
Antocianinas: Por el método espectrofotométrico del pH diferencial (Giusti y Wrolstad)4. Las lecturas se realizaron a una longitud de onda de 550 nm (absorbancia de antocianinas) y a 700 nm (para correcciones de presencia de materiales coloidales suspendidos en la muestra).
Cuantificación de compuestos fenólicos: Por el método espectrofotométrico (Swain y Hillis)5 que se basa en la cuantificación espectrofotométrica del complejo coloreado formado por la reacción entre los compuestos fenólicos y el reactivo Folin Ciocalteu. Las lecturas se realizaron a una longitud de onda de 755 nm (absorbancia de compuestos fenólicos).
Capacidad antioxidante: Por el método espectrofotométrico (Arnao)6; el método permite evaluar la capacidad antioxidante debido a la decoloración de un radical libre preformado por la acción del compuesto antioxidante. Las lecturas se realizaron a una longitud de onda de 734nm (absorbancia de capacidad antioxidante).
Evaluación estadística
Los resultados de los compuestos fenólicos, capacidad antioxidante, antocianinas y vitamina C (por triplicado), fueron expresados como la media de tres determinaciones ± desviación estándar y la variación en las etapas de proceso evaluados estadísticamente. En un diseño completo al azar (DCA) las diferencias significativas fueron tratadas mediante las pruebas de comparación múltiples de las medias de Tukey. Los análisis estadísticos fueron corridos por el programa Statgraphycs Centurión versión 16.
Preparación de los extractos
Compuestos fenólicos y capacidad antioxidante con el método ABTS: Para todas las muestras se pesó 5 g y se añadió 25 mL de metanol al 80%; se homogenizó la muestra con un agitador magnético durante 5 minutos en la obscuridad; se transvasó la mezcla obtenida con cuidado en tubo cónico protegido de la luz y se dejó en maceración por 24 horas a una temperatura de 4 ºC. Transcurrido el tiempo de maceración se procedió a centrifugar la muestra a 4000 rpm, luego se filtró el extracto en papel Whatman Nº 4; el sobrenadante se colocó en frascos ámbar de 20 mL y se mantuvieron a -18 ºC hasta su análisis.
Para proceder a la cuantificación de la capacidad antioxidante se tomó 150 µL de la muestra y se adicionó 2850 µL de la solución de ABTS diluida. Al mismo tiempo se corrió un blanco con 150 µL de metanol para obtener un factor de corrección.
Materia prima: En la materia prima clasificada se efectuó los siguientes análisis por triplicado: análisis proximal, acidez titulable, °Brix, pH, vitamina C, antocianinas, compuestos fenólicos totales y capacidad antioxidante (ABTS).
Pulpeado y refinado, estandarización, homogeneizado y pasteurizado: Se evaluó el contenido de compuestos fenólicos totales, la capacidad antioxidante (ABTS), la vitamina C con el objetivo de determinar la influencia de las operaciones realizadas en cada uno de estos componentes.
Caracterización: El producto obtenido fue caracterizado en los siguientes análisis por triplicado: proximal, energía total, azúcares reductores, pH, °Brix, acidez titulable, capacidad antioxidante, compuestos fenólicos, antocianinas y vitamina C.
RESULTADOS Y DISCUSIÓN
En la tabla 1 se muestra la composición fisicoquímica del fruto de zarzamora. Se encontró 0,93% de proteínas, 0% de grasa, 13,19% de carbohidratos y 0,42% de cenizas en base húmeda; valores muy cercanos a los hallados por otros autores7. En relación al contenido de fibra, se obtuvo 2,48% (bh); este valor es alto en comparación a otros frutos como el sanqui 0,9% 8. La acidez expresada en ácido cítrico tuvo un valor de 0,93%, muy cercano a 0,87% reportado por Kopjar et al.9. Se encontró 3,4 de pH, valor que está dentro del rango 3,23 a 3,42 reportado por Hassimotto et al.10. Los sólidos solubles fueron de 10,55 % encontrándose dentro del rango 7 -11% reportado por Tosun et al.11.
En la tabla 2 se puede observar que el contenido de fenoles totales (b.h) fue de 400,67 ± 3,28 mg equivalentes de ácido gálico/100 g de peso fresco; valor superior a las variedades de Chester 226 ± 4,5 y Hull Thornless 248 ± 5,9 mg equivalentes de ácido gálico/100 g (b.h) en estado maduro12. Por lo que podemos afirmar que el fruto de zarzamora evaluado tiene un contenido importante de fenoles.
La capacidad antioxidante fue de 39,02 ± 0,10 µmol equivalentes de Trolox / g (b.h), valor superior al reportado por Sepallan et al.13, quienes obtuvieron 38,29 µmol equivalentes de Trolox / g (b.h).
Referente al contenido de antocianinas totales en la zarzamora se encontró 109,07±0,90 mg cianidina 3-glucósido/100 g de peso fresco; este valor es inferior a las variedades Tupy 116 ± 2 y Brazos 133 ± 3 mg cianidina 3-glucósido/100 g (b.h) de zarzamora10; sin embargo, se encuentran dentro del rango 83 a 326 reportado por otros autores4.
En lo referente al contenido de vitamina C, la zarzamora presentó 14,37 ± 0,11 mg de ácido ascórbico/100 g (b.h), valor similar en las variedades Chester 14,3 ± 0,9 y Thornless 17,5 ± 2,7 mg ácido ascórbico /100 g (b.h)14.
Variación de los compuestos fenólicos, capacidad antioxidante, antocianinas y vitamina C por efecto del proceso en la elaboración del néctar de zarzamora
En la figura 1 se presenta de manera gráfica los resultados promedios de la variación de los compuestos fenólicos, capacidad antioxidante, antocianinas y vitamina C en todas las etapas de procesamiento: materia prima, pulpeado -refinado, estandarizado, homogeneizado y pasteurizado; debido al efecto del proceso durante la elaboración del néctar.
En las figuras 1- a, b y c se puede apreciar que la zarzamora en general presentó un alto contenido de compuestos fenólicos, capacidad antioxidante y antocianinas, siendo afectada significativamente por el proceso al cual fue sometido. Se puede observar en la etapa de pulpeado - refinado el contenido de fenoles fue de 371,72 ± 4,94 mg equivalentes de ácido gálico/100 g (b.h), valor superior en comparación a la pulpa de mora (b.h) 330 ± 4 mg equivalentes de ácido gálico/100 g15. Por otro lado, la actividad antioxidante que se determinó fue de 25,74 ± 0,04 µmol equivalentes de Trolox/ g (b.h); este valor es superior en comparación a otras pulpas: mora 7,1 ± 0,2, uva 9,2 ± 0,2 µmol equivalentes de Trolox/ g16.
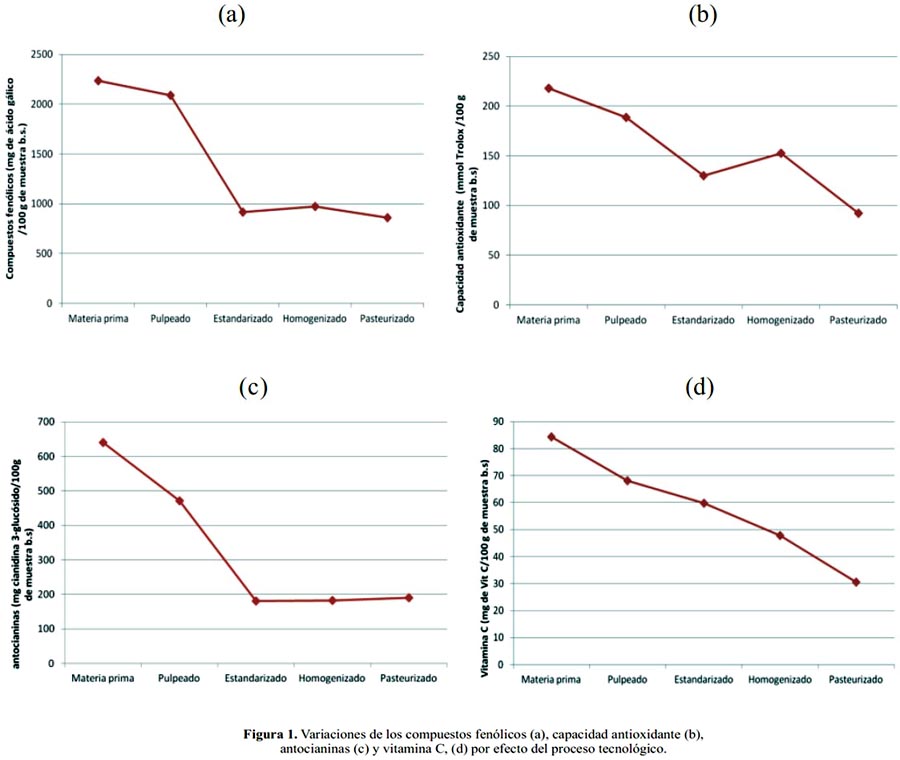
Con respecto al contenido de antocianinas se encontró 75,53 ± 0,30 mg cianidina 3- glucósido / 100 g (b.h) valor superior al mencionado por Kuskoski et al.16 Se encontró 10,90 ± 0,10 mg de ácido ascórbico / 100 g (b.h) valor por debajo en comparación a la pulpa de sanqui 57 mg8 y pulpa de carambola 31,79 mg de ácido ascórbico / 100 g (bh)17.
Respecto a la etapa de estandarización, los resultados muestran una disminución de todos sus componentes evaluados, debido a la adición de los ingredientes para la obtención del néctar, influyendo en la reducción de la capacidad antioxidante, compuestos fenólicos y otros fitoquímicos presentes en el producto8. Lo que explicaría la disminución experimentada en esta investigación.
En la etapa del homogeneizado se observa un pequeño incremento de compuestos fenólicos, capacidad antioxidante y antocianinas y una reducción de la vitamina C. Respecto a los compuestos fenólicos, capacidad antioxidante y antocianinas podría explicarse que para obtener un producto uniforme hubo ruptura de tejidos del fruto que acumula a estos componentes ocasionando su liberación e incrementando por efecto del proceso. Al comparar los resultados obtenidos en la presente investigación con los reportados por otros investigadores, existen varias causas que ocasionan esta diferencia. El poder antioxidante depende no sólo de la calidad original de la planta, origen geográfico, las condiciones climáticas, la fecha de cosecha y almacenamiento, sino también de factores tecnológicos, que afectan la capacidad antioxidante18. Por otro lado, la aglicosilacion también puede ser causa del aumento de la actividad antioxidante, así como los efectos aditivos y sinérgicos entre otros fitoquímicos y fenólicos alterados debido al proceso al que es expuesto19.
Según estudios20, se encontró incrementos significativos en el contenido de compuestos fenólicos en maíz dulce cuando aumentaba la temperatura y el tiempo del tratamiento térmico, indicando que durante el tratamiento térmico se produce una creciente liberación de los fenólicos conjugados de la matriz del alimento así como de otros fitoquímicos por efecto del proceso; en la investigación realizada es probable que algo similar ocurra en la pulpa al ser sometido al homogeneizado. En lo referente a la reducción de vitamina C es posible se deba a su inestabilidad. La vitamina C es el más lábil de los nutrientes y que una gran parte se pierde en el procesamiento de alimentos21. Lo que explicaría la disminución experimentada en esta investigación.
En la figura 1-c se observa que en la etapa del homogeneizado y pasteurizado se dio un pequeño incremento en el contenido de antocianinas; esto es posible que se deba a la formación y liberación de otros compuestos por efecto del proceso, los cuales podrían tener potencial antioxidante. Al respecto, otros autores22 observaron que la estabilidad de los pigmentos se incrementa con el aumento de los grupos metoxilo y disminuye con el incremento de los grupos hidroxilo. Asimismo, el autor menciona que la termoestabilidad de las antocianinas se vería incrementada si presenta una mayor cantidad de ácidos cinámicos en su estructura; al parecer, en este caso la zarzamora posee ese tipo de acilación, lo cual favorecería su termoestabilidad.
Se puede apreciar que en la etapa de pasteurizado hubo una disminución de todos los componentes por efecto de la temperatura. Algunos autores23 afirman que aunque la cocción disminuye el contenido de fotoquímicos en los alimentos, esto no significa que su consumo no pueda ejercer un efecto positivo. En efecto, la liberación de los compuestos de la matriz del alimento los vuelve más disponibles, mejorando su absorción en el tracto gastrointestinal. Por otro lado, algunos investigadores indican que cuando las frutas son sometidas a procesos tecnológicos para obtener jugo, néctar, puré y vino, se afectan los contenidos de vitamina C, modificación que ocurre especialmente durante el tratamiento térmico24. Los resultados obtenidos coinciden con lo determinado en esta investigación donde el néctar que fue pasteurizado a 100°C presentó una disminución del contenido de vitamina C, tal como se observa en la figura 1-d. La evaluación estadística de prueba de rangos múltiples de Tukey encontró diferencias significativas con nivel de significancia del 5% entre todas las etapas de procesamiento con respecto al contenido de compuestos fenólicos, capacidad antioxidante, antocianinas y vitamina C.
Composición fisicoquímica del néctar de zarzamora
En la tabla 3 se muestra la composición química del néctar de zarzamora. Como se aprecia, está exento de grasa; siendo de mucho interés en la alimentación moderna por cuanto evitaría problemas cardiovasculares y de obesidad; esta es una característica propia de la materia prima. Varios autores25 indican que el néctar de zarzamora reduciría los niveles de triglicéridos séricos y colesterol total. En el néctar se encontró 87,3% humedad, 12,5% carbohidratos, 0% fibra, 0,10% cenizas, 0,23% acidez y 12,5 % carbohidratos; todos expresados en base húmeda, valores menores que en la materia prima, debido a que en el néctar se lleva a cabo la estandarización donde se adicionan otros componentes tales como el agua, azúcar, CMC y conservante que reducen el porcentaje de pulpa.
Comparando el valor encontrado en esta investigación con otros productos similares, se concluye que el néctar de zarzamora tiene un aporte interesante en compuestos fenólicos, por encima al de otras variedades de néctar como: fresa 42,1 mg equivalentes de ácido gálico/100 g (b.h)26, albaricoque 45,7 mg equivalentes de ácido gálico /100 g (b.h), guinda 47,5 mg equivalentes de ácido gálico/100 g (b.h)27.
Se encontró 4,12 ± 0,01 µmol equivalentes de Trolox / g (b.h) de capacidad antioxidante; este valor es superior a 0,47 µmol equivalentes de Trolox / g (b.h) en néctar de fresa por el método ABTS27. Como contenido de antocianinas se obtuvo 24,33 ±0,90 mg cianidina 3glucósido/100 g (b.h), valor superior al mencionado por Yuksel y Koca28 quienes reportaron un valor de 13,56 mg cianidina 3-glucósido/100 g (b.h) en néctar de zarzamora. En lo referente a la vitamina C, se encontró 3,87 ± 0,06 mg de ácido ascórbico/ 100 g (b.h), valor inferior al néctar de zarzamora variedad Tupy 10,78 ± 0,26 mg de ácido ascórbico/ 100 g (b.h)25 y superior al néctar de guinda 2,5 mg ascórbico/ 100 g (b.h)27.
CONCLUSIONES
La zarzamora, como materia prima y néctar reporta la siguiente composición físico-química porcentual en base seca: proteína 5,44 y 0,78; fibra 14,59 (materia prima); ceniza 2,43 y 0,78 y carbohidratos 77,49 y 98,43, respectivamente.
Por efecto del proceso, la zarzamora disminuyó su contenido de compuestos fenólicos (mg de ácido gálico /100 g de muestra b.s.) y antocianinas (mg cianidina 3- glucósido / 100 g de muestra b.s.), de 2234,15 y 640,81 (materia prima), a 2086,54 y 472,08 debido al pulpeado-refinado; 914,40 y 188,24 por al estandarizado; 974,866 y 181,96 debido al homogeneizado; 860,71 y 190,85 en el pasteurizado, respectivamente.
En la elaboración del néctar de zarzamora hubo una reducción de su capacidad antioxidante (µmol Trolox/g b.s.) y vitamina C (mg de ácido ascórbico / 100 g muestra b.s.) durante el proceso de 217,66 y 84,41 (materia prima) a 188,48 y 68,13 por efecto del pulpeado-refinado, 130,09 y 59,86 debido al estandarizado, 152,57 y 47,84 por efecto del homogeneizado y 92,21 y 30,50 en el pasteurizado, respectivamente.
A partir del análisis obtenido experimentalmente se puede inducir que la zarzamora tanto como materia prima y néctar, son de gran interés para la industria alimentaria ya que representan un importante aporte de compuestos fenólicos, capacidad antioxidante y antocianinas, los cuales son beneficiosos para la salud.
AGRADECIMIENTOS
Ala EPG -UNALM, al Ing. Kenneth Peralta y Zoila Salinas (Centro Experimental Huayuna).
BIBLIOGRAFÍA
1. O. Chávez. "Cultivo y manejo de la zarzamora", tesis para optar el título de biólogo, Universidad Michoacana de San Nicolás de Hidalgo. Michoacán. México, 2011.
2. AOAC. Official Methods of Analysis of Association the Official Agricultural Chemists. 18va. Ed. 1-2. 2005.
3. AOAC. Official Methods of Analysis of the Association the Official Agricultural Chemists. 16va. Ed. 1-2.1995.
4. M. Giusti; R. Wrolstad.Anthocyanins.Characterization on measurement of anthocyanins by uv- visible spectroscopy. En: Current protocols in Analytical Chemistry, 2001; Unit F1.2:1-13.
5. T. Swain; W. Hillis. The phenolic constituents. Journal of Science and Food Agricultural, 1959; 10: 63-68.
6. B. Arnao. Some methodological problems in the determination of antioxidant activity using chromogen radicals: A practical case. Trends in Food Science and Technology. 2000; 11: 419-421.
7. E. Wrolstad; D. Culbertson; A. Nagaki. Sugars and Volatile acids of blackberries. J. Agri. Food Chem., 1980; 28: 553-558.
8. D. Nolazco, "Elaboración de néctar de sanqui", tesis para optar el título de Ingeniero en Industrias Alimentarias, Universidad Nacional Agraria La Molina, Lima, Perú.2007; 109p.
9. M. Kopjar; N.Nedic; V. Pilizota; J. Babic. Stability of anthocyanins, phenols and free radical scavenging activity through sugar addition during frozen storage of blackberries. Journal of Food Processing and Preservation, 2008; 33: 1-11.
10. N. Hassimotto; R. Vieira da Mota; B. Cordenunsi; F. Lajolo. Physico-chemical characterization and bioactive compounds of blackberry fruits (Rubus sp.) grown in Brazil.Campinas. Brazil, 2008; 28:702-703.
11. I.Tosun; N. Sule; B. Tekguler. Physical and chemical changes during ripening of blackberry fruits. Journal of Sci. Agric., 2008; 6:87-90.
12. S. Wang y H. Lin Antioxidant Activity in Fruits and Leaves of Blackberry, Raspberry, and Strawberry Varies with Cultivar and Developmental Stage. Journal of Agriculture of Food Chemistry, 2000; 48:140-146.
13. S. Sellappan; C. Akoh; G. Krewer. Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries. Journal of Agricultural and Food Chemistry, 2002; 50:2432-2438.
14. G. Pantedilis.; M. Vasilakakis; G. Mangaranis; G.Diamantidis. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries. Faculty of Agriculture. Aristotle University. Food Chemistry. Grecia, FR., 2007; 102: 777-783.
15. A. Proteggente; A. Pannala; G. Paganga; L.Van Buren; E.Wagner et. al., The antioxidant activity of regularly consumed fruit and vegetables reflects their phenolic and vitamin C composition. Free Radical Research, Food Chemistry, 2002; 36:217-233.
16. M. Kuskoski; A.Troncoso; J.Mancini; R. Fett. Aplicación de diversos métodos químicos para determinar la actividad antioxidante. Cienc. Tecnol. Aliment. Campinas, 2005; 25:726-732.
17. R. Dávila, "Determinación de taninos, vitamina C y capacidad antioxidante en frutos de carambola (Averrhoa carambola L.)", tesis para optar el título de Ingeniero en Industrias Alimentarias, Universidad Nacional Agraria La Molina. Lima. Perú. 2003; 130 p.
18. A. Moure; M. Cruz; D. Franco; M. Domínguez; J. Sineiro et. al., Natural antioxidants from residual sources. Food Chemistry, 2001; 72: 145-171.
19. R. Randhir; Y. Kwon; K. Shetty. Effect of thermal processing on phenolics, antioxidant activity and health -relevant functionality of select grain sprouts and seedlings. Innovative food Science and Emerging Technologies, 2008; 9:355-364.
20. V. Dewanto; X. Wu; R. Liu. Processed sweet corn has higher antioxidant activity. Food Chemistry , 2002; 50:4959-4964.
21. P. Castillo y L. Miranda.1995. Cinética de la degradación de la vitamina C en el jugo concentrado y congelado de maracuyá. Universidad de Campiñas. Sao Paulo, Brasil. Disponible: http://www.dspace.espol.edu.ec/bitstream/123456789/2054/1/4073.pdf. Acceso el 5 marzo del 2009.
22. R. Quispe. "Estudio de la extracción de antocianinas del camote morado (Ipomoea batatas (L) Lam)", tesis para optar el título de ingeniero de Industrias Alimentarias, Universidad Nacional Agraria La Molina. Lima, Perú, 2003; 125p.
23. J. Tudela; J. Espin; M. Gil. Vitamin C retention in fresh -cut potatoes. Journal of Postharvest Biology and Technology, 2002; 26:75-84.
24. O. Reátegui; E. Guija; M. Castillo. Determinación de la capacidad antioxidante de néctares de frutas. Revista científica de la Universidad Científica del Sur, Lima, Perú, 2008.
25. P. Ferreira; V. Da silva; A. Rodrigues; C. Gevehr; A. Silva; R. Silva. Benefits of blackberry néctar (Rubus spp.) relative hypercholesterolemia and lipid peroxidation. Nutrición hopitalaria. Brasil, 26 nº. 5, 2011.
26. Y. Klopotek; K. Otto; V.Bohm.Processing Strawberries to different products alters contents of Vitamin C, total phenolics, total anthocyanins, and Antioxidant Capacity. J. Agrie. Food. Chem., 2005; 53:5640 -5646.
27. I. Tosun; N. Sule. An investigation about antioxidant capacity of fruit nectars. Journal of Nutrition, 2003; 2:167-169.
28. Yuksel, S.; Koca, I. Color Stability of blackberry nectars during storage. Turkey. Journal of Food Technology, 2008; 97:166 – 169.
Recibido el 19-02-2013
Aprobado el 05-04-2013













