Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.2 Lima Apr./Jun. 2013
TRABAJOS ORIGINALES
Evaluación de electrodos basados en SnO2 dopados con Sb, Ru y TiO2, fabricados por la técnica Pechini
Manufacture and evaluation of SnO2 electrodes, doped with Sb, Ru and TiO2 by the Pechini method
Pilar del Socorro Lázaro Rubioa*, Adolfo La Rosa-Toro Gómezb
a* Licenciada en Química, Laboratorio de Electroquímica Aplicada Facultad de Ciencias, Universidad Nacional de Ingeniería, e-mail: lazaro@uni.edu.pe, Facultad de Ciencias.
b Profesor Principal y Jefe del Laboratorio de Investigación en Electroquímica Aplicada de la Facultad de Ciencias, Universidad Nacional de Ingeniería. Av. Túpac Amaru 210, Rímac, e-mail: toro@uni.edu.pe
RESUMEN
Electrodos de SnO2 sin dopar y dopados con Sb, Ru y TiO2 fueron preparados mediante impregnación, sinterización y tratamiento térmico empleando la técnica de precursor polimérico (Pechini). Los electrodos preparados fueron comparados con un electrodo obtenido a partir de la descomposición térmica de una disolución precursora. La caracterización se realizó mediante difracción de rayos X (DRX), microscopía electrónica de barrido (SEM) y voltametría cíclica (VC); finalmente su estabilidad electroquímica fue evaluada mediante cronopontenciometría.
Palabras clave: Pechini, ánodo de titanio, dióxido de estaño, electrocatálisis.
ABSTRAC
SnO2 electrodes undoped and doped with Sb, Ru and TiO2 were prepared by impregnation and sintered by thermal treatment using the polymeric precursor technique (Pechini). The electrodes were compared with an electrode produced the thermal decomposition of a precursor solution. The characterization was done by X-ray diffraction (XRD), scanning electron microscopy (SEM) and cyclic voltammetry (CV), and finally its electrochemical stability was evaluated by cronopontenciometría.
Key words: Pechini, titanium anode, tin dioxide, electrocatalisys.
INTRODUCCIÓN
Los ánodos de óxidos soportados sobre titanio son descritos como uno de los más grandes progresos tecnológicos en el campo de la industria electroquímica. En 1965 Henry Beer patentó este tipo de electrodos denominados (DSA-"Dimensionally Stable Anodes")2,3 y en la actualidad casi la mayoría de las plantas industriales utilizan ánodos de titanio recubiertos de óxidos metálicos. Estos ánodos se caracterizan por presentar alta resistencia a la corrosión, buena conductividad y actividad electrocatalítica para la reacción de evolución del cloro. Los ánodos conteniendo óxido de estaño son frecuentemente utilizados, especialmente en los ánodos de óxidos ternarios TiO2 + SnO2 + RuO2 soportados en Ti las cuales son muy utilizados en la industria cloro-sosa4,5.
Los electrodos de RuO2 soportados sobre titanio son los ánodos activos más importantes usados en la industria cloro-sosa6; sin embargo, el RuO2 es poco estable a elevado potencial7.
Por este motivo, el RuO2 es mezclado con aditivos como IrO2, TiO2, Sb2O3, SnO2 para mejorar la actividad, estabilidad o selectividad de los electrodos hacia la reacción de evolución de cloro8 así como también disminuir el costo del electrodo9. El óxido de estaño es un buen material para ser usado como ánodo en la generación de agua electro-oxidada.
Los electrodos Ti/SnO2-Sb presentan un elevado sobrepotencial para la reacción de oxígeno, comportamiento que se encuentra asociado a la generación de radicales hidroxilo10; la elevada eficiencia obtenida se le atribuye a la capa de óxido de antimonio11; sin embargo, son muy poco estables en condiciones de polarización anódica. En este contexto, el material del ánodo juega un papel crítico, porque este deberá ser inocuo, de bajo costo y deberá tener un tiempo de vida útil. La mezcla de óxidos de estaño, antimonio, titanio y rutenio puede ser una buena elección en términos del tiempo de vida, así como la incorporación de un metal noble puede mejorar la eficiencia bajo condiciones agresivas.
Existen una gran variedad de técnicas para el desarrollo de óxidos conductores. Las propiedades de estos depósitos dependerán, fundamentalmente, de su estructura, morfología superficial y de la naturaleza de las sustancias empleadas; parámetros que están relacionados con la técnica que se utilice para la realización del depósito. Entre las más utilizadas tenemos: evaporación en vacio, bombardeo (sputtering), depósito químico en fase vapor (chemical vapour deposition), pulverización más pirólisis (spray pyrolysis), técnica de mojado (dip coating), pintado (brushing), crecimiento químico (chemical solution growth), etc.
La mayor dificultad en la preparación de electrodos de estaño es el control de la cantidad de SnO2 en el recubrimiento, ya que la volatilización del SnCl4 ocurre a temperaturas cercanas a 114°C; por esta razón el control de los parámetros del proceso resulta crítico. Existen diferentes métodos para preparar óxidos de estaño, rutenio y antimonio en solución, evitando la pérdida de estaño, como son sol-gel, co-precipitación y precursor polimérico (Pechini). El método sol-gel permite un buen control del contenido de estaño así como del tamaño de partícula, aunque el método Pechini es preferido por la facilidad de ejecución, por los buenos resultados obtenidos y por proporcionar mayor estabilidad que otras técnicas para elaborar nanopartículas de óxidos, lo que lo convierte en un método prometedor para la obtención de óxidos de SnO212.
Con el fin de aumentar la conductividad del electrodo de SnO2 se introdujo en la disolución precursora dopantes de antimonio13 y rutenio14,15. La estabilidad del electrodo fue mejorada incorporando titanio en forma de óxido.
Método del Precursor Polimérico (Pechini).
El método Pechini, también denominado mezcla de líquidos, resina intermedia o complejo polimerizable, es un método que permite, de manera general, obtener un polímero homogéneo órgano-metálico en el cual el metal se ubica en la cadena principal del polímero. El proceso utiliza la capacidad de ciertos ácidos débiles (ácido piroxicarboxílicos α) de formar quelatos ácidos polibásicos con cationes de los elementos Ti, Zr, Cr, Mn, Ba, La, Sn, etc.
Los quelatos que se forman pueden experimentar poliesterificación al calentarlos en presencia de un alcohol polihidroxílico generando un polímero transparente, resina, en la que los cationes se encuentran distribuidos uniformemente. La resina retiene la homogeneidad a escala atómica de los iones del sistema debido a su alta viscosidad. La calcinación a una temperatura relativamente baja, entre 500 y 650ºC, se obtienen óxidos con partículas finas y una composición química que ha sido controlada de manera precisa durante el proceso. Por lo general, el proceso Pechini utiliza una solución de ácido cítrico y etilenglicol de tal manera que la quelación del metal se puede esquematizar de acuerdo a la Ec.116,17:
Por otro lado, la poliesterificación del citrato metálico con el etilenglicol, que también ocurre por la influencia de la temperatura se puede representar según la Ec.216,17:
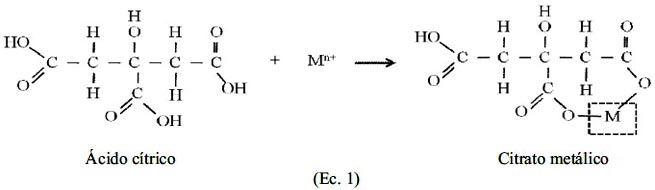
En la práctica, no se ha determinado si la reacción de la Ec. 1, formación del citrato metálico, y la reacción de la Ec. 2, polimerización, ocurren simultáneamente o en secuencia. El calentamiento de la solución se debe realizar continuamente hasta que el agua y el ácido acético se destilen por completo dando como resultado el polímero.
En este trabajo se utilizó Pechini como método de síntesis para obtener los óxidos correspondientes a las series PSb, PRu y DT con diferentes composiciones. Los óxidos depositados se caracterizaron utilizando difracción de rayos X (DRX), microscopía electrónica de barrido (MEB) y voltametría cíclica (VC).
PARTE EXPERIMENTAL
Preparación de los electrodos SnO2-Ti-Sb y SnO2-Ti-Ru mediante Pechini.
Los reactivos utilizados fueron: etilenglicol (Merck), ácido cítrico monohidratado (Fermont), SnCl4.5H2O (Sigma Aldrich), RuCl3(Merck), SbCl3(Merck) y TiO2 (Degussa P-25).
Para obtener los óxidos a partir del método Pechini se elaboró dos series de electrodos: PSb y PRu (Tablas 1 y 2). Inicialmente se calentó 44,6 mL de etilenglicol a 70°C y se le adicionó lentamente 34,5 g de ácido cítrico monohidratado agitando continuamente la solución, hasta obtener una solución transparente. Separadamente se preparó soluciones acuosas 0,5M a partir de las sales precursoras de SnCl4.5H2O, RuCl3, SbCl3. Se usó TiO2, el cual se dispersó en agua, siendo su concentración final 0,5M.
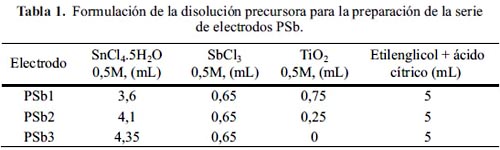
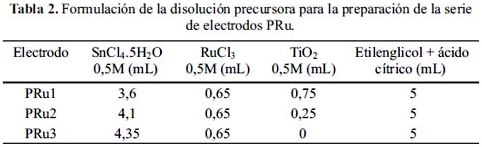
A la mezcla de etilenglicol y ácido cítrico se le adicionó cantidades controladas de las sales precursoras con agitación constante, de tal manera que el volumen final fue de 10 mL. La formulación de las disoluciones precursoras se muestran en las tablas 1 y 2.
Alcanzada la completa homogenización de la mezcla etilenglicol y ácido cítrico se redujo la temperatura a 25°C y se adicionó gradualmente NH4OH hasta llevar la solución a un pH de 9; la solución se calienta a 140°C para promover la reacción de poliesterificación, obteniéndose una resina negra. Los cambios en la coloración, producto del aumento de temperatura durante el proceso de formación de la resina, se aprecia con claridad en el electrodo PSb3 ya que los precursores de rutenio y titanio interfieren en la visibilidad; por tal motivo, todas las disoluciones se trabajaron bajo las mismas condiciones.
En todos los casos, en la preparación de los electrodos se usó como soporte una lámina de titanio 99,99% de Goodfellow, cortada en forma rectangular de 1x5 cm (espesor 0,5 mm). El soporte así elaborado, fue desengrasado con acetona y posteriormente atacado químicamente con una solución de ácido oxálico al 10%, a ebullición durante una hora. El tratamiento produjo una superficie rugosa apropiada para la adhesión de los óxidos.
La disolución obtenida se aplica al soporte por brushing, humedeciendo bien la superficie, pero sin que llegue a gotear. Las etapas fueron las siguientes:
-
Impregnación de la solución.
-
Secado en estufa a 125 ºC por 10 minutos.
-
Tratamiento térmico a 400 ºC por 10 minutos.
-
Enfriado y repetición de todo el proceso.
Culminada la aplicación de 21 capas, según los pasos descritos anteriormente, se realizó un tratamiento térmico final a 650 ºC, con la finalidad de lograr la sinterización homogénea de los óxidos. La composición nominal atómica de los electrodos se muestra en la tabla 4.
Preparación del electrodo SnO2-Sb mediante descomposición térmica
Para elaborar el electrodo DT (descomposición térmica) se preparó una disolución precursora con las sales de los metales a depositar: cloruro de estaño y cloruro de antimonio utilizando etanol como solvente (tabla 3). La solución precursora fue impregnada sobre un soporte de titanio y se realizó el tratamiento térmico bajo el mismo procedimiento y condiciones especificados en el procedimiento utilizado en las series PSb y PRu.
RESULTADOS Y DISCUSIÓN
Caracterización electroquímica de los electrodos de estaño soportados en titanio.
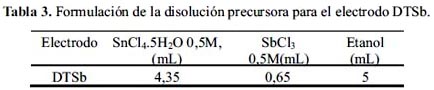
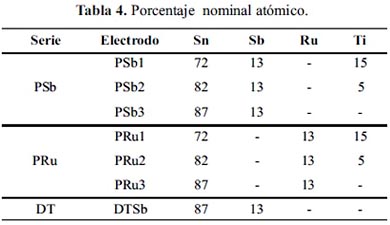
En las figuras 1 y 2 se presenta los voltagramas estabilizados de los electrodos de estaño soportados sobre titanio, empleando una solución de Na2SO4 0,2 M y Na2SO4 0,2 M + NaCl 0,2M, utilizando como electrodo de referencia Ag/AgCl y contraelectrodo de platino.
En los voltagramas (a) y (b) de la figura 1 destaca el pico de alta intensidad producido a potenciales mayores a 0,0 V correspondiente a la reacción de oxidación del agua para producir oxígeno. Los electrodos preparados según el método Pechini presentan una mayor densidad de corriente para dicha reacción, atribuible al incremento del área superficial de los electrodos PSb y PRu con respecto al electrodo DTSb. Por otro lado, se observa que, en todos los casos, el potencial para la evolución de oxígeno es menor que el electrodo DTSb. Los resultados son mostrados en la tabla 5.
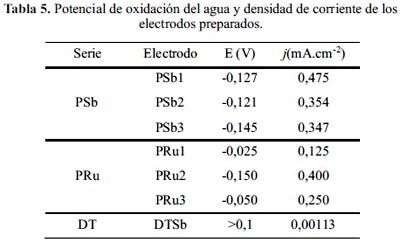
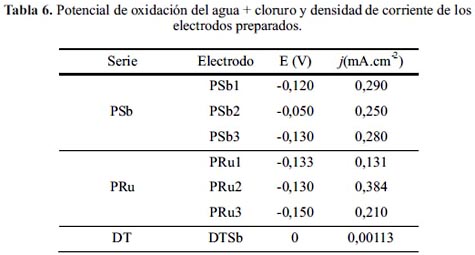
En la figura 2 se presenta los voltagramas de los electrodos ciclados en disolución 0,2 M de NaCl, observándose que los electrodos preparados mediante el método Pechini presentan un adelanto en el potencial de evolución de oxígeno y formación de cloro. Se identifican los electrodos de la serie PRu como los más activos para la reacción de formación de cloro (tabla 6).
Evaluación de la estabilidad electroquímica de los electrodos.
El tiempo de vida útil, de los electrodos, fue examinado mediante electrólisis de una solución de NaCl. Las condiciones de la electrólisis para la prueba de estabilidad fueron las siguientes:
-
j=50mA.cm-2.
-
Temperatura = 25°C.
-
Agitación = 600 rpm.
-
Electrolito: NaCl 6%, 8L.
-
Ánodo: Electrodos preparados.
-
Cátodo: Electrodo de titanio.
La prueba de estabilidad se llevó a cabo en un recipiente conteniendo 8 L de disolución de NaCl al 6% con el objeto de evitar cambios de concentración del NaCl. El incremento de potencial del electrodo fue medido mediante la técnica de cronopotenciometría con un multímetro Tech TM-145, frente a un electrodo de calomel. El incremento final del potencial del ánodo, con un valor de ΔE ≅ 5V, advierte de su desactivación. En la figura 3 se puede observar que el electrodo DTSb se desactiva a los pocos minutos de iniciada la electrólisis. Los electrodos después de la electrólisis perdieron masa. Asumiendo que el tipo de corrosión es lineal, se obtienen los resultados mostrados en la tabla 7 y figura 4.
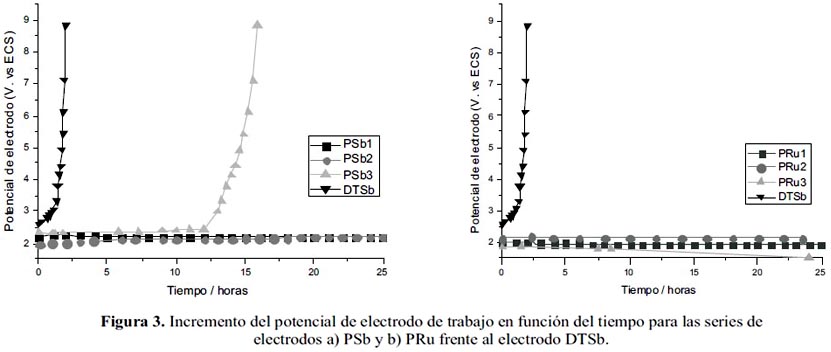
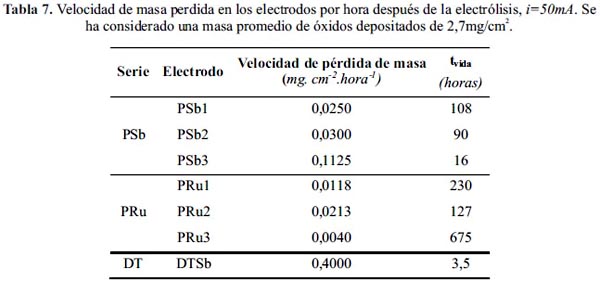
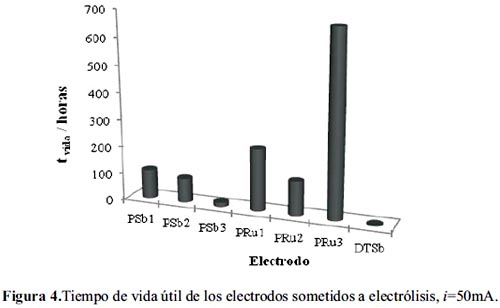
Los electrodos preparados mediante el método Pechini, PSb y PRu presentan mayor tiempo de vida útil que el electrodo preparado mediante descomposición térmica, DTSb. Los electrodos PRu presentan un mayor tiempo de vida útil que los PSb influenciados por la presencia de óxido de rutenio. La incorporación de TiO2 en los electrodos PSb incrementa significativamente su tiempo de vida útil, sin embargo su efecto en los electrodos PRu es menos significativo siendo superado por el rutenio.
ORP (Potencial de oxidación-reducción) de la solución electrolizada de NaCl 2%.
El ORP es una técnica muy útil para determinar la capacidad oxidante de una solución, y puede realizar una medida indirecta de la producción de agentes oxidantes en la celda electrolítica. Para llevar a cabo las medidas se preparó 100 mL de una solución de NaCl al 2% a pH neutro a partir del cual se generó agua electro-oxidada mediante electrólisis de los electrodos preparados. Las condiciones de la electrólisis para ORP fueron:
-
j
T=25°C.
Agitación = 600rpm.
Ánodo: Electrodos preparados.
Cátodo: Electrodo de titanio.
Tiempo = 4 minutos.
Las medidas se llevaron a cabo tomando 0,5mL de la solución electro-oxidada y adicionando 9,5mL de solución buffer 0,3M de KH2PO4 a pH=6,3 medidas en intervalos de 4 minutos. En todos los casos se partió de un blanco a t=0 minutos, antes de iniciar la electrólisis. En la figura 5 se muestra la evolución de los valores de ORP según el avance de la electrólisis para lo cual se utilizó electrodos de las series PSb y PRu como ánodos.
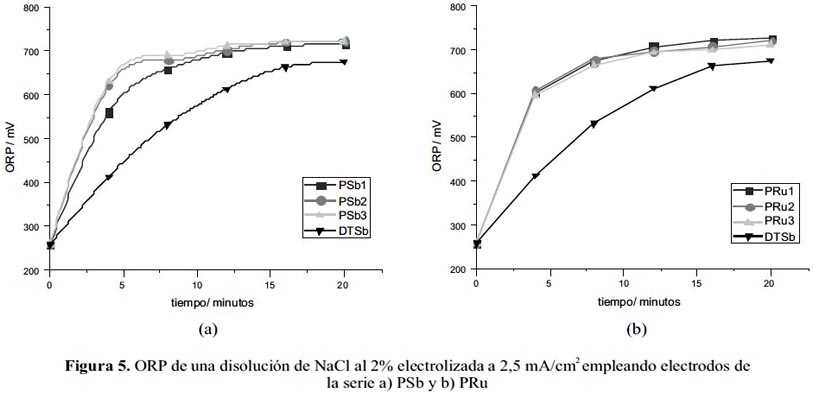
Los electrodos preparados son sometidos a electrólisis para analizar su efectividad en la producción de especies oxidantes. Las gráficas parten de un valor inicial promedio de ORP de 259mV y se llega a alcanzar valores de hasta 727mV. Los electrodos preparados por el método Pechini, PSb y PRu son más eficientes que el electrodo DTSb en la producción de especies oxidantes.
Microscopía Electrónica de Barrido (SEM)
En la figura 6 se muestra la imagen correspondiente al soporte de titanio tras el tratamiento químico descrito; se caracteriza por presentar una superficie rugosa con microcavidades lo cual favorece la adherencia del óxido al soporte.
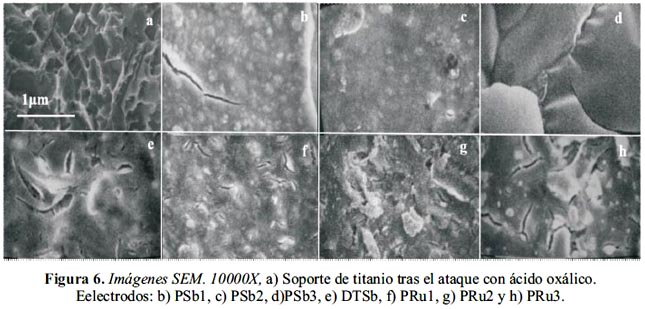
Las micrografías de los electrodos PSb1 y PRu1 caracterizados por contener mayor cantidad de TiO2, como dopante, presentan una superficie más compacta, en tanto las que contiene un mayor contenido de rutenio presentan una superficie más rugosa y microfisurada.
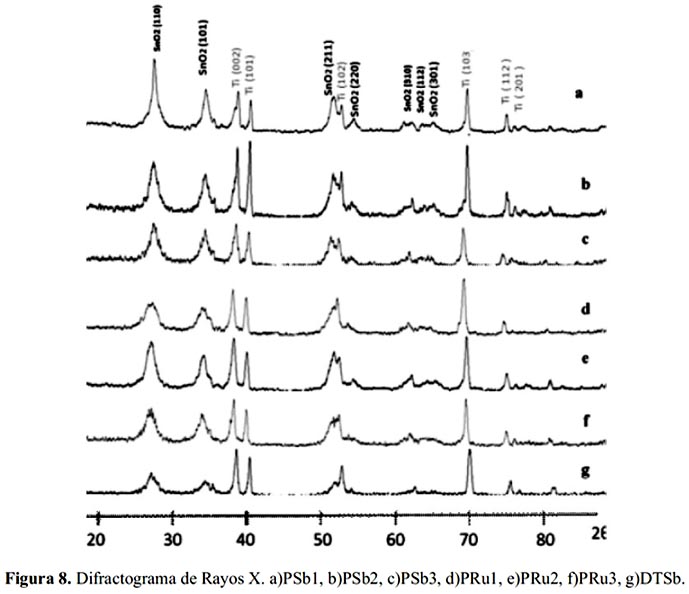
Difracción de rayos X
Los electrodos fueron caracterizados mediante la técnica de difracción de rayos X; para el análisis se utilizó tubo de Cu kα (1.541874 nm) en un difractómetro SHIMADZU modelo DRX-6000, con energía de 40KV, 30 mA.
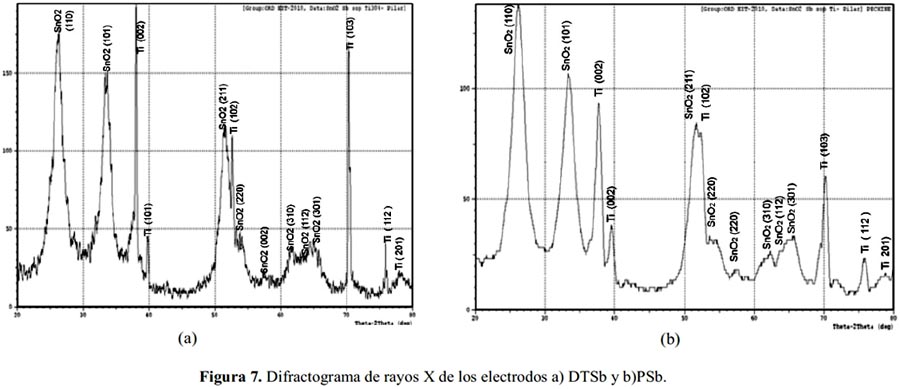
En la figura 7 se comparan los difractogramas del electrodo patrón DTSb obtenido a partir de una disolución etanólica frente al electrodo PSb obtenido por Pechini; ambos de la misma composición. En ambos casos se evidencia como dominante la fase cristalina de casiterita (SnO2) con la presencia de picos adicionales correspondientes al soporte de titanio. En el caso del espectro DRX del electrodo PSb se observa mejor perfilado y las líneas de difracción del titanio se observan atenuadas debido al mayor espesor de la capa de óxido.
Los difractogramas de la figura 8 presentan picos dominantes correspondiente al mineral casiterita (SnO2) y como fondo del soporte de titanio metálico. No se observa picos adicionales asignables a la presencia de otras fases cristalinas pudiendo suponerse que el SnO2 se encuentra conformando soluciones sólidas con los dopantes de Sb y Ru en sus formas oxidadas adoptando la estructura tipo rutilo. Los difractogramas de los electrodos preparados mediante la técnica Pechini presentan picos más anchos y perfilados, indicador de cristalitas de menor tamaño.

En los difractogramas mostrados, figuras 7 y 8, el pico de difracción correspondiente al plano (200) del SnO2 (2θ = 37,982) se encuentra enmascarado por el intenso pico de difracción de la red del titanio metálico, correspondiente al plano Ti (002) con 2θ = 38,422.
CONCLUSIONES
Los electrodos preparados mediante la técnica Pechini presentan mayor actividad electrocatalítica que los electrodos preparados a partir de disolución etanólica y descomposición térmica, observado mediante la medida de ORP y la disminución del potencial de evolución de oxígeno, cuantificado a partir del análisis de los voltagramas correspondientes. Este comportamiento podría atribuirse a una morfología rugosa y de mayor área superficial como consecuencia de la disminución del tamaño de partícula.
La incorporación de rutenio en los electrodos de la serie PRu incrementa significativamente su tiempo de vida útil, comparativamente mayor frente al aporte mostrado por el TiO2 (serie PSb); este comportamiento es atribuible a la naturaleza de metal noble y estabilidad química del rutenio frente al cloro. El electrodo PRu3 presenta la mayor estabilidad electroquímica con un tiempo de vida de 675 horas electrolizando a j=50 mA.cm-2.
Los mejores electrodos basados en SnO2 con mayor actividad electrocatalítica y estabilidad electroquímica, fueron obtenidos empleando la técnica de precursor polimérico (Pechini) dopándolos con mayor contenido de rutenio.
AGRADECIMIENTO
Al Instituto de Investigación de la Facultad de Ciencias de la UNI, por el soporte económico al presente proyecto.
BIBLIOGRAFÍA
1. HB Beer. Brit. Patent, 1965; (1): 147-442.
2. Alonso Vante Nicolás. Electroquímica y electrocatálisis. Buenos Aires. 2003; 75-76.
3. Hardee K.L., Mitchell L.K., Rudd. E.J. Plating and Surface Finishing 1989; 68:71.
4. Peidong Yao., Xueming Chen., Hao Wu., Dahui Wang. Sience Direct. Surface & Coatings Technology. 2008; 202: 3850.
5. Juliane Cristina Forti, Paulo Olivi, Adalgisa R. de Andrade. Electrochimica Acta, 2001; (47): 913-920.
6. T. Arikawa., Y. Murakami., Y. Takasu. Journal of Applied Electrochemistry, 1998; (28): 511-516.
7. Heine A. Hansen., Isabela C. Man., Felix Studt, Frank Abild-Pedersen., Thomas Bligaard., Jan Rossmeisl. Physical Chemistry Chemical Physics, 2010; (12): 283-290.
8. Vladimir Panic., Aleksandar Dekanski., Slobodan Milonji., Slobodan Milonji., Vesna B. Miskovic-Stankovic, Branislav Nikolic. Journal Serbian Chemical Society, 2006; (71): 1173-1186.
9. Erzsébet Horváth., J. Kristóf., L. Vázquez-Gómez., Á. Redey., Veronika Vágvölgyi. Journal of Thermal and Calorimetry, 2006; (86): 141-146.
10. Comninellis C. Electrochimica Acta, 1994; (39): 1857.
11. Kaijin Zhu., Wencai Zhang., Huifang Wang., Zhongliang Xiao. Clean, 2008; (36): 97-102.
12. Ararat C., Varela J.A., Rodriguez P. Bol. Soc. Esp. Ceram. V., 2005; 44 (4): 215-222.
13. Vicent F., Morallón E., Quijada C., Vazquez J. L., A. Journal of Applied Electrochemestry, 1998; (28): 610.
14. Jiang Tao K, Shao Yuan S, Journal of Environmental Sciences, 2007; (19): 1380-1386.
15. R. Berenguer., C. Quijada., E. Morallón. Electrochimica Acta, 2009; (54): 5230-5238.
16. Mosquera A., Rodriguez P. Bol. Soc. Esp. Ceram. V., 2008; 47 (5): 278-286.
17. Ochoa Y., Ortegón Y., Vargas M., Rodríguez J. Rev. Latin Am. Metal. Mater, 2009; (3): 932.
18. Roberta D. Coteiro, Fernando S. Teruel, Josimar Ribeiro and Adalgisa R. de Andrad, J. Braz. Chem. Soc, 2006; 17 (4): 771-779.
19. A. La Rosa-Toro., M. Ponce Vargas, Revciuni, 2010; 13 (1): 11-16.
20. Miguel Armando Ponce Vargas. Preparación y Caracterización de Electrodos de Ti/Co3O4 y de Ti/PbO2, y su Evaluación en la Oxidación Electroquímica de Colorantes Azo. Tesis para optar el título de Licenciado en Química. Lima, Perú. Universidad Nacional de Ingeniería 2008; 51, 52.
Recibido el 13-11-2012
Aprobado el 18-04-2013













