Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.3 Lima jul./set. 2013
TRABAJOS ORIGINALES
Preparación y caracterización de películas de quitosano despolimerizado y reticulado con tripolifosfato de sodio
Preparation and characterization of depolymerised chitosan films and crosslinked with sodium tripolyphosphate
Max Carlos Salazar1*, Ana Valderrama Negrón1
1* Laboratorio de Investigación en Biopolímeros y Metalofármacos - LIBIPMET. Facultad de Ciencias. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210. Rímac, Lima-Perú. mcarloss@uni.pe
RESUMEN
En este trabajo se ha estudiado la preparación y caracterización de películas de quitosano (CS) reticuladas con tripolifosfato de sodio (TPP), preparadas por el método de evaporación del solvente. Inicialmente se estudió la despolimerización del quitosano con nitrito de sodio con el fin de obtener diferentes pesos moleculares del polímero utilizado, logrando conseguir así quitosanos de 554,22kDa y 133,37kDa de masa molar. Posteriormente se preparó y caracterizó películas de quitosano reticuladas con TPP, evidenciando la interacción puente hidrógeno con el polianión mediante técnicas FTIR, SEM, TG. También se realizó estudios de hinchamiento, con el objetivo de identificar el tipo del modelo cinético que permite explicar dicho fenómeno en estas películas.
Palabras clave: Quitosano, tripolifosfato de sodio, despolimerización.
ABSTRACT
This work has studied the preparation and characterization of chitosan films (CS) crosslinked with sodium tripolyphosphate (TPP), prepared by the solvent evaporation method. Initially we studied the depolimeryzation of chitosan with sodium nitrite to get different polymer molecular weights in the used polymer. For example, we obtained chitosans of 554.22kDa and 133.37kDaof molecular weight. Afterward, prepared and characterized chitosans films crosslinked with TPP, evidently the hydrogen brigde interaction with the polyanion through IR, SEM, TG; also was performed swelling studies, with the objetive of identified the type of kinetic model in which enable explain said phenomenon in these films.
Keywords: Chitosan, sodium tripolyphosphate, depolymerization.
INTRODUCCIÓN
En las últimas décadas, el desarrollo de nuevas formas farmacéuticas de liberación modificada (FFLM), también llamadas de liberación controlada, ha suscitado gran interés en la industria farmacéutica. Se trata de dispositivos que aportan mejores pautas posológicas, mejor perfil farmacocinético e incluso reducción de efectos adversos. De acuerdo con la Real Farmacopea Española1, las FFLM son aquéllas en las que la velocidad y el lugar de liberación de la sustancia o sustancias activas son diferentes a la de la forma farmacéutica de liberación convencional, administrada por la misma vía. En ellas se introduce modificaciones en la formulación o en el proceso de producción con el fin de alterar la velocidad, el tiempo o el lugar de liberación del fármaco2. De esta forma se puede alcanzar los niveles terapéuticos del fármaco en el lugar de acción y mantenerlos a lo largo del tiempo.
Actualmente, en la elaboración de sistemas de liberación controlada, se utilizan un gran número de polímeros, entre los que existen dos grandes grupos:
Polímeros naturales, como el colágeno, la albúmina o el quitosano. Polímeros sintéticos, entre los que se distingue: Polímeros biodegradables, como los ácidos poliláctico, poliglicólico, y polímeros no biodegradables, como los ácidos poliacrílicos.
El quitosano es un polímero natural que se obtiene a partir de la quitina, uno de los biopolímeros más abundantes en la naturaleza. Se trata de un copolímero de 2- acetamido-2desoxy-β-D-glucosa y 2-amino-2-desoxy-β-D-glucosa. Algunas de las propiedades funcionales del quitosano, tales como la biodegradabilidad, biocompatibilidad, mucoadhesión, capacidad filmogénica, capacidad hemostática, promotor de absorción, actividad antimicrobiana, anticolesterolémica y antioxidante , han promovido su utilización en varios campos distintos, como son agricultura, industria y medicina.
El término degradación de polímeros se refiere a los procesos inducidos por luz solar, calor y otros agentes atmosféricos que conducen a una modificación de la estructura del polímero. Un polímero puede tener diversos cambios físicos o químicos. En este trabajo se utilizará la degradación oxidativa, para poder obtener quitosano con menores masas moleculares.
El carácter filmogénico del quitosano dio lugar a una de las primeras aplicaciones investigadas de este polímero natural. Es posible formar películas de quitosano con buenas propiedades físicas y mecánicas a partir de sus disoluciones en ácidos diluidos, tales como fórmico, acético o propiónico. Las propiedades filmogénicas del quitosano se deben a la formación de enlaces de hidrógeno intermoleculares entre los grupos amino e hidroxilo de sus cadenas. A pH ácido, estos enlaces de hidrógeno se disocian debido a la protonación de los grupos amino y se produce un rápido hinchamiento de la película. Durante el proceso de hinchamiento se produce la incorporación del líquido en el interior de la matriz, producto de la diferencia de potencial químico del disolvente dentro y fuera de ella, provocando una dilatación de la misma; este fenómeno es estudiado mediante modelos matemáticos de difusión, denominados leyes de Fick.
PARTE EXPERIMENTAL
Materiales:
Quitosano (CS), suministrado por Sigma -AldrichChemistry, (Irlanda); tripolifosfato de sodio (TPP), suministrado por Sigma - AldrichChemistry, (USA); nitrito de sodio (G.A.), hidróxido de sodio (G.A.), ácido clorhídrico (G.A), cloruro de sodio (G.A.).
Obtención de quitosano despolimerizado:
El quitosanodespolimerizado se obtuvo mediante degradación oxidativa utilizando nitrito de sodio. Se preparó una solución de 1% (m/v) de quitosano en 1% (m/v) de ácido acético. Se adicionó NaNO2 0,1M tal que la relación de moles entre el quitosano y el nitrito fue de 0,01.
Posteriormente se mantuvo en reacción durante 3h con agitación constante. La recuperación del quitosano despolimerizado se realizó con hidróxido de sodio, llevando la solución hasta pH=8, posteriormente se hizo un lavado con agua. Finalmente se recuperó el quitosano por centrifugación a 1000rpm por 5min, y secado en estufa a 45ºC, hasta peso constante.
Obtención de películas de quitosano:
Las películas de quitosano cargadas con antocianinas se obtuvieron por el método de evaporación del solvente. Se preparó una solución de quitosano al 1% (p/v) en ácido acético 1%(v/v) y se añadió 0,1g de extracto de antocianinas en polvo. Para esto se pesó 1,0g del polímero y la cantidad indicada de la antocianina y se disolvieron en 25mL de ácido acético 1%(v/v), con agitación constante durante 4h.
Se colocaron 25mL de solución en una superficie de acrílico de 10,0x10,0cm2 que fue nivelada horizontalmente. Se llevó el soporte con la solución a una estufa a 45°C durante 24h. Se retiró la película seca de la superficie del soporte. Se sumergió la película preparada en 100mL de solución de TPP 5% durante un tiempo determinado (0,5 a 4h). Finalmente, se secó la película en una estufa a 60ºC durante 30min para luego ser almacenada en un desecador.
Caracterización de películas de quitosano:
Determinación del grado de desacetilación
Se pesó 200 mg de quitosano, posteriormente se adicionó 5mL de HCl 1,0 M, hasta disolver la muestra completamente. Se agregó 450mL de NaCl 0,001 M, y se llevó a agitación para lograr una solución uniforme. La solución anterior se tituló conductimétricamente con 60mL de NaOH 0,1M estandarizado. La titulación se realizó descargando 0,5mL de NaOH 0,1M, anotando las lecturas del conductímetro.
Determinación del peso molecular
Se determinó por viscosimetría, utilizando un buffer de 0,1M de CH3 COOH en 0,02M de NaCl a 30ºC, en diferentes concentraciones de quitosano. Se midió la densidad de las soluciones utilizando un picnómetro con brazo lateral, y la viscosidad, utilizando un viscosímetro de Oswald; mediante la ecuación de Mark-Houwink-Sakurada se determinó el peso molecular.
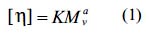
En esta ecuación, [η] es la viscosidad intrínseca, Mv es el peso molecular promedio viscosimétrico y K y a son dos constantes que dependen de la naturaleza del polímero.
Espectroscopía infrarroja (FTIR)
Se obtuvo los espectros de infrarrojo del quitosano en forma de películas con un Magna-IR 750 (Nicolet) por el método de transmisión (Unidad de Espectroscopía de Infrarrojo, Laboratorio de Espectroscopía Molecular, Instituto de Química, Universidad de São Paulo, (Brasil). Las muestras se midieron con un beamsplitter de KBr y un detector DTGS de KBr entre 400 y 4000 cm-1. Se midió las muestras de películas de quitosano a 4cm-1 con 128 acumulaciones.
Estudios de morfología
Las imágenes de microscopía electrónica de barrido (SEM) se obtuvieron en el Laboratorio de Películas delgadas de la Facultad de Ciencias de la Universidad Nacional de Ingeniería. Las muestras de películas, se adhirieron con una cinta de doble haz adhesivo sobre los portamuestras cilíndricos.
Las muestras se metalizaron con Au utilizando un recubridor de oro (Electron Microscopy Science, EMS-550). Se empleó un microscopio electrónico de barrido (SEM) modelo Philips 505.
Análisis termogravimétrico:
Se llevó a cabo a partir de 5mg de muestra (película) con el uso del programa de calentamiento del equipo SDT Q600 V8.3 Build 101, perteneciente al Instituto de Química de São Carlos, USP – Brasil, donde se utilizó un intervalo de temperatura desde 30 hasta 1000°C, con una velocidad de calentamiento de 10 grado/min y un flujo de aire seco de 50mL/min.
Se calculó la primera derivada (dm/dT) a las curvas calorimétricas obtenidas, para determinar la temperatura de máxima velocidad de descomposición.
Grado de hinchamiento:
El hinchamiento de las películas se llevó a cabo en PBS a pH 6,5. Se utilizó para ello muestras de películas con una superficie de 10x10cm2 y que no contenían principio activo.
Se pesó el fragmento de película en una placa Petriy se anotó su peso exacto; se añadió 50mL de medio atemperado y en un agitador magnético a 37ºC y 100 rpm. A intervalos de tiempos predeterminados, la película se extrajo, de forma rápida y cuidadosa, dejándola secar ligeramente sobre un papel de filtro para eliminar el exceso de líquido.Se pesó y se volvió a introducir en la placa. El grado de hinchamiento (W) se determinó mediante la siguiente expresión (2):
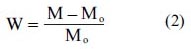
donde M es el peso a tiempo t y Mo el peso a tiempo cero. Posteriormente estos valores se utilizaron en el análisis cinético.
RESULTADOS Y DISCUSIÓN
Despolimerización del quitosano
El quitosano a trabajar posee las siguientes características (tabla 1.)
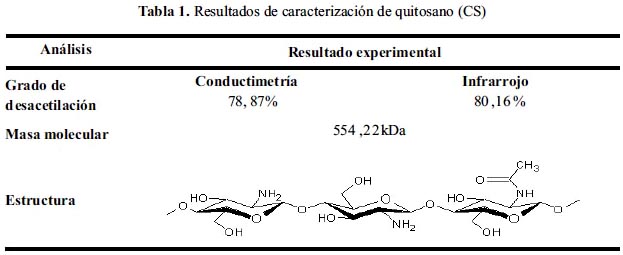
Con la finalidad de obtener oligómeros y materiales de bajo peso molecular basados en este biopolímero, se realiza la despolimerización del quitosano; ésta es un área de mucho interés actual por diversas razones. Una de ellas se sustenta en que varios derivados de bajo peso molecular muestran mayor solubilidad en medios acuosos de pH neutro que sus homólogos de mayor tamaño. Las soluciones de quitosano que podríamos obtener sólo están limitadas por su viscosidad, es decir, ahora podemos preparar soluciones más concentradas.
Se despolimeriza el quitosano con nitrito de sodio mediante un mecanismo de degradación oxidativa. Gracias al poder oxidativo del nitrito es posible conseguir rupturas en los enlaces glucosídico del quitosano, generando así cadenas poliméricas más cortas que llevan a la disminucion del peso molecular del quitosano. Se resumen los resultados de la caracterización del quitosano despolimerizado en la siguiente (tabla 2).
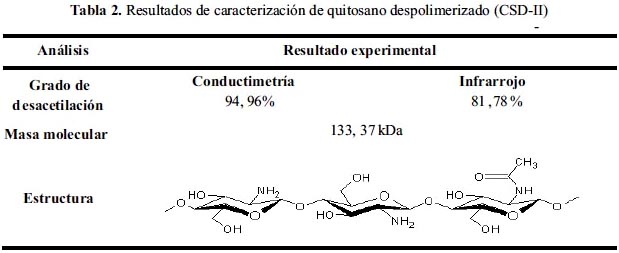
Caracterización de películas de quitosano
Las películas fueron cargadas en el momento de la preparación de las mismas, adicionando una determinada cantidad de antocianinas antes del procedimiento de secado.
En el campo de la farmacia, las películas de quitosano podrían ser utilizadas para el recubrimiento de comprimidos y como sistemas de liberación controlada de fármacos. En los últimos años, el uso de películas de quitosano para el tratamiento de heridas e infecciones cutáneas ha suscitado un gran interés puesto que se puede administrar el fármaco de forma localizada y sostenida en el sitio de acción. Además, el carácter antimicrobiano y cicatrizante del quitosano aporta propiedades favorables a los sistemas de liberación de uso tópico.
El objetivo del trabajo ha sido la obtención, por el método de evaporación del solvente, de películas de quitosano para el posterior encapsulamiento de antocianinas.
Una de las características importantes observadas en el proceso de reticulación de una película de quitosano, es el cambio de color observado en éstas al ser sumergidas en la solución de TPP(figura 2); en el proceso adquieren una coloración blanca, no traslúcida y no removible al ser enjuagado con agua. Esta característica sólo se presenta mientras la película permanezca húmeda, luego del proceso de secado la película vuelve a adquirir la tonalidad amarillenta y traslúcida, característica de las películas de quitosano. Esta observación nos lleva a la suposición de que dicha coloración es debido a una interacción intermolecular entre el reticulante (TPP) y la matriz polimérica (quitosano); la permanencia de dicha coloración, después del enjuague con agua con el fin de remover TPP sin interaccionar, refuerza esta hipótesis.

Espectroscopía infrarroja
En la figura 3 se observa los espectros correspondientes a las películas de quitosano CDP1 y CDP3 (peso molecular de 133,37kDa). A partir de estos espectros se puede observar en el espectro de quitosano/TPP que el pico vinculado a las amidas a 1653cm-1 desaparece; ademas, se muestra un pico a 1632cm-1 atribuido a la vibración de flexión de la amina de quitosano; ésta ha sufrido un corrimiento hacia mayores frecuencias debido a una interacción externa con otra molécula. También se muestra otro nuevo pico a 1540cm-1, el cual está atribuido a la vibración de tensión del grupo de la amina protonada. El espectro también mostró picos a 1206cm-1 y 1151cm-1 correspondientes al enlace P=O y R-O-P-O. Xu et al5, Knaul et al6, y Wang et al7 observaron resultados similares en su estudio de la formación de nanopartículas de quitosano y películas de quitosano tratados con fosfato. Otro pico importante que podemos observar es el de 889cm-1 atribuido al enlace P─O─P.
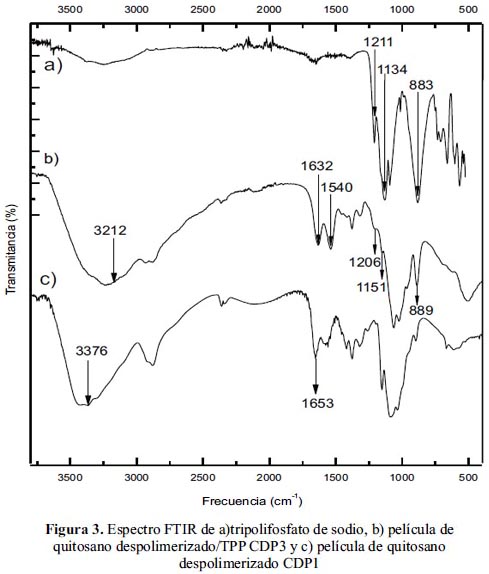
Otra característica importante que no podemos dejar de mencionar es el corrimiento nuevamente observado en el pico del grupo amínico, desplazándose de 3376 a 3212 cm-1; este fenómeno nos indica claramente una interacción externa en este grupo; en este caso, dada la naturaleza del reticulante, se trata de un puente hidrógeno entre la amina y el oxígeno del tripolifosfato.
En esta figura se puede apreciar con bastante claridad que existe diferencia entre los principales picos de las películas de quitosano y las que aparecen en el quitosano reticulado, corroborando nuestra hipótesis de interacción puente hidrógeno.
Estudios de morfología
En la figura 4 se muestra las microfotografías de diferentes películas de quitosano; corresponden a la variación de la concentración de tripolifosfato utilizado en la reticulación de las películas, en concentraciones de 0; 2,5; 5,0; 7,5 y 10%, respectivamente. La interacción puente de hidrógeno entre las aminas de las cadenas de quitosano con el oxígeno del tripolifosfato es homogénea, prácticamente, en toda su morfología; esta observación nos hace pensar que la característica plana y homogénea de los filmes generan una interacción puente de hidrógeno entre la superficie de la película de quitosano con el tripolifosfato de manera homogénea, es decir, sin acumulaciones debido a imperfecciones o irregularidades en la superficie; esta fenómeno empieza con el hinchamiento del film, su hidratación y posterior interacción, lográndose formar una pequeña capa de complejo quitosano/TPP; después de la pérdida de agua a causa del secado la película retoma la morfología inicial, debido a que el tripolifosfato no es lo suficientemente grande como para modificar la superficie del quitosano. A pesar de este fenómeno la presencia de la interacción se hace más notable en los demás análisis. Las partículas insolubles de la solución de quitosano son las mostradas en las figura 4 en las fotografías d) y e). En contraposición con esta afirmación a nivel macroscópico la interacción se puede asociar con el cambio de coloración en la película húmeda en el proceso de reticulación.

Analisis termogravimétrico
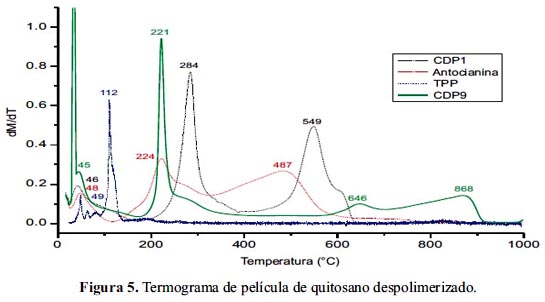
Para poder estudiar y analizar los fenómenos existentes en la degradación térmica de una película de quitosano cargada y reticulada con tripolifosfato tenemos la figura 5. En la primera gráfica podemos observar una primera degradación entre la temperatura ambiente y 173°C correspondiente a la pérdida de agua; el segundo evento térmico comprendido entre 173 y 560°C corresponde la degradación de despolimerización de las cadenas de quitosano en la película, junto con la degradación parcial de las antocianinas. Podemos notar que la pérdida de oxígeno del tripolifosfato a una temperatura promedio de 112°C no se presenta ya que éste está protegido por el enlace de puente hidrógeno existente con las aminas del quitosano. También notamos que la segunda degradación de las antocianinas que ocurre a una temperatura promedio de 487°C ha sufrido un corrimiento ya que el tercer evento térmico de nuestra película presenta un intervalo de 560 a 700°C, que indica que la degradación de las antocianinas está térmicamente impedido por una fuerza de interacción intermolecular; este último fenómeno nos hace pensar que el ambiente electronegativo generado por la deslocalización de electrones en la estructura de la antocianina sufre una interacción con las aminas protonadas del quitosano, generando así un corrimiento en dicho evento térmico. El último evento presentado comprende de 700 a 927°C que según el espectro de quitosano debió ocurrir a 618°C, aproximadamente; ahora nos confirma la existencia de la interacción de puente hidrógeno entre las aminas de quitosano y el oxígeno de tripolifosfato; una vez quebrada la interacción, la materia restante se degrada mediante una termooxidación.
Estudio de hinchamiento
El hinchamiento de las películas de quitosano entrecruzadas con TPP dependerá del pH del medio de liberación, ya que las interacciones electrostáticas existentes entre ambos polianiones están controladas por el pH del medio. Se estudió el efecto de la concentración de TPP, el tiempo de entrecruzamiento y el espesor sobre el hinchamiento de las películas sin antocianinas en PBS a pH 6,5. El hinchamiento se determinó por la ecuación 1.
Efecto de la concentración de tripolifosfato:
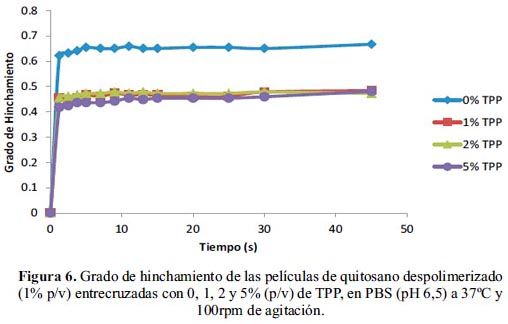
En la figura 6 se muestra que las películas de quitosano despolimerizado poseen un comportamiento similar. La película no entrecruzada presentó un grado de hinchamiento de 0,66; mientras que las películas reticuladas con soluciones de TPP al 1, 2, y 5% (p/v) presentaron un grado de hinchamiento más bajo, 0,48; 0,47 y 0,48, respectivamente. Por lo tanto, podemos concluir que el entrecruzamiento de las películas con polianiones da lugar a un bajo grado de hinchamiento, y este hecho favorecerá el control de la liberación de compuesto encapsulado. Por otra parte, el hinchamiento no fue significativamente distinto; los valores son prácticamente los mismos para las concentraciones estudiadas. Esto resultados nos indican que la reticulación con diferentes concentraciones de TPP dio lugar a una matriz lo suficientemente entrecruzada como para no permitir la entrada de agua.
Efecto del tiempo de entrecruzamiento sobre el grado de hinchamiento.
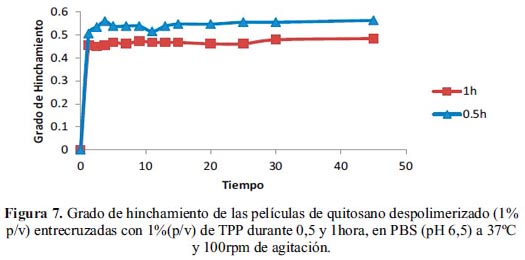
La figura 7 muestra el hinchamiento de dos películas entrecruzadas con 1% (p/v) de TPP a pH 6,5 y sometidas a distintos tiempos de entrecruzamiento (0,5 y 1 hora). El grado de hinchamiento, para las películas sumergidas en la solución de TPP durante 0,5 y 1 hora fue de 0,56 y 0,48, respectivamente. Como se puede observar, un aumento del tiempo de entrecruzamiento provocó una ligera disminución del grado de hinchamiento, aunque no existen diferencias significativas entre los perfiles de hinchamiento..
Efecto del espesor de las películas sobre el grado de hinchamiento
En la figura 8 se puede apreciar el efecto del espesor en la reticulacion de las películas; para eso se comparan dos películas, en las cuales se utilizó diferente volumen de solución de quitosano para prepararlas, 25 y 50mL, respectivamente.
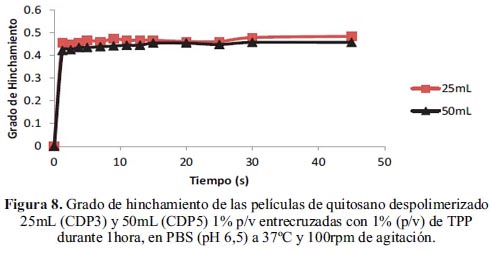
Como se puede apreciar, la película de 25mL y 50mL poseen un grado de hinchamiento de 0,48 y 0,46 respectivamente; podemos deducir que la película con mayor volumen de solución debido al mayor espesor que posee demora un poco más en dejar pasar el agua al interior de la matriz que su homóloga más delgada; sin embargo los resultados no presentan diferencias significativas.
Efecto del peso molecular de las películas sobre el grado de hinchamiento:
En la tabla 3, se muestra películas de quitosano y quitosano despolimerizado preparadas en condiciones similares. A partir de las comparaciones puede obtenerse el siguiente resultado.
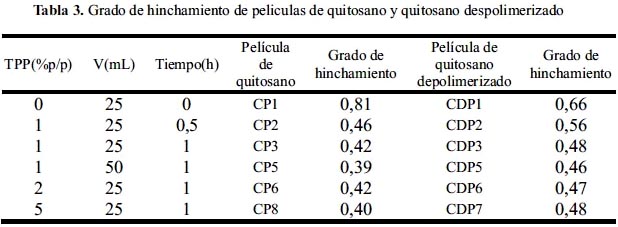
Todas las películas preparadas correspondientes al quitosano despolimerizado presentan un mayor grado de hinchamiento que las películas preparadas a partir del quitosano de mayor peso molecular. Estos resultados podemos atribuirlos al hecho de que las cadenas del polímero despolimerizado son más pequeñas, presentando mayor número de poros por lo que el solvente puede entrar con mayor facilidad; sin embargo, la diferencia no es considerable como para poder deducir dicha afirmación; sólo en el primer caso podemos ver que las películas de quitosano sin reticular presentan un mayor hinchamiento que sus análogas de menor peso molecular.
Modelo cinético:
Los perfiles de hinchamiento se ajustaron a la ecuación de Schott
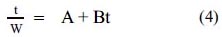
Donde w representa al hinchamiento en el tiempo t y B es el inverso del hinchamiento máximo.
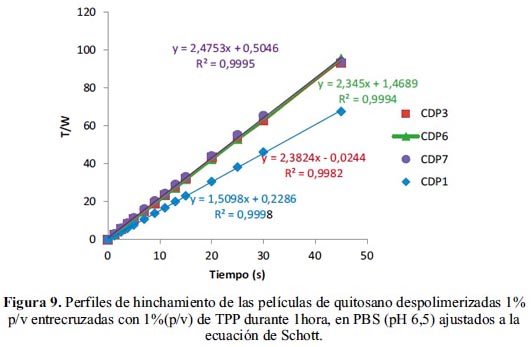
Como se observa en la figura 9, los ajustes presentaron altos coeficientes de correlación (R2≥ 0,99). Por consiguiente, el proceso de hinchamiento de estas películas está gobernado por la relajación de las cadenas del polímero. Los materiales que se ajustan a la ecuación de Schott siguen una cinética de 2do orden, hecho que cumplen los resultados de este apartado. Dependiendo de los valores obtenidos en la constante B, podemos deducir el hinchamiento máximo alcanzado en las películas, como podemos ver en las figuras 7 y 8; éstas son muy similares, por lo que muy probablemente encontraremos comportamientos similares o muy poco apreciables en la liberación del fármaco.
CONCLUSIONES
Se logró caracterizar y despolimerizar quitosano, bajando el peso molecular de 554,22kDa a 133,37kDa; adicionalmente, se construyó la curva de despolimerización del quitosano inicial, con la finalidad de controlar el peso molecular deseado en la despolimerización. Se obtuvo películas de quitosano de bajo y alto peso molecular, reticulado con tripolifosfato y cargado con antocianinas por el método de evaporación de solvente. Los estudios de espectroscopía de infrarrojo y microscopía electrónica de barrido, termogravimetría e hinchamiento, mostraron que el tripolifosfato reacciona electrostáticamente con el quitosano, manteniendo las antocianinas dentro de la matriz polimérica.
AGRADECIMIENTOS
Agradezco al Laboratorio de Química Nº 33 y Nº 12 de la Facultad de Ciencias de la Universidad Nacional de Ingeniería, así como al Instituto de Química(IQ) e Instituto de Química de São Carlos (IQSC)- Universidad de São Paulo – Brasil.
REFERENCIAS
1. Ministerio de Sanidad y Consumo, Monografías de formas farmacéuticas. Formas farmacéuticas. in: Real Farmacopea Española. 3ª Edición. Madrid, 2005, pp. 645.
2. X. Ding, A.W.G. Alani, J.R. Robinson, Extended-release and targeted drug delivery system, in: D.B. Troy (Ed.), The Science and Practice of Pharmacy, 21st Edition, Remington, Lippincott Williams & Wilkins, 2002, pp. 939-964.
3. I. Aranaz, M. Mengibar, R. Harris, I. Paños, B. Miralles, N. Acosta, G. Galed, A. Heras, Functional Characterization of Chitin and Chitosan, Current Chemical Biology 3, 2009; 2; 203-230.
4. Expósito, Ruth. Quitosano, un Biopolímero con aplicaciones en sistemas de liberación controlada de fármacos. Tesis doctoral. Universidad Complutense de Madrid. Facultad de Ciencias Biológicas. Departamento de Bioquímica y Biología molecular I. 2010.
5. Xu Y, Du Y. Effect of molecular structure of chitosan on protein delivery properties of chitosan nanoparticles. Int J Pharm. 2003; 250: 215-226.
6. Knaul J Z, Hudson SM, Creber KAM. Improved mechanical properties of chitosan fibres. J Appl Polym Sci.1999; 72:1721-1731.
7. Wang X, MaJ, Wang Y, He B. Structural characterization of phosphorylated chitosan and their applications as effective additives of calcium phosphate cements. Biomaterials. 2001; 22: 2247-2255.
8. X. Z. Shu, K. J. Zhu, A novel approach to prepare tripolyphosphate/chitosan complex beads for controlled release drug delivery, Int. J. Pharm, 2000;201: 51-58.
9. Aguiló, E. et al. Quitina y Quitosano: obtención, caracterización y aplicaciones. Pp 26-29 (Fondo editorial de la Pontificia Universidad Católica del Perú: Perú, 2004).
10. Jacinto, Christian. Liberación Controlada de difosfato de Cloroquina a través de micropartículas de quitosano entrecruzadas con glutaraldehído. Tesis de Maestría. Universidad Nacional de Ingeniería, Facultad de Ciencias, 2010.
Recibido el 07-08-2013
Aprobado el 27- 08-2013













