Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.3 Lima July/Sep. 2013
ARTÍCULO DE REVISIÓN
Quinoxalinas como potenciales agentes Antimycobacterium tuberculosis: una revisión
Quinoxalines as potent Antimycobacterium tuberculosis agents: a review
Mery Santivañez-Veliz1*, Elsa Moreno-Viguri, Antonio Monge y Silvia Pérez-Silanes
1
Universidad de Navarra, Pamplona, España. *msantivanez.1@alumni.unav.es
RESUMEN
La tuberculosis requiere nuevos tratamientos frente a su compleja resistencia como MDR-TB y XDR-TB. Las quinoxalinas presentan una amplia variedad de propiedades biológicas antichagásica, antimalarial, antileishmanial, antifungal, antimicobacteriana, antiviral, antitumoral, anticancerosa, analgésica, antiinflamatoria, antioxidante, antihipertensiva y antitrombótica. En esta revisión se muestra las propiedades y nuevas aproximaciones de derivados de 1,4-di-N-óxido de quinoxalina como potenciales agentes con actividad antimicobacterial.
ABSTRACT
Tuberculosis requires of new treatments against their complex resistance as MDR-TB and XDR-TB. Quinoxalines present a wide variety of biological properties as antichagasic, antimalarial, antileishmanial, antifungal, antibacterial, antiviral, antitumor, anticancer, analgesic, antiinflammatory, antioxidant, antithrombotic and antihypertensive. This review shows the properties and new approaches for 1,4-di-N-oxide quinoxaline derivatives as potential antimycobacterial active agents.
Key words: Tuberculosis, quinoxalinas, di-N-óxido, chalconas.
INTRODUCCIÓN
La Tuberculosis (TB) es una enfermedad contagiosa por vía aérea, generalmente afecta a los pulmones pero también puede afectar a cualquier otro órgano del cuerpo. Está causada por especies del complejo Mycobacterium (M.tuberculosis (M.tb.), M.africanum, M.bovis, M.bovis Calmette Guerin (BCG), M.microti).1 Para su tratamiento se requiere un régimen que incluye una combinación de medicamentos de primera y segunda línea.
Las estadísticas muestran que aproximadamente un tercio de la población expuesta a la TB pulmonar se infectan con la bacteria, pero sólo una de cada diez personas infectadas desarrollan la enfermedad activa durante su vida.1,2 De manera global, las tasas de incidencia se han mantenido estables entre 1990-2001.3 En el 2009, la TB generó 14 millones de casos prevalentes, 9,4 millones de casos nuevos y 1,7 millones de muertes en todo el mundo. Debido a los bajos niveles de detección y a las notificaciones incompletas se calcula que estas cifras deberían ser mayores. Aunque el número absoluto de incidencias aumenta debido al crecimiento poblacional, la tasa de incidencia disminuye lentamente.4
Entre el 2010-2011, se observó una ligera disminución en las 6 regiones de la OMS.3 En la actualidad, la TB sigue siendo un importante problema de salud mundial, siendo una de las principales causas de muerte y discapacidad en el mundo, especialmente entre las personas co-infectadas por el VIH.3 Se ubica como la segunda causa principal de muerte dentro de las enfermedades infecciosas después del VIH.4
Según el último informe de la OMS, la incidencia estimada a nivel mundial en 2011 corresponde a 8,7 millones de nuevos casos, equivalentes a 125 casos por cada 100.000 habitantes y 1,4 millones de muertes, de los cuales 990.000 no asociadas a VIH y 430.000 asociadas a VIH.4 La mayor proporción de casos se encuentra en el sureste Asiático (59%); seguidos de África (26%), del Mediterráneo Oriental (7,7%); de Europa (4,3%) y América (3%).3 Los cinco países con la mayor incidencia son: India, China, Sudáfrica, Indonesia y Pakistán. Siendo India y China el 26% y el 12% respectivamente y en conjunto suman el 40% de los casos de TB a nivel mundial. Mientras el 60% restante se encuentra distribuido entre el sureste Asiático y el Pacífico occidental.3
De manera preocupante, a finales del 2011 se ha reportado en 84 países por lo menos un paciente con XDR-TB, incluidos España y Perú.3 En América, cada año, mueren alrededor de 23.000 personas a causa de la TB y se contagian 270.000, incluyendo 44.000 niños. Estas cifras son un avance si se considera que desde 1990, se ha reducido en 60% el número de casos y en dos tercios el número de muertes. Según la OPS, los países con mayor incidencia de la enfermedad son Haití, Surinam, Bolivia, Guyana y Perú, reportando en el año 2010 de 106 a 230 casos por cada 100.000 habitantes. Canadá, Cuba y Estados Unidos son los de menor incidencia, con menos de 10 casos por cada 100.000 habitantes.
Con la finalidad de erradicar la TB y disminuir el riesgo de muerte de unos 10 millones de personas, se ha elaborado estrategias de control epidemiológico (tabla 1).
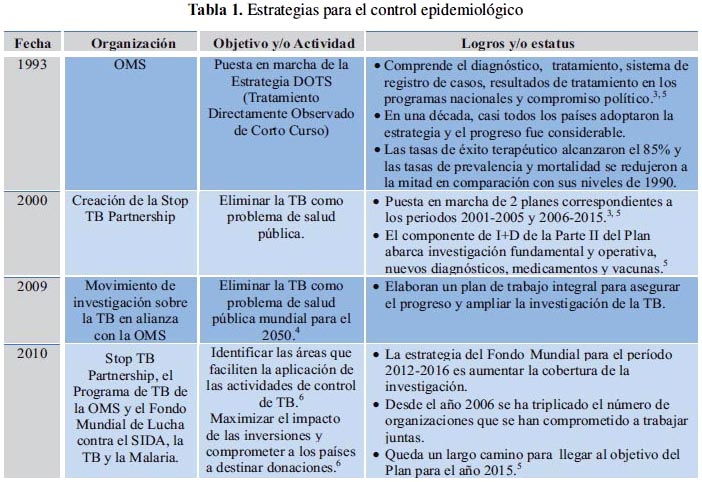
Los países miembros de la OPS se han propuesto el objetivo de eliminar la TB de la región para el 2050.7 Para esto se necesitaría una tasa de disminución aproximada de 16% por año. Se debería combinar las intervenciones que mejoren el diagnóstico, prevención de la infección con una vacuna pre-exposición, reducción de los factores de riesgo y mejorar la comprensión de la epidemiología con el fin de facilitar las actividades de control.4
La detección precoz de la resistencia a los fármacos antituberculosos sería esencial para el correcto control de la MDR-TB.8,9 El conocimiento de los mecanismos de resistencia permitiría desarrollar técnicas moleculares para su detección.10 Se conoce los genes involucrados con la resistencia de M.tb. a los fármacos anti-TB y algunos mecanismos de acción han sido descubiertos.11
La falta de capacidad de diagnóstico ha sido una barrera importante en la respuesta eficaz y en la rapidez de la detección. Cuando la MDR-TB se encuentra asociada al VIH es aún más grave porque sólo se detecta el 7% de la carga mundial estimada y todavía en menor fracción para los casos de XDR-TB.1 En las Nuevas Tendencias Diagnósticas, el objetivo principal es aumentar la detección de casos, siendo tarea prioritaria la innovación en las pruebas diagnósticas que permitan predecir la progresión de la TB y su clasificación.4,5 La OMS en el año 2010, aprobó el sistema Xpert MTB/RIF.3 Es un sistema automatizado en tiempo real de la tecnología de amplificación de ácidos nucleicos. Permite diagnosticar la TB y la resistencia a RIF en 100 minutos, frente a los 3 meses que toman los exámenes actuales; ofreciendo una mejora drástica del diagnóstico de la TB activa y la MDR-TB.6,12
La eficacia del tratamiento farmacológico depende de la dosificación y del tiempo. Se justifica con el hecho de que a dosis sub-terapéuticas se favorece la aparición de resistencias y a dosis elevadas se puede producir mayores efectos secundarios.13
El paciente puede tener diversas poblaciones bacilares, intra o extracelular y con diferente actividad metabólica. M.tb. tiene la capacidad de entrar en períodos de latencia aún al tener actividad metabólica limitada, dificultando la acción de los antimicrobianos.14 En el tratamiento estándar se utiliza los fármacos de primera línea, siendo los bactericidas: la INH, RIF y Pirazinamida (PZA) y los bacteriostáticos: el Etambutol (ETB) y Estreptomicina (STR).15,16 La MDR-TB se produce cuando una cepa de M.tb. es resistente a la INH y a la RIF. Se recurre a una combinación de fármacos de segunda línea como las tioamidas, clicloserina, fluoroquinolonas, péptidos cíclicos, aminoglucósidos y el acido-p-amino salicílico (PAS). La XDR-TB es la forma de TB multi-resistente más difícil de tratar; se produce cuando una cepa de M.tb., además de ser resistente a INH y RIF, es resistente también a los fármacos de la segunda línea y al menos a 1 de los 3 medicamentos inyectables (amikacina, kanamicina o capreomicina). Se recurre a un tratamiento combinado amplio que complica enormemente la terapia.17
Los objetivos principales de las Nuevas tendencias terapéuticas son el desarrollo de nuevos fármacos activos frente a las cepas resistentes, que permitan regímenes de tratamiento más cortos y con menos efectos secundarios.4
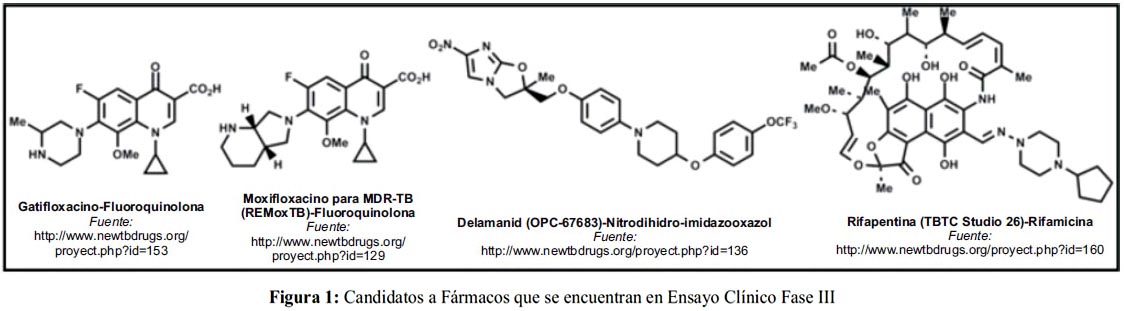
El TB Alliance se creó en el 2000 para avanzar en el descubrimiento de prometedores candidatos a nuevos fármacos anti-TB. En la actualidad, cuenta con más de 20 proyectos en su cartera con el objetivo de disminuir el tiempo de tratamiento de 2 años a 6 meses, hasta conseguir algún tratamiento de 1 semana. Se encuentran en fase clínica 3 candidatos a fármaco y un régimen de tratamiento multi-fármaco con moxifloxacino. Comparado con el estándar, el tratamiento con moxifloxacino pretende reducir en un 33% la duración del tratamiento actual, con una administración menor a 2 semanas, al igual que cualquier tratamiento antibiótico.18
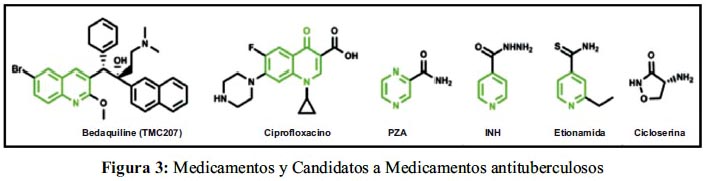
Tiene también 2 ensayos de tratamiento Combinado: El NC-003 en fase 2A, en NC-002 en fase 2B y el RemoxTB en fase 3.19 En diciembre del 2012, la FDA aprobó SirturoTM tabletas (figura 3) para casos de MDR-TB con una duración aproximada de 6 meses de tratamiento. 20 Comercializada por Janssen Pharmaceutical, una compañía de Johnson & Johnson.21
Hipótesis inicial
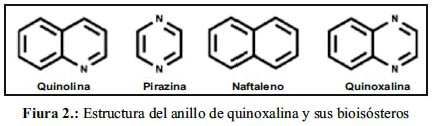
Químicamente, la quinoxalina es un biciclo aromático que presenta 2 átomos de nitrógeno en posición 1 y 4. Se describe como un bioisóstero de quinolina, naftaleno o algún otro anillo aromático que incluya la pirazina o piridina 13,22 (figura 2).
La INH y PZA, utilizadas en la actualidad para el tratamiento de la TB, incluyen en su estructura anillos de piridina y pirazina, respectivamente. Considerando factores estéricos y electrónicos, la quinoxalina es una bencilpirazina cuya estructura es similar a INH y PZA. Existen otros compuestos con actividad antibacteriana conocida, como ciprofloxacino (figura 3), obtenido como producto de la oxidación de la quinolina. La quinolina es otro conocido bioisóstero del anillo de quinoxalina y la estructura heterocíclica es el scaffold de las fluoroquinolonas.23 Otro derivado de quinolina es el compuesto TMC207 (Bedaquilina), recientemente aprobado por la FDA, como SirturoTM tabletas (figura 3).
Actividad biológica de las quinoxalinas:
Diversas son las actividades biológicas que presentan los derivados de quinoxalina. Como la actividad antimicobacterial26-28, anti-chagásica29-33, antimalarial34-36 y antileishmanial37, que pertenecen al subgrupo de enfermedades debidas a protozoos. Otras son las actividades Antifungal26, antibacterial38 y antiviral.39-41 En cuanto a la clasificación correspondiente a neoplasmas, se encuentran las actividades antitumoral42-44 y anticancerosa44,45 que están relacionadas con la inhibición selectiva de células hipóxicas. Formando parte del grupo de enfermedades del sistema nervioso central y de los órganos sensoriales, se encuentran, la 32 actividad analgésica46,47 anti-inflamatoria y antioxidante.48,49 Finalmente, han mostrado también actividad antihipertensiva50,51 y antitrombótica52,53 que son clasificadas como enfermedades del sistema circulatorio.
Derivados de quinoxalina como agentes antituberculosos:
La Unidad de I+D de Medicamentos de la Universidad de Navarra (UN), cuenta con una línea de investigación que trabaja desde hace décadas en el desarrollo y síntesis de nuevos derivados de quinoxalina, con potencial actividad antituberculosa (anti-TB). En esta revisión se presenta una descripción de los aportes que el equipo del Dr. Monge ha realizado a la comunidad científica en cuanto a la actividad anti-TB de las quinoxalinas. La experiencia del grupo se centra en la variedad de series obtenidas, derivadas de las modificaciones realizadas en las posiciones R2, R3, R6 y/o R7 de la quinoxalina 1,4-di-N-óxido. Estas posiciones son consideradas como influyentes en la actividad biológica (figura 4).
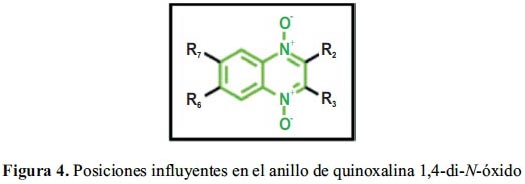
En la posición R2, el grupo ha trabajado, principalmente con derivados carbonitrilo, amida, cetona y éster. Los grupos estudiados en la posición R3 son entre otros, metilo, amina, piperazina, trifluorometilo y fenilo. Finalmente, en las posiciones R6 y R7, en las cuales se han realizado las sustituciones de los hidrógenos por flúor, cloro, metilo, trifluorometilo y metoxilo. Estas modificaciones estructurales han permitido obtener una gran variedad de compuestos que ha facilitado un amplio análisis de la relación estructura-actividad (SAR).
Las primeras publicaciones del grupo sobre las quinoxalinas como agentes anti-TB se realizaron en la década de los años 90. En estos primeros ensayos, solamente las quinoxalinas 2-carbonitrilo 1,4-di-N-óxido presentaron actividad anti-TB al ser comparadas con sus análogos reducidos.54 De este modo se confirma la importancia de los grupos 1,4-di-N-óxido en el anillo de quinoxalina, como un requerimiento estructural imprescindible para la actividad antimicobacteriana54-56 (figura 4). El grupo de Carta hizo lo mismo con derivados de quinoxalina-2-ona28,57 Estudios adicionales realizados por nuestro grupo confirmaron la importancia de la presencia de los N-óxido en las diferentes propiedades biológicas, porque su ausencia, lleva a la pérdida de la actividad antimicobacteriana.56,58
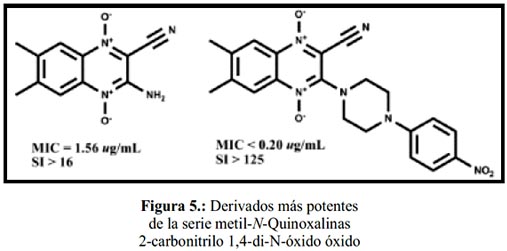
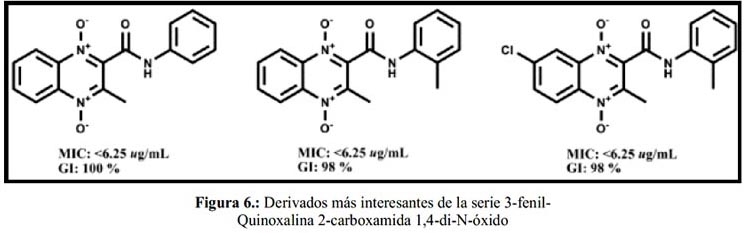
A principios de la década del 2000, se obtuvo resultados positivos en diversas series de quinoxalina 1,4-di-N-óxido, destacando por sus buenos resultados de actividad los 2 compuestos de la figura 5. Sin embargo, estudios posteriores demostraron que los derivados de quinoxalina-2-carbonitrilo parecían ser bastante tóxicos56, proponiéndose entonces la sustitución del grupo carbonitrilo por un grupo carboxamida59, cetona60 o carboxilato61. Así, se sintetizaron 31 nuevos derivados 3-metilquinoxalina-2-carboxamida 1,4-di-N-óxido, encontrándose 3 compuestos con gran selectividad (figura 6).
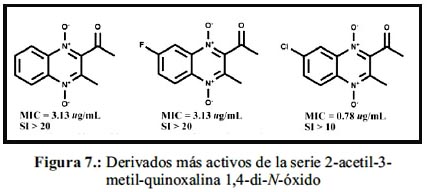
En el mismo año, Jaso et al., sintetizaron 27 derivados de 2-acetil-3-metil-quinoxalina 1,4-diN-óxido, de los cuales 4 compuestos presentaron actividad anti-TB, buena selectividad y baja citotoxicidad. Siendo los más potentes los que están representados en la figura 7. Por el contrario, los compuestos 2-acetil-3-(4-fenilpiperazin-1-il) metilquinoxalina no mostraron ninguna actividad.60
En el 2005, Jaso et al., sintetizaron 29 derivados de quinoxalin-2-carboxilato 1,4-di-N-dióxido con diferentes sustituyentes en R2: metilo, etilo, bencilo y ter-butilo y en la posición R3: 2-etoxi, 2-oxoetilo y metilo. Estos derivados permitieron concluir que la actividad anti-TB depende principalmente de los sustituyentes en el grupo carboxilato, de la posición R2 y mejora en el siguiente orden: bencilo > etilo > 2-metoxietilo > alilo > ter-butilo (figura 8).
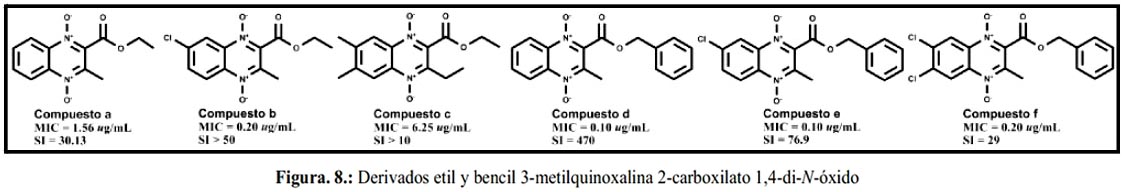
En el 2008, debido a los prometedores resultados se profundizó en la evaluación biológica del derivado etil-7-cloro-3-metilquinoxalin-2-carboxilato 1,4-di-N-óxido, incluyendo ensayos in vivo y frente a otras cepas de M.tb. (Compuesto b, figura 8) Los ensayos mostraron resultados alentadores, tal como buena actividad en ratones, vía oral y también actividad frente a Mycobacterium bovis PA-824 resistente. Finalmente, demostró ser muy activo frente a bacterias no replicantes, adaptadas a condiciones de poco oxígeno destacando como compuesto líder en la búsqueda de nuevos fármacos para el tratamiento de la TB.62 En el mismo año Villar et al. amplía el estudio biológico de 10 derivados. Se evaluó la actividad frente a cepas resistentes a MDR-TB, la dosis máxima tolerada, la biodisponibilidad oral y la eficacia in vivo en ratones. Este estudio mostró el carácter bactericida del compuesto 2-acetil3-metil-quinoxalina 1,4-di-N-óxido con el cloro en la posición R7, considerándolo como posible candidato para un tratamiento corto.63
En el 2008, el grupo de Dinorah et al., continúan con sus estudios de derivados de quinoxalinas asociadas a complejos metálicos, como el hierro.64 Los nuevos complejos mostraron mayor actividad inhibidora in vitro sobre el crecimiento de M.tb. cepa H37Rv que los medicamentos de "segunda línea", así como una baja citotoxicidad inespecífica en células eucariotas.65
En el mismo año, se cuentan con 2 estudios claves en el grupo, por un lado el de Moreno et al, que sintetizan 43 nuevos derivados de quinoxalina-2-carboxamida 1,4-di-N-óxido, donde los derivados de 3-metilquinoxalina-2-carboxamida 1,4-di-N-óxido mostraron buena actividad in vitro.
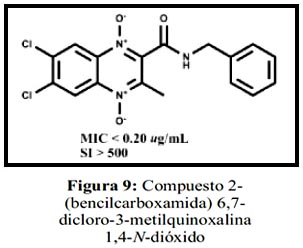
Por otro lado, con los estudios realizados por Ancizu et al., que sintetizan 36 nuevos derivados 1,4-di-N-óxido-3-metilquinoxalina-2-carboxamida, donde 34 de estos compuestos mostraron una inhibición ≥ al 90%, siendo el compuesto más activo el que se muestra en la figura 9.13
Ambos estudios ayudan a proporcionar conclusiones de estructura-actividad:
En posición R2, pequeñas modificaciones pueden afectar seriamente la actividad:
-
La longitud de la cadena alifática entre el grupo carboxamida y el aromático: debe ser la de un grupo metileno.66, 67 Mientras se hace más larga, aumenta la citotoxicidad.
-
En cuanto al sistema aromático: es mejor un benceno no-sustituido, porque no afecta negativamente la actividad antituberculosa. La inserción de un p-sustituyente, ya sean grupos aceptores de electrones (cloro, bromo trifluorometilo) o grupos donadores de electrones (metilo) no mejora la actividad antituberculosa; disminuye o aumenta la citotoxicidad del compuesto.27, 66
-
Se vio que sustituyentes como bifenil, benzodioxol no mejoran la actividad anti-TB.66
En posición R3, la presencia de un metilo es indispensable y se descarta el fenilo o cualquier otro aromático.36, 62, 63, 66, 68
En posición R6/R7, se puede decir que la inserción de un resto electroatrayente, aumenta la actividad antituberculosa, especialmente si es un átomo de cloro.66
-
La presencia de un grupo donador de electrones, reduce la actividad.67
-
Se considera también que se mejora el efecto si ambas posiciones se encuentran sustituidas por un halógeno como Cl o F.
-
Finalmente, mediante estudios de electroquímica, se sugiere una posible relación entre el potencial de reducción y la actividad anti-TB como parte del mecanismo de acción.69
En conclusión, la potencia, selectividad y baja citotoxicidad de estos compuestos los convierte en nuevos líderes para sintetizar nuevos derivados con mejor actividad.66, 67
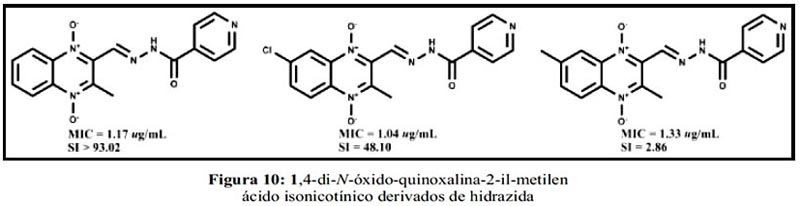
Finalmente, también en el año 2010, Torres et al., con el objetivo de identificar nuevos candidatos a fármacos anti-TB, aplican una nueva estrategia de diseño. Se basa en la hibridación molecular, combinando restos farmacofóricos de diferentes sustancias bioactivas para producir un compuesto híbrido con una afinidad (perfil de selectividad modificado) y eficacia mejorada (reduciendo los efectos adversos). Aplicando esta estrategia, se sintetizan 7 compuestos 1,4-di-N óxido-quinoxalina-2-il-metilen ácido isonicotínico, derivados de hidrazida, que presentan diferentes sustituyentes en posiciones R6/R7 (figura 10). Con estos resultados, se concluye que en estos derivados, los sustituyentes en R6/R7 no parecen ser decisivos para la actividad antimicobacteriana, porque tanto el compuesto sustituido como el no-sustituido, ya sea por un grupo donador o un grupo aceptor de electrones mostraron alta actividad.70
Finalmente, se puede concluir que hasta el 2011, el grupo ha sintetizado una gran cantidad de derivados de quinoxalinas y se continúa con el rediseño de nuevos derivados para la obtención de nuevos candidatos, dirigida a tener actividad anti-TB, considerando modificaciones en las posiciones R2, R3, R6 y R7.
AGRADECIMIENTOS
Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID) de EE.UU. Contrato Nº. HHSN272201100012I.
FIMA(Fundación para la Investigación Médica Aplicada) de la Universidad de Navarra.
Beca Talento Internacional del Gobierno de Navarra. Beca de doctorado con el apoyo de la "Asociación de Amigos" de la Universidad de Navarra.
Dr. Fernando Quevedo y al Dr. José Juárez, por su continuo apoyo y orientación.
REFERENCIAS
1. Martínez González, M.; Seguí Gómez, M.; Carlos Chilleron, S., Compendio de Salud Pública. 2da. Edición ed.; 2011.
2. NIAID National Institute of Allergy and Infectious Diseases. http://www.niaid.nih.gov/topics/tuberculosis/Understanding/WhatIsTB/Pages/TBdefinitions.aspx (2012).
3. WHO Global Tuberculosis Report 2012.; World Health Organization: http://www.who.int/tb/publications/global_report/en/index.html, 2012.
4. Ditiu, L.; Raviglione, M. C. An International Roadmap for Tuberculosis Research: Towards a world free of tuberculosis; World Health Organization Stop TB Partnership: 2011.
5. Espinal, M.; Raviglione, M. The Global Plan to Stop TB 2011–2015; Stop TB Partnership WHO Stop TB Department: http://www.who.int/tb/publications/global_report/en/index.html, 2011.
6. Ditiu, L.; Atun, R. Priorities in Operational Research to improve Tuberculosis Care and Control; WHO Stop TB Partnership The Global Fund To Fight AIDS. Tuberculosis and Malaria 2011.
7. ONU Centro de Noticias de la ONU. http://www.un.org/spanish/News/fullstorynews.asp?newsID=23019 (2012).
8. Heym, B.; Honore, N.; Truffot-Pernot, C.; Banerjee, A.; Schurra, C.; Jacobs, W. R., Jr.; van Embden, J. D.; Grosset, J. H.; Cole, S. T., Implications of multidrug resistance for the future of short-course chemotherapy of tuberculosis: a molecular study. Lancet 1994; 344: 293-8.
9. Telzak, E. E.; Sepkowitz, K.; Alpert, P.; Mannheimer, S.; Medard, F.; el-Sadr, W.; Blum, S.; Gagliardi, A.; Salomon, N.; Turett, G., Multidrug-resistant tuberculosis in patients without HIV infection. The New England journal of medicine 1995; 333: 907-11.
10. Torres, M. J.; Criado, A.; Palomares, J. C.; Aznar, J., Use of real-time PCR and fluorimetry for rapid detection of rifampin and isoniazid resistance-associated mutations in Mycobacterium tuberculosis. Journal of clinical microbiology 2000; 38: 3194-9.
11. Coll, P., [Active drugs against Mycobacterium tuberculosis]. Enfermedades infecciosas y microbiologia clinica 2009; 27: 474-80.
12. CINU Centro de Informacion de las Naciones Unidas. http://www.cinu.mx/noticias/mundial/tuberculosis-oms-respalda-prue/ (2012).
13. Moreno, E. Design, Synthesis and Study of Qunixaline-2-carboxamide 1,4-di-N-oxide derivates against tuberculosis. Universidad de Navarra, Universidad de Navarra, 2011.
14. Wayne, L. G., Dormancy of Mycobacterium tuberculosis and latency of disease. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology 1994; 13: 908-14.
15. Gillespie, S. H., Evolution of drug resistance in Mycobacterium tuberculosis: clinical and molecular perspective. Antimicrobial agents and chemotherapy 2002; 46: 267-74.
16. Domýnguez-Castellano A; Del Arco A; Canueto-Quintero J; Rivero-Roman A; Kindelan R; Dýez-Garcýa, F.Guýa de practica clýnica de la Sociedad Andaluza de Enfermedades Infecciosas(SAEI) sobre el tratamiento de la tuberculosis. Enferm InfeccMicrobiolClin. 2007; 25: 519–34.
17. NIAID National Institute of Allergy and Infectious Diseases http://www.niaid.nih.gov/topics/tuberculosis/Understanding/WhatIsTB/ScientificIllustrations/Pages/extensivelyDrugResistantIllustration.aspx (2012).
18. Alliance, T. Global Alliance for TB Drug Development. http://www.tballiance.org/why/economic-impact.php (2012).
19. Alliance, T. Development Regimens. http://www.tballiance.org/downloads/mediakit/TBA_Pipeline_May_2013.pdf http://www.tballiance.org/pipeline/developing-regimens.php (2013).
20. FDA Food and Drug Administration http://www.accessdata.fda.gov/scripts/cder/drugsatfda/index.cfm?fuseaction=Search.Label_ApprovalHistory#labelinfo (2013),
21. Chrispin Kambili, M. D. Bedaquiline TMC207 - Clinical Development Program An Update. Janssen Pharmaceutical Companies of Johnson& Johnson. http://www.newtbdrugs.org/meetings/annual2012/downloads/presentations/5-Janssen_C-Kambili-WGND2012.pdf (November 2012).
22. Lima, L. M.; Barreiro, E. J., Bioisosterism: a useful strategy for molecular modification and drug design. Current medicinal chemistry 2005; 12: 23-49.
23. Sacchettini, J. C.; Rubin, E. J.; Freundlich, J. S., Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nature reviews. Microbiology 2008; 6: 41-52.
24. Andries, K.; Verhasselt, P.; Guillemont, J.; Gohlmann, H. W.; Neefs, J. M.; Winkler, H.; Van Gestel, J.; Timmerman, P.; Zhu, M.; Lee, E.; Williams, P.; de Chaffoy, D.; Huitric, E.; Hoffner, S.; Cambau, E.; Truffot-Pernot, C.; Lounis, N.; Jarlier, V., A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis. Science 2005; 307: 223-7.
25. OMS Clasificacion Internacional de las Enfermedades. http://www.iqb.es/patologia/toc01.htm
26. Carta, A.; Piras, S.; Loriga, G.; Paglietti, G., Chemistry, biological properties and SAR analysis of quinoxalinones. Mini reviews in medicinal chemistry 2006; 6: 1179-200.
27. Carta, A.; Loriga, M.; Paglietti, G.; Mattana, A.; Fiori, P. L.; Mollicotti, P.; Sechi, L.; Zanetti, S., Synthesis, anti-mycobacterial, anti-trichomonas and anti-candida in vitro activities of 2-substituted-6,7-difluoro-3-methylquinoxaline 1,4-dioxides. European journal of medicinal chemistry 2004; 39: 195-203.
28. Sanna, P.; Carta, A.; Loriga, M.; Zanetti, S.; Sechi, L., Synthesis of 3,6,7-substitutedquinoxalin- 2-ones for evaluation of antimicrobial and anticancer activity. Part 2. Farmaco 1999; 54: 161-8.
29. Vicente, E.; Duchowicz, P. R.; Benitez, D.; Castro, E. A.; Cerecetto, H.; Gonzalez, M.; Monge, A., Anti-T. cruzi activities and QSAR studies of 3-arylquinoxaline-2-carbonitrile di-N-oxides. Bioorganic & medicinal chemistry letters 2010; 20: 4831-5.
30. Urquiola, C.; Vieites, M.; Aguirre, G.; Marin, A.; Solano, B.; Arrambide, G.; Noblia, P.; Lavaggi, M. L.; Torre, M. H.; Gonzalez, M.; Monge, A.; Gambino, D.; Cerecetto, H., Improving anti-trypanosomal activity of 3-aminoquinoxaline-2-carbonitrile N1,N4- dioxide derivatives by complexation with vanadium. Bioorganic & medicinal chemistry 2006; 14: 5503-9.
31. Aguirre, G.; Cerecetto, H.; Di Maio, R.; Gonzalez, M.; Alfaro, M. E.; Jaso, A.; Zarranz, B.; Ortega, M. A.; Aldana, I.; Monge-Vega, A., Quinoxaline N,N'-dioxide derivatives and related compounds as growth inhibitors of Trypanosoma cruzi. Structure-activity relationships. Bioorganic & medicinal chemistry letters 2004; 14: 3835-9.
32. Benitez, D.; Cabrera, M.; Hernandez, P.; Boiani, L.; Lavaggi, M. L.; Di Maio, R.; Yaluff, G.; Serna, E.; Torres, S.; Ferreira, M. E.; Vera de Bilbao, N.; Torres, E.; Perez-Silanes, S.; Solano, B.; Moreno, E.; Aldana, I.; Lopez de Cerain, A.; Cerecetto, H.; Gonzalez, M.; Monge, A., 3-Trifluoromethylquinoxaline N,N'-dioxides as anti-trypanosomatid agents. Identification of optimal anti-T. cruzi agents and mechanism of action studies. Journal of medicinal chemistry 2011; 54: 3624-36.
33. Torres, E.; Moreno-Viguri, E.; Galiano, S.; Devarapally, G.; Crawford, P. W.; Azqueta, A.; Arbillaga, L.; Varela, J.; Birriel, E.; Di Maio, R.; Cerecetto, H.; González, M.; Aldana, I.; Monge, A.; Pérez-Silanes, S., Novel quinoxaline 1,4-di-N-oxide derivatives as new potential antichagasic agents. European journal of medicinal chemistry 2013; 66: 324- 334.
34. Marin, A.; Moreira Lima, L.; Solano, B.; Vicente, E.; Perez Silanes, S.; Maurel, S.; Sauvain, M.; Aldana, I.; Monge, A.; Deharo, E., Antiplasmodial structure-activity relationship of 3-trifluoromethyl-2-arylcarbonylquinoxaline 1,4-di-N-oxide derivatives. Experimental parasitology 2008; 118: 25-31.
35. Vicente, E.; Lima, L. M.; Bongard, E.; Charnaud, S.; Villar, R.; Solano, B.; Burguete, A.; Pérez-Silanes, S.; Aldana, I.; Vivas, L.; Monge, A., Synthesis and structure-activity relationship of 3-phenylquinoxaline 1,4-di-N-oxide derivatives as antimalarial agents. European journal of medicinal chemistry 2008; 43: 1903-10.
36. Zarranz, B.; Jaso, A.; Aldana, I.; Monge, A.; Maurel, S.; Deharo, E.; Jullian, V.; Sauvain, M., Synthesis and antimalarial activity of new 3-arylquinoxaline-2-carbonitrile derivatives. Arzneimittel-Forschung 2005; 55: 754-61.
37. Burguete, A.; Estevez, Y.; Castillo, D.; Gonzalez, G.; Villar, R.; Solano, B.; Vicente, E.; Silanes, S. P.; Aldana, I.; Monge, A.; Sauvain, M.; Deharo, E., Anti-leishmanial and structure-activity relationship of ring substituted 3-phenyl-1-(1,4-di-N-oxide quinoxalin-2-yl)-2-propen-1-one derivatives. Memorias do Instituto Oswaldo Cruz 2008; 103: 778-80.
38. Asghari, S.; Qandalee, M.; Naderi, Z.; Sobhaninia, Z., One-pot synthesis of 4- arylquinolines from aromatic aminoketones and vinylphosphonium salts. Molecular diversity 2010; 14: 569-74.
39. Kleim, J. P.; Winters, M.; Dunkler, A.; Suarez, J. R.; Riess, G.; Winkler, I.; Balzarini, J.; Oette, D.; Merigan, T. C., Antiviral activity of the human immunodeficiency virus type 1- specific nonnucleoside reverse transcriptase inhibitor HBY 097 alone and in combination with zidovudine in a phase II study. HBY 097/2001 Study Group. The Journal of infectious diseases 1999; 179: 709-13.
40. Kleim, J. P.; Rosner, M.; Winkler, I.; Paessens, A.; Kirsch, R.; Hsiou, Y.; Arnold, E.; Riess, G., Selective pressure of a quinoxaline nonnucleoside inhibitor of human immunodeficiency virus type 1 (HIV-1) reverse transcriptase (RT) on HIV-1 replication results in the emergence of nucleoside RT-inhibitor-specific (RT Leu-74-->Val or Ile and Val-75-->Leu or Ile) HIV-1 mutants. Proceedings of the National Academy of Sciences of the United States of America 1996; 93: 34-8.
41. Kleim, J. P.; Bender, R.; Billhardt, U. M.; Meichsner, C.; Riess, G.; Rosner, M.; Winkler, I.; Paessens, A., Activity of a novel quinoxaline derivative against human immunodeficiency virus type 1 reverse transcriptase and viral replication. Antimicrobial agents and chemotherapy 1993; 37: 1659-64.
42. Junnotula, V.; Rajapakse, A.; Arbillaga, L.; de Cerain, A. L.; Solano, B.; Villar, R.; Monge, A.; Gates, K. S., DNA strand cleaving properties and hypoxia-selective cytotoxicity of 7-chloro-2-thienylcarbonyl-3-trifluoromethylquinoxaline 1,4-dioxide. 2010/04/08 ed.; 2010; 18: 3125-32.
43. Solano, B.; Junnotula, V.; Marin, A.; Villar, R.; Burguete, A.; Vicente, E.; Pérez-Silanes, S.; Aldana, I.; Monge, A.; Dutta, S.; Sarkar, U.; Gates, K. S., Synthesis and biological evaluation of new 2-arylcarbonyl-3-trifluoromethylquinoxaline 1,4-di-N-oxide derivatives and their reduced analogues. Journal of medicinal chemistry 2007; 50: 5485- 92.
44. Zarranz, B.; Jaso, A.; Aldana, I.; Monge, A., Synthesis and anticancer activity evaluation of new 2-alkylcarbonyl and 2-benzoyl-3-trifluoromethyl-quinoxaline 1,4-di-N-oxide derivatives. Bioorganic & medicinal chemistry 2004; 12: 3711-21.
45. Alleca, S.; Corona, P.; Loriga, M.; Paglietti, G.; Loddo, R.; Mascia, V.; Busonera, B.; La Colla, P., Quinoxaline chemistry. Part 16. 4-substituted anilino and 4-substituted phenoxymethyl pyrrolo[1,2-a]quinoxalines and N-[4-(pyrrolo[1,2-a]quinoxalin-4- yl)amino and hydroxymethyl]benzoyl glutamates. Synthesis and evaluation of in vitro biological activity. Farmaco 2003; 58: 639-50.
46. Gomtsyan, A.; Bayburt, E. K.; Schmidt, R. G.; Zheng, G. Z.; Perner, R. J.; Didomenico, S.; Koenig, J. R.; Turner, S.; Jinkerson, T.; Drizin, I.; Hannick, S. M.; Macri, B. S.; McDonald, H. A.; Honore, P.; Wismer, C. T.; Marsh, K. C.; Wetter, J.; Stewart, K. D.; Oie, T.; Jarvis, M. F.; Surowy, C. S.; Faltynek, C. R.; Lee, C. H., Novel transient receptor potential vanilloid 1 receptor antagonists for the treatment of pain: structure-activity relationships for ureas with quinoline, isoquinoline, quinazoline, phthalazine, quinoxaline, and cinnoline moieties. Journal of medicinal chemistry 2005; 48: 744-52.
47. Ismail, M. M.; Ammar, Y. A.; Ibrahim, M. K.; El-Zahaby, H. S.; Mahmoud, S. S., Synthesis and pharmacological evaluation of novel quinoxalines as potential nonulcerogenic anti-inflammatory and analgesic agents. Arzneimittel-Forschung 2005; 55: 738-43.
48. Burguete, A.; Pontiki, E.; Hadjipavlou-Litina, D.; Ancizu, S.; Villar, R.; Solano, B.; Moreno, E.; Torres, E.; Perez, S.; Aldana, I.; Monge, A., Synthesis and biological evaluation of new quinoxaline derivatives as antioxidant and anti-inflammatory agents. Chemical biology & drug design 2011; 77: 255-67.
49. Burguete, A.; Pontiki, E.; Hadjipavlou-Litina, D.; Villar, R.; Vicente, E.; Solano, B.; Ancizu, S.; Perez-Silanes, S.; Aldana, I.; Monge, A., Synthesis and antiinflammatory/ antioxidant activities of some new ring substituted 3-phenyl-1-(1,4-di-Noxide quinoxalin-2-yl)-2-propen-1-one derivatives and of their 4,5-dihydro-(1H)- pyrazole analogues. Bioorganic & medicinal chemistry letters 2007; 17: 6439-43.
50. Foks, H.; Wisterowicz, K.; Nasal, A.; Damasiewicz, B.; Radwanska, A., Studies on quinoxaline derivatives. Synthesis of quinoxalylamino-1,3-diazacycloalkanes with potential hypotensive activity. Acta poloniae pharmaceutica 1999; 56: 201-6.
51. Nunez, J. L.; Bambrick, L. L.; Krueger, B. K.; McCarthy, M. M., Prolongation and enhancement of gamma-aminobutyric acid receptor mediated excitation by chronic treatment with estradiol in developing rat hippocampal neurons. The European journal of neuroscience 2005; 21: 3251-61.
52. Ries, U. J.; Priepke, H. W.; Hauel, N. H.; Handschuh, S.; Mihm, G.; Stassen, J. M.; Wienen, W.; Nar, H., Heterocyclic thrombin inhibitors. Part 2: quinoxalinone derivatives as novel, potent antithrombotic agents. Bioorganic & medicinal chemistry letters 2003; 13: 2297-302.
53. Ries, U. J.; Priepke, H. W.; Hauel, N. H.; Haaksma, E. E.; Stassen, J. M.; Wienen, W.; Nar, H., Heterocyclic thrombin inhibitors. Part 1: design and synthesis of amidino-phenoxy quinoline derivatives. Bioorganic & medicinal chemistry letters 2003; 13: 2291-5.
54. Ortega, M. A.; Sainz, Y.; Montoya, M. E.; Jaso, A.; Zarranz, B.; Aldana, I.; Monge, A., Anti-Mycobacterium tuberculosis agents derived from quinoxaline-2-carbonitrile and quinoxaline-2-carbonitrile 1,4-di-N-oxide. Arzneimittel-Forschung 2002; 52: 113-9.
55. Sainz, Y.; Montoya, M. E.; Martinez-Crespo, F. J.; Ortega, M. A.; Lopez de Cerain, A.; Monge, A., New quinoxaline 1,4-di-N-oxides for treatment of tuberculosis. Arzneimittel- Forschung 1999; 49: 55-9.
56. Ortega, M. A.; Montoya, M. E.; Jaso, A.; Zarranz, B.; Tirapu, I.; Aldana, I.; Monge, A., Antimycobacterial activity of new quinoxaline-2-carbonitrile and quinoxaline-2- carbonitrile 1,4-di-N-oxide derivatives. Die Pharmazie 2001; 56: 205-7.
57. Carta, A.; Corona, P.; Loriga, M., Quinoxaline 1,4-dioxide: a versatile scaffold endowed with manifold activities. Current medicinal chemistry 2005; 12: 2259-72.
58. Boiani, M.; Cerecetto, H.; González, M.; Risso, M.; Olea-Azar, C.; Piro, O. E.; Castellano, E. E.; Lopez de Cerain, A.; Ezpeleta, O.; Monge-Vega, A., 1,2,5-Oxadiazole N-oxide derivatives as potential anti-cancer agents: synthesis and biological evaluation. Part IV. European journal of medicinal chemistry 2001; 36: 771-82.
59. Zarranz, B.; Jaso, A.; Aldana, I.; Monge, A., Synthesis and antimycobacterial activity of new quinoxaline-2-carboxamide 1,4-di-N-oxide derivatives. Bioorganic & medicinal chemistry 2003; 11: 2149-56.
60. Jaso, A.; Zarranz, B.; Aldana, I.; Monge, A., Synthesis of new 2-acetyl and 2-benzoyl quinoxaline 1,4-di-N-oxide derivatives as anti-Mycobacterium tuberculosis agents. European journal of medicinal chemistry 2003; 38: 791-800.
61. Jaso, A.; Zarranz, B.; Aldana, I.; Monge, A., Synthesis of new quinoxaline-2-carboxylate 1,4-dioxide derivatives as anti-Mycobacterium tuberculosis agents. Journal of medicinal chemistry 2005; 48: 2019-25.
62. Vicente, E.; Villar, .R.; Burguete, A.; Solano, B.; Perez-Silanes, S.; Aldana, I.; Maddry, J. A.; Lenaerts, A. J.; Franzblau, S. G.; Cho, S. H.; Monge, A.; Goldman, R. C., Efficacy of quinoxaline-2-carboxylate 1,4-di-N-oxide derivatives in experimental tuberculosis. Antimicrobial agents and chemotherapy 2008; 52: 3321-6.
63. Villar, R.; Vicente, E.; Solano, B.; Perez-Silanes, S.; Aldana, I.; Maddry, J. A.; Lenaerts, A. J.; Franzblau, S. G.; Cho, S. H.; Monge, A.; Goldman, R. C., In vitro and in vivo antimycobacterial activities of ketone and amide derivatives of quinoxaline 1,4-di-Noxide. The Journal of antimicrobial chemotherapy 2008; 62: 547-54.
64. Tarallo, M. B.; Urquiola, C.; Monge, A.; Pavan, F. R.; Leite, C. Q.; Torre, M. H.; Gambino, D., Novel iron complexes with quinoxaline N(1),N(4)-dioxide derivatives: synthesis, characterization and antimycobacterial activity. In Metal Ions in Biology and Medicine, Vol 10, Collery, P.; Maymard, I.; Theophanides, T.; Khassanova, L.; Collery, T., Eds. 2008; 10: 867-872.
65. Tarallo, M. B.; Urquiola, C.; Monge, A.; Costa, B. P.; Ribeiro, R. R.; Costa-Filho, A. J.; Mercader, R. C.; Pavan, F. R.; Leite, C. Q.; Torre, M. H.; Gambino, D., Design of novel iron compounds as potential therapeutic agents against tuberculosis. Journal of inorganic biochemistry 2010; 104: 1164-70.
66. Moreno, E.; Ancizu, S.; Perez-Silanes, S.; Torres, E.; Aldana, I.; Monge, A., Synthesis and antimycobacterial activity of new quinoxaline-2-carboxamide 1,4-di-N-oxide derivatives. European journal of medicinal chemistry 2010; 45: 4418-26.
67. Ancizu, S.; Moreno, E.; Solano, B.; Villar, R.; Burguete, A.; Torres, E.; Perez-Silanes, S.; Aldana, I.; Monge, A., New 3-methylquinoxaline-2-carboxamide 1,4-di-N-oxide derivatives as anti-Mycobacterium tuberculosis agents. Bioorganic & medicinal chemistry 2010; 18: 2713-9.
68. Vicente, E.; Perez-Silanes, S.; Lima, L. M.; Ancizu, S.; Burguete, A.; Solano, B.; Villar, R.; Aldana, I.; Monge, A., Selective activity against Mycobacteriumtuberculosis of new quinoxaline 1,4-di-N-oxides. Bioorganic & medicinal chemistry 2009; 17: 385-9.
69. Moreno, E.; Pérez-Silanes, S.; Gouravaram, S.; Macharam, A.; Ancizu, S.; Torres, E.; Aldana, I.; Monge, A.; Crawford, P. W., 1,4-Di-N-oxide quinoxaline-2-carboxamide: Cyclic voltammetry and relationship between electrochemical behavior, structure and anti-tuberculosis activity. Electrochimica Acta 2011; 56: 3270-3275.
70. Torres, E.; Moreno, E.; Ancizu, S.; Barea, C.; Galiano, S.; Aldana, I.; Monge, A.; Perez- Silanes, S., New 1,4-di-N-oxide-quinoxaline-2-ylmethylene isonicotinic acid hydrazide derivatives as anti-Mycobacterium tuberculosis agents. Bioorganic & medicinal chemistry letters 2011; 21: 3699-703.
71. Vicente, E.; Villar, R.; Perez-Silanes, S.; Aldana, I.; Goldman, R. C.; Mong, A., Quinoxaline 1,4-di-N-oxide and the potential for treating tuberculosis. Infectious disorders drug targets 2011; 11: 196-204.
Recibido el 15-07-2013
Aprobado el 19-07-2013













