Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.4 Lima oct./dic. 2013
TRABAJOS ORIGINALES
Estudio de la biosorcion de cromo (VI) con quitosano cuaternario reticulado para su aplicación en biorremediación de aguas contaminadas
Study of the biosorption of chromium (VI) on crosslinked-quaternary chitosan for their application on the bioremediation of waster waters
Carlos Díaz, Christian Jacinto1, Rosa Medina2, Abel Navarro3, N. Cuizano4 y Bertha Llanos4*
1 Facultad de Ciencias, Universidad Nacional de Ingeniería Lima, Perú.
2 Escuela de Ingeniería Geológica FIGMMG Universidad Nacional Mayor de San Marcos.
3 Graduate School of Arts and Science, Department of Chemistry / New York University, NY,USA.
4 Departamento de Ciencias Exactas, Facultad de Ciencias, Universidad Peruana Cayetano Heredia.
* bertha.llanos@upch.pe. Av. Honorio Delgado 430 – Urb. Ingeniería SMP Lima 31 - Perú 305
RESUMEN
Se investigó el uso de quitosano cuaternario entrecruzado, QC2, en la remoción de ion cromo (VI) a partir de soluciones acuosas a temperatura ambiente, mediante experimentos de adsorción discontinuos.
Los parámetros que se ha evaluado en la capacidad de adsorción del ion mencionado, el adsorbente, fueron efecto de: pH, masa de adsorbente, concentración del ion, cinética de adsorción y fuerza iónica, apoyados por los análisis FTIR, SEM, TGA. Los resultados se han analizado usando los modelos matemáticos de Langmuir y Freundlich; los resultados muestran que la adsorción se da mediante un mecanismo mixto. Los parámetros calculados demuestran una alta afinidad adsorbente/adsorbato para QC2 con una máxima capacidad de adsorción de 208,3 mg g-1, elucidando el potencial uso de este adsorbente para la remoción de ion cromo (VI) en soluciones acuosas, mediante una cinética de seudo segundo orden con una constante de velocidad de 0,289 g mg-1 min-1. La desorción es eficiente en una mezcla NaCl / NaOH (1,0 M) con 99,78 % de remoción a pH 4,5. Altas concentraciones de fuerza iónica afectan la capacidad de adsorción de cromo (VI).
Palabras clave: Quitosano cuaternario, quitosano cuaternario entrecruzado, cromo (VI), isotermas de adsorción, biosorción.
ABSTRACT
In this work, the stoichiometric amounts of the amino-quaternaries and cross-linker were studied to produce the most stable cross-linked quaternary Chitosan (QC2). Preliminary assays were carried out to test the improvement in their mechanical and chemical properties (extreme conditions, surface area and thermogravimetry). Then, the adsorption of chromium (VI) on the QC2 was studied at changing experimental conditions like: pH, adsorbent dose, initial chromium concentration and ionic strength. Moreover, the kinetics of the process was also evaluated as well as the optimization, the desorption of chromium (VI) from the adsorbent for metal recovery and adsorbent recycling. Finally, was characterized by using instrumental techniques such as FTIR, SEM. These tools allowed us to investigate the adsorption mechanism. The calculated parameters indicate a high adsorbent/adsorbato affinity for QC2 with a maximum adsorption capacity of 208 mg g-1 for Cr (VI), elucidating its potential use for the removal of chromium from aqueous solutions. Also showed a pseudosecond order adsorption kinetics with a velocity constant of 0.289 g.mg-1.min-1. Desorption of chromium was efficiently accomplish with a mixture of 1M of NaCl and NaOH, reaching a recovery up to 99.78% of the initial metal concentration at pH 4.5. Finally, high ionic strength shows an effect on the adsorption of chromium (VI) onto the studied adsorbents.
Key words: Chitosan quaternary, quaternary crosslinked chitosan, chromium VI, adsorption isotherms, biosorption.
INTRODUCCIÓN
Los metales pesados y preciosos están involucrados directa o indirectamente en gran parte de las actividades humanas, especialmente en los sectores industriales, agrícolas, minero y urbano. Actualmente dichas actividades se están acrecentando aceleradamente, aumentando al mismo tiempo sus residuos líquidos y sólidos, multiplicando la concentración de iones metálicos en los sistemas bióticos terrestres, acuáticos y aéreos. Esto es uno de los principales problemas ambientales a nivel nacional y mundial, debido a que su acumulación y biomagnificación, a través del tiempo, afecta toda la cadena trófica en un ecosistema (superando ampliamente las concentraciones permitidas (Cd+2: 0,001 mg/L y Cr+6: 0,05)1. En el hombre, los metales pesados promueven la aparición de cáncer y otras enfermedades degenerativas e inducen mutaciones genéticas, afectando así su descendencia2.
El cromo está presente en los ambientes acuáticos como Cr (III) y Cr (VI). Si bien el Cr (III) es esencial para el metabolismo humano a bajas concentraciones, el Cr (VI) es tóxico y letal3. El cromo no puede degradarse, sólo transformarse y/o retirarse del medio. Por esto, las metodologías actuales de remediación de este ion metálico requieren de altos costos y un gran avance tecnológico1,2. Actualmente, los procesos biotecnológicos han llamado la atención de la comunidad científica por la variedad de métodos destoxificantes empleados para la descontaminación del ambiente4. Estos procesos se han separado en dos grandes rubros dentro del mismo objetivo: bioacumulación y biosorción4,5,6. La biosorción ya ha abordado el problema de la eliminación de cromo de fuentes acuíferas, usando una variedad de biomasas, como: algas, levadura, hongos, bacterias, quitosano, etc.7,8-13, lamentablemente los resultados obtenidos no han sido tan exitosos como los hallados con plomo, cadmio y otros metales pesados que existen en forma catiónica en solución acuosa 4,14-16. Oro y cromo son dos de los pocos metales que existen en forma aniónica en solución acuosa formando iones complejos, y dado que la mayoría de biosorbentes presentan bases de Lewis como centros activos, la adsorción de aniones es reducida; por ese motivo en la presente investigación se usó el quitosano cuaternario (QC) como una mejor alternativa; el QC ha sido exitosamente usado como adsorbente para humedad, compuestos orgánicos e inorgánicos7,17,18. Los resultados demuestran que el intercambio iónico es importante en el mecanismo de adsorción.
Acerca del adsorbente
La quitina (figura 1), es el segundo polisacárido en abundancia. El nombre sistemático de la quitina es β-(1-4)-2-acetamido-2-desoxi-D-glucosa. Es completamente insoluble en agua o en medio ácido.
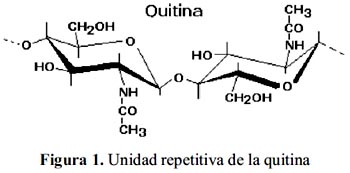
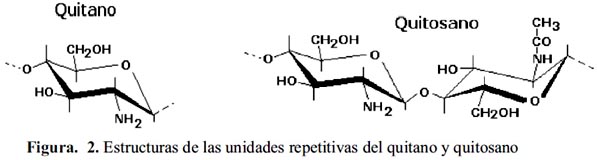
La total desacetilación de la quitina produce un material soluble en medio ácido conocido como quitano; sin embargo, cuando la desacetilación es incompleta se crea una mezcla de cadenas que tienen distintas proporciones de unidades β-(1-4)-2-acetamido-2-desoxi-Dglucosa y β-(1-4)-2amino-2-desoxi-D-glucosa, cuya relación depende de las condiciones de reacción y genera materiales de distintas propiedades denominados quitosanos (figura 2). La presencia de grupos aminos en la cadena polimérica ha hecho del quitosano un material versátil (se puede realizar una amplia variedad de modificaciones, tales como la obtención de películas entrecruzadas19) (figura 3). Existen varios agentes entrecruzantes), pero quizá la reacción de entrecruzamiento más utilizada es la reacción con dialdehídos para formar uniones químicas tipo bases de Schiff 19-21.
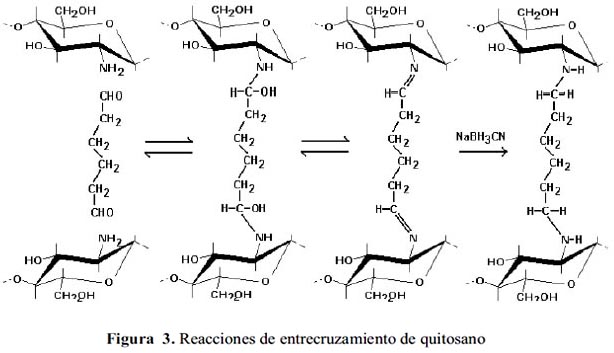
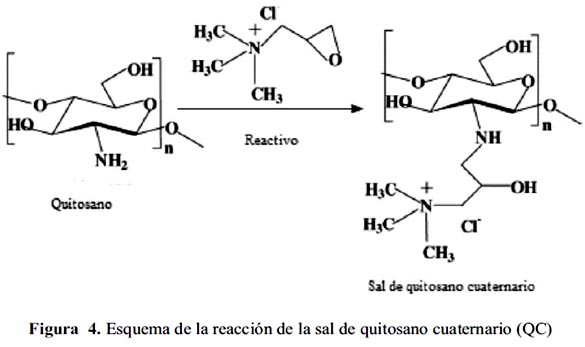
Una alternativa para mejorar la porosidad es la formación de perlas de gel mediante disolución de quitosano en una solución de ácido acético, seguido por precipitación en una solución diluida de hidróxido de sodio21. Rosa et al.17 han reportado la eficacia de quitosano cuaternario en la adsorción de colorantes aniónicos (figura 4).
Acerca del proceso de adsorción
La adsorción es un fenómeno espontáneo debido a la existencia de fuerzas no compensadas en la superficie de división de fases. En el caso de adsorbatos, como los aniones AuCl4-y CrO4-2, respectivamente, la adsorción es un fenómeno más complejo que la adsorción molecular, por cuanto los iones en una solución se encuentran rodeados de una capa de solvente y de una atmósfera iónica. Existen reglas para la adsorción de iones22.
El uso de isotermas de adsorción es ampliamente difundido así como la determinación del parámetro "q" (mg de adsorbato / gramo de adsorbente), que mide la capacidad de adsorción del adsorbato en el adsorbente y que definen los parámetros del proceso. Las isotermas más usadas son: Isoterma de Langmuir1,23, Isoterma de Freundlich1,22. El mecanismo de adsorción se describe como una serie de etapas consecutivas para el transporte del adsorbato desde la solución hasta su posición final en el sitio activo24. En biosorción, los modelos cinéticos matemáticos más utilizados son: pseudo-primer orden o ecuación de Lagergren25, pseudo-segundo orden de Ho y McKay26 y de difusión intraparticular.
PARTE EXPERIMENTAL
Materiales y métodos
Reactivos
Los reactivos usados en la investigación son los siguientes: quitosano (Spectrum Chemical) con grado de desacetilación (75–92%), cloruro de glicidiltrimetil amonio (Fluka analytical) 90 %, acetona (MercK) para análisis, ácido acético glacial (Merck) 100 %, etanol (Merck) para análisis, glutaraldehído (Merck), hidróxido de sodio (Merck), nitrato de plata (Merck) para análisis, dicromato de potasio grado reactivo (Merck), solución patrón para cuantificar cromo (Merck), ácido clorhídrico concentrado, ácido nítrico concentrado y azul de metileno (Merck).
Preparación de los adsorbentes
Con quitosano (Spectrum Chemical) se preparó quitosano cuaternario (QC1) y luego quitosano cuaternario entrecruzado (QC2). Para preparar QC1, se pesó una cantidad de quitosano, se dispersó en un volumen de agua y luego se agregó un volumen de cloruro de glicidiltrimetilamonio (Fluka) y se dejó en agitación por 24 horas a 50 ºC. El producto de la reacción se colocó sobre un determinado volumen de acetona grado analítico (Merck) hasta precipitación completa después se filtró, lavó con acetona y se dejó secar a 60 ºC en una estufa (Memmert). Luego se procedió a reducir el tamaño de las partículas mediante un molino (analitical mill Cole Parmer) y separar las partículas por tamaño mediante tamices de la serie Tyler. Para preparar QC2, se pesó 10 g de QC1 se suspendió en 200 mL de etanol y luego se añadió 10 mL(25 % w/V) de glutaraldehído; el sistema se agitó durante 24 horas a temperatura ambiente, se filtró y secó a 50 ºC. Finalmente se molió y se separó las partículas por tamaños.
Preparación de las soluciones:
Las soluciones acuosas de cromo se prepararon a partir de dicromato de sodio (Merck 99%). Se preparó soluciones stock de 1000 mg L-1 con agua desionizada y a partir de ellas las soluciones diluidas necesarias de diferentes concentraciones.
Análisis de las soluciones de cromo (VI)
La cuantificación de cromo (VI) en todas las soluciones acuosas antes y después de ser adsorbidas, se realizó mediante espectrofotometría de adsorción atómica (Perkin Elmer AAnalyst 100).
Caracterización de los adsorbentes
Los espectros de infrarrojo fueron obtenidos por espectroscopía infrarrojo con transformada de Fourier, usando el espectrofotómetro Nicolet 510 PFT-IR. Los análisis termogravimétricos (TGA) se realizaron usando un Shimadzu model 50; el método consiste en registrar la pérdida de peso de la muestra durante el incremento de la temperatura; se escaneó a una velocidad de calentamiento de 10 ºC/min bajo flujo de nitrógeno desde temperatura ambiente hasta 700 ºC.
Experimentos de adsorción y desorción
Efecto del pH
En varios matraces de Erlenmeyer se pesó una masa constante de adsorbente; se añadió 50 mL de solución de cromo VI de una determinada concentración previamente ajustados a distintos valores de pH con soluciones diluidas de ácido clorhídrico e hidróxido de sodio; el tiempo de contacto fue de 18 horas mediante una agitación constante de 200 rpm a temperatura ambiente, mediante un agitador orbital INNOVA, modelo 2100. Luego mediante filtración se separó el adsorbente de la solución, al filtrado se le analizó la concentración ion cromo (VI).
Parámetros de equilibrio termodinámico
Se pesó varias masas de adsorbente y a cada uno ellos se le adicionó 50 mL de la solución de cromo (VI) de una determinada concentración, como 10 mg L-1, ajustada al pH óptimo, luego se dejó en contacto mediante agitación a las mismas condiciones que se realizó en efecto de pH.
Para obtener las isotermas de adsorción se usó 50 mLde soluciones de cromo (VI) de distintas concentraciones y una masa constante de adsorbente, luego se dejó mediante agitación a las mismas condiciones que los procedimientos anteriores. Se repitió el procedimiento para diferentes masas de adsorbente.
Cinética de adsorción
Para determinar la velocidad de adsorción se procedió de la manera siguiente: se pesó una cantidad de adsorbente; previamente en un recipiente se colocó suficiente cantidad de solución de cromo (VI), ajustada al pH óptimo y se dejó en agitación constante evitando la turbulencia; luego sobre él se agregó rápidamente adsorbente e inmediatamente se accionó el cronómetro para medir el tiempo por 24 horas. Cada cierto tiempo se retiró pequeñas cantidades de la mezcla; se filtró y analizó el contenido de cromo (VI).
Fuerza iónica
Se hizo corridas de adsorción semejantes a las realizadas para determinar las isotermas en cada ensayo se utilizó como solvente soluciones de nitrato de sodio de diferentes concentraciones.
Desorción
Para el estudio de la desorción se preparó suficiente cantidad de solución acuosa (mezcla de NaCl e NaOH) de diferentes concentraciones. Una determinada cantidad de adsorbente fue sometido al proceso de adsorción con solución de cromo (VI); terminado el mismo, se filtró y a los sólidos se les adicionó 100 mL de la mezcla NaCl /NaOH de una concentración específica; este sistema se mantuvo en contacto mediante agitación durante 12 horas, después se filtró y se analizó la concentración de cromo (VI) en la solución filtrada. Se repitió el mismo procedimiento para las otras concentraciones de mezcla (NaCl / NaOH).
RESULTADOS Y DISCUSIÓN
Caracterización de los adsorbentes
La cantidad de grupos aminos cuaternarios introducidos, es el grado de cuaternización del quitosano y se determinó mediante titulaciones conductimétricas. En la figura 5, se muestra una gráfica de titulación conductimétrica; se cuantifica la cantidad de iones cloruro usando una solución estándar de nitrato de plata (AgNO3) y el punto de equivalencia es justo el cruce de las dos líneas de disminución e incremento de la conductividad.
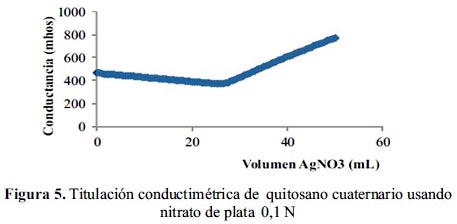
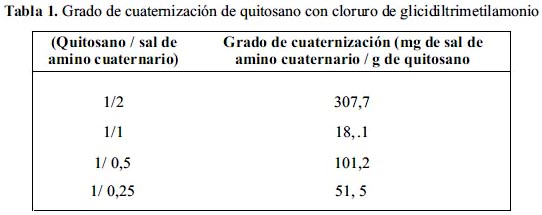
En la tabla 1, se tiene los resultados del grado de cuaternización del quitosano de acuerdo a la relación de quitosano y amino cuaternario; a mayor grado de cuaternización las propiedades mecánicas son afectadas, haciendo que sean muy frágiles y se rompen con facilidad, según pruebas cualitativas de fracturas mecánicas por simple agitación, por lo que se decidió disminuir los niveles de cuaternización.
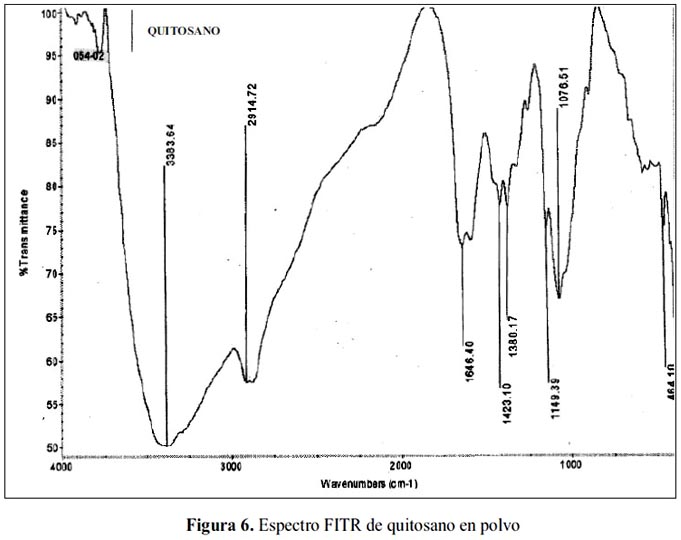
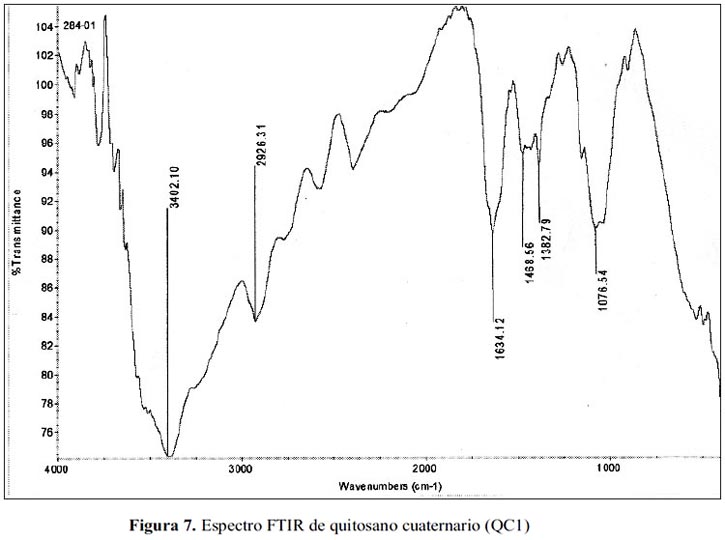
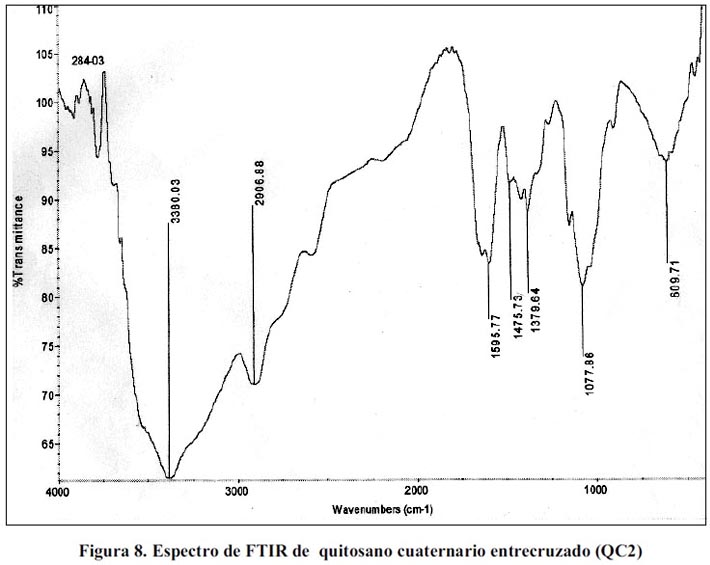
En las figuras 6, 7 y 8 se tienen los espectros FTIR de quitosano (Q), QC1 y QC2 respectivamente; los espectros muestran las bandas características del quitosano, pero en los espectros de los quitosanos cuaternizados, alrededor de 1480 cm-1, aparece una señal que corresponde a los metilos del nitrógeno de la amina cuaternaria, misma banda obtenida por Spinell7 y para el QC2, se obtuvo un espectro similar al del QC1 con la única diferencia que tiene una banda adicional alrededor de 600 cm-1, que generalmente esta señal corresponde a la huella digital del compuesto.
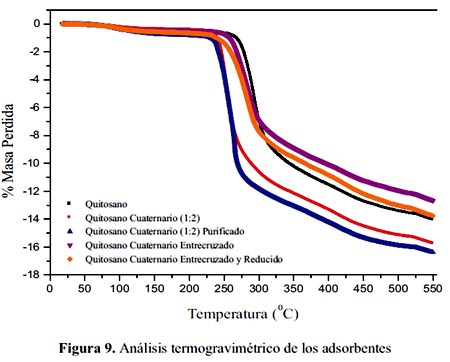
En las curvas del análisis termogravimétrico (TGA) (figura 9) se aprecia que todos los adsorbentes se degradan con la temperatura en dos etapas, hay una pérdida de peso muy pequeña alrededor de 100 ºC pero la mayor pérdida de peso ocurre a 250 ºC para C1; en cambio, para QC2 esto ocurre a más de 300 C y tiene una buena estabilidad al igual que el quitosano.
Los resultados de la tabla 2, indican que el QC2 tiene mayor superficie específica que QC1, alrededor del 50 % más; el mismo que se determinó por el método del azul de metileno.

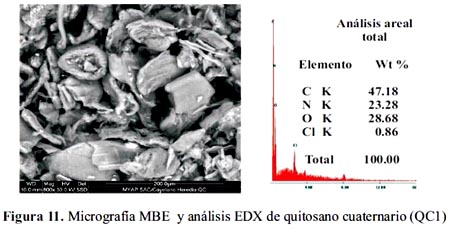
En las figuras 10, 11, se tienen las microscopias (SEM) y el análisis EDX de los adsorbentes; en ellos se ve el contenido de nitrógeno, confirmando estos resultados, con los anteriores, que el quitosano ha sido modificado, para obtener los quitosanos cuaternarios QC1 y QC2.

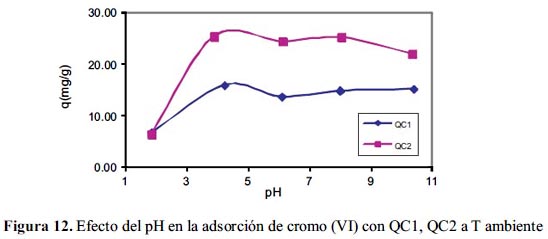
En la figura 12, se observa que la mayor capacidad de adsorción del ion cromo VI con QC1 y QC2, está entre pH 4 y 5, por lo que se consideró como el óptimo a 4,5; a pH mayor que 6 disminuye la adsorción, haciéndose asintótica para QC1; a pH bajos la capacidad de adsorción es muy baja con ambos adsorbentes. También se observa que QC2, tiene mayor capacidad de adsorción en todos los pH medidos; excepto a pH 2.
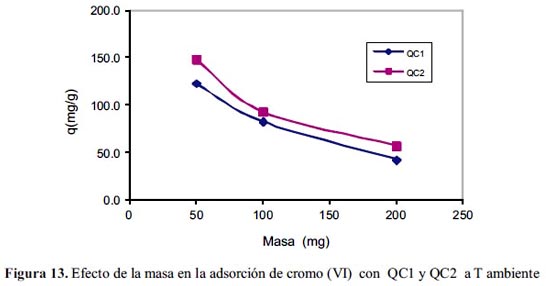
En la figura 13, se observa el efecto de la masa de adsorbente QC1 y QC2 en la capacidad de adsorción; los resultados muestran que la mejor capacidad de adsorción para ambos adsorbentes es con menor cantidad de adsorbente y esto es precisamente lo que se esperaba, que se use la mínima cantidad de adsorbente y que tenga una alta capacidad de adsorción.
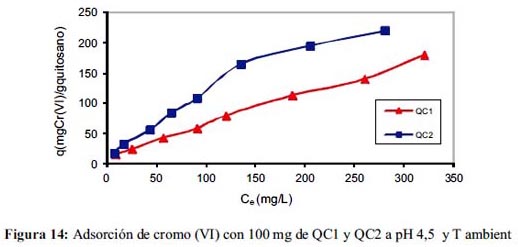
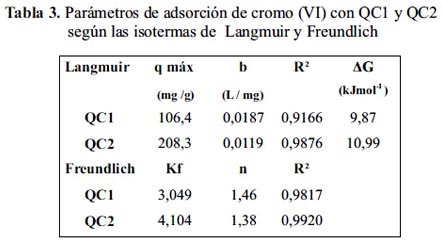
En la figura 14 se aprecia la tendencia de la adsorción de ambos adsorbentes sin alcanzar un máximo en las concentraciones de equilibrio, por lo que los modelos matemáticos de Lagmuir y Freundlich para QC2 adsorbentes tienen un alto coeficiente de linealidad tal como se observa en la tabla 3, la máxima capacidad de adsorción según el modelo de Langmuir tiene QC2 con 208,3 mg g-1 y según el modelo de Freundlich también tiene la constante Kf más alta; si se compara estos resultados con lo reportado por Spinelli 7 quien trabajó con quitosano cuaternario (qmáx = 68,3 mg g-1) a pH 4,5, el adsorbente propuesto QC2 es mejor. Estos resultados inducen a elucidar que los centros activos del adsorbente son equivalentes, restringiéndose la adsorción en monocapa y no existen interacciones laterales entre las moléculas del adsorbato y que la superficie es energéticamente heterogénea, conformada por grupos de sitios de adsorción de energías características. Estos resultados coinciden con los obtenidos a distintos pH (figura 12), que siempre el q de QC2 fue mayor.
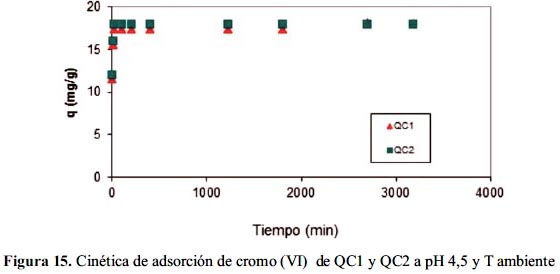
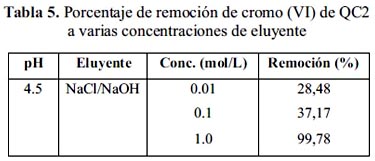
En la figura 15 se presenta la cinética de adsorción de cromo (VI) con QC1 y QC2, con ambos adsorbentes se alcanza muy rápido el equilibrio de adsorción con un tiempo menor a 4 horas. El modelo matemático al que se ajustan con un alto coeficiente de correlación tal como se observa en la tabla 4 es de un seudo-segundo orden pero con constantes de velocidad bajos.
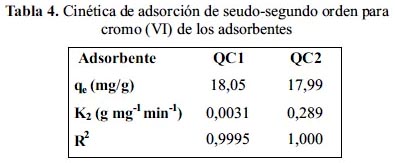
En la figura 16 se tienen los análisis por EDX y las micrografías obtenidas por microscopias de barrido electrónico en ella se aprecia que efectivamente el adsorbente ha adsorbido el cromo (VI). La micrografía de QC2 con cromo (VI) presentó diferentes formas: aglutinadas, laminar, en capas superpuestas, como hojuelas tipo "corn flakes", de tamaños más o menos homogéneos y desagregados. Se observa la fibra del quitosano original antes de ser modificada y las superficies de los agregados: lisos, rugosos, fracturados, de bordes subredondeados y tipo "riple mark" (marcas que dejan las ondas del mar en la arena).
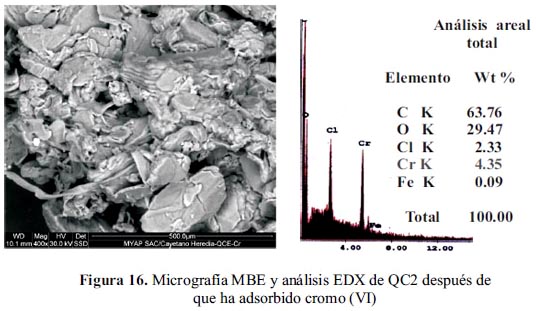
En la figura 17, se muestra el efecto de la fuerza iónica en la adsorción de ion cromo (VI); a medida que aumenta la concentración de nitrato de sodio hasta un máximo de 0,1 mol L-1 la capacidad de adsorción se incrementa. De estos resultados se deduce que puede producirse una interacción por la presencia de iones nitrato con el adsorbente del tipo electrostática y que compiten con el cromo (VI).
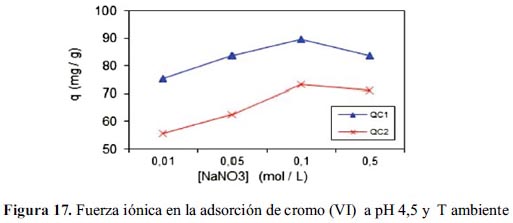
En la tabla 5, se muestran los resultados obtenidos del proceso de remoción de cromo (VI) realizado a temperatura ambiente y pH 4,5 para el mejor adsorbente, QC2, la remoción es muy efectiva si la concentración del eluyente (mezcla de NaCl / NaOH) es 1,0 M.
CONCLUSIONES
El adsorbente seleccionado, modificado, quitosano cuaternario entrecruzado (QC2), tiene la capacidad de adsorber cromo (VI), con una alta eficiencia.
El adsorbente QC2 es mejor porque tiene una buena capacidad de adsorción y se ajusta a los modelos de Langmuir y Freundlich, y tiene una capacidad máxima de adsorción de 208,3 mg g-1.
La cantidad de adsorbente influye en la capacidad de adsorción; los resultados demuestran que con menor cantidad de adsorbente la adsorción es más eficiente.
El pH de la solución muestra un fuerte efecto en la capacidad de adsorción, siendo el óptimo de 4,5. Altas concentraciones en la fuerza iónica afectan la capacidad de adsorción de cromo (VI).
AGRADECIMIENTOS
Los autores quieren agradecer al Consejo Nacional de Ciencia y Tecnología e Innovación Tecnología (CONCYTEC) del Perú – Concurso Nacional de Subvenciones para Proyectos de Investigación PROCYT 2008 por el apoyo económico para culminar la investigación. A la Sección Química Dpto. de Ciencias Exactas Facultad de Ciencias y Humanidades "Alberto Cazorla Talleri" Universidad Peruana Cayetano Heredia. A la Facultad de Ciencias de la Universidad Nacional de Ingeniería.
REFERENCIAS
1. Mejía G. Revista CES Medicina Veterinaria y Zootecnia 2006; 1: 77-99. [ Links ]
2. Cañizares-Villanueva R. Rev. Latinoamer. Microbiol. 2000; 42: 131-143. [ Links ]
3. Barán E. Química Bioinorgánica. España: Ed. McGraw-Hill; 1995. [ Links ]
4. Ramos K, Navarro A, Chang L, Maldonado H. Rev. Soc. Quím. Perú 2004; 70: 136-146. [ Links ]
5. Flores J, Ly M, Maldonado H. Rev. Latinoamer. Quím. 2003; 31: 100-110. [ Links ]
6. Navarro A, Ramos K, Campos K, Llanos B, Maldonado H. Rev. Quím PUCP 2005; XIX: 53-59. [ Links ]
7. Spinelli V, Laranjeira M, Fávere V. React. Funct. Polym. 2004; 61: 347-352. [ Links ]
8. Park D, Yun Y, Park J. Chemosphere 2005; 60: 1356-1364. [ Links ]
9. Chen G, Zeng G, Tu X, Niu C, Huang G, Jiang W. J. Hazard. Mater. 2006; 135: 249-255. [ Links ]
10. Chojnacka k, Chojnacki A, Gorecka H. Chemosphere 2005; 59: 75-84. [ Links ]
11. Donmez G, Aksu Z, Process Biochem. 2002; 38: 751-762. [ Links ]
12. Li H, Li Z, Liu T, Xiao X, Peng Z, Deng L. Bioresour. Technol. 2008; 99: 6271-6279. [ Links ]
13. Pehlivan E, Altun T. J Hazard. Mater. 2008; 155: 378-384. [ Links ]
14. Navarro A, Blanco D, Llanos B, Flores J, Maldonado H. Rev. Soc. Quím. Perú 2004; 70: 147-157. [ Links ]
15. Cuizano N, Llanos B, Navarro A. Desalination 2008; submitido. [ Links ]
16. Cuizano N, Navarro A. An. Quím 2008; 104: 120-125. [ Links ]
17. Rosa S, Laranjeira M, Riela H, Fávere V. J. Hazard. Mater. 2008; 155: 253-260. [ Links ]
18. Sun L, Du Y, Shi X, Chen X, Yang J, Xu Y. J Appl. Polym. Sci. 2006; 102: 1303-1309. [ Links ]
19. Larez C. Rev. Iberoamer. Polím. 2003; 4: 91-109. [ Links ]
20. Guibal E, Milot C, Tobin J. Ind. Eng. Chem. Res. 1998; 37: 1454-1463. [ Links ]
21. Rojas G, Silva J, Flores J, Rodriguez A, Ly M, Maldonado H. Sep. Purif. Technol. 2005; 44: 31-36. [ Links ]
22. Tapia N. Adsorción y Biosorción, Mecanismos y Principales Modelos para describir el fenómeno de biosorción. Curso: Aplicaciones ambientales de la biotecnología en la industria; Agosto 2002. PUCP. [ Links ]
23. Langmuir I. J. Am. Chem. Soc 1918; 40: 1361. [ Links ]
24. Navarro A. Selección del mejor biosorbente para la biosorción de ion cadmio (II): Modelamiento del Equilibrio y cinética. [Tesis Licenciatura en Química]. Lima, Perú: UPCH ; 2004. [ Links ]
25. Lagergreen S. Kungliga Svenska Vetenskapsakademiens Handlingar 1898; 24: 1- 39. [ Links ]
26. Ho Y, McKay G. Chem. Eng. J 1998; 70: 115-124. [ Links ]
Recibido el 15-08-2013
Aprobado el 13-11-2013













