Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.4 Lima Oct./Dec. 2013
TRABAJOS ORIGINALES
Variación del contenido de vitamina C y antocianinas en Myrciaria dubia "camu camu"
Variation of vitamina c and antocianins in Myrciaria dubia "camu camu"
Juan C. Castro Gómeza*, Freddy Gutiérrez Rodrígueza, Cinthya Acuña Amarala, Luis A. Cerdeira Gutiérreza, Alex Tapullima Pacayaa, Marianela Cobos Ruiza, Sixto A. Imán Correab
a Unidad Especializada de Biotecnología (UEB). Centro de Investigaciones de Recursos Naturales (CIRNA). Universidad Nacional de la Amazonía Peruana (UNAP). AAHH Nuevo San Lorenzo, Pasaje Los Paujiles S/N. San Juan Bautista, Iquitos-Perú. CP: 496S. * juanccgomez@yahoo.es.
b Recursos Genéticos Vegetales. Instituto Nacional de Innovación Agraria (INIA). Iquitos-Perú.
RESUMEN
Myrciaria dubia es un arbusto amazónico que produce varios compuestos nutritivos y bioactivos. Esta investigación se realizó para ampliar el conocimiento relacionado a la vitamina C y antocianinas. Las muestras fueron obtenidas de la Colección de Germoplasma del INIA. La vitamina C y las antocianinas se analizaron con técnicas estándares. El contenido de vitamina C mostró una amplia variación y gradientes de concentración con diferencias significativas en frutos verdes (F = 36, gl = 3, p < 0,001) y maduros (F = 42, gl = 3, p < 0,001). También, las antocianinas totales presentaron una amplia variación y gradientes de concentración muy marcadas en los frutos maduros (F = 34, gl = 3, p < 0,001). Estas diferencias se debieron primariamente entre el contenido de vitamina C y antocianinas de la cáscara y las demás partes del fruto (p < 0,01). Asimismo, se registró correlaciones positivas en el contenido de vitamina C y antocianinas. Adicionalmente, ambos compuestos se detectaron en diferentes tejidos en los procesos de germinación y crecimiento inicial. En conclusión, M. dubia presenta una amplia variación en el contenido de vitamina C y antocianinas en sus frutos, principalmente por la influencia de factores genéticos. También, ambos compuestos tienen gradientes de concentración desde la cáscara hasta el centro de frutos verdes (excepto las antocianinas) y maduros. Además, en los frutos maduros existe correlación positiva entre el contenido de vitamina C y antocianinas de la cáscara y la pulpa en contacto con ésta. Adicionalmente, la vitamina C y las antocianinas, particularmente la cianidina-3-glucósido, son sintetizadas en el proceso de germinación y crecimiento inicial.
Palabras clave: crecimiento inicial, frutal amazónico, germinación, gradiente de concentración.
ABSTRACT
Myrciaria dubia is an Amazonian shrub that produces various nutritional and bioactive compounds. This research was conducted to expand our knowledge about vitamin C and anthocyanins. Samples were obtained from the INIA Germplasm Collection and analyzed using standard techniques. The vitamin C content showed a wide variation and concentration gradients were significant in unripe (F = 36, df = 3, p < 0.001) and ripe fruits (F = 42, df = 3, p < 0.001). Also, total anthocyanins showed extensive variation and very marked concentration gradients in ripe fruits (F = 34, df = 3, p < 0.001). These differences were primarily among vitamin C and anthocyanins in the peel and other fruit parts (p <0.01). We also found positive correlations in vitamin C and anthocyanin content. In addition, both compounds were detected in different tissues in the germination and early growth processes. In conclusion, M. dubia has a wide variation in vitamin C and anthocyanins content in fruits, mainly due to the influence of genetic factors. Also, both compounds have concentration gradients from the peel to the center of unripe (except anthocyanins) and ripe fruits. Additionally, there was positive correlation in ripe fruits between vitamin C and anthocyanins content in the peel and pulp in contact with it. Additionally, vitamin C and anthocyanins, especially cyanidin-3-glucoside, are synthesized in germination and early growth processes.
Key words: initial growth, Amazonian fruit, germination, concentration gradient.
INTRODUCCIÓN
Myrciaria dubia es un arbusto amazónico que produce varios compuestos nutritivos y bioactivos. Entre éstos, sobresale la vitamina C por su alta concentración (>2,0 g/100 g de pulpa)1. Además, contiene inhibidores de aldosa reductasa2, antocianinas3 y el compuesto hepatoprotector 1-metilmalato4. También, posee propiedades antioxidantes y antiinflamatorias5, efectos antigenotóxicos6 y mejora el perfil bioquímico de obesidad7. Por tanto, M. dubia podría emplearse como suplemento de alimentos funcionales para retardar el envejecimiento y controlar enfermedades crónicas asociadas con la diabetes, la obesidad y el cáncer.
En las plantas, tanto la vitamina C como las antocianinas, cumplen roles fundamentales. Ambos compuestos son factores esenciales en las interacciones de las plantas con su ambiente, frecuentemente sirven como la primera línea de defensa contra los radicales libres, la radiación ultravioleta y ataque de patógenos8. Además, en el caso de la vitamina C se ha demostrado que es importante para la división y diferenciación celular9,10. Consecuentemente, la vitamina C y las antocianinas son moléculas multifuncionales muy importantes porque dan soporte al normal funcionamiento, el crecimiento y desarrollo de las plantas.
Aunque se ha realizado varios estudios de M. dubia aún existen muchos vacíos en el conocimiento científico de algunos aspectos bioquímicos y biológicos básicos. Por ejemplo, algunas investigaciones indican que existe una amplia variación en el contenido de vitamina C en los frutos de M. dubia11, información que necesitamos confirmar, pero falta evaluar si ocurre lo mismo con las antocianinas y cómo son influidos por los factores ambientales y genéticos. Asimismo, aún falta determinar si la concentración de vitamina C y de las antocianinas es uniforme o muestran gradientes de concentración en los frutos, también, debe analizarse si en los frutos existe correlación entre el contenido de vitamina C y antocianinas, ya que la vitamina C es cofactor de varias enzimas que sintetizan antocianinas12. Asimismo, se necesita conocer si la vitamina C está presente en todos los tejidos de M. dubia. Finalmente, se desconoce si las antocianinas presentes en la cáscara de los frutos son las mismas que se observan en los procesos de germinación y crecimiento inicial de esta especie13. Por tanto, la presente investigación se realizó para responder a varias de estas preguntas básicas y ampliar el conocimiento científico de este importante frutal amazónico.
PARTE EXPERIMENTAL
Colecta y transporte del material botánico
Las hojas, frutos verdes y frutos maduros de M. dubia fueron obtenidos de la Colección Nacional de Germoplasma, Campo Experimental El Dorado, Estación Experimental San Roque-Loreto, Instituto Nacional de Innovación Agraria (INIA), ubicado en el Km 25½ de la carretera Iquitos- Nauta (03°57'17? LS, 73°24'55? LO), el cual está constituido por 43 accesiones representativas de la variabilidad genética de esta especie. Pertenecen a 8 principales cuencas hidrográficas de la Región Loreto (Nanay, Itaya, Napo, Ucayali, Putumayo, Curaray, Tigre y Amazonas), establecidas hace aproximadamente 20 años. Las muestras obtenidas fueron transportadas en condiciones de refrigeración a los laboratorios de la UEB-CIRNA-UNAP, donde se almacenaron a -80°C, las que posteriormente fueron procesadas para determinar su contenido de vitamina C y antocianinas.
Germinación de semillas
Las semillas de M. dubia fueron obtenidas después de despulpar manualmente frutos maduros recién colectados. Las semillas fueron lavadas con agua destilada hasta quitar toda la pulpa. Estas semillas fueron puestas entre dos capas de gasa embebidas con agua destilada estéril en recipientes de plástico y cubiertas con bolsas negras. La temperatura ambiental promedio fue 25±1°C y la humedad relativa promedio fue 92±2%. La germinación se evidenció (emergencia de la radícula) a partir de la segunda semana de iniciado el proceso.
Tinción histoquímica de vitamina C
Las semillas sin testa y plántulas de dos etapas de desarrollo fueron teñidas por 24 horas a 4°C en una solución que contenía AgNO35%, alcohol metílico 70% y ácido acético 5% y fijadas en una solución que contenía alcohol metílico 70% y NH4OH 5% por 30 minutos.14 Finalmente, las muestras teñidas se transfirieron a una solución de alcohol etílico al 70% y almacenó a 4°C hasta su registro fotográfico.
Determinación de vitamina C por HPLC-DAD
Se realizó de acuerdo a Ledezma-Gairaud.15 En un mortero se trituró 500 mg de la muestra y 2,0 mL de solución extractora (HPO 3 3%, ácido acético 8% y ácido etilenodiamino tetraacético 0,36%). El homogenizado se transfirió a microtubos de 1,5 mL y centrifugó a 20000 x g por 10 minutos a 4°C; 100 µL del sobrenadante obtenido se diluyó diez veces, se filtró a través de un filtro para jeringa de 0,45 µm y 25 µL de las muestras filtradas se analizaron en un equipo de cromatografía líquida de alta eficiencia con detector de arreglo de diodos HPLC-DAD (Elite La Chrome, modelo HP 1100). El análisis cromatográfico se hizo empleando una columna Purospher®STAR LiChroCART RP-18e (5 µm, 250 x 4,6 mm). La temperatura de la columna fue mantenida a 56°C. El flujo de la fase móvil (KH2PO4 100 mM pH 2,5) fue 0,7 mL/min y la vitamina C se detectó a 245 nm. La cuantificación de la vitamina C se realizó en base a la ecuación de la curva estándar preparada.
Determinación de antocianinas totales
Se realizó según Page et al.16 Un mililitro del sobrenadante obtenido en el proceso de extracción de vitamina C se empleó para medir su absorbancia a 530 y 657 nm empleando un espectrofotómetro UV/Vis (Genesys 6, Thermospectronic) y la concentración de la muestra se determinó con la siguiente ecuación:
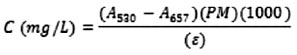
Donde:
-
PM = peso molecular de la cianidina-3-glucósido = 448,82 g/mol
ε
Los valores fueron normalizados con el peso de las muestras.
Análisis cromatográfico de antocianinas por HPLC-DAD
Se realizó de acuerdo a Figueras et al.17 7on modificaciones menores. Para ello se trituró en un mortero 1 g de la muestra (cáscara, plúmula, raíz o semilla sin testa) y 20 mL de solución extractora (alcohol etílico 99% y ácido fórmico 1%). El homogenizado se filtró a través de tres capas de Miracloth (Calbiochem) y el filtrado se transfirió a vasos de precipitado de 100 mL. El alcohol etílico se evaporó a 40°C por 24 h. El residuo seco se disolvió con 2 mL de una solución de alcohol metílico al 50% y ácido fórmico al 1%. La solución homogenizada fue transferida a microtubos de 1,5 mL y centrifugó a 20000 x g por 5 minutos; el sobrenadante obtenido se filtró con filtros para jeringa de 0,45 µm; 100 µL de las muestras filtradas se analizaron en el HPLC-DAD (Elite La Chrome, modelo HP 1100). El análisis cromatográfico se hizo empleando una columna Purospher®STAR LiChroCART RP-18e (5 ìm, 250 x 4,6 mm). La temperatura de la columna fue mantenida a 40°C. El volumen de inyección de la muestra fue 100 ìL. Se empleó una fase móbil binaria: la solución A compuesta de ácido fórmico:agua (10:90) y la solución B compuesta de metanol:agua:ácido fórmico (45:45:10). Se usó una gradiente lineal de 80:20 a 60:40 en 15 minutos con un flujo de 1,5 mL/min y de 60:40 a 20:80 en 10 minutos con un flujo de 2 mL/min y un tiempo adicional de 5 min en la proporción 20:80. La detección se programó de 450 a 550 nm. La longitud de onda analítica para detectar las antocianinas fue programada a 535 nm.
Análisis de datos
Los análisis estadísticos descriptivos, el ANVA con prueba HSD de Tukey y la prueba t de Student y la correlación de Pearson se hicieron con el programa IBM SPSS Statistics versión 21 y los gráficos estadísticos fueron diseñados con el programa R versión 3.0.1.
RESULTADOS Y DISCUSIÓN
Variación en el contenido de vitamina C y antocianinas
Las pulpas de frutos verdes y maduros de M. dubia presentaron una amplia variación en el contenido de vitamina C (figura 1A). En los frutos verdes las concentraciones más frecuentes fueron de 1,6 a 1,8 g de vitamina C/100 g pulpa y en los frutos maduros de 1,2 a 1,6 g de vitamina C/100 g pulpa. En promedio se registró mayor contenido en frutos verdes (1,63±0,29 g/100g pulpa) que en frutos maduros (1,47±0,32 g/100g pulpa), siendo estas diferencias significativas (t = -4,8; gl = 354; p < 0,001). Estos resultados concuerdan con otras investigaciones, tanto en la amplia variación encontrada y en el mayor contenido de vitamina C en frutos verdes que en maduros.1,11,18 En la figura 1B se muestra un bajo contenido de antocianinas en la cáscara de frutos verdes (0,85 a 2,42 mg/100 g cáscara), mientras que en frutos maduros el contenido de antocianinas fue de 6 a >140 veces mayor que en frutos verdes y mostró una amplia variación con distribución normal. En promedio se registró más antocianinas en frutos maduros (55,17±24,30 mg/100 g cáscara) que en frutos verdes (1,64±0,44 mg/100 g cáscara), siendo estas diferencias estadísticamente significativas (t = 9,1; gl = 153; p < 0,001). Estos resultados concuerdan con otra investigación que indica variación en el contenido de antocianinas de 22,8 a 86,7 mg/100 g cáscara de frutos maduros.3 La amplia variación registrada en el contenido de vitamina C y de antocianinas en frutos de M. dubia debe estar controlada por factores ambientales y genéticos. Los factores ambientales podrían tener menor influencia, porque todas las plantas de la colección de germoplasma del INIA están distribuidas en un área de 0,5 ha, en un suelo con propiedades fisicoquímicas similares (franco arenoso, pH = 4,1), la precipitación pluvial mensual (211,6±120,5 mm), la temperatura ambiental (máxima = 31,9±0,9 °C y mínima = 22,1±0,5 °C), la humedad relativa (84,0±2,2%) y las horas de radiación solar (4,7±1,0 h), son las mismas. Sin embargo, la colección de germoplasma consta de 43 accesiones obtenidas de ocho cuencas hidrográficas de la Región Loreto: Nanay, Itaya, Napo, Ucayali, Putumayo, Curaray, Tigre y Amazonas11 y con técnicas moleculares se ha demostrado que la colección está constituida por múltiples genotipos.19
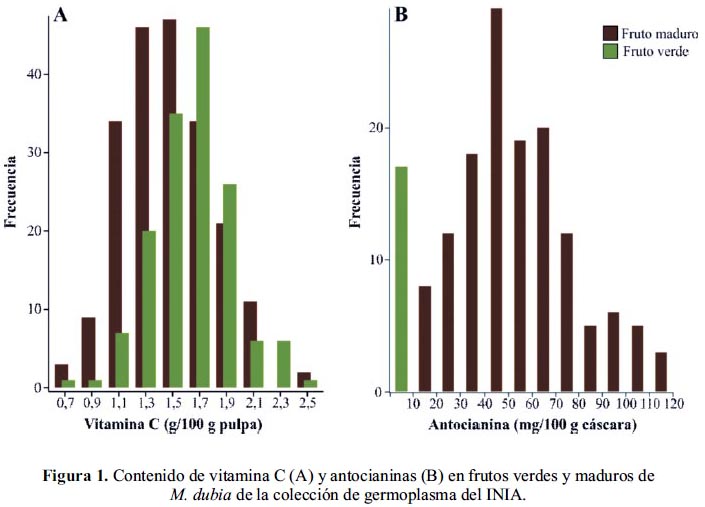
Por tanto, los factores genéticos moleculares estarían determinando la amplia variación en el contenido de ambos compuestos en esta especie. En cuanto a la variación del contenido de vitamina C, Cobos20 reporta que en M. dubia el gen que codifica la enzima L-galactono-1,4lactona deshidrogenasa, una enzima de la vía biosintética de vitamina C (Smirnoff-Wheeler), está sobreexpresada en plantas con alto contenido de vitamina C. También, estudios recientes demuestran que la actividad catalítica diferencial de otras enzimas de esta vía, tales como Lgalactosa deshidrogenasa y L-gulono-1,4-lactona deshidrogenasa21 y de enzimas del ciclo ascorbato-glutatión22 determinan la acumulación de vitamina C en esta especie. Adicionalmente, estudios realizados con Solanum lycopersicum indican que la variación en el contenido de vitamina C se atribuye principalmente a factores genéticos. 23 Consecuentemente, las plantas de M. dubia de la colección de germoplasma del INIAdifieren significativamente en su producción de vitamina C aún estando bajo las mismas condiciones ambientales, lo que sugiere que las diferencias observadas son controladas por múltiples genes que codifican enzimas involucradas en el metabolismo de la vitamina C.
Similar a lo descrito, la amplia variación en el contenido de antocianinas en la cáscara de los frutos de M. dubia también estaría controlada por múltiples genes. Aunque a la fecha no existen estudios moleculares del metabolismo de antocianinas en esta especie, pero investigaciones realizadas en Vitis vinifera sugieren la participación de genes reguladores (codifican factores de transcripción) y genes estructurales (codifican enzimas de la vía biosintética de antocianinas). Por ejemplo, Castellarin y Di Gaspero24 concluyen que la variación del color en frutos de V. vinifera depende de un patrón peculiar de expresión genotipo-específico de todos los genes que participan en la biosíntesis de antocianinas en una relación directa del transcripto-metabolito-fenotipo. Los niveles y la abundancia relativa de los ARNm de los genes estructurales en el proceso de maduración, explica per se el fenotipo final para el contenido de antocianina, la composición de antocianinas y la intensidad del color. Asimismo, Cardoso et al.25 empleando una estrategia de genes candidatos encuentran que los genes que codifican los factores de transcripción MYB11, MYBCC y MYCB están asociados con el contenido de antocianinas totales en la cáscara. También, muestran que los genes estructurales UFGT y MRP están asociados con la producción de diferentes tipos de antocianinas.
Gradientes de concentración de vitamina C y antocianinas en frutos
Los frutos verdes y maduros de M. dubia mostraron gradientes de concentración de vitamina C (figura 2). De tal modo, que en ambos estados de maduración la cáscara presentó más vitamina C por gramo de peso fresco, y ésta disminuyó gradualmente desde la pulpa que está en contacto con la cáscara hasta la pulpa que está en contacto con las semillas (centro del fruto); estas diferencias fueron significativas, tanto en frutos verdes (F = 36, gl = 3, p < 0,001) como en frutos maduros (F = 42, gl = 3, p < 0,001), principalmente entre el contenido de vitamina C de la cáscara y las otras partes del fruto (p < 0,01). También observamos que los frutos verdes no presentaron diferencias en el contenido de antocianinas entre las diferentes partes analizadas (F = 2, gl = 3, p = 0,094). En contraste, los frutos maduros pesentaron gradientes de concentración muy marcadas (F = 34, gl = 3, p < 0,001). Estas diferencias se debieron primariamente entre el contenido de antocianinas de la cáscara y las demás partes del fruto (p < 0,01). Esto puede deberse a que la cáscara, por tener capacidad de fotosíntesis, dispone de más precursores para la biosíntesis de vitamina C y antocianinas, en tanto que la pulpa nó, pero tal como ha sido demostrado en varias investigaciones; las hojas, pulpa y cáscara de M. dubia tienen capacidad de biosíntesis de vitamina C debido a que en estos tejidos se expresan los genes y hay actividad de las enzimas de la vía Smirnoff-Wheeler.21,26,27
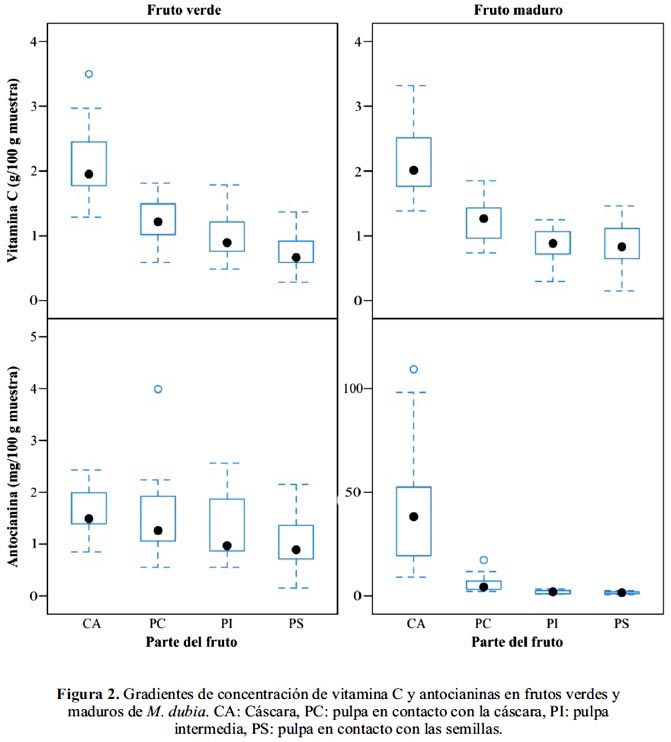
La presencia de estas gradientes sugieren que la vitamina C y las antocianinas son transportadas desde la cáscara hasta las otras partes del fruto por sistemas de transporte, facilitado en favor de la gradiente.
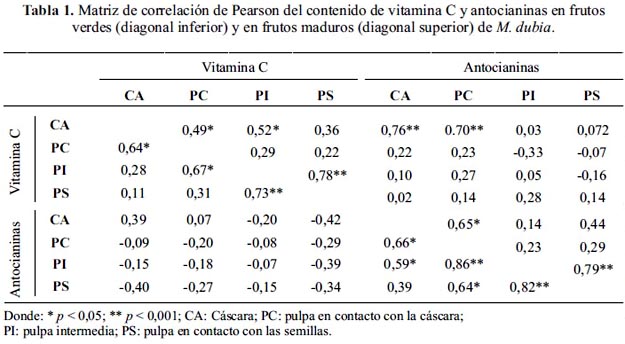
Asimismo, en la tabla 1, los análisis de correlación de Pearson muestran que existe correlación positiva en el contenido de vitamina C y antocianinas entre varias partes del fruto y entre el contenido de vitamina C y antocianinas en determinadas partes del fruto (tabla 1). La correlación positiva de la concentración de vitamina C entre cáscara y pulpa en contacto con la cáscara en frutos verdes y maduros, concuerda con resultados obtenidos en Malus domestica. 28 Asimismo, la correlación positiva registrada entre el contenido de vitamina C y antocianinas en la cáscara de los frutos maduros es similar al reportado para Arabidopsis thaliana, 16 porque por lo menos tres enzimas que participan en el proceso de biosíntesis de antocianinas emplean como cofactor a la vitamina C, que permite mantener el hierro de sus sitios activos en el estado de oxidación apropiado para su actividad catalítica.12
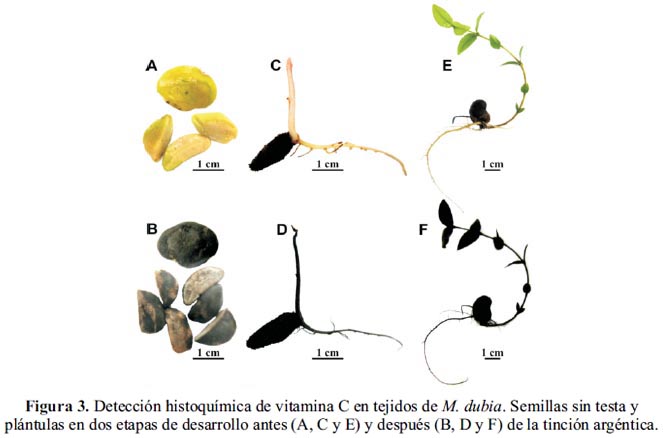
Detección histoquímica de vitamina C
La tinción argéntica reveló que la vitamina C es un compuesto común de todos los tejidos de M. dubia (figura 3). Es decir, además de estar presente en la pulpa y cáscara de los frutos (figura 2), se le encuentra en las semillas, plúmulas, hojas, raíces primarias y secundarias. Esto se puede atribuir a los múltiples roles que tiene esta vitamina en las plantas, como antioxidante, fotoprotector, como cofactor para la biosíntesis de antocianinas y otros compuestos importantes. Además, está demostrado que estimula el crecimiento y diferenciación celular.9,10,29
Antocianinas en frutos y en el proceso de germinación y crecimiento inicial
Las antocianinas están presentes en la cáscara de los frutos maduros y en las etapas de germinación y crecimiento inicial de M. dubia (figura 4). En la cáscara de los frutos pintones y maduros (figuras 4A, B) se observan hasta dos tipos de antocianinas (figura J), la más abundante es cianidina-3-glucósido (tiempo de retención=12,5 minutos) y la segunda antocianina (tiempo de retención = 22,5 minutos) es desconocida. Estos resultados concuerdan parcialmente con Zanatta et al. 3 quienes indican que la cianidina-3-glucósido es la antocianina predominante en esta especie. También, en la germinación y en las etapas iniciales de crecimiento de M. dubia (figuras 4C-I) se observa que la cianidina-3-glucósido es la única antocianina sintetizada (figura 4K). Es evidente la acumulación de este compuesto en la zona de brote de la radícula, de las raíces secundarias, de la plúmula, y en las plántulas se detecta acumulación en la plúmula, particularmente en las zonas apicales de mayor crecimiento celular. Además, en la figura 4A evidenciamos que las áreas de los frutos expuestas a mayor radiación solar acumulan más antocianinas; esto se debe a que se desencadena un mecanismo molecular para activar las enzimas responsables de la biosíntesis de antocianinas.30 Sin embargo, el proceso de germinación y crecimiento inicial de M. dubia se realizó en total oscuridad, pero igual se sintetizó la cianidina-3-glucósido, lo que sugiere que existen otros mecanismos moleculares independientes de la inducción de la luz que permiten la síntesis de antocianinas en esta especie.
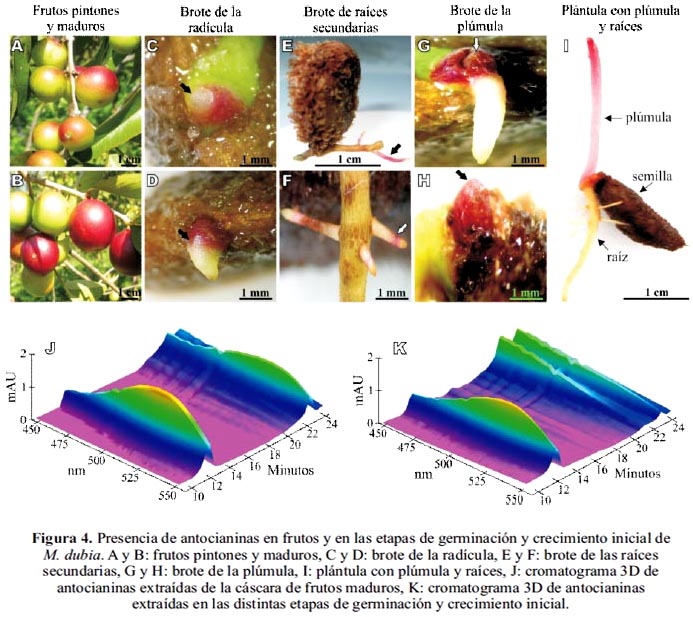
Aunque no existen reportes del papel de las antocianinas, particularmente cianidina-3glucósido en el proceso de división y diferenciación celular, pero su acumulación en las distintas etapas de germinación y desarrollo inicial sugiere que estos compuestos químicos están implicados directa o indirectamente en estos procesos fundamentales.
CONCLUSIONES
Myrciaria dubia presenta una amplia variación en el contenido de vitamina C y antocianinas en sus frutos, principalmente por la influencia de factores genéticos. También, ambos compuestos tienen gradientes de concentración desde la cáscara hasta el centro de frutos verdes (excepto las antocianinas) y maduros. Además, en los frutos maduros existe correlación positiva entre el contenido de vitamina C y antocianinas de la cáscara y la pulpa en contacto con ésta. Adicionalmente, la vitamina C y las antocianinas, particularmente la cianidina-3-glucósido, son sintetizadas en el proceso de germinación y crecimiento inicial.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONCYTEC) y a la Universidad Nacional de la Amazonía Peruana (UNAP) por el apoyo financiero. Al Dr. Jorge L. Marapara por el apoyo con equipos de la Unidad Especializada de Biotecnología del Centro de Investigaciones de la Amazonía-UNAP y un especial agradecimiento al Dr. J. Dylan Maddox por la revisión crítica del Abstract.
BIBLIOGRAFÍA
1. Imán S, Bravo L, Sotero V, Oliva C. Contenido de vitamina C en frutos de camu camu Myrciaria dubia (H.B.K) Mc Vaugh, en cuatro estados de maduración, procedentes de la Colección de Germoplasma del INIALoreto, Perú. Sci Agropecu. 2011;2(3):123-130. [ Links ]
2. Ueda H, Kuroiwa E, Tachibana Y, Kawanishi K, Ayala F, Moriyasu M. Aldose reductase inhibitors from the leaves of Myrciaria dubia (H. B. & K.) McVaugh. Phytomedicine Int J Phytother Phytopharm. 2004;11(7-8):652-656. [ Links ]
3. Zanatta CF, Cuevas E, Bobbio FO, Winterhalter P, Mercadante AZ. Determination of anthocyanins from camu-camu (Myrciaria dubia) by HPLC-PDA, HPLC-MS, and NMR. J Agric Food Chem. 2005;53(24):9531-9535. [ Links ]
4. Akachi T, Shiina Y, Kawaguchi T, Kawagishi H, Morita T, Sugiyama K. 1-methylmalate from camu-camu (Myrciaria dubia) suppressed D-galactosamine-induced liver injury in rats. Biosci Biotechnol Biochem. 2010;74(3):573-578. [ Links ]
5. Inoue T, Komoda H, Uchida T, Node K. Tropical fruit camu-camu (Myrciaria dubia) has anti-oxidative and anti-inflammatory properties. J Cardiol. 2008;52(2):127-132. [ Links ]
6. Da Silva FC, Arruda A, Ledel A, Dauth C, Romão NF, Viana RN, et al. Antigenotoxic effect of acute, subacute and chronic treatments with Amazonian camu-camu (Myrciaria dubia) juice on mice blood cells. Food Chem Toxicol. 2012;50(7):2275-81. [ Links ]
7. Nascimento OV, Boleti APA, Yuyama LKO, Lima ES. Effects of diet supplementation with Camu-camu (Myrciaria dubia HBK McVaugh) fruit in a rat model of diet-induced obesity. An Acad Bras Ciências. 2013;85(1):355-363. [ Links ]
8. Wang Y, Chen S, Yu O. Metabolic engineering of flavonoids in plants and microorganisms. Appl Microbiol Biotechnol. 2011;91(4):949-956. [ Links ]
9. Edgar, JA. Dehydroascorbic Acid and Cell Division. Nature. 1970;227:24-26. [ Links ]
10. Horemans N, Potters G, De Wilde L, Caubergs RJ. Dehydroascorbate uptake activity correlates with cell growth and cell division of tobacco bright yellow-2 cell cultures. Plant Physiol. 2003;133(1):361-367. [ Links ]
11. Imán, SA, Pinedo, S, Melchor, M. Caracterización morfológica y evaluación de la colección nacional de germoplasma de camu camu Myrciaria dubia (H.B.K) Mc Vaugh, del INIALoreto-Perú. Sci Agropecu. 2011;2:189-201. [ Links ]
12. Prescott AG, John P. DIOXYGENASES: Molecular Structure and Role in Plant Metabolism. Annu Rev Plant Physiol. 1996;47:245-271. [ Links ]
13. Medina, A, Córdova, E, Fasabi, J, Rodríguez, NH, Imán, SA, Castro, JC. Semillas y plántulas de Myrciaria dubia "camu-camu": biometría, germinación, desarrollo y crecimiento inicial. Artículo en redacción.
14. Chinoy NJ. On the specificity of the alcoholic, acidic silver nitrate reagent for the histochemical localization of ascorbic acid. Histochemie. 1969;20(2):105-107. [ Links ]
15. Ledezma-Gairaud, M L-GM. Validación del método: Determinación de vitamina C total por Cromatografía Líquida de Alta Resolución «HPLC». Tecnología En Marcha. 1993;417(4):15-23. [ Links ]
16. Page M, Sultana N, Paszkiewicz K, Florance H, Smirnoff N. The influence of ascorbate on anthocyanin accumulation during high light acclimation in Arabidopsis thaliana: further evidence for redox control of anthocyanin synthesis. Plant Cell Environ. 2012;35(2):388-404. [ Links ]
17. Figueras ML, Valls J, Roquet-Jalmar MN, Arola L. Importancia de los compuestos fenólicos en la calidad de los vinos tintos de crianza. Aliment Equipos Tecnol. 2000;19(2):119-124. [ Links ]
18. Justi KC, Visentainer JV, Evelázio de Souza N, Matsushita M. Nutritional composition and vitamin C stability in stored camu-camu (Myrciaria dubia) pulp. Arch Latinoam Nutr. 2000;50(4):405-8. [ Links ]
19. Ríos, LM, Pérez, JJ, Cabrera, LD, Ramírez, R, Adrianzen, PM, Cobos, M, et al. Caracterización molecular de Myrciaria dubia (HBK) Mc Vaugh «camu camu» del banco de germoplasma del INIA. IX Asam Gen UNAMAZ. Iquitos; 2010. p. 16. [ Links ]
20. Cobos, M. Nivel de expresión genética de la L-Galactono-1,4-lactona deshidrogenasa y contenido de vitamina C en Myrciaria dubia (HBK) McVaugh «camu camu» [Doctoral]. [Iquitos]: Universidad Nacional de la Amazonía Peruana; [ Links ] 2013.
21. Castro, JC, Araujo, A, Gutiérrez, F, Imán, SA. L-Galactosa deshidrogenasa y L-Gulono1,4-lactona deshidrogenasa influyen en la biosíntesis de vitamina C en Myrciaria dubia (Kunth)McVaugh «camu-camu». Rev ECIPerú. 2013;9(2):77-83. [ Links ]
22. Acuña, C, Cerdeira, LA. Comparación de la actividad catalítica de enzimas de la vía Halliwel-Asada entre plantas de Myrciaria dubia «camu-camu» que producen frutos de alto y bajo contenido de vitamina C [Titulación de Químico-Farmacéutico]. [Iquitos-Perú]: Universidad Nacional de la Amazonía Peruana; [ Links ] 2013.
23. Roselló, S., Adalid, AM, Cebolla-Cornejo, J, Nuez, F. Evaluation of the genotype, environment and their interaction on carotenoid and ascorbic acid accumulation in tomato germplasm. J Sci Food Agric. 2011;91:1014-1021. [ Links ]
24. Castellarin SD, Di Gaspero G. Transcriptional control of anthocyanin biosynthetic genes in extreme phenotypes for berry pigmentation of naturally occurring grapevines. BMC Plant Biol. 2007;7:46. [ Links ]
25. Cardoso S, Lau W, Eiras Dias J, Fevereiro P, Maniatis N. A candidate-gene association study for berry colour and anthocyanin content in Vitis vinifera L. PloS One. 2012;7(9):e46021. [ Links ]
26. Egoávil, A., Torres, J. Expresión de genes que codifican enzimas: GDP-L-Galactosa Fosforilasa, L- Galactosa Deshidrogenasa y L-Galactono-1,4-Lactona Deshidrogenasa de la ruta biosintética de Vitamina C en Myrciaria dubia (kunth) McVaugh "camu camu" [Titulación de Biólogo]. [Iquitos-Perú]: Universidad Nacional de la Amazonía Peruana; 2012. [ Links ]
27. Gutiérrez, F. Identificación de enzimas de la vía Smirnoff-Wheeler en hojas y frutos de Myrciaria dubia (Kunth) McVaugh "camu camu" [Titulación de Biólogo]. [Iquitos-Perú]: Universidad Nacional de la Amazonía Peruana; [ Links ] 2012.
28. Davey MW, Kenis K, Keulemans J. Genetic control of fruit vitamin C contents. Plant Physiol. 2006;142(1):343-351. [ Links ]
29. Gest N, Gautier H, Stevens R. Ascorbate as seen through plant evolution: the rise of a successful molecule? J Exp Bot. 2013;64(1):33-53. [ Links ]
30. He F, Mu L, Yan G-L, Liang N-N, Pan Q-H, Wang J, et al. Biosynthesis of anthocyanins and their regulation in colored grapes. Mol Basel Switz. 2010;15(12):9057-9091. [ Links ]
Recibido el 15-08-2013
Aprobado el 13-11-2013













