Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.79 no.4 Lima oct./dic. 2013
TRABAJOS ORIGINALES
Influencia de las variables experimentales de preparación en la obtención de nanopartículas de magnetita por el método de descomposición térmica
Influence of synthesis experimental parameters on the formation of nanoparticles of magnetite prepared by thermal decomposition method
Jaime Vega*a, Gino Picasso**a, Luis Avilés Félixb, Alcides Lópeza
a Laboratorio de Investigación de Fisicoquímica, Facultad de Ciencias, Universidad Nacional de Ingeniería, Av. Túpac Amaru 210, Rímac, Lima- Perú, * jvegachacon@gmail.com, ** gpicasso@uni.edu.pe
b Centro Atómico Bariloche, División de Resonancias Magnéticas, Avenida Ezequiel Bustillo Km 9500 San Carlos de Bariloche C.P. 8400, Rio Negro, Argentina
RESUMEN
En este trabajo, se ha preparado nanopartículas de magnetita (Fe3O4) por el método descomposición térmica en síntesis controlada utilizando trietilenglicol (TREG). Se preparó muestras a partir de soluciones nitrato y acetilacetonato de Fe. Las nanopartículas obtenidas fueron caracterizadas mediante Difracción de Rayos X (XRD), adsorción-desorción de N2 (técnica BET), Microscopía Electrónica de Barrido (SEM), Análisis termogravimétrico (TGA), Magnetometría de Muestra Vibrante (VSM) y Espectroscopía Mössbauer (EM). Los resultados de XRD revelaron la presencia mayoritaria de la fase espinela de magnetita en las muestras. Las micrografías SEM mostraron diferencias morfológicas; las preparadas a partir de precursor acetilacetonato presentaron buena dispersión, mientras que las de nitrato, pequeñas aglomeraciones. Las isotermas de adsorción de N2 revelaron presencia mayoritaria de superficie mesoporosa en todas las muestras con un perfil tipo IV. El análisis TGApermitió observar la formación de 2 zonas que correspondieron a la volatilización de las fracciones ligeras y del TREG. Según el análisis VSM, no se ha observado campo coercitivo, sugiriendo un comportamiento superparamagnético. El espectro Mössbauer detectó la presencia de 4 subespectros del tipo doblete que corresponderían a 4 sitios ocupados por Fe en estado paramagnético o superparamagnético.
Palabras clave: Nanopartículas de magnetita, descomposición térmica, solvente de polioles.
ABSTRACT
In this work, nanoparticles based on magnetite have been synthesized by thermal decomposition via solvent-controlled synthesis in polyols, using triethylene glycol (TREG). The starting precursor were solutions of nitrate and acetatylacetonate of Fe.
The samples have been characterized by X-ray diffraction technique (XRD), adsorptiondesorption of N2 (BET equation model), scanning electronic microscopy (SEM), thermogravimetric analysis (TGA), vibration sample magnetometry (VSM) and Mössbauer spectroscopy. XRD difractogramms revealed the majority presence of spinel-like structural phases of magnetite in all samples. SEM micrographs showed morphological differences; the samples prepared from acetatylacetonate presented good dispersion of particles whereas the ones prepared from nitrate - small agglomerations. BET isotherms of samples depicted a mesoporous profile which corresponded to IV type. TGAthermogramms showed two defined regions which corresponded to vaporization of polyol light fractions and TREG. Zero coercivity on the magnetization curve of acetatylacetonate precursor samples have been observed by VSM, which indicates superparamagnetic behavior. Mössbauer spectra of samples detected the presence of 4 doublet-like subspectra due to the presence of 4 sites occupied by Fe in paramagnetic or superparamagnetic state.
Key words: Nanoparticles of magnetite, thermal decomposition, polyol solvent.
INTRODUCCIÓN
La magnetita (Fe3O4) en forma de nanocristal ha llamado la atención en los últimos años por sus propiedades físicas, en particular, el superparamagnetismo para ser aplicado en el mejoramiento de imágenes con fines biomédicos, como un trazador para la reparación de tejidos, para el mejoramiento de las propiedades de fármacos, detección temprana de algunos carcinomas, entre otros1-5. Se ha aplicado diversos métodos de síntesis de nanopartículas de magnetita, que incluye, coprecipitación6, sonoquímica7, química coloidal8, combustión9, síntesis solvotérmica10, síntesis hidrotérmica11, microemulsión12 y descomposición térmica13. Todos estos métodos han permitido obtener nanocristales estables de magnetita, aunque los pasos elementales de cada método son bastante diferenciados y demanda en mayor o menor medida tratamientos térmicos y consumo en material de partida, además de gasto energético y tiempo de síntesis para su aplicación en gran escala.
El método de descomposición térmica es, entre los métodos mencionados, el que más aplicación ha encontrado en los últimos años por sus potenciales aplicaciones en biomedicina14-16. Este método tiene a su vez algunas variantes. La primera introducida por Rockenberger et al.17, es la descomposición del precursor de Fe en un solvente de alto punto de ebullición con ayuda de surfactantes como ácido oleico, trioctelamina, oleilamina, entre otros18. Sin embargo, las nanopartículas magnéticas son solubles en solventes no polares debido a la naturaleza hidrofóbica del surfactante que limita las aplicaciones biomédicas19. La segunda opción es la descomposición del precursor en un poliol como trietilenglicol, que funciona simultáneamente como agente antiaglomerante, reductor y acomplejante de los iones de las espinela y permite en un solo paso obtener en ambiente hidrofílico las nanopartículas de magnetita, aunque es necesario prevenir una posible aglomeración en ambiente polar usando etanol y acetato de etilo20. Este método de obtención de nanocristales constituye un paso importante para su funcionalización en tejidos hidrofílicos y biocompatibles, capaces de influir favorablemente en el contraste de imágenes obtenidas por resonancia magnética21-23.
Este trabajo persigue sintetizar nanopartículas de magnetita en polioles usando diferentes precursores de Fe y explorar la influencia de algunas variables experimentales durante la síntesis para la obtención de nanocristales superparamagnéticos estables. Este trabajo forma parte de un proyecto mayor que busca aplicar nanopartículas de magnetita como sensor de colorantes y para aplicaciones biomédicas en la detección temprana de algunas enfermedades. Este es un segundo avance del primer trabajo24 y está dedicado a la aplicación del método de descomposición térmica de obtención de magnetita en forma de nanocristales superparamagnéticos y la influencia de factores estructurales texturales y morfológicos en la estabilidad del producto final.
PARTE EXPERIMENTAL
Materiales de partida
Los materiales de partida fueron los siguientes:
-
- Acetilacetonato de hierro (III) 97%, Sigma-Aldrich.
-
- Nitrato de hierro (III), Fe(NO3)3.9H2O, 99% pureza, Merck.
-
- Trietilenglicol, 99% (TREG), Merck.
-
- Acetato de etilo, (AE), Merck.
-
- Etanol, QP(Aldrich).
Las nanopartículas de óxido de hierro fueron sintetizadas mediante el método de descomposición térmica en poliol, desarrollado en el trabajo de Cai et al.20. El método seguido es el siguiente: Una determinada cantidad de Fe(acac)3 se mezcló con 80 ml de TREG en un balón adaptado a un condensador; se calentó la mezcla a 120°C por 30 minutos bajo agitación magnética para asegurar la disolución total. Después, se mantuvo la solución a 180°C por 30 minutos bajo agitación magnética; se calentó hasta la temperatura de ebullición del TREG (280°C) por una hora, manteniendo la agitación magnética. Se dejó enfriar hasta temperatura ambiente; se agregó aproximadamente 60 ml de AE y 10 ml de etanol, luego se agitó la mezcla y se dejó reposar por un período de 24 horas, después del cual, las nanopartículas han floculado y con ayuda de un imán se eliminó el sobrenadante. Se lavó las nanopartículas con agua ultrapura dispersándolas en la misma cantidad de acetato de etilo y etanol antes mencionado, y precipitándolas con ayuda de un imán. Se repitió el procedimiento hasta que el sobrenadante fue incoloro. Finalmente, se dispersó las nanopartículas en agua y luego conservadas en un desecador. Se repitió todo el procedimiento mencionado a partir del precursor nitrato. Un resumen de las muestras se presenta en la tabla 1.
RESULTADOS Y DISCUSIÓN
Caracterización
Análisis por difracción de rayos X (XRD) y análisis por adsorción-desorción de N2 (superficie BET)
Para la identificación cristalográfica de las muestras se utilizó la técnica de difracción de rayos X (XRD). El equipo utilizado fue un difractómetro RIGAKU Modelo Miniflex, con tubo de cobre y filtro de níquel, con 30 kV y 15 mA. El equipo está provisto de un ánodo rotatorio. Se usó un monocromador de grafito con el objeto de seleccionar la radiación CuKα del ánodo de cobre y se ha trabajado con ángulos de barrido entre 10 y 80º a una velocidad de 0,04 º/s. El tamaño medio de los granos cristalinos fue calculado a partir del análisis de los picos de difracción más intensos mediante la ecuación de Debye-Scherrer:
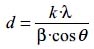
Donde d es el tamaño medio de grano cristalino o cristalita (Å), λ es la longitud de onda de la radiación incidente CuKα igual a 1,5418 Å, k es una constante que toma el valor de 0,9 (previamente calibrada en el equipo a partir de muestras patrón de tamaño de grano conocido), β es la anchura del pico a la mitad de su intensidad máxima (en radianes) y θ es el ángulo de difracción para dicha intensidad.
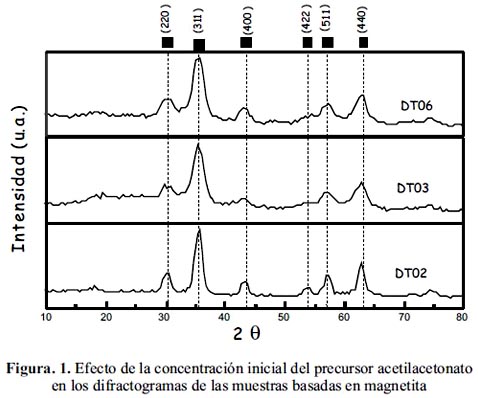
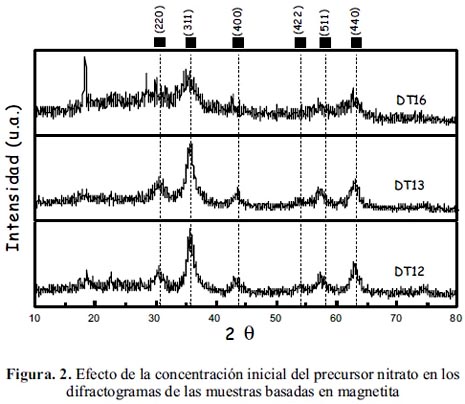
En general, las muestras sintetizadas han mostrado mayoritariamente los picos característicos de la espinela inversa de Fe3O4 en las posiciones angulares: 30,06º, 35,42º; 62,55º (JCPDS – Internacional Centre for Diffraction Data Nº 33-0664) como se observa en las figuras 1 y 2. En general, una menor concentración del precursor de partida utilizado en la preparación de las muestras permitió obtener mayor cristalinidad en la magnetita, como se observa en las figuras 1 y 2 para las muestras DT02 y DT12, comparadas con sus homólogas preparadas a partir del mismo precursor.
Para la medición de la superficie específica y tamaño de poro se usó el equipo Micromeritics GEMINI-VII serie t del Laboratorio de Investigación de la Facultad de Ciencias (UNI), que permite el registro de la isoterma de adsorción en todo el rango de presiones parciales P/P0. Se utilizó N2 como gas de análisis (gas N2, 99% AGA) y nitrógeno líquido (PRAXAIR) con punto de ebullición a -195,79 °C como refrigerante para la condensación del N2. El área BET se calculó en el rango de presiones P/Ps entre <0,05 a 0,33> correspondiente a la adsorción de una monocapa. Los puntos de equilibrio se midieron siguiendo el programa GAS MICROMERITICS con un total de 50 puntos y con un tiempo de equilibrio en cada punto de 7s. Previo a la adsorción, las muestras fueron desgasificadas al vacío durante 2 h a 250 °C con el propósito de eliminar el agua y las impurezas superficiales. La magnitud de la superficie específica y el tamaño de cristalita de las muestras se presentan en la tabla 2.
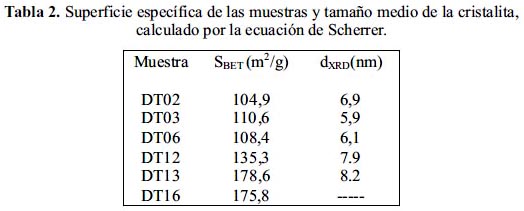
En esta tabla se observa, en general, que existe buena correlación entre el tamaño de cristalita y superficie, es decir, a una menor superficie corresponde mayor tamaño de cristalita; por ejemplo, para las muestras DT02 y DT03 con una superficie 104,9 y 110,6 m2/g, respectivamente, corresponde una cristalita de 6,9 y 5,9 nm, respectivamente.
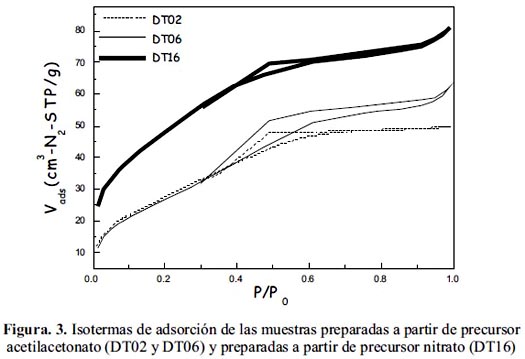
De acuerdo al perfil de las isotermas (figura 3), todas corresponden al tipo IV según la clasificación IUPAC con presencia de histéresis y que describen a un sólido mesoporoso. Las muestras presentan, en general, poros de tipo laminar aunque, en algunas se ha observado poros con cuello de botella, considerando la mayor histéresis observada (DT06).
Microscopía electrónica de barrido
La figura 4a presenta la micrografía SEM de la muestra DT02, donde las nanopartículas tienen tamaño medio entre 6,6 y 7,6 nm, una magnitud similar al tamaño de cristalita (entre 6,1 y 6,9 nm); por lo que probablemente las nanopartículas de la serie DT0X están monodispersas. Esta distribución aseguró, además, menor tendencia a la aglomeración. En contraste, las nanopartículas preparadas a partir del precursor nitrato, como se observa en la micrografía de la muestra DT13 (figura 4b), están fuertemente aglomeradas y recubiertas por trietilenglicol (figura 5), lo que dificulta la medición del tamaño real de las nanopartículas. Por este análisis se infiere que, si bien es posible utilizar el nitrato de hierro para formar nanopartículas, no son estables independientemente, por lo que tienden a aglomerarse, y en el proceso atrapan moléculas de trietilenglicol fuertemente ligadas.


Análisis termogravimétrico (TGA)
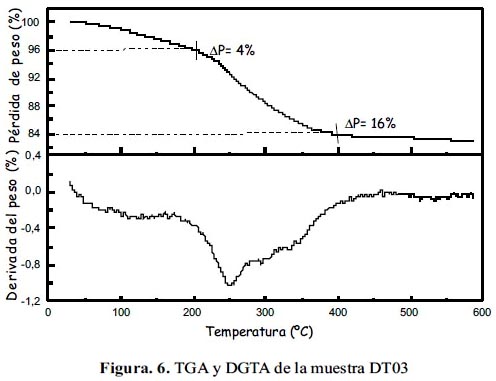
Se realizó pruebas de TGA de las muestras DT03 y DT13, utilizando una balanza termogravimétrica Perkin Elmer TGA 4000, calentando bajo una atmósfera de nitrógeno desde 30°C hasta 600°C a una velocidad de 10°C/min. La curva DTGA se obtuvo derivando la curva TGA, utilizando el programa Pyris.
En las figuras 6 y 7 se presenta los termogramas TGA de las muestras DT03 y DT13 con fines de comparación. La temperatura final de 600 °C asegura la descomposición térmica de la mayor parte del producto orgánico y al mismo tiempo evita la reducción de la magnetita. Como se observa en dichas figuras, hasta los 200°C DT03 perdió 4% en masa, y DT13, 9%. A 430°C ambos dejan de perder masa, DT03 entonces perdió 12% en masa adicional, mientras DT13 perdió 19%. Se puede interpretar la curva TGA para ambas muestras como una reducción de masa que se lleva a cabo en dos etapas: la primera hasta antes de 200°C que corresponde a la desorción de moléculas ligeras como agua, etanol y acetato de etilo, ligadas a las nanopartículas; la segunda etapa ocurre entre 200°C y 430°C; está relacionada con la desorción inicial de trietilenglicol residual y la descomposición de éste. La curva de DTGA para la muestra DT03 muestra un pico en 250°C; valor cercano a la temperatura de ebullición del trietilenglicol (280°C), por lo cual se confirmaría que la segunda etapa está fuertemente relacionada con este episodio. La presencia de moléculas de trietilenglicol en la superficie de las nanopartículas son las que le confieren hidrofilidad a las nanopartículas permitiendo que éstas formen una dispersión estable en agua.
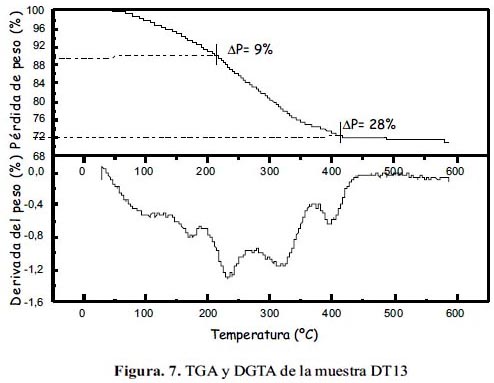
Por último, comparando ambas curvas TGA, la muestra DT13 es la que tiene una mayor cantidad de trietilenglicol desorbido, cerca de 12% más en masa, que se apreció previamente en las micrografías SEM de esta muestra (figura 5). Además, según la curva DTGA de la muestras DT13 (figura 7), la disociación de TREG ocurre en 2 etapas: a 320 ºC y 395 ºC, que podría atribuirse a la interacción electrostática de las partículas del Fe3O4 con el trietilenglicol, que se manifestaría en mayor pérdida de masa.
Análisis por magnetometría de muestra vibrante (VSM)
Para la caracterización magnética se utilizó un VSM comercial marca LakeShore serie 7300. El análisis VSM se realizó con el objeto de estudiar las propiedades magnéticas de las nanopartículas sintetizadas. Se obtuvo las curvas de histéresis de las nanopartículas de donde se obtuvo la saturación de remanencia y el campo coercitivo. Un resumen de las medidas de magnetización realizadas se presenta en la tabla 3.
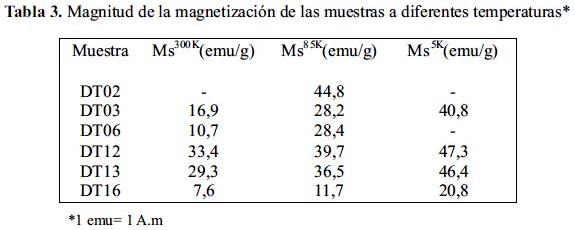
En esta tabla se observa la variación de la magnetización de saturación de las muestras con la temperatura: La magnetización disminuye con el aumento de la temperatura. Cuando se aplica un campo magnético al arreglo de espines de las nanopartículas, éstos se orientan paralelos al campo magnético para reducir la energía del sistema, aumentando así la magnetización. Por otro lado, cuando aumenta la temperatura la energía térmica del sistema aumenta, alejándolo a los momentos magnéticos de la dirección del campo magnético, por lo que al aumentar la temperatura disminuye la magnetización.
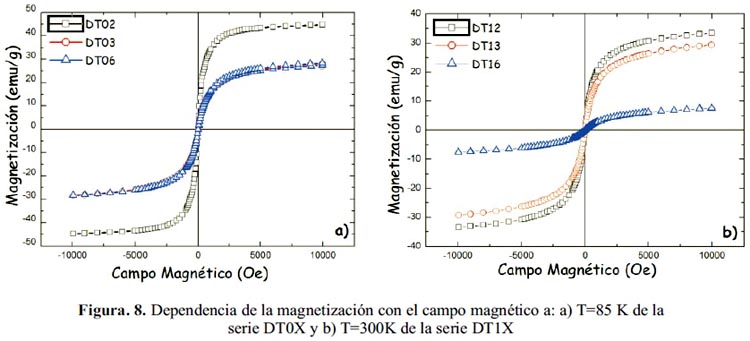
Se realizó también medidas de histéresis magnética a la temperatura de 300 K (figura 8). Se comprobó que las nanopartículas tienen un comportamiento superparamagnetico pues el material tiene un campo coercitivo nulo, lo que se verifica en la gráfica de VSM, como una curva que no presenta histéresis (figura 8); considerando, además, que la energía térmica, medida a 300 K, es mayor a la energía de anisotropía magnética (Energía requerida para que los momentos magnéticos apunten en una dirección preferencial). Por otro lado, se observa una magnetización mayor en las muestras sintetizadas a partir de una concentración de 0,066 mol/L del precursor de partida (acetato y nitrato), en comparación de las nanopartículas sintetizadas con 0,10 y 0,15 mol/L. Estos resultados pueden ser explicados de las medidas de XRD. En las medidas de XRD se observó que las nanopartículas obtenidas a partir de una menor concentración del precursor presentaban un comportamiento más cristalino. Al obtenerse nanopartículas con un mayor orden estructural, el momento magnético aumenta acercándose al valor medido para la magnetita, cercano a 84 emu/g correspondiente al bulk.
Espectroscopía Mössbauer
Para confirmar la presencia de superparamagnetismo en las muestras sintetizadas se utilizó espectroscopía Mössbauer. Para este análisis se utilizó un espectrómetro Mössbauer marca FastComTec en la modalidad de transmisión con señal sinusoidal. Se utilizó una fuente de Co57 en matriz de Rh con una actividad aprox. de 10 mCi. Los espectros se tomaron a una velocidad de 11,038 mm/s con una tasa de conteo de alrededor de 7,2x10 cts/s y se acumuló en 1024 canales. El detector utilizado es del tipo proporcional y usa gas de kriptón. En la preparación de los analitos se utilizó 100 mg aprox. en un portamuestra con diámetro interno de 1,7 cm. Es pertinente mencionar que sólo los átomos de Fe-57 (abundancia de 2,12%) contribuyen a la formación del espectro Mössbauer.
En las figuras 9, 10 y 11 se muestra los resultados del análisis de los espectros Mössbauer experimentales tomados de la muestras DT02, DT03 y DT06, respectivamente; además, en la tablas 4, 5 y 6 se presenta los parámetros hiperfinos calculados para cada caso. El análisis se ha realizado con la suposición que cada espectro, en dada caso, es la superposición de por los menos 2 subespectros tipo dobletes. En el caso de las muestras DT02 y DT06 el ajuste de los espectros permitió incluir 3 dobletes, mientras que en DT03 solo dobletes. Para el análisis se utilizó el porgrama MOS90. Para la representación de los resultados se utilizó el programa MOSVIEW.
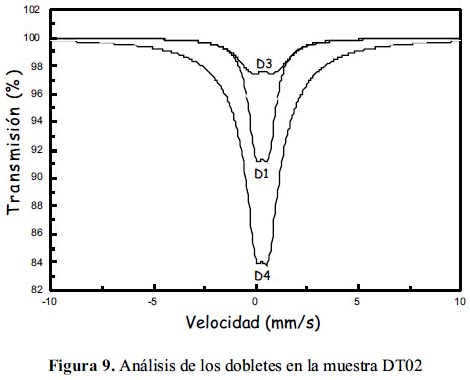
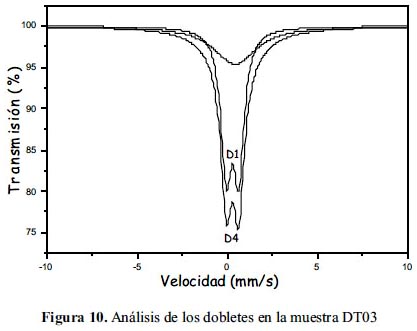
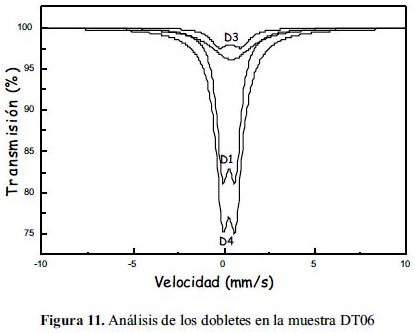
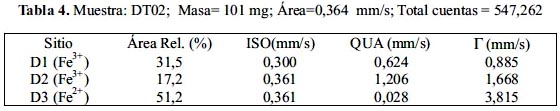

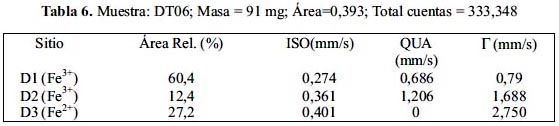
Los subespectros D1 corresponden a sitios tetraédricos ocupados por iones férricos, pero con una alta distorsión en sus posiciones. Los subespectros D2 corresponden a sitios B en la espinela inversa, es decir, compuestos por iones férrico y ferroso en sitios octaédricos; finalmente, el doblete-3 (D3) se reduce a un singlete (QUA=0) con un ancho de línea grande de 3,8 mm/s en el caso de la muestra DT02 y alrededor de 2,8 mm/s en el caso de otras dos muestras. Los valores de ISO son mayores que en el caso de D1 y muy cercanos entre sí; se pueden asociar a cationes de Fe3+ en sitos octaédricos. En el caso de la muestra DT02 este doblete D2 contribuye a una mayor área relativa que en el caso de otras 2 muestras. El ancho de línea grande está asociado al proceso de relajación magnética, que se puede relacionar a los granos de mayor tamaño. Este dato confirma lo observado por análisis XRD (tabla 2) y SEM (figura 4).
Las figuras 12, 13 y 14 muestran los espectros Mössbauer experimentales tomados conjuntamente con los resultados de los ajustes de los mismos sobre la base que están constituidos por 4 subespectros del tipo doblete que corresponderían a 4 sitios ocupados por Fe en estado paramagnético o súper paramagnético. Las tablas 7, 8 y 9 listan los parámetros hiperfinos: áreas de absorción resonante, corrimiento isomérico (ISO), desdoblamiento cuadripolar (QUA) y ancho de línea experimental (Γ) de cada uno de los dobletes; en estas tablas también se incluye: la masa de cada analito, el conteo del continuo y el chi-cuadrado de cada ajuste de espectro.
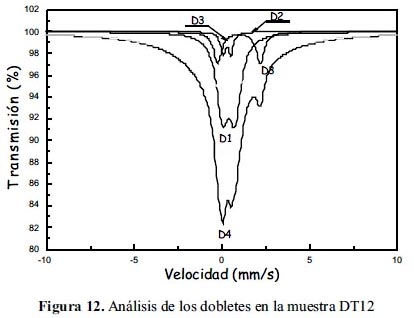
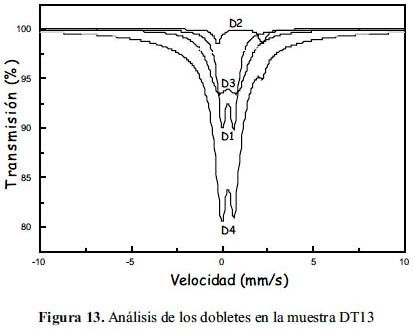
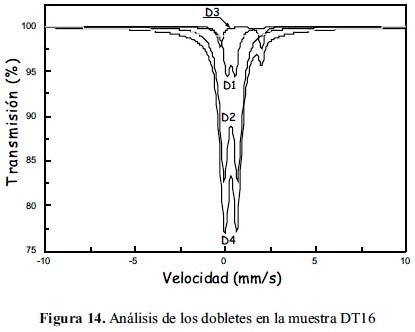
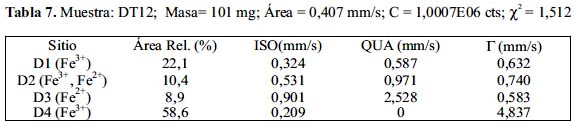
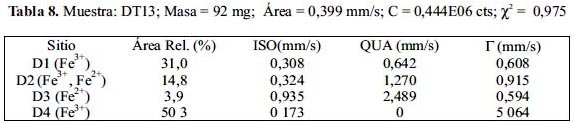
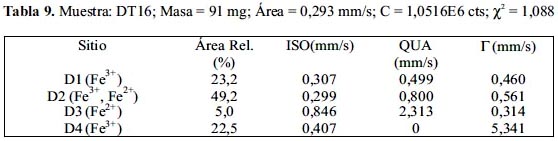
Los subespectros asignados a D1 corresponden a sitios tetraédricos altamente distorsionados ocupados por iones férrico (Fe3+). Esto, gracias al bajo valor de desplazamiento isomérico de aproximadamente 0,3 (tabla 7); la distorsión se justifica por el valor de aprox. 0,5 en desdoblamiento cuadripolar (tabla 7); se espera normalmente que sea un valor mucho menor, si es que la estructura no tiene defectos. Los subespectros D3 corresponden a sitios tetraédricos ocupados por iones ferroso (Fe2+), esto debido al valor normal que tienen estos sitios en desplazamiento isomerico de aproximadamente 1 (tabla 7) y al elevado valor del desplazamiento cuadripolar, mayor que 2, el cual también es esperado para esta clase de sitios (la posición A en la espinela inversa). Los subespectros D2, al parecer corresponderían a una mezcla de iones férrico y ferroso en sitios octaédricos debido a que los valores de desplazamiento isomérico y desdoblamiento cuadripolar parece ser una media entre los valores esperados para ion ferroso e ion férrico en posición octaédrica (la posición B en la espinela inversa). Los subespectros D4 tienen un desplazamiento isomérico correspondiente a ion férrico, quizás en posición tetraédrica con gran distorsión; lo curioso en este caso es que no presenta desdoblamiento cuadripolar, QUA=0 (tabla 7), pero el ancho grande de línea es de un valor aproximadamente igual a 5, en contraste con sus análogos en los demás dobletes, con un valor de aproximadamente 0,5. Se ha reportado resultados similares en el trabajo de Ayyub et al. 25, atribuyendo a los iones férricos una estructura desordenada y amorfa. Las mayores áreas superficiales en las muestras de la serie DT1X respecto a la serie DT0X confirman dicha observación.
Se desprende, en general, del análisis Mössbauer, la formación de la espinela de magnetita en las muestras sintetizadas. Se rebela también el predominio del tamaño nanoparticulado en todas las muestra por la presencia de dobletes en lugar de sextetos, que ha modificado la configuración de la distribución de los sitios tetraédricos y octaédricos de los cationes Fe2+ y Fe3+, respectivamente, confirmando el análisis XRD y SEM. Adicionalmente, la formación de dobletes confirma el carácter supermagnético en todas las muestras sintetizadas, como también se desprende de las forma de histéresis de las muestras.
CONCLUSIONES
Se ha preparado nanopartículas de magnetita por descomposición térmica en ambiente hidrofílico en poliol, utilizando trietilenglicol (TREG) como disolvente y agente reductor, a partir de soluciones precursoras de Fe(acac)3 y Fe(NO3)3. De acuerdo al análisis XRD, todas las muestras mostraron la estructura típica de espinela, siendo las preparadas por acetilacetonato, más cristalinas que las de nitrato. En todos los casos, la cristalinidad empeoró con el aumento de la concentración inicial del precursor que se verificó con la diminución del tamaño de la cristalita. Según el análisis SEM, la serie de muestras con precursor acetato permitió obtener partículas más pequeñas y monodispersas, entre 6,6 y 7,6 nm, mientras que las nanopartículas procedentes del nitrato mostraron mayores tamaños con presencia de aglomeraciones, debido probablemente a la presencia remanente del TREG en las partículas, lo que se verificó en los análisis TGA-DGTA. Se comprobó por análisis VSM que las nanopartículas tienen un campo coercitivo distinto de cero, además de la prevalencia de la energía térmica sobre la energía magnética a 300 K, sugiriendo la presencia de superparamagnetismo. Esta característica fue confirmada por los subespectros Mössbauer de tipo doblete presentados en todas las muestras de magnetita sintetizadas en este trabajo, que corresponderían a 4 sitios ocupados por Fe en estado supepararmagnético.
AGRADECIMIENTO
Se agradece al Instituto de Investigación de la Universidad Nacional de Ingeniería (IGI), por la ayuda económica concedida para este trabajo durante el periodo junio de 2012 a mayo de 2013 y a la Dra. Pilar Taboada Sotomayor de la Universidad Estadual Paulista "Julio de Mesquita Filho" – UNESP, Brasil por la estancia de investigación concedida a Jaime Vega Chacón. Al Dr. Torres García y al Ing. Troncoso Heros de la Pontificia Universidad Católica del Perú por la cooperación en los análisis termogravimétricos.
REFERENCIAS
1. Brigger I., Dubernet C., Couvreur P., Nanoparticles in cancer therapy and diagnosis, Adv. Drug Deliv. Rev. 2012; 64: 24–36. [ Links ]
2. Guo M., Que C., Wang C., Liu X., Yan H., Liu K., Multifunctional superparamagnetic nanocarriers with folate-mediated and pH-responsive targeting properties for anticancer drug delivery, Biomaterials 2011; 32 (1): 185-194. [ Links ]
3. Tu Z., Zhang B., Yan G., Wang M., Zhao F., Sheng D. et al., Synthesis of poly(ethylene glycol) and poly(vinyl pyrrolidone) co-coated superparamagnetic iron oxide nanoparticle as a pH-sensitive release drug carrier, Colloids Surf. A 2013; 436: 854– 861. [ Links ]
4. Fan T., Li M., Wu X., Li M., Wu Y., Preparation of thermoresponsive and pH-sensitivity polymer magnetic hydrogel nanospheres as anticancer drug carriers, Colloids Surf. B 2011;88 (2): 593– 600. [ Links ]
5. Kakar S., Batra D., Singh R., Nautiya U., Magnetic microspheres as magical novel drug delivery system: Areview, Journal of Acute Disease 2013; 2 (1): 1-12. [ Links ]
6. Amighian J., Karimzadeh E., Mozaffari M., The effect of Mn2+ substitution on magnetic properties of MnxFe3-xO4 nanoparticles prepared by coprecipitation method, J. Magn. Magn. Mater. 2013; 332: 157-162. [ Links ]
7. Phu N.D., Sy T.X., Cao H.T., Dinh N. N., Thien L.V., Hieu N.M., et. al., Amorphous ironchromium oxide nanoparticles prepared by sonochemistry, J. Non-Cryst. Solids 2012; 358 (3): 537-543. [ Links ]
8. Vereda F., De Vicente J., Hidalgo-Alvarez R., Oxidation of ferrous hydroxides with nitrate: A versatile method for the preparation of magnetic colloidal particles, J. Colloid Interface Sci. 2013; 392 (15): 50-56. [ Links ]
9. Kulkarni Sachnin A., Sawadh P.S., Palei Prakash K., Kokate Kiran K., Effect of synthesis route on the structural, optical and magnetic properties of Fe3O4 nanoparticles, Ceramics International 2013; In Press. [ Links ]
10. Liu J., Wang L., Wang J., Zhang L., Simple solvothermal synthesis of hydrophobic magnetic monodispersed Fe O nanoparticles, Mater. Research Bull. 2013 (48):416-421. [ Links ]
11. Ahmadi S., Chia C.H., Zakaria S., Saeedfar K., Asim N., Synthesis of Fe3O4 nanocrystals using hydrothermal approach, J. Magn. Magn. Mater. 2012; 324 (24):4147-4150. [ Links ]
12. Shen K., Wang J., Li Ying, Wang Y., Li Yang, Preparation of magnetite core–shell nanoparticles of Fe3O4 and carbon with aryl sulfonyl acetic acid, Mater. Research Bull. 2013; 48 (11): 4655-4660. [ Links ]
13. Zhao F., Zhang B., Feng L., Preparation and magnetic properties of magnetite nanoparticles, Mater. Lett. 2012; 68 (1): 112-114. [ Links ]
14. Lee Eun-Hee, Kim Chang-Yeoul, ChoaYong-Ho, Magnetite nanoparticles dispersed within nanoporous aerogels for hyperthermia application, Curr. Appl. Phys. 2012; 12 (2): S47-S52. [ Links ]
15. Cótica L., Freitas V., Dias G., Santos I. A., Vendrame S., Khalil N. M. et al., Simple and facile approach to synthesize magnetite nanoparticles and assessment of their effects on blood cells, J. Magn. Magn. Mater. 2012; 324 (4): 559-563. [ Links ]
16. Asuha S., Suyala B., Siqintana X., Zhao S., Direct synthesis of Fe3O4 nanopowder by thermal decomposition of Fe–urea complex and its properties, J. Alloys Compd. 2011; 509 (6): 2870-2873. [ Links ]
17. Rockenberger J, Scher EC, Alivisatos AP. J. Am. Chem.Soc. 1999; 121:11595–6. [ Links ]
18. Sun S.H. , Zeng H. J. Am. Chem.Soc. 2002; 124: 8204–5. [ Links ]
19. Arruebo M., Fernández-Pacheco R., Ibarra R., Santamaría J., Magnetic nanoparticles for drug delivery, Nano Today 2007; 2 (3): 22-32. [ Links ]
20. Cai W., Wan J., Facile synthesis of superparamagnetic magnetite nanoparticles in liquid polyols, J. Coll. Interf. Sci. 2007; 305: 366–370 [ Links ]
21. Sancho M, Miguel O.B., Colom G., Salvador J.P., Marco M.P., Santamaria J., Development of stable, water-dispersible, and biofunctionalizable superparamagnetic iron oxide nanoparticles, Chem. Mater. 2011; 23: 2795–2802. [ Links ]
22. Zhang B., Tu Z., Zhao F., Wang J., Superparamagnetic iron oxide nanoparticles prepared by using an improved polyol method, Appl. Sur. Sci. 2013; 266: 375– 379. [ Links ]
23. Zhao F., Zhang B., Feng L., Preparation and magnetic properties of magnetite nanoparticles, Mater Lett 2012; 68:112–114. [ Links ]
24. Picasso G., Vega J., Uzuriaga R., Ruiz G.P., Preparación de nanopartículas de magnetita por los métodos sol-gel y precipitación: estudio de la composición química y estructura, Revista de la Soc. Quim. Perú 2012; 78 (3): 170-182. [ Links ]
25. Ayyub P., Multani M-S., Barma M., Palkar V. R., Vijayaraghavan R., Size-induced structural phase transitions and hyperfine properties of microcrystalline Fe2O3, J. Physics C: Solid State Physics 1988; 21: 2229-2240. [ Links ]
Recibido el 19-09-2013
Aprobado el 11-10-2013













