Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.80 no.1 Lima Jan. 2014
TRABAJOS ORIGINALES
Micropartículas de Ag/Ag2S tipo core-shell como sensor potenciométrico para la detección de cianuro
Microparticles of Ag/Ag2S type core-shell as potenciometric sensor for deteccion of cyanide
Renzo Olazo Quispe1, Adolfo La Rosa-Toro Gómez1*
1 Laboratorio de Electroquímica Aplicada. Facultad de Ciencia. Universidad Nacional de Ingeniería. Av. Túpac Amaru 210-Rimac/ Lima 25-Perú. qirenzo17@gmail.com
* Autor de correspondencia: toro@uni.edu.pe
RESUMEN
La síntesis de micropartículas de plata con película superficial de sulfuro de plata mezcladas con grafito en polvo ha permitido obtener un sensor electroquímico capaz de detectar cianuro con buena sensibilidad. Se caracterizó las micropartículas de plata y sulfuro de plata mediante voltametría cíclica (VC), Difracción de Rayos X (DRX), Fluorescencia de Rayos X (XRF), Microscopía de Barrido Electrónico(SEM) y Espectrometría de Energía Dispersiva de Rayos X (EDX). Se realizó ensayos potenciométricos para determinar el coeficiente de selectividad del sensor.
Palabras clave: Micropartículas core-shell, Ag/Ag2S, sensor de cianuro.
ABSTRACT
The synthesis of silver microparticles with surface film of silver sulfide mixed with graphite powder has yielded an electrochemical sensor capable of detecting cyanide with good sensitivity. silver and silver sulfide microparticles was characterized by cyclic voltammetry (CV), X-ray diffraction (XRD), X-ray Fluorescence (XRF), Scanning Electron Microscopy (SEM) and Energy Dispersive Spectrometry X-ray (EDX). Potentiometric assays were performed to determine the selectivity coefficient of the sensor.
Keywords: Microparticles core-shell, Ag/Ag2S, cyanide sensor.
INTRODUCCIÓN
El nivel de contaminación de las aguas es una preocupación permanente de las poblaciones cercanas a los asentamientos mineros y metalúrgicos, así como industrias en las zonas urbanas. El cianuro es uno de los principales contaminantes y forma parte de los efluentes de la industria galvánica, así como de la metalurgia de lixiviación de oro y plata1. Los ECA (DS Nº 002-2008 MINAM) para agua limitan el contenido de cianuro en el agua potable, con tratamiento químico, a un valor máximo de 0,022ppm2; es por ello que para el control del cumplimiento de los estándares en las aguas se requiere instrumentación sofisticada y de muy alto costo, entre ellas la cromatografía iónica, Raman y HPLC; una alternativa sin sacrificar exactitud y sensibilidad son los sensores fabricados en base a óxidos metálicos3. El presente trabajo se enfoca en la fabricación de un sensor potenciométrico con alta sensibilidad, capaz de medir la concentración de cianuro al nivel de las establecidas en las ECAs4. Los sensores presentan la ventaja de su facilidad de bajo costo, preparación y fácil uso, siendo un método eficaz y eficiente.5
PARTE EXPERIMENTAL
Reactivos. AgNO3, (NH4)2S, NaOH, HNO3, alcohol polivinílico (PVP), etanol, NaCN y grafito conductor (GC).
Equipos. Potenciostato/Galvanostato, ORP, Difracción de Rayos X, Fluorescencia de Rayos X, Microscopía de Barrido Electrónico y Espectrometría de Rayos X.
Preparación de micropartículas de Ag. En un vaso de precipitación se preparó 0,2 M de AgNO3, se ajustó su pH hasta el valor de 7 añadiendo NaOH 0,1 M. En otro vaso precipitado se preparó 0,15M de ácido ascórbico y 4% de dispersante PVP (relativo a la masa de AgNO3). Ambas soluciones a un mismo volumen. Luego se vertió el primer vaso al segundo lentamente, formándose inmediatamente precipitado de polvo de plata La solución se filtró y se lavó con abundante agua ultrapura y etanol. El sólido se secó en una estufa a 60°C por 12 horas.6
Preparación de macropartículas de Ag encapsuladas con Ag2S. En un vaso de 200 mL se dispersa polvo de plata en una solución al 20% de sulfuro de amonio (NH4)2S, mezclándolo cuidadosamente mediante agitador magnético, asegurando que todas las partículas se encuentren en contacto con la solución durante 8 minutos; posteriormente el polvo se separa mediante filtración y se enjuaga con agua ultrapura repetidas veces. Finalmente se seca a temperatura ambiente, obteniéndose micropartículas de plata‐Ag S7 representándose como Ag/Ag2S.
Limpieza del electrodo de carbón vítreo. La superficie del electrodo de carbón vítreo se pulió mecánicamente con papel abrasivo de 1000 y posteriormente alúmina de 0,3 µm hasta obtener una superficie muy lisa y brillante; luego se enjuaga en acetona y se somete a ultrasonido en alcohol absoluto; posteriormente se sumergió en HNO3 50% durante 1 minuto y en solución 1M de NaOH, procediéndose a enjuagarlo en agua ultrapura de 18 MΩ.cm de resistividad, procediendo a secarlo a temperatura ambiente.6
Construcción del sensor electroquímico. Se utilizó polvo de Ag/Ag2S como componente electroactivo con el cual se preparó los siguientes electrodos de estudio.8
-
Electrodo de Ag/Ag2S puro.
-
Electrodo de Ag/Ag2S-GC mezcla de micropartículas de Ag/Ag2S con grafito conductor en las proporciónes (1:1), (1:2) y (1:3).
En todos los casos se utilizó nujol como ligante.9
RESULTADOS Y DISCUSIÓN
Cronopotenciometría de la conversión química de Ag2S sobre la superficie de Ag
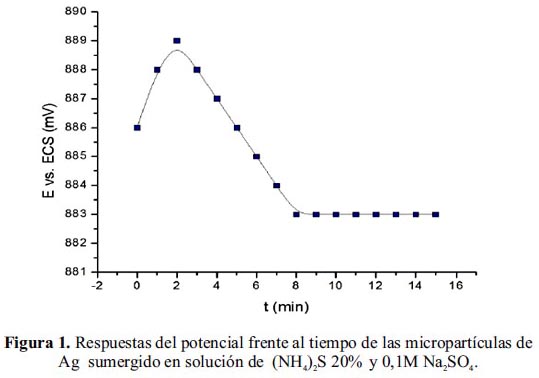
Se ha utilizado la técnica de cronopotenciometría para la determinación del tiempo de reacción de conversión química de la superficie de las micropartículas de plata en solución de (NH4)2S al 20% en volumen para la formación superficial de sulfuro de plata, Ag2S. El procedimiento experimental se realizó utilizando 0,1M Na2SO4 como electrolito soporte; como electrodo de trabajo se utilizó un alambre de Ag, y calomel como electrodo de referencia. La figura 1 muestra la variación del potencial en función al tiempo de reacción; tiempo en el cual ocurre la formación de la película de Ag2S sobre el alambre de Ag. Del gráfico se deduce que el cambio de potencial se encuentra relacionado al cambio químico que sucede en la superficie de la plata por reacción de la plata con el (NH4)2S. A los 8 minutos de inmersión el potencial se estabiliza, pudiendo interpretarse como el punto final de la conversión química, habiéndose conseguido encapsular por completo la superficie de plata. El mismo procedimiento se aplicó a la micropartículas de plata para formar partículas de plata tipo core-shell.
Caracterización voltamétrica de la mezcla de micropartículas de Ag/Ag2S y grafito conductor, Ag/Ag2S-GC, en solución 0,1M equimolar de Fe2+/Fe3+
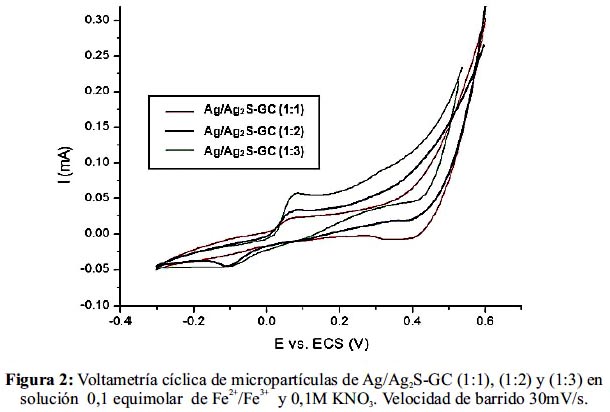
La figura 2 muestra los voltagramas de las micropartículas de Ag/Ag2S mezcladas con grafito conductor en electrolito de 0,1M equimolar de Fe2+/Fe3+ empleando platino como contraelectrodo y calomel como electrodo de referencia. En el gráfico se observa que a potencial anódico de 0,05 V ocurre la oxidación de Fe2+/Fe3+ y a potencial de -0,15 V se desarrolla la reducción de Fe3+/Fe2+. En el voltagrama, correspondiente a la mezcla Ag/Ag2S- GC (1:2) el perfil de óxido-reducción de la transición Fe2+/Fe3+ y viceversa, se muestra más definido que los electrodos preparados con las proporciones (1:1) y (1:3), debido a su mejor transferencia electrónica anódica-catódica con su entorno, seleccionándolo como la mejor mezcla para el sensor.
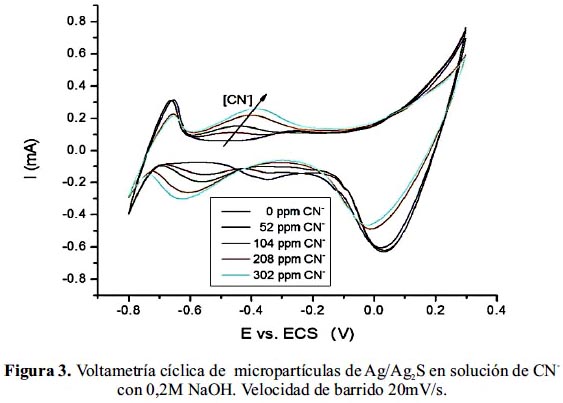
En la figura 3, se muestra el comportamiento voltamétrico del electrodo Ag/Ag2S-GC (1:2) en solución 0,2 M de NaOH y añadiendo progresivamente solución de cianuro de potasio. A potencial de -0,6 V en sentido catódico se observa la formación de un pico de adsorción del ion CN- sobre la superficie del Ag2S el cual presenta su correspondiente pico de desorción a potencial de -0,45 V mostrando buena respuesta voltamétrica con el aumento de la concentración de ion CN- en la solución.
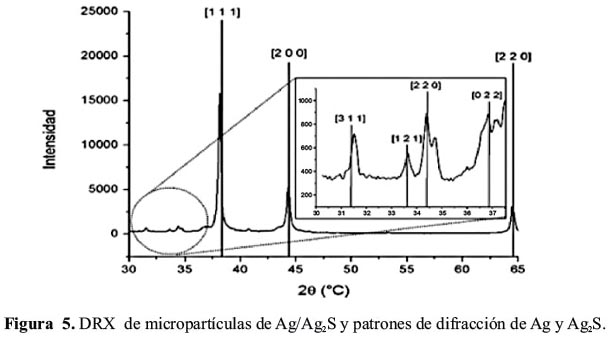
Difracción de rayos X (DRX) para micropartículas Ag y Ag/Ag2S
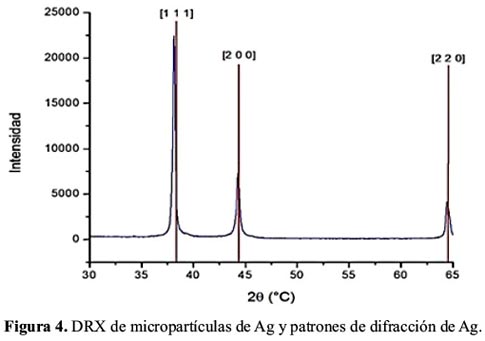
En las figuras 4 y 5 se muestra los difractogramas de las micropartículas de Ag y Ag/Ag2S, respectivamente. En la figura 5 se observa las líneas de difracción características de Ag, Ag2S. El Ag2S se presenta en 2 alótropos, acantita y argentita, respectivamente. La intensidad de la señal de Ag2S es bastante menor comparado a la de Ag, la que se encuentra relacionada a la abundancia de los mismos. En el gráfico in situ se observa las líneas de difracción magnificadas del Ag2S en el rango de 2Ɵ de 30-37.
Fluorescencia de Rayos X (XRF) de micropartículas Ag y Ag/Ag2S
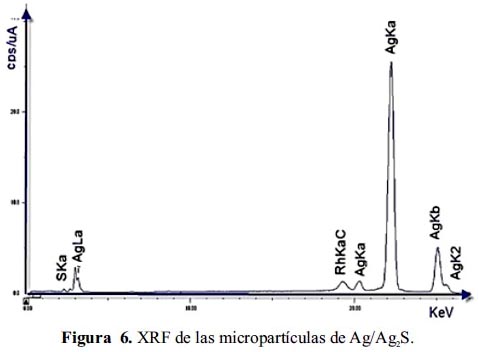
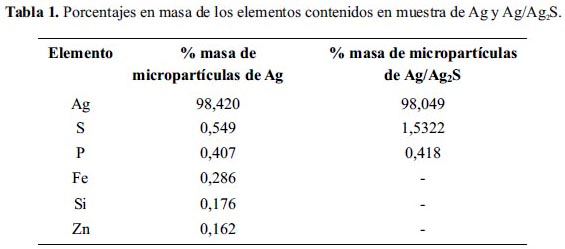
Se realizó el análisis químico de las muestras de micropartículas de Ag y Ag/Ag2S empleándose la técnica de Fluorescencia de Rayos X. En la figura 6 se muestra el espectro del análisis de la muestra de Ag/Ag2S y en la tabla 1 se presenta los resultados de la cuantificación de los componentes de las muestras de Ag y Ag2S.
Microscopía de barrido electrónico de micropartículas Ag y Ag/Ag2S
Las micropartículas de Ag y Ag/Ag2S fueron caracterizadas mediante la técnica Microscopia de Barrido Electrónico (SEM). Las imágenes SEM presentadas en la figura 7a y 7b muestran una estructura conformada por micropartículas esféricas formando aglomeraciones distribuidas uniformemente.

En la figura 8 se presenta las imágenes SEM de la micropartículas de Ag/Ag2S. En las amplificaciones x5000 y x10000 se puede observar superficies esféricas y homogéneas.

El diámetro medio de las micropartículas fue determinado en las respectivas micrografías SEM, siendo estas de 1,4 y 1,6 µm para las micropartículas de Ag y Ag/Ag2S, respectivamente.
Espectrometría de dispersión de rayos X de las micropartículas Ag y Ag/Ag2S
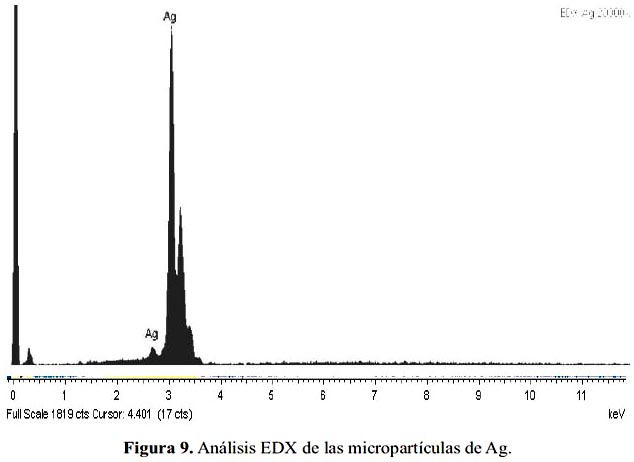
Se caracterizó las micropartículas de Ag mediante la técnica de Espectrometría de Dispersión de Rayos X (EDX). En la figura 9, se presenta el análisis EDX de micropartículas de Ag donde se observa la presencia de Ag y O. En la tabla 2, se presenta los porcentajes atómicos de los componentes.
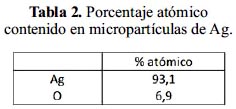
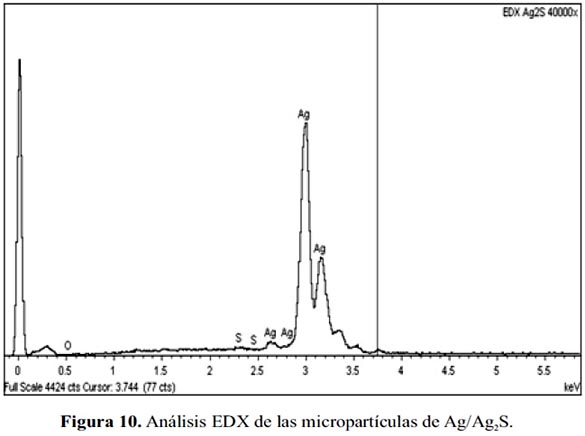
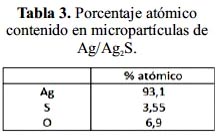
En la figura 10, se muestra el análisis EDX de las micropartículas de Ag/Ag2S, mostrando la presencia de Ag, S y O. Los porcentajes atómicos de estos elementos se muestran en la tabla 3. La correlación S/Ag en las micropartículas de Ag/Ag2S es de 0,062, valor muy inferior a la relación estequiometría del componente Ag2S, igual a S/Ag=0,5. Por ello, se deduce que el Ag2S se presenta como una película que encapsula las partículas esféricas de Ag presentando una estructura del tipo core-shell.
Curva de calibración del sensor de micropartículas Ag/Ag2S-GC
En la figura 11, se observa las curvas de calibración del electrodo de micropartículas de Ag/Ag2S solo y mezcladas con grafito conductor en proporciones de 1:1, 1:2 y 1:3 en concentraciones controladas de ion cianuro.
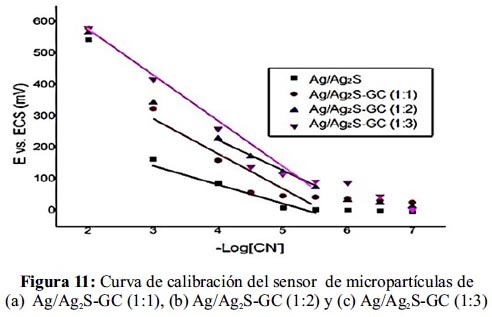
En el gráfico, se puede observa una menor pendiente de respuesta al sensor fabricado de micropartículas de Ag/Ag2S sin mezcla, mejorando su respuesta con la mezcla de grafito conductor.
En la tabla 4, se presenta los resultados de la respuesta de los sensores preparados frente a la concentración del ión cianuro. De los datos obtenidos se puede observar que el sensor de micropartículas de Ag/Ag2S-GC (1:2) presenta la mejor linealidad para el rango de concentración (–Log[CN-]) de 4 a 6, la mejor correlación de la pendiente igual a 0,9985 y el mejor límite de detección (LOD) igual a 0,020ppm.
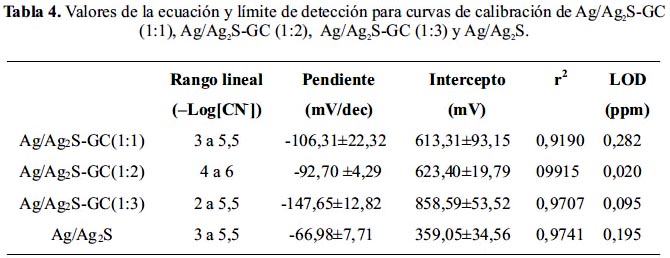
Reproducibilidad del sensor de micropartículas de Ag/Ag2S-GC (1:2)
Se realizó tres curvas de calibración del sensor de micropartículas de Ag/Ag2S-GC (1:2) para evaluar su reproducibilidad. La figura 12 muestra que los potenciales son similares en cada curva de calibración. La tabla 5 muestra las pendientes y límites de detección mostrando una buena reproducibilidad para mediciones continuas de cianuro en agua.
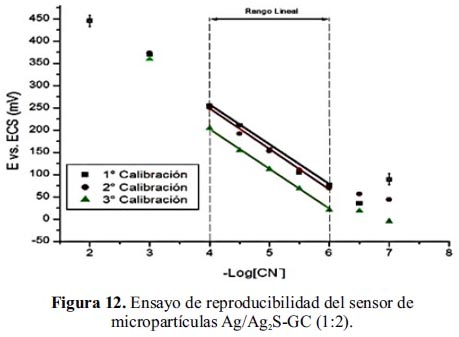
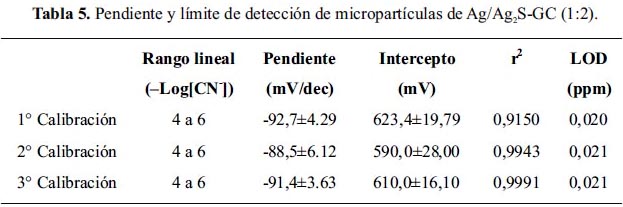
En la tabla 5, se puede observar que para tres eventos de calibración de cianuro en el rango de concentración (–Log[CN-]) de 4-6, los valores de regresión lineal es superior a 0,99 presentando un buen indicador de reproducibilidad para el sensor fabricado.
Evaluación del sensor Ag/Ag2S-GC (1:2) frente a interferentes
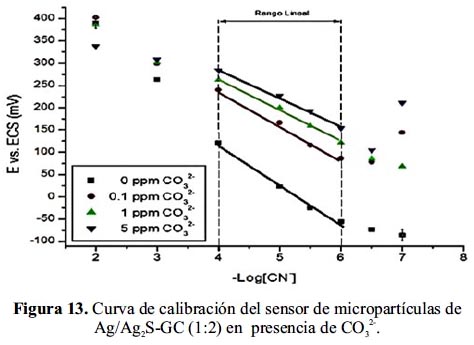
Se ha estudiado el comportamiento del sensor de micropartículas de Ag/Ag2S-GC (1:2) frente a los interferentes en agua Cl-, CO32- y S2-; Los ensayos fueron realizados evaluando los electrodos a concentración definida de interferente y calibrando el sensor frente a la concentración de cianuro.
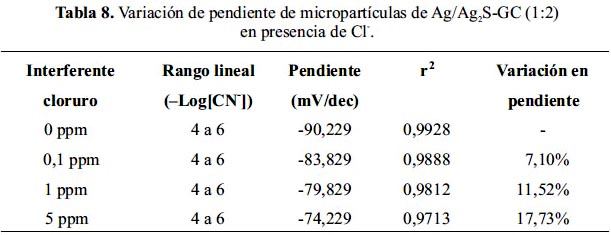
En la figura 13, se muestra la variación de la curva de calibración del sensor de micropartículas de Ag/Ag2S-GC (1:2) en presencia del interferente CO32-. La tabla 6 muestra que a 0,1ppm y 1ppm CO32- se presenta un descenso de la pendiente conservando la linealidad. Sin embargo, a 5ppm CO32- se afecta significativamente la linealidad.
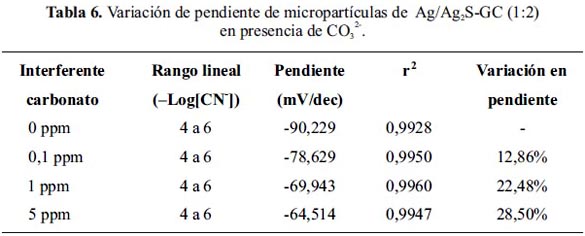
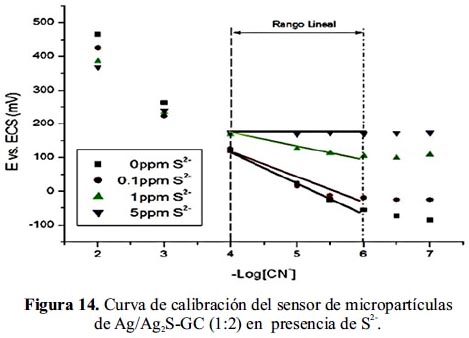
En la figura 14 y tabla 7, se muestra los resultados del estudio de interferencia del ion sulfuro. De acuerdo a los resultados del gráfico, se observa que a concentración de 0,1 ppm de S2- el rango de sensibilidad se acorta variando a (–Log[CN-]) de 3 a 5,5 A concentración de 1 ppm la linealidad y pendiente se afectan significativamente.
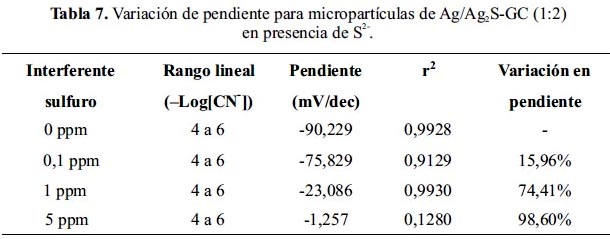
En la tabla 8 se muestra los resultados de las evaluaciones del interferente Cl- en la cual se observa que la pendiente sufre variaciones con respecto al aumento de contenido del ión Cl- en la solución.
Coeficiente de selectividad
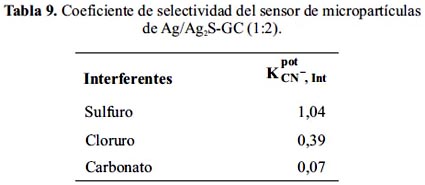
Con el propósito de establecer cuantitativamente el efecto de los interferentes Cl-, CO32- y S2- en la medida del ion cianuro se aplicó el modelo matemático de soluciones constantes para la determinación del coeficiente de selección del sensor de micropartículas de Ag/Ag2S-GC (1:2) con los correspondientes interferentes. En la tabla 9, se muestra que el ion sulfuro es una fuerte interferente en la mediciones potenciométricas de cianuro.
CONCLUSIONES
Se preparó micropartículas de Ag mediante reducción química, lo que fue tratado en solución de sulfuro de amonio para la conversión química de la superficie, formando micropartículas de Ag/Ag2S tipo core-shell. El electrodo fue caracterizado por voltametría cíclica y DRX, confirmándose la formación de Ag2S sobre la superficie de las micropartículas de Ag. La forma esférica de las micropartículas y el diámetro medio fue determinado mediante análisis SEM. La composición química fue analizada mediante Fluorescencia de Rayos X y EDX. La evaluación del comportamiento rédox de los electrodos preparados indican que el sensor de micropartículas de Ag/Ag2S-GC (1:2) presenta la mejor sensibilidad, alcanzando linealidad para mediciones de 1x10-6 M de CN-. La evaluación de iones interferentes indican que la sensibilidad al cianuro es afectado en el siguiente orden: S2- > Cl- > CO32-.
AGRADECIMIENTO
Los autores agradecen al Instituto de Investigación de la Universidad Nacional de Ingeniería (IGI- 2012) y al CONCYTEC-proyecto especial del PROCYT 2012, por los recursos económicos aportados para la realización del presente proyecto.
BIBLIOGRAFÍA
1. Mark; Hagelstein, Karen; Mudder, Terry. El manejo del cianuro en la extracción de oro. Consejo Internaciónal de Metales y Medio Ambiente. 2001: 7-10. [ Links ]
2. Estándares nacionales de calidad ambiental para agua. http://intranet2.minem.gob.pe/Web/archivos/dgaae/legislación/DS002-2008.pdf [ Links ]
3. A. La Rosa-Toro, R. Berenguer, C. Quijada, F. Montilla, E. Morallon, and J. L. Vázquez, Preparation and Characterization of Copper-Doped Cobalt Oxide Electrodes, J. Phys. Chem. B 2006; 110: 24021-24029 [ Links ]
4. Cano, Manuel. Diseño y Aplicación de Sensores Electroquímicos basados en Moléculas Orgánicas Conductoras. Departamento de Química Física y Termodinámica Aplicada. [Tesis Doctoral]. Universidad de Córdoba: España. 2008: 19- 22. [ Links ]
5. Cuervo, G. Efecto de la variación de la composición y del espesor de la membrana selectiva sobre el comportamiento de electrodos selectivos de contacto sólido para Pb2+. XXV Congreso de la Sociedad Mexicana de Electroquímica. México. 2010. [ Links ]
6. Guiquan Guo. Preparation and dispersive mechanism of highly dispersive ultrafine silver powder. Applied Surface Science. 2010; 256: 6683–6687 [ Links ]
7. Dobenik, D. A silver/silver sulphide selective electrode prepared by means of chemical treatment of silver wire. Acta Chim. Slov. 1998; 45(3): 209-216. [ Links ]
8. Maria Gismera. Desarrollo de Nuevos Sensores Potenciométricos para Metales basados en Receptores con grupos tio y ditio. Universidad Autónoma de Madrid: España. 2006: 3-7. [ Links ]
9. Lázaro, Osvaldo. Furoiltioureas: Naturaleza de sus complejos con CdCl2 y HgCl2 y su utilización en sensores electroquímicos. [Tesis Doctoral] Universidad de Cádiz. España. 2006: 25-26. [ Links ]
Recibido el 26-02-2014
Aprobado el 03-03-2014














