Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.80 no.4 Lima oct./dic. 2014
TRABAJOS ORIGINALES
Determinación de compuestos fenólicos, flavonoides totales y capacidad antioxidante en mieles peruanas de diferentes fuentes florales
Determination of phenolic compounds, total flavonoids and antioxidant activity in peruvian honey from different flower´s sources
Ana María Muñoz Jáuregui1; Carlos Alvarado-Ortíz Ureta2; Teresa Blanco Blasco2; Benjamín Castañeda Castañeda3; Julio Ruiz Quiroz4; Ángel Alvarado Yarasca3
1 Escuela de Ciencia de los Alimentos. Facultad de Farmacia y Bioquímica UNMSM. Jr. Puno 1002. Lima, Perú. amariamj@yahoo.es
2 Escuela de Postgrado. Universidad San Ignacio de Loyola
3 Instituto de Investigación. Facultad de Medicina Humana, USMP
4 Facultad de Farmacia y Bioquímica. UNMSM.
RESUMEN
Se realizó el estudio en doce mieles de diferentes marcas colectadas en supermercados de Lima, determinándose el contenido de compuestos fenólicos totales según Pérez et al, flavonoides totales por Zhishen et al, ensayo de 2-desoxi-D-ribosa por Sandoval et al, capacidad antioxidante por el método ABAP/ABTS, según Overveld et al., su efecto antioxidante sobre el anión superóxido según Bermúdez-Campos et al y contenido de fenólicos por HPLC según Muñoz et al. La miel silvestre del callejón de Huaylas tuvo mayor contenido (207,89 mg/100g) de fenólicos, mientras la multifloral de Piura, mayor contenido (3,839 mg QE/100g) de flavonoides totales y apigenina (1,799 ppm), pero menor inhibición del anión superóxido (53,21%), mientras la de eucalipto de la sierra central, mayor capacidad antioxidante por el método ABTS (68,452 μg TEAC / 100 g) y de inhibición del anión superóxido (64,73%). Por otro lado, la de Zapote en panal de Piura presentó menor contenido (0,914 mg QE/100g) de flavonoides totales, pero mayor inhibición (54,80%) de radical oxhidrilos y de clorogénico (0,866i mg/kg). Asimismo se encontró mayor contenido de ácido coumárico en la de algarrobo (1,572 ppm). Se concluyó que la miel contiene una gran capacidad antioxidante, relacionada al contenido de compuestos fenólicos, variando según su origen floral y procedencia.
Palabras clave: Fenólicos totales, flavonoides, miel, antioxidante
ABSTRACT
The study was realized in twelve different brands of honey collected from supermarkets in Lima, determining the content of total phenolic compounds according to Pérez et al, total flavonoids by Zhishen et al trial Desoxy-D-ribose by Sandoval et al, antioxidant capacity method ABAP / ABTS as Overveld et al., its antioxidant effect on superoxide as Bermudez- Campos et al and phenolic content by HPLC according to Muñoz et al. Wild honey Huaylas had higher content (207,89 mg / 100 g) of phenol, whereas the higher content from Piura multifloral (QE 3,839 mg / 100g) of total flavonoids and apigenin (1,799 ppm) but less inhibition of superoxide anion (53,21 %), while the central mountain eucalyptus higher antioxidant capacity by ABTS method (TEAC 68,452 mg / 100 g) and inhibition of superoxide anion (64,73%). Furthermore the honeycomb Zapote Piura showed less content (QE 0,914 mg / 100g) of total flavonoids but greater inhibition (54, 80%) of oxhidrilos radical and chlorogenic (0,866 mg / kg). Also higher content of coumaric found in carob (1,572 ppm). It was concluded that honey contains a high antioxidant capacity related to the content of phenolic compounds varies by floral source and origin.
Key words: Total phenolics, flavonoids, honey, antioxidant
INTRODUCCIÓN
La miel es un producto de la colmena preparado por las abejas a partir de sustancias azucaradas, el néctar y otros derivados de muchas plantas1. La miel se compone principalmente de los azúcares glucosa y fructosa, y su tercer componente más grande es agua. También contiene muchos otros tipos de azúcares, así como ácidos, proteínas y minerales2.
Los fitoquímicos son sustancias que se encuentran en los alimentos de origen vegetal, biológicamente activos; se encuentran en las plantas y son ampliamente investigados por los científicos por su promoción de la salud. La miel tiene una amplia gama de fitoquímicos, como los polifenoles, que actúan como antioxidantes3.
Los antioxidantes son sustancias nutritivas y no nutritivas que pueden retardar o inhibir la oxidación y/o neutralizar los efectos perjudiciales de los radicales libres. En los seres humanos, el estrés oxidativo está implicado en un número cada vez mayor de enfermedades crónicas, como las cardiovasculares y el cáncer. Mayor contenido de antioxidantes en el organismo podría ayudar a proteger contra el daño celular y el desarrollo de enfermedades crónicas. La investigación indica que la miel contiene numeros antioxidantes fenólicos y nofenólicos; la cantidad y tipo dependen, en gran medida, de la fuente floral de la miel. Mieles más oscuras son generalmente más altas en contenido de antioxidantes que las mieles más claras; se ha demostrado ser similares en la capacidad antioxidante al de las frutas y vegetales4. Los polifenoles y ácidos fenólicos encontrados en la miel varían de acuerdo a las condiciones geográficas y climáticas. Algunos de ellos fueron reportados como un marcador específico del origen botánico de la miel. Se ha encontrado diferencias considerables, tanto en la composición como en el contenido de compuestos fenólicos de las diferentes mieles florales5. Los principales metabolitos en las mieles son: pinobanksina, crisina, hesperetina, luteolina, 3- metil quercetina, isorramnetina, pinocembrina, dimetil cafeato, fenil etil cafeato, miricetina- 3,7,4',5'-metiléter, galangina, galangina-3-metiléter, tectocrisina, ácido elágico, 8- metoxikaempferol, apigenina, dimetilalil cafeato, quercetina, kaempferol, pinobanksin-3- acetato6.
PARTE EXPERIMENTAL
Muestra
Las muestras fueron colectadas de los supermercados de la capital (Lima-Perú) y almacenadas a temperaturas de refrigeración en el Centro de Investigación de Bioquímica y Nutrición.
Doce muestras de mieles fueron colectadas de diferente origen floral; entre ellas el algarrobo (Prosopis pallida), eucalipto (Eucalyptus globulus), faique (Acacia macracantha), zapote (Capparis angulata), vichayo (Capparis ovalifolia), pájaro bobo (Tesalia integrifolia), chilco (Bacharis Lanciolata), suelda y mano de ratón (tabla 1).
Reactivos
Ácido gálico, Folin-Ciocalteu, catequina, 1,1-diphenyl-2-picrylhydrazyl (DPPH), 2,2'- Azobis (2-methylpropionamidine) dihydrochloride (ABAP), 2,2'-Azino-bis (3-ethylbenzothiazoline- 6-sulfonic acid) (ABTS), 2-desoxi-D-ribosa, pirogalol; fueron obtenidos de Sigma (Sigma-Aldrich GmbH, Sternheim, Alemania).
Métodos de Análisis
Polifenoles totales
El contenido de polifenoles totales fue determinado mediante el método descrito por Pérez et al1. Se tomó de 0,5 a 0,6 g de miel aproximadamente; 25 μL del extracto fue mezclado con 450 μL de agua desionizada y 1500 μL de la solución A (1 % de SDS, 0,4 % NaOH, 2 % de Na2CO3, 0,16 % tartrato de sodio y potasio); a la solución A, se adicionó 1000 μL de CuSO4 al 4 %. La mezcla fue incubada a 37 ºC por 10 minutos. Luego se agregó 150 μL del reactivo Folin- Ciocalteu 0,2 N. La absorbancia fue medida a 750 nm y se utilizó ácido gálico como estándar de referencia.
Flavonoides totales
Los flavonoides totales fueron determinados por el método desarrollado por Zhishen et al7; una alícuota de 250 μL del extracto de la muestra fue mezclada con 1000 μL de agua desionizada; inmediatamente después se añadió 75 μL de NaNO2 y se dejó reaccionar 5 minutos. Posteriormente, 75 μL de AlCl3 al 10 % fue adicionado y 500 μL de NaOH 1 M. La mezcla fue centrifugada a 3500 r.p.m. durante 5 minutos. Los flavonoides totales fueron expresados en mg CAT/100 g de muestra. Las absorbancias fueron medidas a 510 nm.
Actividad antioxidante
Ensayo de DPPH
La actividad antioxidante se determinó mediante el método modificado por Brand-Williams et al.8; consistió en hacer reaccionar 50 mL de la dilución con 950 μL de DPPH a 100 μM. La actividad antioxidante de las mieles fue expresada como μg de vitamina equivalente (VCEAC) por 100 g de muestra. El tiempo de reacción fue de 5 minutos y los valores de absorbancia fueron registrados a 515 nm.
Ensayo de ABTS/ABAP
Las mediciones del potencial antioxidante por radical-trapping (TRAP) fue desarrollado por el ensayo ABAP/ABTS, usando el método descrito por Overveld et al.9. Los radicales ABTS+ fueron generados por descomposición termal del compuesto soluble en agua, 2,2'- azobis (2- amidopropano) hidrocloride (ABAP), generando un compuesto de color verde debido a la formación estable del radical catiónico 2,2'-azinobis (3-etilbenzotiazolino-6-ácido sulfónico) ABTS+. El producto de oxidación es medido a 414 nm. Los resultados fueron expresados como μg de trolox equivalente (TEAC) por 100 g de muestra.
Ensayo de 2-desoxi-D-ribosa
Para la determinación de captura del radical OH se usó el método utilizado por Sandoval et al10. Una cantidad de 200 μL de 2-desoxy-D-ribosa (2 mM), 200 μL de KH2PO4 (20 mM), 100 μL de FeCl3 (100 μM), 100 μl de EDTA (100 μM), 100 μl de H2O2 (1 mM), 100 μL de ácido ascórbico (100 μM) y 50 μL de muestra o estándar fueron mezclados. La reacción fue incubada por 2 horas a 37 ºC. Después de este tiempo se adicionó TBA al 1 % y se llevó a 100 ºC por 20 minutos. El producto color rosado generado por la reacción con TBA fue medido a 540 nm.
Ensayo del anión superóxido
Se acondicionó los métodos descritos por Bermúdez-Camps et al.11. El medio de reacción contenía un volumen final de 3 mL de las siguientes concentraciones finales: 1000 μL Tris-HCl de 50 mM a pH 8,2; 1000 μL EDTA a 1 mM, 500 μL de muestra y 500 μL de pirogalol a 1 mM. Los valores de absorbancia se registraron a 420 nm.
Determinación de compuestos fenólicos por HPLC
Se pesó 50g de miel, y se diluyó esa muestra hasta completar 250 mL con agua acidificada con HCl a pH 2. Las columnas cromatográficas se llenaron con amberlita, y se llevó a empaquetar con agua destilada; luego se lavó la columna con un flujo de 200 mL de agua destilada seguido por 100 mL de agua acidificada con HCl a pH 2, luego de lo cual se añadió 250 mL de muestra previamente filtrada, después de lo cual se agregó 150 mL de agua acidificada con HCl a pH 2 y luego se agregó 300 mL de agua destilada para retirar los azúcares de la muestra presentes en la columna con la amberlita empaquetada y obteniendo un pH neutro; finalmente, se añadió 300 mL de metanol p.a. para la extracción de compuestos fenólicos presentes en la muestra (miel o polen). Para finalizar el proceso y trabajar las siguientes muestras se lavó la columna con 100 mL de agua destilada seguido por 150 mL de agua acidificada con HCl a pH 2, y se continuó con el mismo proceso indicado anteriormente. Una vez extraído los compuestos fenólicos en los balones de vidrio de base plana, se llevó a evaporar en baño maría a 80 ºC hasta sequedad; luego ese residuo se disolvió con 5 mL de agua destilada y se extrajo los compuestos fenólicos con éter dietílico realizando el lavado tres veces en una pera de decantación; ese último extracto se evaporó a temperatura ambiente en una campana de extracción y el residuo obtenido se reconstituyó con 2 mL de metanol grado CG, para posteriormente ser analizadas en el HPLC.
RESULTADOS Y DISCUSIÓN
Los resultados obtenidos en todas las tablas fueron evaluados estadísticamente mediante análisis de varianza (ANOVA) y al ser significativo su análisis, se realizó el test de comparación múltiple, aplicando la prueba de Duncan (p<0,05), donde las letras iguales indican que son muestras estadísticamente similares, mientras que letras diferentes indican que son muestras estadísticamente diferentes.
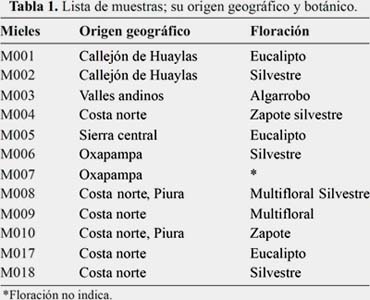
Contenido de polifenoles totales y flavonoides totales
En la tabla 2 se muestra el contenido de polifenoles totales en distintas muestras de miel expresado como ácido gálico (GAE) / 100 g muestra. La muestra 2 miel silvestre fue la que tuvo el mayor contenido de polifenoles totales, y la muestra 5 miel eucalipto la que tuvo menor contenido de polifenoles totales. El contenido hallado es superior a los encontrados por Muñoz y colaboradores6 en mieles chilena, cuyo valor máximo fue de 8,8mg/100g. Por otro lado, Vit y colaboradores determinaron polifenoles en mieles producidos por la abeja Tetragonisca fiebrigi de Argentina y Paraguay, cuyos contenidos de compuestos fenólicos fue un promedio de 240,7mg/100g y 148,3 mg/100g respectivamente.12
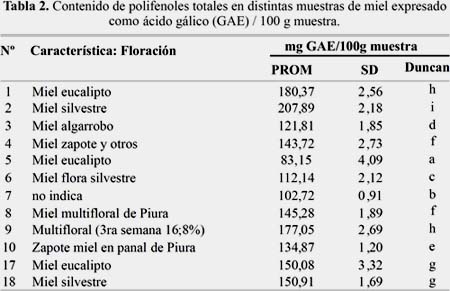
En la tabla 3 se muestra el contenido de flavonoides totales en distintas muestras de miel expresado como quercetina (QE) / 100 g muestra. El máximo contenido en mieles multifloral en Piura (3,83 mg QE/100g) fueron cercanos a los encontrados por Ciappini y colaboradores que arrojó valores promedio de : 3,28 ± 1,13 mg QE/100 g de miel de trébol, 3,95 ± 1,29 mg QE/100 g de miel de eucalipto y 3,63 ± 0,74 mg QE/100g para mieles de alfalfa13.
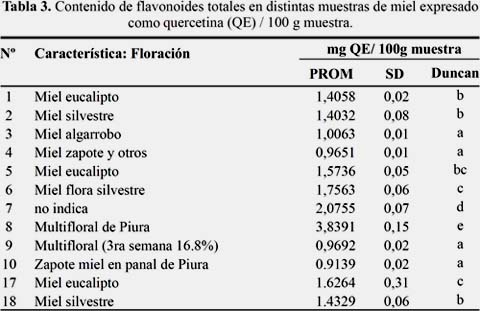
La muestra 8 miel multifloral fue la que tuvo el mayor contenido de flavonoides totales, y las muestras 3, 4, 9 y 10 (miel algarrobo, miel zapote y otros, multifloral-3ra semana 16,8% y miel de zapote en panal respectivamente) las que tuvieron estadísticamente menor contenido de flavonoides totales.
Ensayo de DPPH
En la tabla 4 se muestra la capacidad antioxidante medido por el ensayo de DPPH en distintas muestras de miel expresado como μg de vitamina C equivalente (VCEAC) / 100 g muestra.
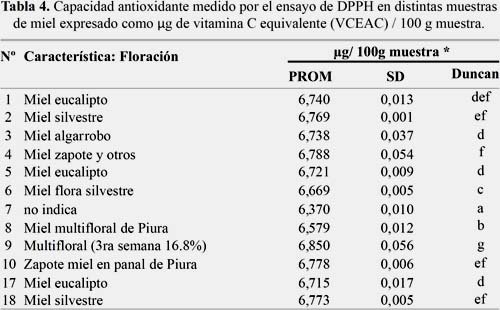
La muestra 9 multifloral (3ra semana 16,8%) fue la que tuvo la mayor capacidad antioxidante, y la muestra de Oxapamapa, la que tuvo menor capacidad antioxidante; ambas medidas por el ensayo DPPH expresado como μg de vitamina C equivalente (VCEAC) / 100 g muestra. Otros estudios encontrados por Ciappiani y col., determinaron valores de capacidad antioxidante por el ensayo de DDPH expresado en trolox (x=42,55 ± 33,19 mg TE/100 g) en mieles13.
Ensayo de ABTS/ABAP
En la tabla 5 se muestra la capacidad antioxidante medido por el ensayo de ABTS en distintas muestras de miel expresado como μg Trolox equivalente (TEAC) / 100 g muestra.
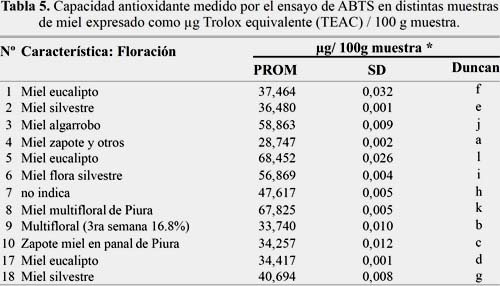
La muestra 5 miel de eucalipto fue la que tuvo la mayor capacidad antioxidante y la muestra 4 miel zapote y otros la que tuvo menor capacidad antioxidante; ambas medido por el ensayo ABTS en distintas muestras de miel expresado como μg Trolox equivalente (TEAC) / 100 g muestra. Otros estudios encontrado por Ciappiani13 y col; indican contenidos de 102,02 ± 44,69 μg TE/100 g).
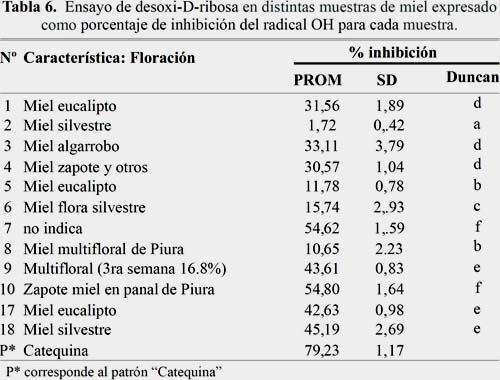
Ensayo de 2-desoxi-D-ribosa
En la tabla 6 se muestra el ensayo de desoxi-D-ribosa en distintas muestras de miel expresado como porcentaje de inhibición para cada muestra. Las muestras 7 y 10 fueron las que tuvieron estadísticamente el mayor porcentaje de inhibición (54,62 y 54,80% respectivamente), y la muestra 2 miel silvestre la que tuvo el menor porcentaje de inhibición; ambas medido por el ensayo 2-desoxi-Dribosa en distintas muestras de miel expresado como porcentaje de inhibición para cada muestra. Otros estudios realizados por Rodríguez y colaboradores en la miel proveniente de Apis miellifera, obtuvieron un mayor porcentaje de inhibición (62,73%)14.
Ensayo de anión superóxido
En la tabla 7 se muestra el ensayo de anión superóxido en distintas muestras de miel expresado como porcentaje de inhibición para cada muestra.
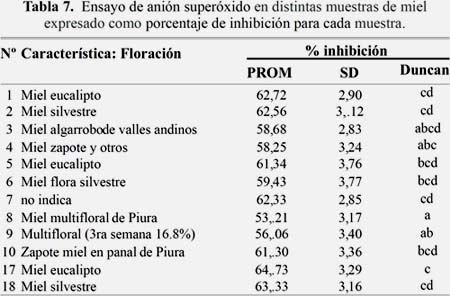
Las muestras 1, 2, 3, 5, 6, 10, 17 y 18 fueron las que tuvieron estadísticamente el mayor porcentaje de inhibición del anión superoxido, siendo la muestra 17 de eucalipto la de mayor inhibición (64,73 %) y las muestras 3, 4, 8 y 9 las que tuvieron, estadísticamente, el menor porcentaje de inhibición. Otros estudios realizados por Rodríguez y colaboradores obtuvieron un valor promedio de 69,06 % de inhibición en miel proveniente de Apis miellifera14.
Determinación de compuestos fenólicos por HPLC en mieles
En la tabla 8 se muestra el contenido de compuestos fenólicos: ácido clorogénico, siríngico, rutina, coumárico y apigenina en distintas muestras de miel expresado como mg/kg de muestra; letras distintas indican que son muestras estadísticamente diferentes, siendo para el contenido de ácido clorogénico (0,866 mg/kg) la muestra 10 quien tuvo estadísticamente el mayor contenido, y las muestras 1 y 2 las que tuvieron, estadísticamente, los menores contenidos; ambas para el contenido de ácido clorogénico (0,007 y 0,009mg/kg).
El contenido de ácido siríngico en la muestra 3 miel algarrobo (0,722 mg/kg) fue la que obtuvo estadísticamente el mayor contenido, y la muestra 2 miel silvestre la de menor contenido (0,018 mg/kg).
El contenido de rutina en la muestra 18 miel silvestre (0,121 mg/kg) fue la que obtuvo estadísticamente el mayor contenido, y la muestra 5 miel eucalipto (0,006 mg/kg) la de menor contenido.
El contenido de coumárico en la muestra 3 miel algarrobo (0,722 mg/kg) fue la que obtuvo estadísticamente el mayor contenido, y la muestra 2 (0,010 mg/kg) la de menos contenido.
El contenido de apigenina en la muestra 8 miel multifloral (1,799 mg/kg) fue la que obtuvo estadísticamente el mayor contenido, y la muestra de Oxapampa (0,027 mg/kg) la de menor contenido. Los flavonoides identificados en la miel son normalmente de los grupos de Flavanonas, flavononas y flavonoles, siendo importante la fuente de origen del néctar de la flor.
CONCLUSIONES
La miel silvestre del callejón de Huaylas tuvo mayor contenido (207,89 mg/100g) de fenólicos, mientras la multifloral de Piura mayor contenido (3,839 mg QE/ 100g ) de flavonoides totales y apigenina (1,799 ppm) pero menor inhibición del anión superóxido (53,21%).
La miel de eucalipto de la sierra central tuvo mayor capacidad antioxidante por el método ABTS (68,452 μg TEAC / 100 g) y de inhibición del anión superóxido (64,73%). La miel de zapote en panal de Piura presentó menor contenido (0,914 mg QE/100g) de flavonoides totales pero mayor inhibición (54,80%) de radical oxhidrilos y mayor contenido de clorogénico (0,866i mg/kg).
Asimismo, se encontró mayor contenido de coumárico en la de algarrobo (1,572 ppm). Se concluyó que la miel contiene una gran capacidad antioxidante relacionada al contenido de compuestos fenólicos, variando según su origen floral y procedencia.
AGRADECIMIENTOS
Loa autores agradecen a la facultad de Medicina Humana de la USMP y la Empresa Apiarios Llona y Bojórquez, por el soporte dado al desarrollo de la presente investigación.
BIBLIOGRAFÍA
1. Pérez E, Rodriguez-Malaver A, Vit P. Antioxidant capacity of Venezuelan honey in wistar rat homogenates. Journal of Medicinal Food 2006; 9: 510 – 516.
2. National Honey Board (NHB). Carbohydrates and the sweetness of honey. http://www.honey.com/downloads/carb.pdf. Release 10, 2009.
3. Jaganathan S, Mandal M. Antiproliferative effects of honey and of its polyphenols: A review. Journal of Biomedicine and Biotechnology 2009; doi:10.1155/2009/830616
4. National Honey Board.. Honey and antioxidants. National Honey Board Web site. http://www.honey.com/consumers/honeyhealth/nutritionresearch/antioxidants.asp. Release 10, 2009.
5. Amiot M, Aubert S, Gonnet M, Tacchini M. Les composés phénoliques des miels: étude préliminaire sur l'identification et la quantification par familles. Apidologie. 1989 ; 20 : 115 – 125.
6. Muñoz O, Copaja S, Speisky H, Peña R, Montenegro G. Contenido de flavonoides y compuestos fenólicos de mieles chilenas e índice antioxidante. Química Nova. 2007; 30: 848 – 851.
7. Zhishen J, Mengcheng T, Jianming W. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food Chemistry. 1999; 64: 555 – 559.
8. Brand-Williams W, Cuvelier M, Berset, C.. Use of a free Radical method to Evaluate Antioxidant Activity. Lebensm. Wiss. Tol. 1995; 28: 25-30.
9. Overveld FWPC, Haenen GRMM, Rhemrev J, Vermeiden JPW, Bast A.. Tyrosine as important contributor to the antioxidant capacity of seminal plasma. Chemico-Biological Interactions. 2000; 127(2): 151 – 161.
10. Sandoval M, Okuhama NN, Angeles FM. Técnicas de investigación para determinar la actividad antioxidativa y antiinflamatoria de plantas medicinales de la amazonía. 1st Internacional Workshop del 13 al 15 de agosto. Iquitos, Perú. 27 p. 2001.
11. Bermúdez-Camps I, Reyes-Hernández I, León-Fernández OS. Evaluación de la actividad antioxidante del propóleos de la región de Manzanillo. Provincia Granma. Cuba. IMBIOMED: Bioquímica. 2000; 25(3): 69 – 74.
12. Vit P, Gutierrez M, Rodriguez- Malaver J, Aguilera G, Fernández-Díaz C, Tricios A. Comparación de mieles producidas por la abeja yateí( Tetragonisca fiebrigi) en Argentina y Paraguay. Acta Bioquím Clín Latinoam. 2009; 43 (2): 219-26.
13. Ciappini M, Stoppani F, Martinet R, alvarez M. Actividad antioxidante y contenido de compuestos fenólicos y favonoides en mieles de tréboles, eucalipto y alfalfa. Rev. Cienc. Tecnol. 2013;15(19):45-51.
14. Rodríguez A, Pérez E , Vit, P. Capacidad antioxidante de mieles venezolanas de los géneros Apis, Melipona y Tetragonisca, evaluada por tres métodos. INHRR [online]. 2007[acceso 26de noviembre de 2014]; 38(2):[13-18]. Disponible en http://www.scielo.org.ve/scielo.php?pid=S0798-04772007000200002&script=sci_arttex
Recibido 21-11-2014
Aprobado 26-11-2014















