Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.80 no.4 Lima oct./dic. 2014
TRABAJOS ORIGINALES
Estudio de la cinética de biosorción de iones cadmio (II) en pectina reticulada proveniente de cáscaras de naranja
Kinetics study of cadmium (II) biosorption on crosslinked pectin from orange peels
Deysi Sánchez Sánchez1; Víctor García Villegas2; Andrea Yipmantin Ojeda1; Enrique Guzmán Lezama1,2; Neptalí Ale Borja2; Holger Maldonado García1,2
1 Facultad de Ciencias y Filosofía Alberto Cazorla Talleri. Departamento de Ciencias Exactas- Sección Química, Universidad Peruana Cayetano Heredia, Lima 31 deysi.sanchez@upch.pe
2 Facultad de Quim. e Ing. Quim., Universidad Nacional Mayor de San Marcos, Lima 1 vrgv03@gmail.com
RESUMEN
Se ha estudiado la cinética de biosorción de cadmio a 20°C en pectina extraída de cáscaras de naranja obteniéndose una capacidad de adsorción en el equilibrio, qe, igual a 99,56 mg/g en el rango de pH de 4,5-5,5. El material péctico fue extraído mediante hidrólisis ácida (pH: 1,5, temperatura: 90°C, tiempo: 30 min) y reticulado con formaldehído en medio ácido para disminuir su capacidad de hidratación e hinchamiento, así como impedir que se produzca la lixiviación del polisacárido al encontrarse en medio acuoso. Los datos experimentales de cinética de biosorción presentaron mayores coeficientes de correlación para el modelo matemático de pseudo segundo orden. Los parámetros fisicoquímicos: influencia de tamaño de partícula (125 μm - 500 μm y 0 μm - 125 μm) y concentraciones de biosorbente y metal en la solución, fueron evaluados en la cinética de biosorción. La constante de pseudo segundo orden, k2= 8,0x10-4 g.mg-1min-1, para el biosorbente con tamaño de partícula 125-500 μm, aumentó en 13,7% cuando la granulometría disminuyó a 0-125 μm, mientras que la qe se incrementó de 140,7 a 148,4 mg/g a las mismas condiciones. La concentración residual de plomo (II) en las soluciones se determinó mediante espectroscopía de absorción atómica. Para el procesamiento de datos y tratamiento estadístico se empleó el programa informático Origin 6.0, ajustándolos mediante regresión no lineal a los modelos de pseudo primer orden y pseudo segundo orden.
Palabras clave: Biosorción, pectina, cadmio, cinética, peseudo-primer orden, pesudo-segundo orden
ABSTRACT
Biosorption kinetics of cadmium (II) on cross-linked pectin extracted from orange peels at 20°C was studied, obtaining an equilibrium sorption capacity, qe, of 99.56 mg/g in pH range 4.5-5.5. Pectic material was extracted through acid hydrolysis (pH: 1.5, temperature: 90°C, time: 30 min) and crosslinked with formaldehyde acidic solution in order to diminish hydration capacity and swelling, as well as polysaccharide leaching when found in aqueous environment. Biosorption kinetics experimental data showed greater coefficients of correlation (R2) on pseudo second order mathematic model. Physical chemistry parameters: particle size influence (125 μm - 500 μm and 0 μm - 125 μm) and biosorbent and metal concentrations in solution were evaluated in the biosorption kinetics. Pseudo second order constant, k2 = 8.0x10-4 g.mg-1min-1, of biosorbent with particle size 125-500 μm increased in 13.7% as particle size decreased to 0-125 μm, meanwhile, qe increased from 140.7 to 148.4 mg/g at the same conditions. Lead (II) residual concentrations in solution were determined by atomic absorption spectroscopy. For data processing and statistic treatment of non-linear regression, Origin 6.0 informatics program was used.
Key words: Biosorption, pectin, cadmium, kinetic, pseudo-first order, pseudo-second order.
INTRODUCCIÓN
Actualmente, el aprovechamiento de los recursos hídricos de las cuencas hidrográficas en el Perú adolece de una planificación integral, provocando el deterioro de la calidad de este recurso, el cual se ve afectado por una descarga anual de 960,5 millones de metros cúbicos (MMC) de desagües sobre el agua superficial, subterránea y marina.1
Entre los contaminantes más comunes que afectan los diversos ecosistemas se encuentran los metales pesados provenientes de relaves mineros, la industria metal-mecánica, curtiembre, fotografía, entre otras.2 Como ejemplo se tiene la desaparición del camarón del río Locumba debido a la deposición de relaves mineros.1 Además de afectar el medioambiente, los metales pesados también perjudican seriamente la salud.3
El cadmio es un elemento peligroso, muy tóxico y causa gran daño medioambiental al no ser biodegradable.4 Es por ello que, debido a la necesidad de remover el ion cadmio de los efluentes industriales, se ha diseñado diversos métodos de tratamiento como los procesos de intercambio iónico, precipitación química, adsorción en carbón activado, entre otros. Sin embargo, la aplicación de tales procesos es a menudo restringida por limitaciones económicas. La biosorción de metales pesados es una de las tecnologías más prometedoras que intervienen en la eliminación de estos iones tóxicos de las aguas residuales al seguir procesos convencionales debido al bajo costo, porque se obtienen de materiales de desechos biológicos (bacterias, algas, hongos, alginatos y residuos agrícolas), la minimización del volumen de producto químico y/o lodos biológicos al ser biodegradables y no hay necesidad de nutrientes.
Estos desechos biológicos presentan biopolímeros estructurales, los cuales son responsables de la interacción con metales pesados, entre los cuales tenemos al quitosano, alginato, carragenanos, pectinas, entre otros. La pectinas están conformadas, principalmente, por polisacáridos aniónicos con unidades de ácido á–D–galacturónico, con grupos carboxílicos que tienden a desprotonarse en solución acuosa predominando la forma aniónica y dependiendo del pH del medio. Esto ocasiona que interactúe con especies cargadas positivamente, como es el caso de los metales. Esta alternativa de control para metales pesados en efluentes representa un método efectivo, económico y de gran rendimiento.
Capacidad de adsorción
La capacidad de adsorción se puede determinar mediante la siguiente relación:
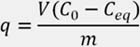
Donde:
q: Capacidad de adsorción (mg.g-1) V: Volumen de la solución (L) C0: Concentración inicial de plomo (ppm) Ceq: Concentración del residual de plomo en el equilibrio (ppm) m: Masa del biosorbente (g)
Cinética de biosorción
El estudio cinético del proceso de biosorción permite determinar la velocidad de fijación del soluto en el biosorbente en el tiempo. Se ha propuesto que este proceso ocurre en dos fases: una de forma rápida y otra donde la velocidad disminuye hasta alcanzar el equilibrio.5,6
El mecanismo cinético es bastante complejo ya que puede involucrar reacciones o interacciones entre grupos funcionales del biosorbente y del soluto. Además, hay que tener en cuenta los procesos de transferencia de materia, tales como transporte de especies en el seno de la fase líquida hasta la superficie del sólido.5,6
Modelo de pseudo primer orden (Largegren, 1898)
Este modelo asume la biosorción como una reacción de primer orden en cada uno de sus reactantes a partir de:
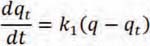
Al resolver la ecuación diferencial tomando en cuenta los límites de integración desde t = 0 hasta t = t se tiene:
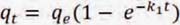
Donde:
qe: Cantidad de soluto adsorbido en el equilibrio por unidad de masa de adsorbente, (mg.g-1). qt: Cantidad de soluto adsorbido en el equilibrio por unidad de masa de adsorbente al tiempo t, (mg.g-1). k1: Constante de velocidad de pseudo primer orden, (min-1).
La constante k1 se puede determinar por análisis de regresión no lineal de la gráfica: qtvs t.
Modelo de pseudo segundo orden
Este modelo fue desarrollado por Ho y McKay y dado a conocer en 1999. En él se supone que el adsorbato se adsorbe en dos sitios activos de la biomasa.7
En este caso, la ecuación de velocidad de la cinética de adsorción se expresa como:6
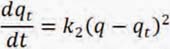
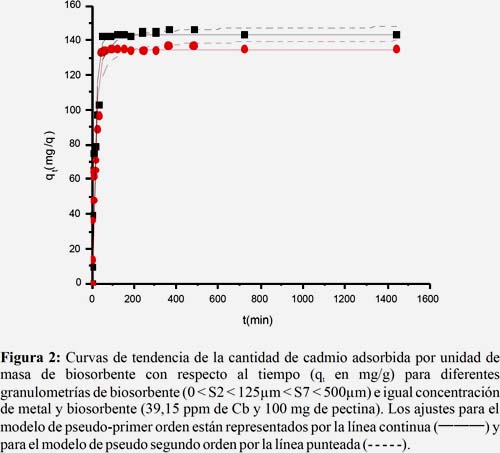
Al resolver la ecuación diferencial tomando en cuenta los límites de integración desde t = 0 hasta t = t se obtiene:
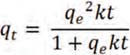
Donde:
k2: Constante de velocidad de pseudo segundo orden, (g.mg-1.min-1).
Las constantes k2 y qeq se pueden determinar por análisis de regresión no lineal de la gráfica: qt vs t.
El objetivo de este trabajo fue encontrar el pH óptimo y el modelo matemático que represente mejor la cinética de biosorción de plomo en pectina reticulada extraída de cáscaras de naranja.
PARTE EXPERIMENTAL
Obtención de la pectina:
El aislamiento del material péctico fue realizado mediante el método de hidrólisis ácida (pH 1,5 y temperatura igual 90 °C), utilizando solución de ácido clorhídrico como agente extractante.7
Reticulación:
Los polímeros reticulados presentan una gran estabilidad frente a la temperatura y el pH. La reticulación se realizó a 50 ºC en presencia de H2SO40,1 M y de formaldehído.8
Obtención del pH óptimo para la biosorción de Cd2+
Se preparó 2L de solución de 42,25 ppm de Cd+2 empleando Cd(NO3)2 y se vertió en 10 frascos de vidrio hasta un volumen de 100mL ajustando cada muestra a diferentes pH (1,5; 2,0; 2.5; 3,0; 3,5; 4,0; 4.5; 5,0; 5,5 y 6,0). Se añadió 25 mg de biosorbente (material péctico reticulado, 0 μm -125 μm) a cada muestra y se colocó, seguidamente en el agitador orbital (Barnstead/Lab-line, MaxQ 4000) a 250 rpm, durante 72 h y a temperatura ambiente. Una vez transcurrido el tiempo, el biosorbente fue separado de las muestras; se filtró y se midió el pH final de las soluciones y se procedió a preservarlas con una gota de HNO3 1:1. La concentración residual de cadmio (ce) en dichas soluciones fue determinada mediante la técnica de espectrometría de absorción atómica de llama.
Cinética de biosorción de Cd (II)
Para el estudio cinético, considerando el tamaño de partícula, se preparó 2 soluciones de 1L de Cd(II) de 39,15 ppm ajustando al pH óptimo (pH 5,5); se agregó 100 mg de biosorbente (0 - 125 ìm/L y 125 - 500 ìm/L en cada caso) y se puso en agitación magnética durante 48h. Seguidamente se procedió a registrar el tiempo de reacción, considerando t = 0 el instante en que el biosorbente se pone en contacto con la solución. A partir de t = 0 se tomó muestras de 10 mL periódicamente hasta t = 2880 min. Finalmente, se determinó la concentración de plomo (c ) para cada muestra mediante la técnica de Espectrometría de absorción atómica de llama t (equipo modelo Perkin Elmer AAnalyst 100).
Para el estudio de la cinética con diferentes concentraciones de metal se preparó tres soluciones de 1L de sal de cadmio (II) de 19,28; 39,15 y 70,97 ppm ajustando al pH óptimo (pH 5,5) y luego se agregó 100 mg de biosorbente (0 - 125 ìm/L) a cada solución. La cinética de biosorción fue determinada para cada sistema de la misma forma que se describe en el análisis cinético considerando diferente tamaño de partícula.
En el estudio cinético con diferentes cantidades de biosorbente se preparó tres soluciones de 1L de sal de cadmio (II) de 38,68 ppm ajustando al pH óptimo (pH 5,5) y se agregó 150, 250 y 350 mg de biosorbente (0 - 125 ìm/L) a cada vaso, respectivamente. La cinética de biosorción fue determinada de la misma forma que se describe en los dos casos anteriones.
Procesamiento de datos
Los datos experimentales fueron procesados ajustándolos a modelos de regresión no lineal, utilizando el programa Origin 6.0.
RESULTADOS Y DISCUSIÓN
La figura 1 muestra la disminución del pH después de producirse la quelación con el metal debido a la desprotonación de grupos carboxílicos del ácido galacturónico desde el momento en que se ponen en contacto con el medio acuoso. El pH en donde se produce la mayor adsorción, 4,5-5,5, se debe al aumento de grupos carboxílicos en su forma aniónica. La disminución del pH a valores más bajos del pH inicial se hace menos considerable debido a que el exceso de iones H+ en la solución desplaza el equilibrio hacia la forma protonada de los grupos carboxilo.9 Sin embargo, a pH 6, y posiblemente a pH superiores, se observa un decrecimiento en la cantidad de metal adsorbido, lo cual puede ser atribuido a la presencia de especies hidratadas del metal, a los cambios en la carga de la superficie de la pectina o a la precipitación de la sal correspondiente del metal.10 Por ello, el pH seleccionado como óptimo fue de 5,5, con una capacidad de adsorción, q, de 99,56 mg/g.
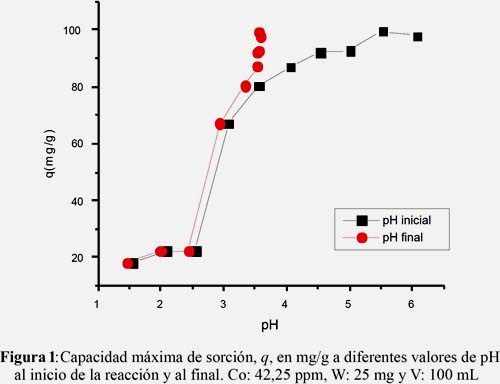
En la figura 2 se observa que al comparar los estudios cinéticos de biosorción utilizando diferentes tamaños de partícula se obtiene mayor rendimiento para sistemas con partículas de menor tamaño. Según Pérez-Marín et al.11, el tamaño de partícula no influye en la biosorción de metales. Sin embargo, Muñoz12 encontró que para la absorción de Pb(II) la capacidad de biosorción aumenta conforme disminuye el tamaño de partícula, debido a la presencia de una mayor área superficial para formar enlaces con el biosorbente. Por otro lado, Volesky13,14 explica que las partículas de mayor tamaño presentan una mejor sorción debido a que tienen una mayor transferencia de masa dentro de las partículas del sorbente. Sin embargo, cuando el proceso de adsorción de los iones de un metal se da a nivel de la superficie de la partícula, se observa una mejor adsorción en partículas más pequeñas.
Como se observa en la tabla 1, los valores de R2 de los datos experimentales obtenidos en la cinética de biosorción comprueban que presentan un mejor ajuste para el modelo de pseudo segundo orden para S2 y S7. La constante de pseudo segundo orden, k2 = 8,0x10-4 g.mg-1min-1, para S7 aumentó en 13,7% cuando la granulometría disminuyó a 0-125 μm, mientras que la q e se incrementó de 140,7 a 148,4 mg/g a las mismas condiciones.

En la figura 3 se observa que el tiempo de contacto entre el cadmio (II) y el biosorbente para alcanzar el equilibrio fue mayor (cerca de 200 min) cuando se trabajó con concentraciones iniciales de cadmio iguales a 70,97 ppm; sin embargo, para concentraciones más bajas (40- 20ppm) el tiempo se redujo hasta cerca de 45 minutos, aumentando la constante de velocidad, k2, con respecto a S3 en factores de 4 y 20, respectivamente, como se muestra en la tabla 2 debido, posiblemente, a que existe una menor población de iones que migran hacia el biosorbente. Cabe decir que, a concentraciones más altas, todos los iones de cadmio presentes en solución pueden interactuar con los sitios de unión, logrando de esta manera la saturación del biosorbente y alcanzar su capacidad máxima de adsorción. Por otro lado, a concentraciones más bajas, fue menor el rendimiento de biosorción porque, probablemente, no se llegó a alcanzar la saturación de los sitios activos para aprovechar el máximo rendimiento.15 Los coeficientes de determinación, R2, de los datos experimentales también comprueban que S1, S2, S3, S4, S5 y S6 presentan un mejor ajuste para el modelo de pseudo segundo orden. Entre los sistemas con iguales concentraciones de metal S4, S5 y S6, el que presentó mayor saturación del biosorbente con los iones metálicos fue el de menor cantidad de material péctico, S4 (alrededor de 80mg/g). Esto se debe a que hay menor disponibilidad de los sitios de unión para la formación de complejos de iones metálicos. Sin embargo, la capacidad de adsorción en el equilibrio, qe, se redujo con el incremento de la cantidad de biosorbente (alrededor de 60mg/g), aumentando k2 con respecto a S4 en factores de 4,5 y 5,5, pudiéndose atribuir a la superposición o agregación de sitios en el biosorbente que disminuyen el área superficial total y aumentan la longitud de la trayectoria de difusión.15,16
CONCLUSIONES
La capacidad de adsorción de cadmio en pectina reticulada correspondió al rango de pH 4,5- 5,5, lo cual se explica porque en este rango ocurre una desprotonación dejando libre los grupos carboxilos para la sorción del metal.
A partir del procesamiento de datos se observó que el ajuste no lineal para el modelo de pseudo-segundo orden presenta coeficientes de correlación más altos, en comparación del modelo de pseudo-primer orden.
Al usar un menor tamaño de partícula (0 - 125 μm) se obtiene una mayor disminución de la concentración inicial de cadmio en la solución y una mayor capacidad de adsorción del biosorbente (148,4 mg/g), debido a un incremento en el área superficial. Mientras que a concentraciones bajas de cadmio en la solución, se obtienen menores rendimientos en la biosorción en pectina, sin embargo, aumenta la velocidad de quelación con el metal.
AGRADECIMIENTOS
Los autores agradecemos al Departamento de Ciencias Exactas-Sección Química de la Facultad de Ciencias y Filosofía Alberto Cazorla Talleri de la Universidad Peruana Cayetano Heredia y al Departamento de Química Analítica de la Facultad de Química e Ingeniería Química de la Universidad Nacional Mayor de San Marcos por el apoyo brindado en la presente investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Agricultura. Sector agrario: hidrometeorología. Problemática. [Monografía en internet]. [Consultado el 24 de marzo del 2013]. Disponible en: http://www.minag.gob.pe/portal/sector-agrario/hidrometeorolog%C3%ADa/cuencase-hidrograf%C3%ADa/problem%C3%A1tica
2. Pacheco, M., Pimentel, J. & Roque, W.. Cinética de la bioadsorción de iones cadmio (II) y plomo (II) de soluciones acuosas por biomasa residual de café (Coffea arabical). Revista Sociedad Química del Perú 2010; 76 (3): 279 - 292.
3. El Comercio. Huánuco: 15 niños intoxicados con plomo, cadmio y arsénico van a lima. [Noticia en internet]. Publicado 18 de enero del 2012. [Consultado el 24 de marzo del 2013]. Disponible en: http://elcomercio.pe/peru/1362403/noticia-huanuco-15-ninosintoxicados-plomo-cadmio-arsenico-van-lima
4. Ulmanu, M., Marañón, E., Fernández, Y., Castrillón, L., Anger, I & Dumitriu, D. Removal of copper and cadmium ions from diluted aqueous solutions by low cost and waste material adsorbents. Water, air, and soil pollution 2003; 142(1-4): 357–373.
5. Siccha, Al. Eficacia de la biosorción de Plomo mediante cochayuyo pre-tratado (Chondracanthus chamissoi). Universidad Nacional del Callao. Facultad de Ciencias de la Salud Escuela Profesional de Enfermería 2012.
6. Pinzón-Bedoya, M. & Vera Le. Modelamiento de la cinética de bioadsorción de Cr (III) usando cáscara de naranja. Revista DYNA 2009; 76(160): 25 -106.
7. Devia, J. Proceso para producir pectinas cítricas 2003; Universidad Eafit. 129
8. García, V., Yipmantin, A., Guzmán, E., Pumachagua, R. & Maldonado, H. Estudio de la cinética de biosorción de iones plomo en pectina reticulada proveniente de cáscaras de cítricos. Revista de la Sociedad Química del Perú 2011; 77: 173- 181
9. Yu, Q. & Kaewsarn, P. A Model for pH Dependent Equilibrium of Heavy Metal Biosorption. Korean Journal of Chemistry Engineering 1999; 16(6): 753-757.
10. Blázquez, G., Hernáinz, F., Calero, M. & Ruiz-Núñez, L. Removal of cadmium ions with olive stones: the effect of somes parameters. Process Biochemistry 2005; 40: 2649–2654.
11. Pérez-Marín, A., Zapata, V., Ortuño, J., Aguilar, M., Sáez, J. & Lloréns, M. Removal of cadmium from aqueous solutions by adsorption onto orange waste. Journal of hazardous materials 2007; 139(1): 122-131.
12. Muñoz, J. Biosorción de plomo (II) por cáscara de naranja Ctrus cinensis pretratada. Universidad Mayor de San Marcos. Facultad de Química e Ingeniería química 2007.
13. Volesky, B. Sorption and Biosorption. BV-Sorbex, Inc. St .Lambert, Quebec, Canada 2004.
14. Volesky, B. Biosorption of heavy metals. CRC Press 1990.
15. Beena, S., King, P. & Prasad, V. Biosorption of copper from aqueous solution by Chaetomorpha antennina algae biomass. Iranian Journal of Environmental Health Science & Engineering 2011; 8(4): 353- 362.
16. Jaikumar, V. & Ramamurthi, V. Effect of Biosorption Parameters Kinetics Isotherm and Thermodynamics for Acid Green Dye Biosorption from Aqueous Solution by Brewery Waste. International journal of chemistry 2009; 1(1): 2-12.
Recibido 22-10-2014
Aprobado 25-11-2014
















