Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.81 no.2 Lima abr./jun. 2015
TRABAJOS ORIGINALES
Preparación, caracterización y evaluación de la estabilidad electroquímica de electrodos Ti/Co3O4- xIrO2
Preparation, characterization and electrochemical stability evaluation of Ti/Co3O4-xIrO2 Electrodes
Wilner Valenzuela Barrientos1; Adolfo La Rosa-Toro Gómez1,*
1 Laboratorio de Electroquímica Aplicada, Facultad de Ciencias, Universidad Nacional de Ingeniería. Av. Túpac Amaru 210, Rímac.
* toro@uni.edu.pe
RESUMEN
La espinela de cobalto es un buen material para la fabricación de electrodos destinados a la oxidación electroquímica de colorantes tipo azo; sin embargo, presenta baja estabilidad electroquímica en electrolitos que contienen cloruros, sufriendo severa corrosión. El presente trabajo se enfoca en la preparación y evaluación de electrodos de espinela de cobalto dopados con óxido de iridio, soportado sobre lámina de titanio, Ti/Co3O4-xIrO2 y su evaluación como electrodos estables a la corrosión por cloruros. Para evaluar la influencia del contenido de IrO2 en la espinela de cobalto a la estabilidad electroquímica, se preparó electrodos dopándolos con 1,25%; 2,5% y 5,0% (porcentaje atómico) de iridio. Los electrodos preparados fueron caracterizados utilizando las técnicas de voltametría cíclica (VC), microscopía electrónica de barrido (SEM), microanálisis de energía dispersiva (EDX) y difracción de rayos X (DRX). Para evaluar la estabilidad de los electrodos se sometió a electrólisis en una solución de cloruro de sodio al 6% (w/v), a temperatura ambiente, manteniendo un pH de 5,8 y a una intensidad de corriente de 0,5A.cm-2. Los resultados mostraron que los electrodos incrementaron su estabilidad electroquímica en relación al aumento del contenido de IrO2 en la espinela de cobalto.
Palabras clave: Electrodos de espinela, espinela de cobalto dopado de iridio, evaluación de la estabilidad electroquímica,
ABSTRACT
Cobalt spinel is a good material for the manufacture of electrodes for the electrochemical oxidation of azo dyes; however, it has poor electrochemical stability in electrolytes with chlorides ion, suffering severe corrosion. This work focuses on the preparation and evaluation of spinel cobalt electrode doped with iridium oxide supported on titanium foil, Ti/Co3O4-xIrO2 and their evaluation as stable to corrosion by chloride electrodes. The influence of IrO2 into cobalt spinel electrode was evaluate, the spinel was doped with 1,25%; 2,5% and 5,0% (atomic percent) iridium. The electrodes were characterized using cyclic voltammetry techniques (VC), scanning electron microscopy (SEM), energy dispersive microanalysis (EDX) and X-ray diffraction (XRD). The test of the stability of the electrodes was subjected to electrolysis in a solution of sodium chloride to 6% (w/v), at room temperature, maintaining pH 5,8 and a current of 0,5A.cm-2. The results showed that the electrodes increased their electrochemical stability relative to IrO2 increased content of cobalt in the spinel.
Key words: Spinel electrodes, spinel doped iridium oxide, electrochemical stability test
INTRODUCCIÓN
La destrucción de contaminantes de las aguas mediante oxidación electroquímica se presenta como una técnica limpia y prometedora en el tratamiento de efluentes industriales, debido principalmente a la posibilidad de la reutilización de las aguas, asociado a los bajos costos de operación de la técnica. En muchos casos, el objetivo de los procesos de oxidación no es la mineralización completa de los compuestos orgánicos contaminantes, sino la transformación de dichos contaminantes en sustancias biodegradables, de tal modo que el tratamiento biológico posterior sea posible y asegure la completa descontaminación del agua, empleando tecnologías amigables con el medio ambiente, evitando problemas de ecotoxicidad1. Este proceso elimina el color de las aguas mediante la oxidación de los azocompuestos, permitiendo plantear un sistema de reúso o reciclaje de las aguas utilizadas con el consiguiente ahorro en el costo del proceso. Publicaciones previas muestran al electrodo de espinela de cobalto como un buen material anódico en los procesos de electro-oxidación de colorantes tipo azo; sin embargo, presentan el inconveniente de su baja estabilidad frente a la corrosión por cloruros y a las reacciones de electro-oxidación en medio ácido2; a pesar de ello es una buena alternativa para procesos de electro-oxidación en medio alcalino. Publicaciones previas han reportado una estabilidad aproximada de 500 A-h.cm-2; no obstante, esta propiedad cambia drásticamente en procesos de oxidación electroquímica de cloruros3,4, bajando a 11,5 A-h.cm-2. En el presente trabajo se busca mejorar las propiedades de estabilidad de los electrodos de espinela de cobalto frente a la corrosión por cloruros, dopando la espinela de cobalto con cantidades controladas de IrO2. El óxido de iridio presenta características de alta estabilidad frente a diferentes medios y se sugiere su uso para sistemas de electrólisis con bajas concentraciones de cloruro, donde el alto sobrepotencial de oxígeno es beneficioso5.
Para evaluar la estabilidad frente a la corrosión por cloruros, los electrodos fueron sometidos a un proceso anódico de electrólisis en una solución de cloruro de sodio al 6% (w/v), a temperatura ambiente, a un pH de 5,8 y a una intensidad de corriente de 0,5A.cm-2 que es un valor 200 veces mayor a la intensidad de corriente empleada en las condiciones de trabajo normales
PARTE EXPERIMENTAL
Preparación de los electrodos
Se utilizó titanio como soporte de los óxidos metálicos para conformar los respectivos electrodos. El titanio fue seleccionado debido a su alta estabilidad química, electroquímica y térmica; además, en el proceso electrolítico funciona como "metal válvula"6,7.
Los electrodos fueron preparados humedeciendo una brocha con la solución precursora e impregnando una lámina de titanio previamente tratado y su posterior descomposición térmica en un horno.
Pre-tratamiento del soporte
Se utilizó una lámina de titanio 99,99%, cortada en forma rectangular de 5,0 x 0,5 cm. El soporte fue pulido con papel abrasivo #200, #400 y #1200, sucesivamente; posteriormente se desengrasó con acetona y se secó. El tratamiento químico de corrosión se realizó con una solución de ácido oxálico al 10% w/v a ebullición durante 60 minutos. El pre-tratamiento elimina la capa superficial de la lámina de titanio y aumenta la rugosidad superficial del metal proporcionándole una mejora en la adhesión del óxido. Una vez finalizada esta etapa se enjuagó con abundante agua destilada iniciándose inmediatamente el proceso de impregnación y tratamiento térmico 8-10
Preparación de las soluciones precursoras
La solución precursora de cobalto fue preparada utilizando Co(NO3)2.6H2O; la sal fue disuelta en etanol hasta lograr una concentración de 1,0M; se acidificó ligeramente con HNO3 para asegurar la completa solubilidad de las sales9,10; la solución precursora de sal de iridio fue preparada utilizando IrCl3.xH2O, la cual fue disuelta en 25% de HCl y luego evaporada casi hasta sequedad. El material resultante fue diluido en alcohol isopropílico para formar la solución final11,12. En la tabla 1, se muestra las concentraciones nominales de las soluciones precursoras.
Impregnación y calcinación
El proceso se desarrolló de acuerdo al orden de las siguientes etapas:
-
Impregnación de la solución sobre el soporte.
-
Secado en estufa a 80°C por 5 minutos.
-
Tratamiento térmico a 350 °C por 10 minutos.
-
Enfriado y repetición de todo el proceso.
-
Calcinación final a temperatura seleccionada para cada tipo de electrodo
Los electrodos de espinela de cobalto fueron calcinados a 350°C11, en tanto los electrodos de espinela de cobalto dopados con óxido de iridio e iridio puro se calcinaron a 400°C12; en ambos casos el tratamiento térmico final fue de una hora con la finalidad de conseguir la descomposición total de las sales precursoras y homogenizar el óxido formado13.
Caracterización de los electrodos
El agua utilizada para la preparación de las soluciones soporte se obtuvo de un sistema MILLIPORE MILLI Q PLUS con una resistividad de 18,2MΩ.cm, medida en línea a 25ºC. Como electrolitos soporte fueron empleados soluciones de H2SO4 y de NaOH. Las soluciones ácidas fueron preparadas a partir de los respectivos ácidos concentrados. La solución de NaOH se preparó utilizando granallas de NaOH y se burbujeó nitrógeno durante 10 minutos antes de iniciar las pruebas.
RESULTADOS Y DISCUSIÓN
Voltametría cíclica del electrodo Ti/Co3O4 en NaOH 0,5M
En la figura 1 se muestra el voltagrama estabilizado del electrodo de espinela de cobalto, Ti/Co3O4 en el rango de potencial entre 0,0 y 0,58V; se utilizó un electrodo reversible de Ag/AgCl como electrodo de referencia y un alambre de platino como contra electrodo.
El gráfico nos muestra un perfil voltamétrico característico de los electrodos de espinela de cobalto. En el barrido anódico se muestra la presencia de dos picos de transición rédox: el primero ubicado a un potencial de 0,2 V y el segundo a un potencial más anódico y de mayor intensidad, a 0,52 V; ambos picos poseen sus correspondientes picos de reducción a 0,18 V y 0,48 V, respectivamente. Los referidos picos pueden relacionarse a dos procesos de oxidación-reducción atribuido al cambio de estado de oxidación de los óxidos de cobalto. El primer pico puede relacionarse con la transformación de Co(II) Co(III) , y el segundo a la transformación de Co(III) Co(IV), respectivamente. Sin embargo, la asignación del primer proceso rédox (A) es ambiguo y se ha asociado a las siguientes reacciones13:

El segundo proceso rédox (B) se puede asociar a la siguiente reacción:
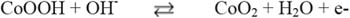
A potenciales mayores a 0,58 V ocurre la formación de oxígeno molecular13
Voltametría cíclica del electrodo de Ti/IrO2 en H2SO4 0,5M y NaOH 0,5M
En la figura 2A se muestra el voltagrama estabilizado del electrodo de óxido de iridio, Ti/IrO2 en medio ácido (H2SO4 0,5M), con un rango de potencial comprendido entre 0,2 y 1,1 V. En el barrido anódico, se observa la formación de dos picos de oxidación: el primero ubicado a un potencial de 0,6 V y el segundo a un potencial más anódico, a 0,92V; ambos picos poseen sus correspondientes picos de reducción a 0,55V y 0,88V, respectivamente. El primer pico puede relacionarse con la transformación de Ir(III) Ir(IV), y el segundo a la transformación de Ir(IV) Ir(V), respectivamente14,15
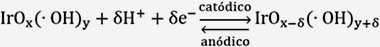
En la figura 2B se muestra el voltagrama estabilizado del electrodo de óxido de iridio, Ti/IrO2 en medio básico (NaOH 0,5M), con un rango de potencial comprendido entre 0,0 y 0,58V, Los picos de óxido-reducción mostrados en la voltametría cíclica del óxido de iridio en medio ácido (H2SO4 0,5M) son desplazados a potenciales menos positivos debido al incremento del pH de la solución16. En el voltagrama no se observa la presencia de picos de óxido-reducción. A potenciales más anódicos que 0,48V se inicia la formación de oxígeno molecular.
2H2 O(l)→ 4H+(aq)+O2(g)+4e-
Voltametría cíclica de los electros de Co3O4+xIrO2 en NaOH 0,5M
En la figura 3 se muestra el voltagrama estabilizado de los electrodos de espinela de cobalto dopados con óxido de iridio, Ti/Co3O4+xIrO2 Co (1,25%, 2,5%, 5,0%), en el rango de potencial entre 0,0 y 0,58V. Se utilizó un electrodo reversible de Ag/AgCl como electrodo de referencia y un electrodo de platino como contra electrodo.
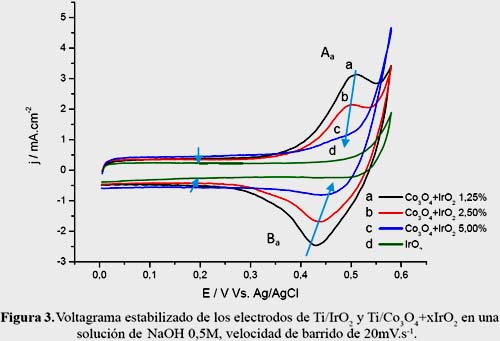
En el voltagrama se puede observar que la corriente de la región anódica correspondiente a los picos Aa, Ba decrece ligeramente conforme se incrementa el porcentaje de óxido de iridio en el electrodo. Es posible que la presencia, cada vez mayor, de iridio sobre la superficie del electrodo actúe bloqueando progresivamente la superficie de los sitios activos de la espinela impidiendo el proceso de transición rédox Co(II)/Co(III) y Co(III)/Co(IV).
Caracterización por difracción de rayos X
El análisis de difracción de rayos X (DRX) de los electrodos, se realizó utilizando un difractómetro modelo Bruker D8-Advance con una potencia de 3000W, energía de 40KV y corriente de 40mA; además, se utilizó la base de datos de JCPDS; el barrido angular fue de 1º/min (grados/minuto), STEP (tamaño del paso en ángulos) = 0,05º, y preset time (tiempo de parada en segundos) = 3s.
DRX de los electrodos de Co3O4 e IrO2
En la figura 4 se presenta los difractogramas del electrodo de A) espinela de cobalto y B) óxido de iridio, respectivamente. En el primer difractograma se observa, A) picos de difracción muy bien definidos del electrodo de espinela de cobalto y en B) estructura tipo rutilo del electrodo de óxido de iridio indicando que se ha logrado sintetizar los referidos óxidos y que la temperatura del tratamiento térmico es la adecuada para la descomposición completa de las sales precursoras.
DRX de los electrodos de Co3O4 + xIrO2
En la figura 5 se muestra los difractogramas de los electrodos de espinela de cobalto dopado con óxido de iridio
Todos los picos de difracción de rayos X muestran perfiles bien definidos para la estructura de espinela; los picos más intensos corresponden al soporte de titanio metálico; los picos de difracción del óxido de iridio, presente en la mezcla, no son evidentes, posiblemente por su alta dispersión y baja concentración en la mezcla de óxidos. El ambiente químico en el proceso de cristalización puede haber afectado el tamaño de partícula acercándose a la condición amorfa del material reflejándose en la inexistencia de picos de difracción. Por otro lado, la temperatura de descomposición térmica de las sales precursoras es dependiente de la naturaleza química y tipo de solvente empleado; valores de temperatura de calcinación de 390-600ºC han sido reportados en la literatura para la preparación de IrO2 17, estos valores se modifican de acuerdo al tipo de mezcla de los óxidos18.
Microscopía electrónica de barrido con energía dispersiva de rayos X
Los análisis de microscopía electrónica se realizaron utilizando un microscopio electrónico de barrido modelo HITACHI S-3000N; el equipo tiene un detector de electrones secundarios tipo centelleador-fotomultiplicador con resolución de 3,5nm, un detector de electrones retrodispersados tipo semiconductor con resolución de 5nm y un detector de rayos X tipo XFlash 3001 de Bruker para microanálisis (EDX) y mapping, capaz de detectar elementos de número atómico comprendido entre 12 y 92.
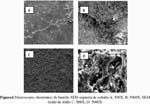
En la figura 6 se muestra las imágenes SEM de la superficie de espinela de cobalto y óxido de iridio con un aumento de 500X y 5000X, respectivamente. En la micrografía 6A-6B se observa una morfología del tipo liso y homogénea, mientras que con un aumento de 5000X la imagen muestra pequeñas grietas sobre la superficie homogénea del recubrimiento. En las imágenes SEM de la figura 6C, para un aumento de 500X, se observa una superficie rugosa, con presencia de cúmulos y pequeños hoyos distribuidos al azar sobre toda la superficie. A un aumento de 5000x (figura 6D) la imagen confirma la presencia de cúmulos y hoyos sobre la superficie del electrodo.
La figura 7 muestra las imágenes SEM para el recubrimiento de espinela de cobalto dopado con óxido de iridio a tres diferentes niveles de dopado. Se puede observar el cambio de la morfología superficial del recubrimiento a medida que aumenta el porcentaje de dopado. En la figura 7 A y B (1,25% de óxido de iridio) se observa el tránsito de una morfología rugosa a una morfología con tendencia a la cristalización. La figura 7 C y D (2,5% de óxido de iridio), nuestra el cambio a una morfología mucho más compacta y cristalina con intersticios. En las figuras 7 E y F (5,0% de óxido de iridio) se observa una superficie más compacta y continua.

La composición real de los recubrimientos sobre cada uno de los electrodos fue determinada por microanálisis de EDX. El promedio de la composición en porcentajes atómicos de Ir y Co presentes en tres diferentes regiones de la película de cada electrodo se presenta en la tabla 2. Los microanálisis de EDX muestran que la composición real, en porcentaje atómico, en cada compósito es cercana al valor nominal.
Ensayos de estabilidad de los electrodos en condiciones agresivas
En el ensayo de estabilidad, los electrodos trabajaron como ánodos en una celda electrolítica, la cual contenía una solución altamente corrosiva (NaCl 6% w/v) y a una intensidad de corriente alta (500mA.cm-2), un valor que es 200 veces la intensidad de corriente de trabajo (2,5mA.cm-2). El volumen de electrolito utilizado fue de 6 litros, suficiente como para considerar despreciable la variación de la concentración durante el tiempo de electrólisis. Las condiciones de trabajo fueron a temperatura ambiente y pH=5,8. Se utilizó un electro de Ag/AgCl como electrodo de referencia para medir el potencial del ánodo, y láminas de titanio como cátodo. La variación del potencial del electrodo (ánodo), con respecto al tiempo fue monitoreada con ayuda de un multímetro conectado a una PC haciendo uso del programa MAS_VIEW. Cuando se observó una subida brusca en el potencial del ánodo (ΔV = 5V) se finalizó la experiencia.
En la figura 8 se muestra la gráfica de la variación de potencial versus el tiempo para los electrodos de Ti/Co3O4+IrO2 1,25%, Ti/Co3O4+IrO2 ; 2,5% y Ti/Co3O4+IrO2 5,0%.
En la tabla 3 se puede notar que en las 10 primeras horas de electrolisis no se observa una gran pérdida de masa (porcentaje de pérdida de masa < 10%) en los electrodos con 1,25% y 2,5% de dopado, mientras que el electrodo de Ti/Co3O4+IrO2 5,0% fácilmente pudo llegar hasta las 15 horas.
La menor pérdida de masa entre uno y otro electrodo para las mismas condiciones de electrólisis está estrechamente relacionada con la estabilidad del material. El incremento en el tiempo de vida de los electrodos está en proporción al mayor contenido de óxido de iridio presente en su estructura.
CONCLUSIONES
La voltametría cíclica, el análisis EDX y el cambio morfológico mostrado en las micrografías del análisis SEM revelan la presencia de iridio en la espinela de cobalto. Los estudios de estabilidad realizados a los electrodos de Ti/Co3O4 +xIrO2, mediante cronopotenciometría y pérdida de masa, muestran el mejoramiento de su estabilidad electroquímica incrementando el tiempo de vida útil de los electrodos de espinela asociados a la incorporación de óxido de iridio en su composición.
AGRADECIMIENTO
Los autores agradecen al Instituto de investigación de la Facultad de Ciencias de la UNI, al CONCYTEC y a los servicios técnicos de la Universidad de Alicante por el apoyo brindado a la realización del presente proyecto.
BIBLIOGRAFÍA
1. R. Berenguer, A. La Rosa-Toro, C. Quijada and E. Morallón J. Phys. Chem. C, 2008; 112; 16945–16952
2. Adolfo La Rosa Toro Gómez, Miguel Ponce Vargas, REVCIUNI, 2010; 138 (1): 11-16
3. Sergio Trassati, electrodes of conductive metallic oxides Part B, Elsevier Scientific Publishing, 1981; Oxford New York U.S.A, pag. 575
4. Andreozzi, R; Caprio, V.; Insola, A.; Marotta, R. Advanced oxidation processes (AOP) for wáter purification and recovery, Catal. Today, 1999; 53 (1): 51-59
5. Adolfo La Rosa Toro, Miguel Ponce Vargas, Evaluación de electrodos de espinela de cobalto y de dióxido de plomo en la oxidación electroquímica de colorantes azo, Rev. Soc. Quím. Perú, 2007; 73 (4): 186-196
6. Bishop P. L. y Jiang H. Aerobic Biodegradation of azo dyes in biofilms.Wat. Sci. Technol. 1994; 29, (10-11): 525-530.
7. L. Bautista. Degradación de colorantes (Azul de metileno) por métodos electroquímicos. Tesis en Ingeniería Química. Universidad Veracruzana, 2011; 10-13
8. A. Rodríguez, P. Letón, R. Rosal, M. Dorado, S. Villar, J. Sanz. Tratamientos avanzados de aguas residuales industriales. Informe de vigilancia tecnológica. Círculo de Innovación en Tecnologías Medioambientales y Energía. España, 2006; 30-40, 52-53
9. S. TrasattiG Lodi, "Electrodes of Conductive Metallic Oxides", Part A, Elsevier Scientific Publishing Company. Nueva York (1980).
10. A. La Rosa Toro Gomez Miguel Ponce Vargas, Eduardo Medina; Preparación y caracterización de nuevos electrodos nanoestructurados de Ti/Co3O4-RuO2, Rev. Soc. Quím. Perú, 2011; 77(1):35-43
11. L. D. Burke, N. S. Naser, B. M. Ahern. J. Solid State Electrochem, 2007; 11: 655-666.
12 E. Chatzisymeon et al. / Catalysis Today, 2010; 151:185–189.
13. A. La Rosa Toro, R. Berenguer, C. Quijada, F. Montilla, E. Morallón y L. Vázquez. Preparación y caracterización superficial de electrodos de espinela de cobalto dopada con cobre, CuCo3-xO4, 0 ≤ X ≤ 1,5. J. Phys. Chem, 2006: 24021- 24029.
14. Th. Pauporté et al. Electrochimica Acta, 1999; 45 : 431 - 439.
15. S. Fierro et al. Electrochemistry communications, 2010; 12: 172-174.
16. M. Pikulski and W. Gorski. Anal. Chem. 2000; 72: 2696 – 2702.
17. G.-W. Yang, K. Rajeshwar, J. Electrochem.Soc. 1987; 134: 1830
18. A.A.F. Grupioni et al. / Electrochimica Acta, 2002; 48: 417-418
Recibido el 14-04-2015
Aprobado el 28-04-2015