Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química del Perú
versión impresa ISSN 1810-634X
Rev. Soc. Quím. Perú vol.81 no.3 Lima jul./set. 2015
TRABAJO ORIGINAL
Propiedades dieléctricas de hidróxidos dobles laminares de Mg:Al
Dielectric properties of Mg:Al layered double hydroxides
Óscar Hernán Giraldo Osorio1,2; Nayda Patricia Arias Duque1,3; Jhon Mauricio Aguirre Cortés1,3
1 Laboratorio de Materiales Nanoestructurados y Funcionales. Universidad Nacional de Colombia Sede Manizales.
2 Departamento de Física y Química. Facultad de Ciencias Exactas y Naturales. Universidad Nacional de Colombia Sede Manizales, Carrera 27 No. 64-60 Manizales, Caldas, Colombia. email: ohgiraldoo@unal.edu.co
3 Facultad de Ingeniería y Arquitectura. Universidad Nacional de Colombia Sede Manizales, Carrera 27 No. 64-60 Manizales, Caldas, Colombia
RESUMEN
Este trabajo describe la síntesis y caracterización de dos hidróxidos dobles laminares Mg2AlNO3 sintetizados mediante el método de coprecipitación. El comportamiento eléctrico de los materiales fue evaluado por espectroscopía dieléctrica. Los resultados del análisis de difracción de rayos X mostraron la formación de una estructura laminar; la presencia de todas las especies en la estructura del material sintetizado se confirmó por absorción atómica y espectroscopía de infrarrojo. Por microscopía electrónica de transmisión se observó agregados de partículas en forma de placas. Los resultados de espectroscopía dieléctrica obtenidos a temperatura ambiente muestran un comportamiento de polarización de orientación que sugiere la rotación de moléculas de agua a alta frecuencia y la rotación de aniones nitrato en el espacio interlaminar a baja frecuencia que puede ser responsable de la conductividad iónica observada en el material.
Palabras clave: Hidróxidos dobles laminares, propiedades dieléctricas, conductividad iónica.
ABSTRACT
This work describes the synthesis and characterization of Mg2Al-NO3 layered double hydroxides nanomaterial prepared using a coprecipitation method. The electrical behavior of this material was evaluated using dielectric spectroscopy. The results from X-ray diffraction analysis showed the formation of lamellar structure, while the atomic absorption and infrared spectroscopy confirms the presence of all species inthe structure of the synthesized material. TEM shows clusters of plate-like particles and the dielectric spectroscopy results at room temperature show an orientational polarization behavior that suggests the rotation of water molecules at high frequency. TEM results also demonstrate the rotation of nitrate anions in the interlayer spacing at low frequency, which may be responsible for producing anionic conductivity.
Key words: Layered double hydroxides, dielectric properties, ionic conductivity.
INTRODUCCIÓN
Los hidróxidos de dobles laminares (LDH), también conocidos como materiales tipo hidrotalcita o arcillas aniónicas,1-3 son estructuralmente similares al hidróxido de magnesio [Mg(OH)2].2 Los LDH se pueden sintetizar como fase cristalográfica pura bajo condiciones controladas a temperatura ambiente.3-5 Este tipo de materiales son considerados actualmente, como materiales nanoestructurados jerárquicos avanzados.4,5 Su fórmula general puede representarse mediante 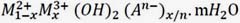 donde M2+ y M3+ representan los cationes di y trivalentes, respectivamente; m representa el contenido de agua, n- la carga del anión y x el grado de sustitución del metal divalente. Los metales en esta estructura tienen coordinación octaédrica con los grupos OH-, en la que los octaedros comparten los bordes formando láminas3 de 4,8Å de espesor extendidas en dos dimensiones2. Las láminas están cargadas positivamente debido al grado de sustitución (x) del metal divalente por el trivalente; se ha reportado que x puede variar entre 0,2 a 0,4.5 El material hospeda, a través de enlaces de hidrógeno e interacciones electrostáticas, iones negativos (An-) que compensan la carga positiva de la lámina.5 La distancia entre las láminas cambia, dependiendo del anión huésped y puede variar entre 3,3 Å a 4,9 Å para
donde M2+ y M3+ representan los cationes di y trivalentes, respectivamente; m representa el contenido de agua, n- la carga del anión y x el grado de sustitución del metal divalente. Los metales en esta estructura tienen coordinación octaédrica con los grupos OH-, en la que los octaedros comparten los bordes formando láminas3 de 4,8Å de espesor extendidas en dos dimensiones2. Las láminas están cargadas positivamente debido al grado de sustitución (x) del metal divalente por el trivalente; se ha reportado que x puede variar entre 0,2 a 0,4.5 El material hospeda, a través de enlaces de hidrógeno e interacciones electrostáticas, iones negativos (An-) que compensan la carga positiva de la lámina.5 La distancia entre las láminas cambia, dependiendo del anión huésped y puede variar entre 3,3 Å a 4,9 Å para 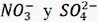 respectivamente;6 además, en la región interlaminar también se puede encontrar moléculas de agua que son representadas por m en la fórmula general del material.2,3 De esta manera, el material de dimensiones nano-métricas considerado como anfitrión puede tener diferentes propiedades, dependiendo de la especie huésped alojada en la región interlaminar. La distancia interlaminar se puede modificar mediante intercambio iónico con la incorporación de nanopartículas, moléculas orgánicas, polímeros, ADN y enzimas, entre otros sistemas.1-6 El amplio rango de variaciones que se pueden realizar en los materiales tipo hidrotalcita permite importantes aplicaciones, como catalizadores, adsorbentes, sistemas para liberación controlada de medicamentos, sistemas para absorción de radiación UV, sensores, biocatalizadores, conductores iónicos en celdas combustibles y como electrodos en dispositivos de almacenamiento de energía.1-7 Se ha estudiado materiales LDH del tipo Ni-Al-Cl por espectroscopía de impedancia electroquímica, evaluando su comportamiento como función de la concentración del metal divalente,8 en el que la impedancia a bajas frecuencias fue dominada por la difusión de la especie interlaminar y el componente resistivo del transporte de masa decreció con el incremento en el estado de oxidación del níquel. Los LDH compuestos por Mg-Mn con carbonato interlaminar han mostrado propiedades de difusión.9 De igual forma, se ha estudiado las propiedades dieléctricas de los LDH de Ca-Fe10 y Zn-Al conteniendo el anión nitrato y molibdato.11 Se encuentran reportados pocos estudios sobre las propiedades dieléctricas de los LDH compuestos por Mg-Al-NO3.12 El propósito de este trabajo es proporcionar una aproximación fenomenológica al proceso que involucra el transporte de carga en HDL de Mg-Al con ion nitrato como huésped.
respectivamente;6 además, en la región interlaminar también se puede encontrar moléculas de agua que son representadas por m en la fórmula general del material.2,3 De esta manera, el material de dimensiones nano-métricas considerado como anfitrión puede tener diferentes propiedades, dependiendo de la especie huésped alojada en la región interlaminar. La distancia interlaminar se puede modificar mediante intercambio iónico con la incorporación de nanopartículas, moléculas orgánicas, polímeros, ADN y enzimas, entre otros sistemas.1-6 El amplio rango de variaciones que se pueden realizar en los materiales tipo hidrotalcita permite importantes aplicaciones, como catalizadores, adsorbentes, sistemas para liberación controlada de medicamentos, sistemas para absorción de radiación UV, sensores, biocatalizadores, conductores iónicos en celdas combustibles y como electrodos en dispositivos de almacenamiento de energía.1-7 Se ha estudiado materiales LDH del tipo Ni-Al-Cl por espectroscopía de impedancia electroquímica, evaluando su comportamiento como función de la concentración del metal divalente,8 en el que la impedancia a bajas frecuencias fue dominada por la difusión de la especie interlaminar y el componente resistivo del transporte de masa decreció con el incremento en el estado de oxidación del níquel. Los LDH compuestos por Mg-Mn con carbonato interlaminar han mostrado propiedades de difusión.9 De igual forma, se ha estudiado las propiedades dieléctricas de los LDH de Ca-Fe10 y Zn-Al conteniendo el anión nitrato y molibdato.11 Se encuentran reportados pocos estudios sobre las propiedades dieléctricas de los LDH compuestos por Mg-Al-NO3.12 El propósito de este trabajo es proporcionar una aproximación fenomenológica al proceso que involucra el transporte de carga en HDL de Mg-Al con ion nitrato como huésped.
PARTE EXPERIMENTAL
Procedimiento de síntesis
Se preparó un hidróxido doble laminar de MgAl con una relación molar Mg/Al 2:1 por el método de coprecipitación a pH constante, descrito por Villegas y colaboradores.3 Para una síntesis típica se disolvieron 10,120 g de Mg(NO3)2.6H2O (Merck, 99%) en 20,0 mL de agua destilada desionizada (DDW) para preparar una solución 2,0M de la sal de nitrato del ion M2+.
Por otro lado, se adicionó 7,340 g de Al(NO3)3.9H2O (Merck, 99%) en el mismo volumen de DDW para preparar una solución 1,0M de la sal de nitrato del ion M3+. La solución de las sales de nitratos se adicionó gota a gota a 20,0 mL de solución acuosa de NaOH (Carlo Erba, 98%) preparada a pH 10,0 ± 0,5. El pH de la reacción se mantuvo en este rango con la adición de NaOH 2,0M. El procedimiento se realizó con burbujeo constante de nitrógeno gaseoso para prevenir la introducción de iones carbonato provenientes del CO2 atmosférico.
Caracterización
La determinación de la cantidad total de Mg y Al se realizó por absorción atómica (AA) en un espectrómetro Perkin Elmer 3110. Los datos de difracción de rayos X en polvo (XRD) se obtuvieron en un difractómetro Rigaku Miniflex II, usando una fuente de Cu Kα y un detector de NaI con una velocidad de barrido de 2 °/ min, un tamaño de paso de 0,02 ° entre 3-70 ° 2θ. Las micrografías se adquirieron en un Microscopio Electrónico de Transmisión (TEM) JEOL JEM-2010. El espectro infrarrojo con transformada de Fourier se analizó en un dispositivo 380 Nicolet, equipado con detector DTGS en el rango 4000-400 cm-1. Las mediciones dieléctricas AC de la muestra en polvo se realizaron en un equipo Solartron 1260 en un rango de frecuencias de 10 MHz a 0,18 Hz a 100 mVrms utilizando un portamuestras Solatron 12964A equipado con dos electrodos paralelos en configuración de dos puntas. La distancia entre el electrodo de trabajo y de referencia fue 1,57 mm con un diámetro efectivo del electrodo de trabajo de 20 mm. El electrodo de trabajo se utilizó con un anillo de protección para evitar el efecto de líneas de corriente parásita en el borde de la muestra. Las condiciones ambientales para las mediciones dieléctricas fueron 21 °C y 50% de humedad relativa. El circuito equivalente que ajusta los datos experimentales se simuló con el software Z-View software® (Scribner Associates).
RESULTADOS Y DISCUSIÓN
Composición, estructura, morfología y espectro infrarrojo
La relación molar Mg/Al experimental determinada por A.A fue de 2,2, que está en buen acuerdo con el valor esperado de 2,0. El patrón de XRD (figura 1), evidenció que se obtuvo una fase pura de LDH. Su carácter laminar se confirmó por los picos armónicos a bajos valores de 2θ. El espaciamiento basal, calculado en 8,9 Å que corresponde al pico más intenso de difracción asociado a la difracción del plano (003), es consistente con la presencia de nitratos en la región interlaminar.2 Las distancias interplanares para los planos (006), (009), (012) y (110) fueron de 4,5Å, 2,6Å, 2,3Å y 1,5Å, respectivamente; la representación esquemática de esta estructura se muestra en la figura 1a. El tamaño de cristal estimado mediante la ecuación de Debye- Scherrer fue de 5,0 nm.
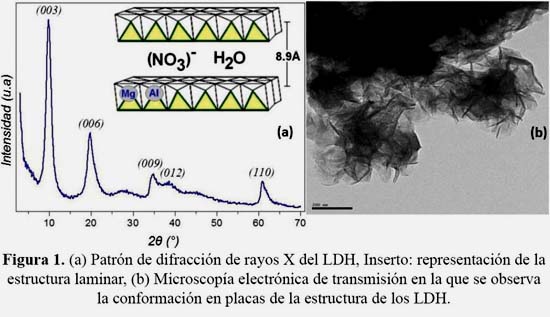
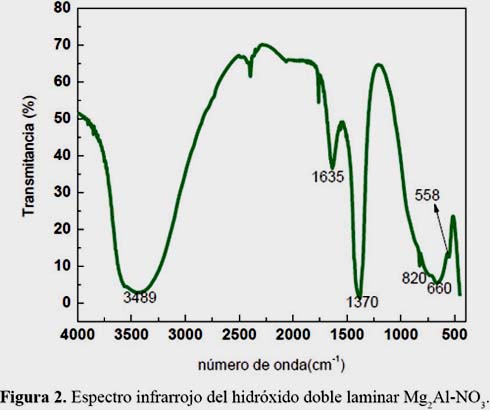
La imagen de TEM para el material LDH Mg-Al (figura 1b) revela una morfología en placas característica de este tipo de estructuras3, que está compuesta por agregados de tamaño homogéneo. La figura 2 muestra el espectro vibracional FT-IR típico de este material. La banda centrada alrededor de 3489 cm-1 se asignó a las vibraciones de estiramiento de los grupos OH debido a las moléculas de agua localizadas en la región interlaminar y a los grupos OH− de la lámina. La vibración alrededor de 1635 cm-1 corresponde a las vibraciones de deformación de los grupos OH− de la estructura laminar y las bandas a 660 cm-1 y 558 cm-1 a las vibraciones metal-OH de la red cristalina de la estructura laminar.3 La presencia de aniones nitrato se confirmó en el espectro por la aparición de bandas vibracionales localizadas a 1370 y 820 cm-1 (modos ν2 y ν3 respectivamente).3
Análisis dieléctrico
Los resultados de la caracterización dieléctrica de este material se muestran en el diagrama Cole-Cole (figura 3a), el cual presenta un semicírculo centrado bajo el eje de la permitividad real a alta frecuencia y una línea recta a bajas frecuencias. Este comportamiento es típico de un material dominado por conductividad DC donde el proceso de transporte de carga tiene similar constante de tiempo, como se reporta en la literatura.6 La especies interlaminares son móviles y contribuyen a este tipo de conductividad debido al efecto cooperativo causado por la polarizabilidad orientacional del anión nitrato.
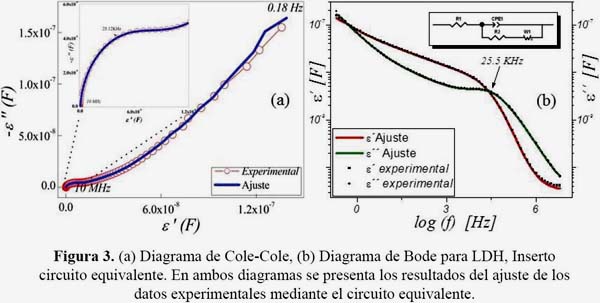
La dinámica del ion nitrato en el sólido está influida por la distribución de los tiempos de relajación debida a las heterogeneidades relacionadas con la presencia de poros y con áreas de contacto irregulares entre agregados de partículas.13 Los dipolos en este material no están localizados en el mismo ambiente químico debido a la presencia de cationes Mg y Al en la lámina; de esta manera, algunos dipolos tendrán más libertad de rotar que los otros.14 Asimismo, la porosidad y el tamaño de cristal influyen en el comportamiento eléctrico de este tipo de materiales. Es probable que el primer parámetro (porosidad) proporcione el espacio necesario para que el anión nitrato se movilice; así se generan regiones de carga espacial entre las partículas de LDH, en donde es probable que se favorezca la conductividad.15a El segundo parámetro (tamaño de cristal), relacionado también con los defectos de apilamiento de las láminas, incrementa la movilidad de los iones debido a que proporciona el ambiente microestructural necesario para las rotaciones de los iones.
El diagrama de Bode de la permitividad real (figura 3b), decrece a medida que la frecuencia se incrementa y presenta un proceso simple de relajación representado por un pico en el diagrama de las pérdidas dieléctricas o permitividad imaginaria (ε''= 4461 nF) a una frecuencia característica de 25,519 KHz asociado con la rotación de las moléculas de agua en el material.11 El valor estimado de la permitividad a esta frecuencia fue de 4105 nF. El proceso de relajación del agua no confinada ocurre a 20 GHz con un tiempo de relajación de 9,3x10-12s a 20 °C,15b mientras que el valor encontrado en el presente trabajo fue 6,34x10-6s, sugiriendo en que ambiente confinado las fuerzas electrostáticas interaccionan con las láminas positivas del LDH, favoreciendo la rotación de los dipolos de las moléculas de agua a una menor frecuencia. Por otro lado, el valor estimado de la constante dieléctrica del LDH fue de 25,30 tomado en un rango de 1x107 a 3,1x106 Hz, donde la permitividad real es aproximadamente constante. El circuito equivalente que tiene significado físico y representa los resultados experimentales, se muestran en el inserto de la figura 3b. Este circuito tipo Randles modificado, presenta un resistor (R1) conectado en serie con un elemento de fase constante (CPE1), que a su vez se encuentra en paralelo con un resistor (R2) y un elemento de tipo Warburg (W1) para simular una difusión semi-infinita, en el caso de los portadores de carga iónicos (tabla 1).

R1 representa la resistencia de contacto entre la muestra y el electrodo. La conexión en paralelo de R2 y CPE1 representa el fenómeno resistivo y capacitivo dentro de los poros del material así como el efecto cooperativo de la orientación de los dipolos de las moléculas de agua localizadas en la región interlaminar. Finalmente, W1 representa la difusión del anión nitrato dentro de los poros del material.
CONCLUSIONES
Los resultados de XRD muestran que el LDH de Mg2Al-NO3 tiene una estructura laminar con un tamaño estimado de cristal de 5,0 nm y el anión nitrato en la región interlaminar como se evidenció por FT-IR. Los resultados sugieren que hay un ambiente químico favorable para la difusión del ion nitrato que contribuye en gran medida a la conductividad DC a bajas frecuencias. El tiempo de relajación estimado para el agua confinada en el LDH (6,34x10-6 s) fue menor que la del agua libre sugiriendo que existe un efecto cooperativo con los OH− localizados en la lámina del material LDH.
AGRADECIMIENTO
Este trabajo fue financiado por la Dirección de Investigación y Extensión DIMA (Proyecto Cod. 28739) y la Facultad de Ciencias Exactas y Naturales de la Universidad Nacional de Colombia, Sede Manizales. Los autores también agradecen a la Universidad de Alicante, España, por las mediciones de microscopía electrónica de transmisión.
BIBLIOGRAFÍA
1. Cavani F, Trifirò F, Vaccari A. Hydrotalcite-type anionic clays: Preparation, properties and applications. Catal. Today. 1991;11(2):173-301.
2. Gu Z, Atherton JJ, Xu ZP. Hierarchical layered double hydroxide nanocomposites: structure, synthesis and applications. Chem. Commun. 2015;51(15):3024-36.
3. Villegas JC, Giraldo OH, Laubernds K, Suib SL. New Layered Double Hydroxides Containing Intercalated Manganese Oxide Species: Synthesis and Characterization. Inorg. Chem. 2003;42(18):5621-31.
4. Han J, Wei M, Evans DG, Duan X. Hierarchical Layered Double Hydroxide Materials. Advanced Hierarchical Nanostructured Materials: Wiley-VCH Verlag GmbH & Co. KGaA; 2014. p. 231-66.
5. Wang Q, O’Hare D. Recent Advances in the Synthesis and Application of Layered Double Hydroxide (LDH) Nanosheets. Chem. Rev. 2012;112(7):4124-55.
6. Tezuka S, Chitrakar R, Sonoda A, Ooi K, Tomida T. Studies on selective adsorbents for oxo-anions. Nitrate ion-exchange properties of layered double hydroxides with different metal atoms. Green Chem. 2004;6(2):104-9.
7. Rives V. Layered Double Hydroxides: Present and Future. New York: Nova Science Publisher; 2006.
8. Roto R, Villemure G. Electrochemical impedance spectroscopy of electrodes modified with thin films of Ni-Al-Cl layered double hydroxides. J. Electroanal. Chem. 2002;527(1–2):123-30.
9. Roto R, Villemure G. Electrochemical impedance spectroscopy of electrodes modified with thin films of MgMnCO3 layered double hydroxides. Electrochim. Acta. 2006;51(12):2539-46.
10. Bugris V, Haspel H, Kukovecz Á, Kónya Z, Sipiczki M, Sipos P, et al. Water Types and Their Relaxation Behavior in Partially Rehydrated CaFe-Mixed Binary Oxide Obtained from CaFe-Layered Double Hydroxide in the 155–298 K Temperature Range. Langmuir. 2013;29(43):13315-21.
11. Frunza L, Schönhals A, Frunza S, Parvulescu VI, Cojocaru B, Carriazo D, et al. Rotational Fluctuations of Water Confined to Layered Oxide Materials: Nonmonotonous Temperature Dependence of Relaxation Times. J. Phys. Chem. A. 2007;111(24):5166-75.
12 (a) Guo X, Zhang F, Xu S, Cui Z, Evans DG, Duan X. Effects of Varying the Preparation Conditions on the Dielectric Constant of Mixed Metal Oxide Films Derived from Layered Double Hydroxide Precursor Films. Ind. Eng. Chem. Res. 2009;48(24):10864-9. (b) Ivanov M, Klemkaite K, Khinsky A, Kareiva A, Banys J. Dielectric and Conductive Properties of Hydrotalcite. Ferroelectrics. 2011;417(1):136-42.
13. Kao KC. Dielectric Phenomena in solids: with Emphasis on Physical Concepts of Electronic Processes;: Elsevier; 2004.
14. Arias NP, Dávila MT, Giraldo O. Electrical behavior of an octahedral layered OL-1-type manganese oxide material. Ionics. 2013;19(2):201-14.
15. (a) Philippe Knauth; Solid State Ionics. 2006;177: 2495-2502 (b) Raju GG. Dielectrics in Electric Fileds;: Marcel Dekker, Inc. 2003.
Recibido el 05-06-2015
Aprobado el 26-06-2015













