Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Sociedad Química del Perú
Print version ISSN 1810-634X
Rev. Soc. Quím. Perú vol.81 no.4 Lima Oct./Dec. 2015
TRABAJOS ORIGINALES
Evaluación de los compuestos fenólicos ycapacidad antioxidante de tres colores de pétalos de mastuerzo (Tropaeolum majus L.)
Evaluation of phenolic compounds andantioxidant capacity of three color petal cress (Tropaeolum majus L.)
Ketty Arellano Linoa, Jaqueline Herrera Rodrígueza, Miguel Quispe Solano*a, Clara Espinoza Silvab, Nora Veliz Sedanob, Wagner Orihuela Vásquezb
a Escuela Académico Profesional de Ingeniería Agroindustrial, Facultad de Ciencias Aplicadas, Universidad Nacional del Centro del Perú, quispe_miguelangel@hotmail.com
b Facultad de Ingeniería en Industrias Alimentarias, Universidad Nacional del Centro del Perú.
RESUMEN
Se evaluó el contenido de compuestos fenólicos y capacidad antioxidante en tres colores de pétalos de mastuerzo (Tropaeolum majus L.). Los pétalos de los colores de mastuerzo rojo, anaranjado y amarillo se secaron a temperatura ambiente; luego se acondicionaron para la extracción de sus componentes bioactivos, los que se cuantificaron mostrando diferencia significativa (p<0,05) entre colores. La mayor concentración de fenoles totales se encuentra en el color anaranjado, seguido por el rojo y el amarillo (917,05; 799,35 y 442,02 mg AGE/g de muestra). Para la cuantificación de flavonoides totales el mayor contenido se encuentra en el color rojo, seguido por el anaranjado y el amarillo (2,184; 1,185 y 0,867 mg QE/g de muestra). En cuanto a los taninos totales, el mayor contenido se encuentra en el color rojo seguido por el anaranjado y el amarillo (342,92; 333,77 y 291,53 mg ATE/g de muestra). Con respecto a la capacidad antioxidante por los métodos DPPH y ABTS, el mayor contenido se encuentra en el color anaranjado, seguido por el rojo y amarillo (3928,226; 3286,163 y 2500,887 μM TE/g de muestra), (622,92; 608,15 y 587,01 μM TE/g de muestra).
Palabras clave: Tropaeolum majus L., fenoles, flavonoides, taninos, capacidad antioxidante.
ABSTRACT
The content of phenolic compounds and antioxidant capacity in three colors of petals cress (Tropaeolum majus L.) was evaluated. Petals colors red cress, orange and yellow were dried at room temperature; then they were conditioned for extracting its bioactive components, which were quantified showing significant difference (p<0.05) between colors. The highest concentration of total phenols is in the orange color, followed by red and yellow (917.05;
799.35 and 442.02 mg AGE/g sample). For quantification of total flavonoids, the highest content is in the red, followed by orange and yellow (2.184; 1.185 and 0.867 mg QE /g sample). As for the total tannins, the highest content is in the red followed by orange and yellow (342.92; 333.77 and 291.53 mg ATE/g sample). With respect to the antioxidant capacity by DPPH and ABTS methods, the highest content is in the orange color, followed by red and yellow (3928.226; 3286.163 and 2500.887 μM TE/g sample), (622.92; 608.15 and 587.01 μM TE/g sample).
Key words: Tropaeolum majus L., phenols, flavonoids, tannins, antioxidant capacity.
INTRODUCCIÓN
El mastuerzo (Tropaeolum majus L.) es también conocido como capuchina, chaguinha, chagas y flor de sangre; pertenece a la diversidad primaria de América del Sur, se encuentra exclusivamente en Colombia, Brasil y Perú.
Presenta un alto contenido de vitamina C, isotiocianatos, antocianinas, compuestos fenólicos: flavonoides, taninos. Estos compuestos fenólicos poseen una estructura química especialmente adecuada para ejercer una acción antioxidante. Además, debido a su reactividad, se encuentran en la mayoría de los casos combinadas con un ácido orgánico, un azúcar o bien, con ellas mismas para formar un polímero; están asociados con características sensoriales (color, sabor y astringencia), características nutrimentales y otras propiedades.Las flores de coloración pálida contienen menos polifenoles (blanca y lila claro) siendo su capacidad antioxidante menor1.
Tras un estudio a las flores de dalia se las consideró como un alimento funcional porque aportan compuestos fenólicos, especialmente las de coloración oscura, ya que presentaron la más alta composición fenólica y capacidad antioxidante2.
Muchas de estas flores contienen en sus pétalos componentes saludables y a su vez nos proporcionan calorías3. Esta funcionalidad se debe sobre todo a su capacidad antioxidante4 por contener elementos que en rosas se relacionan con compuestos fenólicos5 y en capuchina con isotiocianatos. Aunque la información aún es escasa, estos fitoquímicos serían protectores no necesarios para sobrevivir pero sí favorables para reducir el riesgo de padecer enfermedades coronarias y cancerígenas6.
Entre los métodos más aplicados para la determinación de la capacidad antioxidante están el ABTS y DPPH ambos presentan buena estabilidad en ciertas condiciones, aunque también muestran diferencias. El DPPH es un radical libre que puede obtenerse directamente sin una preparación previa, mientras que el ABTS tiene que ser generado tras una reacción que puede ser química, enzimática, o también electroquímica7. La complejidad de la mezcla de compuestos en un extracto, muchas veces requiere de condiciones especiales para poder medir la capacidad antioxidante, por esta razón existen varios métodos para su determinación8.
PARTE EXPERIMENTAL
Materiales y reactivos
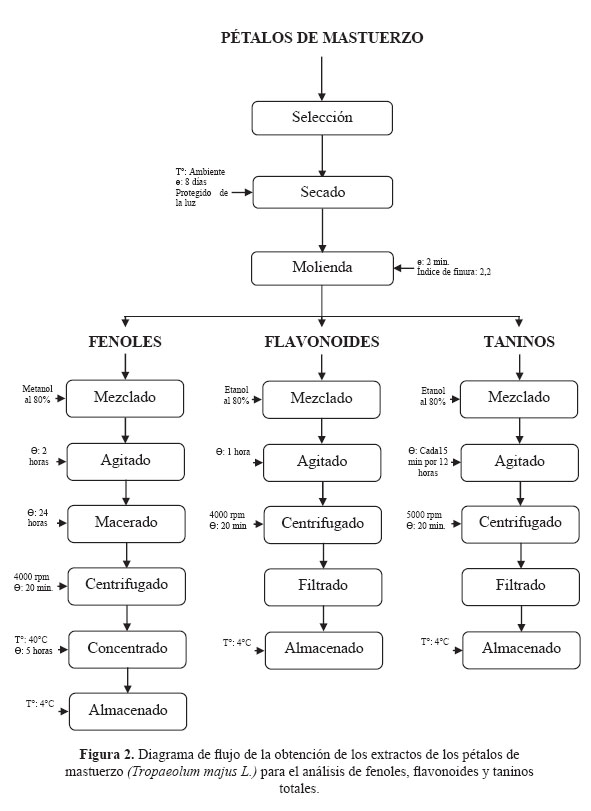
Se trabajó con tres colores de pétalos de mastuerzo (rojo, anaranjado y amarillo), Figura 1 provenientes del anexo de Chipocayo, provincia de Tarma, departamento de Junín.
Obtención del extracto de pétalos del mastuerzo (Tropaeolum majus L.)
El extracto es constituido exclusivamente de los pétalos de la flor para tal fin se prosiguió el diagrama de flujo siguiente (Figura 2):
Cuantificación de compuestos fenólicos y capacidad antioxidante
Se cuantificó los compuestos fenólicos y capacidad antioxidante, para lo cual se realizó una curva estándar para cada análisis con reactivos y protocolos validados.
Cuantificación de compuestos fenólicos
Fenoles totales9
Flavonoides totales10
Taninos totales11
Determinación de la capacidad antioxidante
Método DPPH12
Método ABTS13
Análisis estadístico.
Para la evaluación estadística se utilizó un DCA cuyo análisis de varianza se trabajó con 0,05 de significancia; al encontrar diferencia significativa (p<0,05) se procedió a realizar la prueba de comparación de medias de Tukey. Los datos fueron procesados con la ayuda de los programas estadísticos Minitab y la hoja de cálculo Microsoft Excel 2010.
RESULTADOS Y DISCUSIÓN
Cuantificación de los compuestos fenólicos de los tres colores de pétalos del mastuerzo (Tropaeolum majus L.)
La cuantificación de los compuestos fenólicos de los colores de pétalos de mastuerzo (Tropaeolum majus L.) se efectuaron sobre extractos etanólicos y/o metanólicos de pétalos secos según los protocolos indicados.
Cuantificación de fenoles totales
Este método se basa en la reacción del extracto metanólico de los pétalos de mastuerzo con el Folin-Ciocalteu. Los resultados se reportan en la Tabla 1.
En la Tabla 1 se reporta los resultados de las concentraciones de fenoles totales expresados en mg de ácido gálico equivalente/g de muestra; en la misma línea de investigación Gracia14 reporta un contenido de 221,481 ± 0,630 mg de AGE/g de muestra para el extracto de la flor de manita; Tarhan et al.15, en las flores de Curcubita pepo señalan valores de 189 mg AGE/g de muestra cuyos valores se encuentran muy por debajo de los resultados obtenidos; esto se debe a la diferencia de colores de pétalos, pero que evidencian la presencia de compuestos fenólicos. En el caso de los flavonoides totales están expresados en mg de quercetina equivalente/g de muestra; Souto et al.16, encontró valores de 250,97; 134,76 y 123,83 mg QE/100 g de muestra para flores rojas, anaranjadas y amarillas de mastuerzo (Tropaeolum majus L.); estos resultados se encuentran cercanos a los obtenidos en la investigación.
Finalmente, en el caso de los taninos totales están expresados en mg de ácido tánico equivalente/g de muestra; Márcia De Matos17 reportó el análisis de las flores de caléndula cuyos resultados en porcentaje son valores entre 10,4 y 11,2% del total; a diferencia de éstos los taninos totales de los pétalos de mastuerzo presentaron mayor contenido con valores que figuran entre 29,15% a 34,29% para los tres colores evaluados.
Determinación de la capacidad antioxidante de los tres colores de pétalos del mastuerzo (Tropaeolum majus L.)
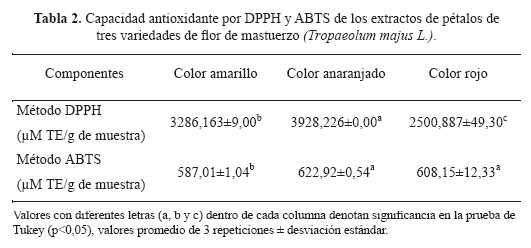
La caracterización de la capacidad antioxidante de los tres colores de pétalos de mastuerzo (Tropaeolum majus L.) se efectuó sobre extractos metanólicos de pétalos secos. Los resultados se han valorado con respecto al Trolox, utilizando dos metodologías: DPPH y ABTS, tal como se muestran en la Tabla 2.
En la Tabla 2 se reporta los resultados de la capacidad antioxidante de los tres colores de pétalos de mastuerzo (Tropaeolum majus L.) expresados en μM de Trolox equivalente/g de muestra, donde se puede apreciar que existe diferencia estadística (p<0,05).
Con respecto al método por DPPH, en trabajos similares se obtuvo resultados de 1507 ± 86,2 y 2651 ± 93,5 μM TE/g de muestra en el análisis a las hojas y tallos del guanandí (Calophyllum brasiliense)18, estos valores se encuentran por debajo de los obtenidos en la investigación con respecto al color rojo, anaranjado y amarillo. Para el caso del método por ABTS, en investigaciones similares se analizó las hojas del limoncillo donde se reportó un valor de 142,8 µM TE/g extracto19; este resultado es menor a los obtenidos en esta investigación.
Con el ABTS se puede medir los compuestos de naturaleza lipofílica como hidrofílica, mientras que el DPPH solo puede disolverse en medio orgánico, el primero es el más indicado para ensayos de compuestos coloreados, reduciendo posibilidades de interferencias de compuestos coloreados que absorben en la región del visible o compuestos resultantes de una reacción secundaria12. Los resultados obtenidos con DPPH y ABTS permiten alcanzar conclusiones prácticamente similares, ya que en ambos casos los pétalos de mastuerzo de color anaranjado obtuvieron resultados mayores, sin embargo al método ABTS es el más viable para el análisis de la capacidad antioxidante los diferentes extractos coloreados de los pétalos de mastuerzo (Tropaeolum majus L.).
CONCLUSIONES
- Se determinó que existe diferencia entre los colores de pétalos de mastuerzo (Tropaeolum majus L.), con respecto al contenido de compuestos fenólicos y capacidad antioxidante.
- Con respecto a la cuantificación de fenoles totales en los pétalos de mastuerzo la mayor concentración se encuentra en el color anaranjado con 917,05, seguido por el rojo con 799,35 y el amarillo con 442,02 mg AGE/g de muestra. En cuanto a la cuantificación de flavonoides totales el mayor contenido se encuentra en el color rojo con 2,184, seguido por el anaranjado con 1,185 y el amarillo con 0,867 mg QE/g de muestra. En lo que se refiere a la cuantificación de taninos totales, el mayor contenido se tiene en el color rojo con 342,92, seguido por el anaranjado con 333,77 y finalmente, el amarillo con 291,53 mg ATE/g de muestra.
- En cuanto a la capacidad antioxidante por método de DPPH se obtuvo que la mayor capacidad antioxidante se encuentra en el color anaranjado con 3928,226, seguido por el amarillo con 3286,163 y el rojo con 2500,887 μM TE/g de muestra; con respecto al método ABTS se reportó que el color anaranjado tiene 622,92, seguido por el rojo con 608,15 y finalmente, el amarillo con 587,01 μM TE/g de muestra.
- La valoración del contenido de fenoles totales, flavonoides, taninos y capacidad antioxidante en los tres colores de pétalos de mastuerzo (Tropaeolum majus L.) podría constituir una alternativa de uso en la industria farmacéutica y alimentaria.
AGRADECIMIENTO
Los autores expresamos nuestro agradecimiento a Dios. Al Instituto de Investigación de la UNCP, a la Facultad de Ciencias Aplicadas de la UNCP y a los Fondos del Canon Minero administrados por la Universidad Nacional del Centro del Perú.
BIBLIOGRAFÍA
1. K. Shindo, E. Saito, M. Sekiya, "Antioxidative activity of de flower of Torenia fournieri",c Revista de Medicinas Naturales, 2007; 62(10): 247-258.
2. E. Lara, O. Martín, P. Osorio, L. Barrera, J. Sánchez, S. Bautista, "Actividad antioxidante composición nutrimental y funcional de flores comestibles de dalia", Revista Chapingo Serie Horticultura, 2014; 20(1): 101-116.
3. H. Friedman, "Tropaeolum majus L. as edible flowers growth and postharvest handling", Advances in Horticultural Science Journal's, 2005; 19(1): 3-8.
4. A. Vidal, A. Fallarero, E. Silva, A. Mara, A. De Lima, R. Pavan, et. al, "Composición química y actividad antioxidante del alga marina roja Bryothamnion triquetrum (S.G.Gmelin) Howe", Revista Brasileña de Ciencias Farmacéuticas, 2006; 42(4): 589-600.
5. T. Vanderjagt, R. Ghattas, D. Vanderjagt, M. Crossey, R. Glew, "Comparison of the total antioxidant content of 30 widely used medicinal plants of New México", Journal Life Sci, 2002; 70(9): 1035-1040.
6. N. Carazo, "Actividad antioxidante de los pétalos de flores comestibles", presentación oral, VI Congreso Ibérico de Ciencias Hortícolas y XII Congreso Nacional de Ciencias Hortícolas, Barcelona - España, 2005.
7. M. Arnao, "Some methodological problems in the determination of antioxidant activity using chromogen radicals: a practical case", Trends in Food Science & Tecnology, 2000; 11(11): 419-421.
8. R. Prior, X. Wu, K. Schaich, "Standardized Methods for the Determination of Antioxidant Capacity and Phenolics in Foods and Dietary Supplements", Journal of the Agricultural and Food Chemistry, 2005; 53(10): 4290–4302.
9. L. Palomino, C. García, J. Gil, B. Rojano, D. Durango, "Determinación del contenido de fenoles y evaluación de la actividad antioxidante de propóleos recolectados en el departamento de Antioquia (Colombia)", Journal Vitae, 2009; 16(3): 388-395.
10. G. Pilco, "Comprobación del efecto adelgazante de la tintura de apio (Apium graveolens) y el perejil (Petroselinum sativum) en voluntarios con sobrepeso", tesis para optar el título de Químico Farmacéutico, Escuela Superior Politécnica de Chimborazo, 119, 2012.
11. Lastra, E. Rodríguez, H. Ponce de León, M. González, "Método analítico para la cuantificación de taninos en el extracto acuoso de romerillo", Revista Cubana de Plantas Medicinales, 2000; 5(1): 17-22.
12. E. Kuskoski, A. Asuero, A. Troncoso, J. Mancini-Filho, R. Fett, "Aplicación de diversos métodos químicos para determinar actividad antioxidante en pulpa de frutos", Revista Brasileña de Ciencia y Tecnología de Alimentos, 2005; 25(4):726-732.
13. M. Arnao, A. Cano, M. Acosta, "The hydrophilic and lipophilic contribution to total antioxidantactivity", Food Chemistry, 2001; 73(11): 239-244.
14. M. Gracia, http://www.uaq.mx/investigacion/difusion/veranos/memorias-2007/56_1UAQGarciaNava.pdf (último acceso 17 de diciembre 2014).
15. L. Tarhan, H. Kayali, R. Urek, "In vitro antioxidant properties of Curcubita pepo L. male and female flowers extracts", Plant Foods for Human Nutrition, 2007; 62(2): 49-51.
16. W. Souto, J. Alves, L. Cavalcante, "Capuchina (Tropaeolum majus L.)", primera edición, Editorial Kiron, Brasilia, Brasil, 2012, 64.
17. A. Márcia De Matos, "Avaliação do potencial antibacteriano de Calendula officinalis (Asteraceae) para seu emprego como fitoterápico", tesis para optar el título de Doctor en Ciencias, Universidad Federal de Paraná, 11, 2005.
18. A. Mesa, "Actividad antioxidante y contenido de fenoles totales de algunas especies del género Calophyllum", Revista Cubana de Plantas Medicinales, 2010; 15(2): 13-26.
19. B. Montoya, J. Lemeshko, A. López, A. Pareja, R. Torres, "Actividad antioxidante de algunos extractos vegetales", Journal Vitae, 2003; 10(2): 72-79.
- Recibido el 12-10-2015
- Aprobado el 04-11-2015